Ремоделирование миокарда и сердечная недостаточность
Патологические изменения у больных с сердечной недостаточностью могут усиливаться при нарушении функции сосудистого эндотелия. Если концентрация эндотелина возрастает и его количество превышает уровень вазорелаксирующих факторов, это приводит к выраженной вазоконстрикции и способствует задержке в организме натрия и воды. При сердечной недостаточности уровень секреции сосудистым эндотелием эндотелина увеличивается, а его концентрация в плазме крови повышена. Обычно уровень эндотелина в крови больных прямо коррелирует с уровнем ангиотензина II. Последний, в свою очередь, еще больше может стимулировать секрецию эндотелина.
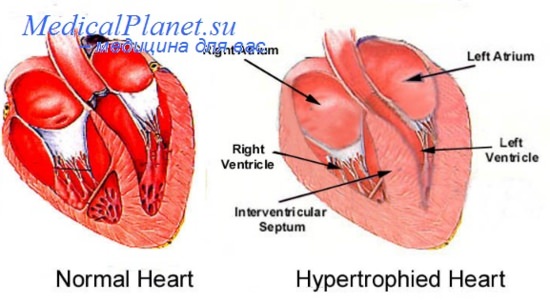
Вследствие прогрессирующей гипертрофии миокарда возникает диастолическая ригидность левого желудочка, резко усиливается дилатация сердца, которую раньше обозначали как миогенная дилатация, к диастолической дисфункции присоединяется систолическая.
Тахикардия, которая первоначально носит компенсаторный характер, резко повышает энергетические затраты сердца и существенно ограничивает толерантность к физическим нагрузкам. Все эти, уже патологические, механизмы стимулируются гиперактивацией нейрогормональных систем. Прогрессирующее снижение сердечного выброса способствует задержке в организме жидкости. В миокардиоцитах происходит трансформация ангиотензина I в ангиотензин П. Длительное повышение его уровня в плазме крови, особенно в сочетании с гиперальдостеронизмом, сопровождается некрозом кардиомиоцитов. Ангиотензин П имеет особое значение в развитии гипертрофии миокарда, которая первоначально, как упоминалось выше, также носит компенсаторный характер.
Параллельно гибели части миокардиоцитов и гипертрофии оставшихся стимулируется рост фибробластов, увеличивается содержание коллагена в мышце сердца, прогрессирует фиброз. Это приводит к снижению эластичности миокарда и усилению его ригидности. Развивается так называемая диастолическая жесткость желудочков сердца. Диастолическая дисфункция является ведущей причиной развития сердечной недостаточности у многих больных с застойной сердечной недостаточностью уже на ранних этапах заболевания.
Чрезмерная гипертрофия сопровождается увеличением потребности миокарда в кислороде. Кроме того, по мере нарастания гипертрофии ухудшается кровообращение миокарда, поскольку развитие коллатералей при этом существенно отстает от увеличения массы миокарда и в конце концов приводит к ослаблению сократительной деятельности сердечной мышцы.
При многих заболеваниях сердечно-сосудистой системы в мышце сердца происходят структурные изменения, затрагивающие как поврежденные, так и неповрежденные участки миокарда. Они развиваются у больных хронической ИБС в результате повторяющихся эпизодов ишемии, у больных инфарктом миокарда вследствие некроза участков функционирующего миокарда, появляются при воспалительных процессах, хронической перегрузке сердца объемом или давлением и при других поражениях миокарда. С одной стороны, они часто предшествуют клиническому проявлению сердечной недостаточности, с другой – сами усугубляют систолическую и диастолическую дисфункции желудочков, способствуют прогрессированию сердечной недостаточности, отрицательно влияют на качество и продолжительность жизни больных.
В последние годы внимание исследователей привлекают структурные изменения сердца, происходящие при сердечной недостаточности и обозначаемые как «ремоделирование». Ремоделирование миокарда можно обозначить как комплекс структурных изменений в мышце сердца, возникающих вследствие сложных нейрогуморальных изменений. Термин «ремоделирование» стал использоваться начиная с 1980-х годов для обозначения структурно-геометрических изменений левого желудочка, развивающихся после инфаркта миокарда. В настоящее время этот термин применяется в более широком смысле.

В широком понимании ремоделирование сердца означает комплекс морфологических и функциональных изменений, происходящих в сердце в ответ на повреждение миокарда. Ремоделирование сердца в первую очередь включает прогрессирующее увеличение массы миокарда, дилатацию полостей, а также изменение геометрии сердца.
Схематично развитие ремоделирования миокарда можно представить следующим образом. После повреждения мышцы сердца (инфаркт миокарда, миокардит, дилатационная кардиомиопатия и т.п.) часть кардиомиоцитов гибнет. В миокарде сразу начинаются процессы, направленные на то, чтобы сохранить основную функцию сердца – сократительную. Происходит компенсаторная активация нейрогормональной системы, прежде всего симпатико-адреналовой и ренин-ангиотензин-альдостероновой, стимулирующих оставшиеся неповрежденные кардиомиоциты взять на себя функцию погибших.
Начинается ремоделирование. Оно характеризуется тем, что оставшиеся в живых кардиомиоциты, переполняясь кальцием, резко повышают свою контрактильность, повышают пейсмекерную активность, начинают гипертрофироваться. Эти процессы позволяют временно поддержать на адекватном уровне сердечный выброс. Однако вскоре компенсаторное (адаптивное) ремоделирование переходит в свою противоположность.
Гипертрофия миокарда, тахикардия, гиперконтрактильность – это энергоемкие процессы, которые сопровождаются повышением потребности миокарда в кислороде. Адекватность доставки кислорода к миокардицитам уменьшается, в результате чего развивается хроническая гипоксия. Гипоксия миокарда наряду с переполнением кардиомиоцитов кальцием приводит к нарушению диастолического расслабления, повреждению клеточных мембран клеток, вызывает электрическую нестабильность миокарда.
При этом включается защитно-приспособительный механизм, получивший название «гибернация миокарда» («спячка»). Часть клеток потребляет минимум энергии, хуже сокращается, но благодаря этому сохраняет свою жизнеспособность.
Среди оставшейся части живых и способных к сокращению клеток миокарда срабатывает генетически детерминированный механизм – гибель клеток путем апоптоза. Апоптоз характерен для всех клеток, но при ХСН он активизируется, в результате чего дополнительно погибает еще часть кардиомиоцитов.
При длительном применении инотропных средств у больных с ХСН все меньшее число кардиомиоцитов способно функционировать адекватно. Это приводит к прогрессирующей дилатации сердца и снижению сердечного выброса. Этим, в частности, объясняется негативное влияние на течение и прогноз у больных с ХСН сердечных гликозидов и других препаратов, обладающих положительным инотропным действием.
На важность взаимоотношения между геометрией и функцией сердца указывал еще Гарвей в XVII в. При нормальной сократительной функции миокарда происходит последовательное динамическое изменение геометрии левого желудочка от более эллипсоидной в фазу систолы к более сферичной в момент диастолы. Относительное удлинение левого желудочка во время систолы является важным механизмом, позволяющим ему выбрасывать больший объем крови. Нарушение геометрии желудочка с его дисфункцией выявляется у всех больных с сердечной недостаточностью и часто предшествует уменьшению фракции выброса, нарушениям системной гемодинамики и клиническим проявлениям заболевания.
У больных ИБС после перенесенного крупноочагового инфаркта миокарда этот процесс может завершиться развитием сердечной недостаточности в течение нескольких месяцев или лет даже в случае прекращения прогрессирования ИБС. Если же ИБС прогрессирует, возникают повторные инфаркты миокарда, вероятность развития сердечной недостаточности резко возрастает.
– Читать далее “Адаптация организма к хронической сердечной недостаточности. Изменения органов при ХСН”
Оглавление темы “Сердечная недостаточность”:
- Ремоделирование миокарда при сердечной недостаточности – механизмы
- Адаптация организма к хронической сердечной недостаточности. Изменения органов при ХСН
- Варианты гипертрофии левого желудочка. Патогенез
- Водный обмен человека – регуляция, нарушения
- Регуляция обмена натрия и его нарушения
- Гипомагниемия, гипермагниемия – клиника, диагностика
- Гипокальциемия, гиперкальциемия – клиника, диагностика
- Классификация сердечной недостаточности
- Немедикаментозное лечение хронической сердечной недостаточности (ХСН) – принципы
- Диуретики для лечения хронической сердечной недостаточности (ХСН)
Источник
Статья посвящена проблеме диагностики сердечной недостаточности с сохранной фракцией выброса, особое внимание уделено возможностям биомаркеров повреждения и ремоделирования миокарда
Введение
Несмотря на то, что сердечная недостаточность (СН) с сохранной фракцией выброса (HFpEF — heart failure with preserved ejection fraction) является весьма распространенным заболеванием во всем мире и численность пациентов с данной патологией с каждым годом лишь возрастает, многие вопросы, касающиеся наилучшего диагностического подхода, остаются без ответа. Диагностика HFpEF часто становится клинической проблемой, и это особенно актуально для амбулаторных больных на ранней стадии заболевания без явных признаков СН [1].
Согласно рекомендациям Европейского сообщества кардиологов необходимыми компонентами для постановки диагноза HFpEF являются [2]:
повышение уровня натрийуретического пептида (BNP ≥35 пг/мл или уровень NT-proBNP ≥125 пг/мл);
сохраненная фракция выброса (ФВ) левого желудочка (ЛЖ) более 50% (ФВЛЖ ≥50%);
дополнительные нарушения структуры и/или функции сердца;
индекс объема левого предсердия (ЛП) >34 мл/м2;
индекс массы ЛЖ ≥115 г/м2 для мужчин и ≥95 г/м2 для женщин;
отношение E к E′ ≥13, где Е — ранняя диастолическая скорость потока крови на митральном клапане, E′ — ранняя диастолическая скорость движения фиброзного кольца митрального клапана по результатам тканевой допплерографии;
средняя E′ в перегородке и боковой стенке ЛЖ <9 см/с.
В случае диагностических сомнений пациенту могут быть выполнены стресс-тесты или инвазивное измерение повышенного давления наполнения ЛЖ [3].
Многообразие биомаркеров повреждения и ремоделирования миокарда
В настоящее время в диагностике HFpEF уделяется большое внимание биохимическим исследованиям, позволяющим оценить активность повреждения и ремоделирования миокарда. Было показано, что плазматические биомаркеры точно отражают изменения гемодинамической нагрузки на сердечную мышцу, фиброз миокарда, поэтому они могут являться значимыми для диагностики и ведения пациентов с HFpEF [4]. Например, матриксные металлопротеиназы, их тканевые ингибиторы и белки, обрабатывающие коллаген, пропептиды коллагена и телопептиды коллагена отражают изменения в гомеостазе коллагена и переход от артериальной гипертензии без поражения органов-мишеней к клинически симптоматическому HFpEF [4, 5]. Галектин-3 и растворимый ингибитор онкогенности 2 (sST2 — soluble suppression of tumorigenicity 2) отражают общую степень фиброза и тяжесть HFpEF, что позволяет их использовать для определения ранней стадии развития СН, вызванной фиброзом. Помимо вышеупомянутых маркеров, ростовой фактор дифференцировки 15 (GDF-15 — growth differentiation factor 15) и микроРНК являются перспективными новыми биомаркерами для выявления фиброза [4–7]. Рассмотрим подробнее наиболее актуальные из биомаркеров HFpEF.
Натрийуретические пептиды
В настоящее время использование натрийуретических пептидов является «золотым стандартом» диагностики СН. Биологически активный BNP и его неактивный аминоконцевой фрагмент NT-proBNP синтезируются миокардом желудочков в ответ на растяжение миоцитов или перегрузку давлением. Основными физиологическими эффектами BNP являются натрийурез, вазодилатация, ингибирование ренин-ангиотензин-альдостероновой системы и симпатической нервной системы [8, 9]. NT-proBNP не оказывает прямого воздействия на данные системы, и период его полураспада составляет примерно 1–2 ч, в то время как BNP имеет весьма короткий период полураспада — приблизительно 20 мин [10, 11].
Недавние исследования показали, что уровни BNP и NT-proBNP в плазме являются достоверными биомаркерами для диагностики и прогноза пациентов с СН. Однако существуют и ограничения на использование натрийуретического пептида, которые необходимо учитывать при интерпретации результатов. Помимо возраста пациента и функции ЛЖ, многие другие факторы, такие как ожирение, почечная дисфункция, предсердные аритмии и кардиотоксические агенты, а также структурные заболевания сердца, влияют на клиническую интерпретацию BNP и NT-proBNP [12].
Стимулом для производства BNP является повышенное диастолическое давление в камерах сердца. У пациентов с HFpEF обычно имеются меньшая полость и более толстые стенки ЛЖ, их конечное напряжение в диастолу намного ниже, чем при СН со сниженной ФВ (HFrEF — heart failure with reduced ejection fraction) даже в условиях высокого диастолического давления. Ввиду этого у пациентов с HFpEF уровни данных биомаркеров ниже, чем у пациентов с HFrEF [13].
Действующие руководства, рекомендующие пороговые значения для всех типов СН, акцентируют внимание на выявлении пациентов с HFrEF и более высоким риском сердечно-сосудистых осложнений, в то время как повышенные пороговые значения BNP и NT-proBNP ограничивают выявление пациентов с HFpEF [14–16].
В настоящее время оценка уровней натрийуретических пептидов у пациентов с разными видами СН затруднена ввиду того, что все еще не определены пороговые значения распознавания и мониторинга HFpEF и HFrEF. Это может быть важной информацией для будущих исследований HFpEF и подтверждает тот факт, что применение натрийуретических пептидов в качестве единственных маркеров СН может быть недостаточным [17,18].
В заключение следует отметить, что использование уровня натрийуретических пептидов в плазме крови для диагностики HFpEF не должно быть изолировано от клинического контекста и эхокардиографии. Поскольку на концентрацию натрийуретических пептидов влияют многие факторы, помимо диастолической функции, их измерения могут давать ложноположительные результаты. В этом контексте, помимо натрийуретических пептидов, необходимы дополнительные биомаркеры для комплексной оценки HFpEF [7].
Растворимый ингибитор онкогенности 2
Источником sST2 является рецептор семейства интерлейкина-1, который экспрессируется в кардиомиоцитах и фибробластах при их механическом напряжении и, таким образом, рассматривается как биомаркер фиброза миокарда, растяжения сердца и ремоделирования сердечно-сосудистой системы [19–21]. Обнаружено, что sST2 имеет диагностическую и прогностическую ценность у пациентов с дестабилизированной СН, острым коронарным синдромом [21] и тяжелой хронической СН, и он был включен в рекомендации американской ассоциации кардиологов 2013 г. для дополнительной стратификации риска у пациентов с острой и хронической СН [23]. Однако диагностическая полезность sST2 у пациентов с HFpEF изучена недостаточно хорошо. K.B. Shah et al. [19] предоставили первые доказательства того, что уровни sST2 могут иметь значение у пациентов с HFpEF. Y.C. Wang et al. [24] обследовали 107 пациентов с гипертонической болезнью и HFpEF. Среди них 68 имели симптомы HFpEF. Интересно, что концентрация sST2 была значительно ниже у пациентов с E/E′ <8 по сравнению с пациентами, имевшими E/E′ 8–15 или >15. Многофакторный анализ показал, что sST2 >13,5 нг/мл связан с наличием HFpEF. P.S. Jhund et al. [25] исследовали 296 пациентов, проходивших лечение по поводу HFpEF ингибитором ангиотензинового рецептора неприлизином и блокатором рецепторов ангиотензина II с измерением sST2 (PARAMOUNT). Более высокий уровень этого биомаркера был связан с более старшим возрастом, высоким классом СН, высоким содержанием NT-proBNP, мужским полом, фибрилляцией предсердий, более низкой скоростью клубочковой фильтрации. Повышение уровня sST2 было связано с более высоким значением E/E′ и бóльшим размером ЛП. P.S. Jhund et al. [25] также выявили связь между более высоким уровнем sST2 и мужским полом, повышением класса СН и объемом ЛП.
Подводя итог исследованиям роли концентрации sST2 в HFpEF, можно заключить, что измерение его уровней полезно для стратификации риска смерти и прогноза пациентов с СН, помимо других факторов риска сердечно-сосудистых заболеваний [26]. Концентрация sST2 показала слабую корреляцию с функциональным классом СН, фракцией выброса ЛЖ, другими показателями сердечной деятельности и функцией почек [27, 28]. Таким образом, растворимый ингибитор онкогенности можно использовать в качестве биомаркера для прогнозирования HFpEF, однако необходимо больше исследований для выявления дополнительных корреляций между концентрацией sST2 в крови и другими маркерами HFpEF.
Галектин-3
Еще одним перспективным биомаркером в диагностике HFpEF является галектин-3. Фиброз миокарда, приводящий к увеличению его жесткости, является проявлением синтеза коллагена (или уменьшенной деградации коллагена), воспаления и окислительного стресса, что, в свою очередь, является основным компонентом патофизиологии HFpEF [29–32]. Недавние исследования подтвердили, что галектин-3 связан с развитием HFpEF и что он участвует в различных процессах, в т. ч. в пролиферации миофибробластов, фиброгенезе, восстановлении тканей, воспалении и ремоделировании желудочков [32–35]. В контексте определения различных фенотипов СН измерение циркулирующего галектина-3 может иметь важное значение, поскольку повышенные уровни галектина-3 обнаружены у пациентов с нарушениями диастолической функции ЛЖ, но без симптоматической СН [36]. Было высказано предположение, что этот биомаркер может помочь в диагностике HFpEF, особенно у пациентов с гипертонией, ишемической болезнью сердца и сахарным диабетом [10, 11]. В настоящее время лишь в нескольких исследованиях описана клиническая ценность галектина-3 у пациентов с HFpEF. Например, в исследовании C.K. Wu et al. [37] уровни галектина-3 в плазме и миокарде коррелировали с выраженностью диастолической дисфункции. В субанализе около 200 пациентов с диагнозом острой декомпенсации СН уровни галектина-3 коррелировали с эхокардиографическими показателями более высокого давления наполнения (более высокое значение отношения Е/E’), диастолической дисфункцией (более низкая E’) и клапанной регургитацией [38]. В целом галектин-3, как и sST2, интересен тем, что может быть использован в качестве биомаркера в диагностике HFpEF. Тем не менее диагностическая значимость данного маркера остается не вполне ясной ввиду отсутствия клинических исследований и алгоритмов, устанавливающих его определенные пороговые значения.
Адреномедуллин
Обращает внимание на себя малоизученный биомаркер, связанный с симпатической активностью, обладающий вазодилатирующим, иммуномодулирующим, антипролиферативным и антиапоптотическим эффектами, — адреномедуллин (ADM). [39] В настоящее время имеется не много данных относительно корреляции ADM и HFpEF. В крупном исследовании F.P. Brouwers и et al. [40] сообщали, что концевой фрагмент данной молекулы MR-proADM (mid-regional pro-adreomedullin) может помочь в диагностике и выявлении новых пациентов с HFpEF, но только после определения базового профиля сердечно-сосудистого риска в популяции HFpEF. С.М. Yu et al. [41] показали, что ADM может специфически реагировать на диастолическую дисфункцию.
Ростовой фактор дифференцировки 15
Другим биомаркером, который может быть применим в диагностике HFpEF, является GDF-15 — член суперсемейства трансформирующих факторов роста: цитокинов и маркеров повреждения клеток и воспаления. GDF-15 может быть использован в качестве нового биомаркера для оценки фиброза миокарда. В исследовании Y.M. Zhou et al. [42] после линейного корреляционного анализа было обнаружено, что экспрессия GDF-15 положительно связана со степенью фиброза сердца у больных с фибрилляцией предсердий. У пациентов с терминальной стадией неишемической дилатационной кардиомиопатии уровень GDF-15 в сыворотке коррелировал с тяжестью фиброза миокарда [43]. Экспрессия GDF-15 сильно индуцируется в кардиомиоцитах в ответ на метаболический стресс, такой как ишемия сердца, повреждение ткани или состояние перегрузки давлением [12, 44, 45]. Y. Izumiya et al. [8] выявили положительную корреляцию между концентрацией GDF-15 в сыворотке крови и функциональным классом СН, а также уровнями BNP в плазме и высокочувствительными уровнями тропонина T в сыворотке у 150 пациентов с HFpEF.
С. Sinning et al. [9] предложили формулу расчета индекса, основанного на концентрации С-реактивного белка (CRP), GDF-15, sST2 и NT-proBNP, который позволяет отличить HFpEF от HFrEF:
(CRP + GDF – 15 + sST2) / NT-proBNP.
Прогностическая ценность GDF-15 также подтверждена в недавних исследованиях. GDF-15 оставался значимым независимым предиктором СН даже после корректировки, учитывающей важные клинические предикторы, включая высокочувствительный тропонин T и NT-proBNP [46, 47]. В целом GDF-15 может служить в качестве биомаркера, помогающего дифференцировать HFpEF и HFrEF, а также как дополнительный индикатор прогноза сердечно-сосудистых осложнений.
Заключение
Таким образом, диагностика HFpEF остается сложной задачей. Однако благодаря объективности, воспроизводимости и доступности биомаркеров, отражающих гемодинамическую нагрузку на миокард и его ремоделирование, они могут быть значимым дополнением в диагностике HFpEF, оценке эффективности проводимой терапии, а также в прогнозировании риска сердечно-сосудистых осложнений [46–49]. В настоящее время единственными рекомендованными к применению биомаркерами СН являются NT-BNP и NT-proBNP. Исследования показывают, что натрийуретические пептиды имеют потенциал для улучшения диагностики даже ранней HFpEF, однако они все еще имеют существенные ограничения.
Акцентируя внимание на новых биомаркерах фиброза и воспаления, таких как sST2, GDF-15 и галектин-3, связанных с диастолической дисфункцией ЛЖ, следует отметить их перспективность, однако до сих пор отсутствуют крупные исследования с большими выборками пациентов с HFpEF.
Источник
