Хроническое заболевание почек и инфаркт миокарда
С ростом частоты возникновения токсических, воспалительных поражений почек, вовлечения их в патогенез гипертонической болезни, а также в связи с нефрологическими осложнениями терапии понятие хронической болезни почек (ХБП) в настоящее время получило широкое распространение. [14,10]
В последние годы особое звучание приобретает термин «ишемическая болезнь почек», в то же время все чаще она обнаруживается у пациентов с ИБС и вне непосредственного поражения почечных артерий. [2] Являясь и самостоятельным, и вторичным процессом, ХБП представляет собой весомый фактор риска неблагоприятных исходов после инфаркта миокарда (ИМ). Причем даже в легком варианте она негативно влияет на частоту сердечно-сосудистых событий и смерти. [1] Раннее выявление ХБП представляется важным особенно при острых формах ИБС, поскольку позволяет выделить подгруппу пациентов, имеющих существенно менее благоприятный прогноз, например при остром коронарном синдроме (ОКС).[3] В литературе представлены данные о том, что среди пациентов с ОКС нормальная функция почек (скорость клубочковой фильтрации (СКФ) > 90 мл мин./1,73 м2) определялась только в 16% случаев! [7]
Анализ данных крупных исследований TIMI, InTIME-II у пациентов с ИМ и подъемом сегмента ST на электрокардиограмме выявил повышение 30-дневной летальности при легкой, умеренной и тяжелой ХБП в 1,4; 2,1 и 3,8 раза соответственно в сравнении с пациентами, имеющими нормальную функцию почек. [5]
При ОКС без подъема сегмента ST, по данным мета-анализа 5 исследований TIMI, снижение СКФ ассоциировалось с возрастанием 30-дневной и 6-месячной летальности, частоты рецидивов ишемии миокарда, инсультов и больших кровотечений. [4]
К дополнительным факторам риска развития сердечно-сосудистых осложнений при патологии почек относятся:
- факторы, связанные с повышенной проницаемостью почечных мембран;
- активация ренин-альдостероновой системы почек;
- почечная артериальная гипертензия;
- нефрогенная анемия, связанная со снижением синтеза эритропоэтина;
- накопление токсических метаболитов и непосредственно уремических токсинов. [14]
В доступной литературе мало представлено работ, характеризующих особенности клинического течения острых форм ИБС у больных с ХБП. Это отчасти обусловлено относительной новизной термина и определения ХБП, применимостью новых критериев нарушения функции почек. В то же время клинические наблюдения свидетельствуют о многочисленных примерах неблагоприятных ассоциаций ХБП и ИБС (в литературе описаны острые и хронические ренокардиальные и крадиоренальные синдромы).
Мы решили в меру сил и возможностей восполнить этот пробел. Целью нашей работы стало изучение влияния хронической болезни почек на клиническое течение инфаркта миокарда. В свое исследование мы включили 455 пациентов, лечившихся в Санкт-Петербургском ГБУ НИИ СП им. И.И. Джанелидзе (2012–2013 гг.) по поводу ИМ. Всех пациентов мы разделили на 3 группы.
В первую (I) группу вошли 310 человек, у которых более 3 месяцев было известно о структурном и/или функциональном повреждении почек и снижении СКФ до 60 мл/мин./1,73 м2 или без таковой, а также пациенты, у которых не было в прошлом этих изменений. Таким образом, в I группу вошли больные, которые страдали ХБП 1 ст., ХБП 2 ст., снижением клубочковой фильтрации, связанным с возрастом, и больные ИБС без ХБП. В этой группе средний возраст пациентов составил 58,4 ± 6,5 года, мужчин было 201 (64,8%), женщин – 109 (35,2%).
Во вторую (II) группу вошли 92 больных, у которых было известно о ХБП 3а ст. (СКФ от 59 мл/мин./1,73 м2 до 45 мл/мин./1,73 м2) с признаками структурного и/или функционального повреждения почек или без такового. Средний возраст пациентов этой группы – 64,5 ± 6,2 года, из них мужчин 51 (55,4%), женщин – 41 (44,6%).
В третью (III) группу вошли 53 пациента с ХБП 3б ст. (СКФ от 44 мл/мин./1,73 м2 до 30 мл/мин./1,73 м2 с признаками структурного и/или функционального повреждения почек или без этого). Средний возраст больных составил 65,3 ± 5,4 года. Мужчин в этой группе было 30 (56,6%), женщин – 23 (43,4%).
Таким образом, II и III группы составили больные с умеренной ХБП.
Пациенты старше 75 лет в исследование не включались. Для характеристики функционального состояния почек использовались Рекомендации K/DOQI(2002);9 CКФ рассчитывалась по формуле MDRD. [6]
Для оценки достоверности различий между показателями в 2 выборках был использован непараметрический критерий – угловое преобразование Фишера (ϕ). Различия между двумя группами считались достоверными (p 2,31). [12]
Мы выявили Q инфаркт миокарда (QИМ) у 170 (54,8%) человек I группы, у 44 (47,8%) Пациентов – II и в 26 (49,1%) случаях – в III (p > 0,05). Соответственно, не QИМ был диагностирован в 140 (45,2%), 48 (52,2%), 27 (50,9%) случаях (все p > 0,05). Таким образом, достоверных различий частоты встречаемости ИМ между исследуемыми группами выявлено не было. При анализе частоты повторных ИМ было обнаружено, что они происходили достоверно чаще у пациентов II (39–42,4%) и III (23–43,4%) групп по сравнению с больными I группы (92–29,7%; p
Анализ случаев острой (по Killip) и хронической (по NYHA) сердечной недостаточности по 3 группам представлен в таблице 1.
Таблица 1. Развитие сердечной недостаточности у пациентов с инфарктом миокарда и хронической болезнью почек
Примечания: ϕ* – уровень значимости эмпирического значения между I и II группами; ϕ** – уровень значимости эмпирического значения между I и III группами.
Как видно из таблицы, развитие как острой, так и хронической сердечной недостаточности достоверно увеличивалось в группах с CКФ
При дальнейшем наблюдении у пациентов всех групп были выявлены случаи развития ранней постинфарктной стенокардии и рецидивы ИМ. Результаты встречаемости этих состояний представлены в таблице 2.
Таблица 2. Развитие острого коронарного синдрома у пациентов с инфарктом миокарда и ХБП
Примечания: ϕ* – уровень значимости эмпирического значения между I и II группами; ϕ** – уровень значимости эмпирического значения между I и III группами.
Частота развития ранней постинфарктной стенокардии была достоверно выше у пациентов с умеренной дисфункцией почек. Так, у пациентов III группы она возникала в 2,8 раза чаще по сравнению с пациентами I группы. Что касается рецидивов ИМ, то по сравнению с I группой они возникали в 4,3 раза чаще во II группе, в 6,5 раз чаще – в III группе и достигали 15,1% у больных ХБП 3 стадии.
Нарушения сердечного ритма: желудочковая экстрасистолия высоких градаций, желудочковая тахикардия и фибрилляция желудочков, а также наджелудочковые нарушения ритма (главным образом мерцания/трепетания предсердий), выявленные у пациентов всех групп, представлены в таблице 3.
Таблица 3. Нарушение сердечного ритма у пациентов всех групп
Примечания: ϕ* – уровень значимости эмпирического значения между I и II группами; ϕ** – уровень значимости эмпирического значения между I и III группами.
Как видно из таблицы, при снижении СКФ у исследованных больных увеличивалось количество желудочковых и наджелудочковых нарушений сердечного ритма. Их частота достоверно увеличивалась с нарастанием степени дисфункции почек, и при ХБП 3б они присутствовали практически у половины больных этой группы, что значительно отягощало течение заболевания у этих пациентов в госпитальном периоде. В литературе также встречаются данные об увеличении частоты нарушений сердечного ритма у больных с ИМ и ХБП. [11]
Летальность среди больных с ИМ и ХБП достоверно возрастала с увеличением степени тяжести ХПБ. Данные по этому положению представлены на рисунке 1.
Летальность во II группе была в 2,4 раза (ϕ* = 4,329; p
Из данных нашего исследования видно, что наличие ХБП и степень тяжести нарушений почечной функции существенным образом влияют на частоту встречаемости неблагоприятных клинических сателлитов ИМ. Это утверждение справедливо для таких значимых клинических событий при ИМ, как сердечная недостаточность, рецидивы острых коронарных синдромов, прогностически неблагоприятные нарушения сердечного ритма. Кроме того, наличие и степень выраженности нарушений клубочковой фильтрации негативно (и значительно!) влияют на показатели летальности у больных ИМ.
Нами также выявлена наиболее тяжелая когорта пациентов (с ХБП выше 3 стадии), у которых госпитальный период протекает с существенными осложнениями и в несколько раз чаще заканчивается летальным исходом по сравнению с больными, имеющими менее существенные нарушения функции почек.
Выводы:
- Умеренная почечная дисфункция достоверно увеличивает частоту повторных ИМ.
- Сердечная недостаточность, как острая, так и хроническая развивается значимо чаще у пациентов с ХБП 3а и ХБП 3б по сравнению с больными со снижением СКФ до 60 мл/мин./1,73 м2.
- Ранняя постинфарктная стенокардия и рецидивы ИМ возникают достоверно чаще у пациентов II и III групп по сравнению с I.
- Наджелудочковые и желудочковые нарушения сердечного ритма выявлены у пациентов с ХБП 3а и ХБП 3б в более значительном числе случаев, чем у больных I группы.
- Среди пациентов с умеренным снижением СКФ отмечена достоверно более высокая летальность по сравнению с показателем смертности у больных с СКФ не ниже 60 мл/мин./1,73 м2.
- Ввиду неблагоприятных клинических ассоциаций и осложненного течения ИМ у пациентов с сопутствующей дисфункцией почек целесообразно максимально раннее выявление нарушений клубочковой фильтрации у таких больных, оказание им повышенного внимания, организация усиленного мониторинга и учета нефротоксического действия ЛС.
По последним данным
…исследования российско-шведской группы ученых показали, что продолжительный прием антиоксидантов, избирательно воздействующих на митохондрии, снижает риск ССЗ, связанных с возрастными изменениями миокарда. Специалисты знают, что сердечно-сосудистая смертность у лабораторных мышек связана с развитием гипертрофической кардиомиопатии, которая сопровождается увеличением размера сердца, воспалением и фиброзом миокарда, т.е. патологическими процессами, связанными с окислительным стрессом. Антиоксиданты, нейтрализующие активные формы кислорода, могут замедлить их развитие. Гистологические исследования подтвердили это: размеры сердца у животных, получавших антиоксидант SkQ1, к концу жизни было в 1,5 раза меньше (как и количество коллагеновых волокон в тканях миокарда), чем у животных из контрольной группы. Таким образом, развитие возрастной кардиомиопатии у животных было существенно снижено.
Литература
- Bhatt D.L., Roe M.T., Peterson E.D. et al. Utilization of early invasive management strategies for high-risk patients with non-ST-segment elevation acute coronary
- Coresh J., Astor B.C., Greene T. et al. Prevalence of chronic kidney disease and decreased kidney function in the adult US population. Third National Health and
- Das M., Aronow W.S., McClung J.A., Belkin R.N. Increased prevalence of coronary artery disease, silent myocardial ischemia, complex ventricular arrhythmias, atrial fibrillation, left ventricular hypertrophy, mitral annular calcium, and aortic valve calcium in patients with chronic renal insufficiency. Cardiol. Rev. 2006; 14: 14–17.
- Gibson C.M. et al. Association of glomerular filtration rate on presentation with subsequent mortality in non-ST-segment elevation acute coronary syndrome; observations in 13307 patients in five TIMI trials. Eur. Heart. J. 2004; 25(22): 1998–2005.
- Gibson C.M., Pinto D.C., Murphy S.A et al. Association of creatinine and creatinine clearance on presentation in acute myocardial infarction with subsequent mortality. JACC. 2003; 42: 1535–1543.
- https://www.mdrd.com/(дата обращения 11.02.2014).
- Masoudi F.A., Plomondon M.E., Magid D.J. et al. Renal insufficiency and mortality from acute coronary syndromes. Am. Heart. J. 2004; 147: 4: 623–629.
- National Kidney Foundation. K/DOQI Clinical Practice Guidelines for Chronic Kidney Disease: Evaluation, Classification, and Stratification. American Journal of Kidney Diseases. 2002; 39(1): 266.
- Nutrition Examination Survey. Am. J. Kidney Dis. 2003; 31: 1–12.
- Sarnak M.J., Levey A.S., Schoolwerth A.C. et al. Kidney disease as a risk factor for development of cardiovascular disease. Circulation. 2003; 108: 2154–2169. syndromes. Results from the CRUSADE Quality Improvement Initiative. JAMA, 2004; 292: 2096–2104.
- Tessone A., Gottlieb S., Barbash I.M. et al. Underuse of Standard Care and Outcome of Patients with Acute Myocardial Infarction and Chronic Renal Insufficiency. Cardiology. 2006; 108(3): 193–199.
- Гублер Е.В. Вычислительные методы анализа и распознавания патологических процессов. Л., 1978, 86 с.
- Николайчук Е.И., Бородзюля М.Э., Беркович О.А. Диагностические методы выявления нарушения функционирования почек у пациентов с ИБС и сердечной недостаточностью//Регионарное кровообращение и микроциркуляция, №4, 2008, с. 10–15.
- Шестакова М.В., Дедов И.И. Сахарный диабет и хроническая болезнь почек. М., Медицинское информационное агентство, 2009, 482 с.
Источник: Обрезан А. Г., Скородумова Е. А., Костенко В. А., Александров М. В., Федоров А. Н. Влияние хронической болезни почек на течение инфаркта миокарда в госпитальном периоде \ Вестник Санкт-Петербургского университета. Серия 11: Медицина. 2014. №4. С. 50-55.
Источник
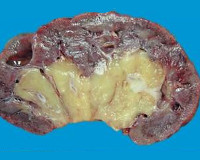
Инфаркт почки – это редкое нефрологическое заболевание, обусловленное эмболией артериальных сосудов органа с последующим некрозом его тканей и нарушением функциональной активности. Симптомы зависят от объема поражения, варьируются от полного отсутствия проявлений до резких болей в пояснице, гематурии, почечной недостаточности, увеличения уровня артериального давления. Диагностика производится на основании данных анамнеза, результатов анализов крови и мочи, УЗДГ сосудов почки, почечной ангиографии. Лечение преимущественно симптоматическое, также включает в себя применение антиагрегантных и антикоагулянтных средств, иногда показано хирургическое вмешательство.
Общие сведения
Инфаркт почки встречается намного реже других ишемических расстройств органов мочевыделительной системы. Данное состояние практически никогда не является изолированным нарушением, а выступает в качестве осложнений других, преимущественно сердечно-сосудистых патологий. Точные статистические данные относительно встречаемости болезни отсутствуют, поскольку определенная доля больных не обращается к специалистам из-за слабой выраженности симптомов.
Заболевание следует дифференцировать с мочекислым инфарктом почек у детей, являющимся одним из этапов адаптации мочевыделительной системы к внеутробному существованию. Из-за особенностей эпидемиологии болезней, способных осложняться инфарктом почки, патология чаще возникает у лиц старшего возраста, страдающих ожирением и обменными нарушениями.

Инфаркт почки
Причины
В подавляющем большинстве случаев состояние имеет ишемический характер и вызывается эмболией магистральных почечных сосудов. Чаще всего эмбол представлен тромботическим сгустком, реже в таком качестве могут выступать фрагменты атеросклеротических бляшек, жировые массы. Картину, схожую с эмболией ветвей почечной артерии, иногда провоцируют артериовенозные фистулы или кровотечения. Таким образом, основной причиной заболевания является наличие в артериальной части большого круга кровообращения эмболов, которые могут образовываться при следующих патологиях:
- Эндокардит. Воспаление внутренней оболочки левого желудочка или предсердия часто осложняется формированием пристеночного тромба. Его фрагменты периодически попадают в большой круг кровообращения и могут закупоривать просвет артерий почек.
- Аритмии и пороки сердца. Различные нарушения сердечного ритма сопровождаются нарушениями гемодинамики внутри полостей сердца, что иногда приводит к тромбообразованию. Схожий механизм возникновения тромбов отмечается при недостаточности митрального клапана или пролапсе его створок.
- Атеросклеротическое поражение. Выраженный атеросклероз аорты или венечных артерий являются одной из наиболее частых причин инфаркта почки. Закупорка сосуда может быть обусловлена как фрагментом собственно атеросклеротической бляшки, так и тромбом, который образовался на ее поверхности. Атеросклероз почечных сосудов может приводить к расслоению их стенок, что также провоцирует закупорку просвета и острую ишемию.
- Узелковый периартериит. Данное состояние неясной этиологии в случае вовлечения в патологический процесс сосудистой сети почек может становиться причиной инфарктов.
- Медицинские манипуляции. Различные диагностические и лечебные манипуляции на органах мочевыделительной системы могут осложняться стенозом сосудов с развитием острой ишемии почечной ткани.
Косвенной причиной патологии иногда является наркотическая зависимость, связанная с частыми внутривенными вливаниями (опиоидная или эфедриновая наркомания). В случае использования нестерильного инструментария развивается специфический эндокардит с образованием многочисленных тромбов. Различные формы инфаркта почки обнаруживаются у 20-30% инъекционных наркоманов. Множественные очаги инфарктов в почечной ткани возникают и при диссеминированном внутрисосудистом свертывании крови (ДВС-синдроме).
Патогенез
Основополагающим звеном патогенеза более чем в 90% случаев инфаркта почки считается образование эмболов, которые вызывают закупорку сосудов органа. В результате нарушается снабжение участка почечной ткани кислородом и питательными веществами. По своей кислородной потребности почки уступают только нервной ткани и миокарду, из-за чего в результате ишемии довольно быстро возникают дистрофические изменения в клетках нефронов. Размер поражения зависит от калибра артериального сосуда, перекрытого эмболом – чем он больше, тем распространеннее зона инфаркта. Характерная форма зоны ишемии – клиновидная или треугольная с вершиной у ворот почки и обращенным к корковому веществу основанием. Это обусловлено особенностями распределения кровеносных сосудов в органе.
После прекращения поступления артериальной крови дистрофия клеток нефронов постепенно нарастает, сменяясь их гибелью и формированием участков некроза. Одновременно возникает раздражение юкстагломерулярного аппарата с образованием больших количеств гормона ангиотензина 2, что приводит к развитию вазоренальной гипертензии и каскаду связанных с этим нарушений (повышается риск инфаркта миокарда или инсульта). Продукты распада некротизированных тканей всасываются в системный кровоток и становятся причиной интоксикации организма, проявляющейся повышением температуры, головными болями, тошнотой. Исходом некроза становится разрастание фиброзной ткани и формирование рубца.
Симптомы инфаркта почки
Клиническая картина заболевания характеризуется различной выраженностью симптомов, которая, прежде всего, зависит от объема ишемизированной и некротизированной ткани почек. При незначительных инфарктах субъективные жалобы отсутствуют, патология выявляется случайно по измененным данным диагностических исследований. В случае более обширных поражений симптоматика становится выраженной, однако большинство проявлений неспецифичны – боль в пояснице, гематурия, уменьшение объема выделяемой мочи.
Болезненные ощущения, возникающие сначала с двух сторон, постепенно смещаются в сторону пораженной почки – двухсторонние инфаркты встречаются крайне редко. Интенсивность болевого синдрома иногда сопоставима с почечной коликой, боль устраняется только приемом сильных наркотических анальгетиков. Степень выраженности гематурии при инфаркте почки также может сильно варьироваться – от микроскопических количеств эритроцитов в моче до ее ярко алой окраски и профузного почечного кровотечения.
Иногда наблюдается реальная почечная колика, обусловленная прохождением кровяного сгустка или кусочка некротизированной ткани по мочевыводящим путям. Проявления почечной недостаточности обычно выражены слабо, особенно при сохраненной функциональной активности второй почки. При тотальном инфаркте возможно токсическое поражение парного органа, что проявляется развитием ОПН – анурией, запахом аммиака изо рта и от кожных покровов больного.
Общие симптомы заболевания сводятся к повышению температуры тела до 38 градусов, явлениям интоксикации (тошноте, рвоте, разбитому состоянию), ознобу. В некоторых случаях из-за нарушенного кровоснабжения почки возникает стимуляция юкстагломерулярного аппарата, провоцирующая рост артериального давления. Вышеперечисленные проявления обычно сочетаются с симптомами основной патологии, которая спровоцировала ишемию и инфаркт почечной ткани. Таковыми могут быть боли в области сердца, нарушения сердечного ритма, признаки циркуляторных расстройств при пороках клапанов (цианоз, повышение давления крови в малом круге кровообращения).
Осложнения
Ранним и наиболее тяжелым осложнением инфаркта почки является развитие острой почечной недостаточности. ОПН наблюдается достаточно редко, поскольку для этого необходимо наличие ряда условий – двухсторонний характер инфаркта либо наличие у больного только одной почки. При тотальной ишемии недостаточность может возникать из-за чрезмерной нагрузки на второй орган или по причине его токсического поражения. В отдаленной перспективе из-за формирования рубцов в пораженной почке снижается ее функциональная активность, что создает предпосылки для возникновения ХПН в будущем. У ряда больных после разрешения инфаркта сохраняется стойкое увеличение артериального давления, обусловленное нарушениями кровообращения в почках.
Диагностика
Определение инфаркта почки осложняется неспецифичностью симптомов, поскольку боли в пояснице, ухудшение общего состояния, гематурия характерны и для иных нефрологических заболеваний. Во многих случаях врачу-нефрологу или урологу требуется кооперация с другими медицинскими специалистами (например, с кардиологом) для уточнения диагноза. Особую важность имеет скорость определения болезни, так как от своевременности лечебных мер зависит ее исход, а при неправильном лечении повышается риск развития осложнений. В числе диагностических мероприятий выделяют следующие группы методов:
- Опрос и общий осмотр. При опросе акцентируют внимание на субъективных симптомах и жалобах больного. Имеет значение выраженность и локализация болезненных ощущений, наличие или отсутствие расстройств мочеиспускания. В анамнезе определяют наличие сердечно-сосудистых, гематологических или иных заболеваний, способных спровоцировать ишемию тканей почки.
- Лабораторные исследования. В общем анализе мочи практически всегда определяется наличие эритроцитов – от выраженной макрогематурии до микроскопических примесей крови, часто возникает протеинурия. При биохимическом исследовании мочи специфическим признаком инфаркта является увеличение уровня лактатдегидрогеназы (ЛДГ), аналогичное повышение наблюдается и в сыворотке крови. У большинства пациентов также обнаруживается незначительный лейкоцитоз, изменяются показатели коагулограммы – последняя выполняется для оценки необходимости использования антикоагулянтов.
- Инструментальные исследования. Обычно при подозрении на инфаркт почки производят ультразвуковую допплерографию (УЗДГ почечных артерий), позволяющую оценить показатели кровотока в основных сосудах органа. Еще больше информации дает селективная контрастная почечная ангиография, по результатам которой выявляется участок ишемизированной ткани, не накапливающей контраст. Как альтернативу последнему исследованию могут назначать МСКТ или МРТ с контрастом и последующим 3Д-моделированием почечной сосудистой сети.
- Эндоскопические исследования. Цистография при данном заболевании производится с целью дифференциальной диагностики. С помощью этого метода исключается вероятность кровотечения из мочевого пузыря (наблюдаемого при опухолях, травмах), уточняется односторонний характер поражения.
Дифференциальную диагностику инфаркта почки проводят с опухолевыми поражениями мочевыводящих путей (чашечно-лоханочной системы, мочеточников, мочевого пузыря и уретры) и кровотечениями из них. Иногда проявления заболевания создают ложную клиническую картину гломерулонефрита – он исключается при подтверждении одностороннего характера процесса и наличии ишемизированного участка тканей. При помощи дополнительных исследований инфаркт почки дифференцируют с почечной коликой при мочекаменной болезни и расслоением стенки брюшной аорты.
Лечение инфаркта почки
Основные цели терапии данного заболевания изменяются в зависимости от этапа патологического процесса. На начальных этапах первоочередной задачей является восстановление адекватного кровотока в органах выделения, что позволяет минимизировать негативные последствия ишемии. В дальнейшем на первый план выступает устранение кровотечения (макрогематурии), явлений общей интоксикации и сохранение функциональности оставшейся части органа. Зачастую для этих целей используют препараты с противоположным действием (например, антикоагулянты и гемостатики), поэтому от специалиста требуется особая осторожность при их назначении. Консервативная терапия инфаркта сводится к использованию следующих лекарственных средств:
- Обезболивающие препараты. Боли могут быть очень интенсивными, в ряде случаев болевой синдром устраняется только мощными наркотическими анальгетиками – морфином, фентанилом и другими.
- Тромболитические средства. К ним относят стрептокиназу и другие препараты данной группы, цель их применения – устранение тромба в сосуде, восстановления адекватного кровотока. Медикаменты используются только на первых этапах заболевания, до развития выраженной гематурии. После начала выделения крови с мочой назначение этих средств строго запрещено.
- Гемостатические препараты. Применяются при выраженной гематурии и профузном почечном кровотечении. Основным лекарственным средством данной группы является этамзилат натрия, введение которого позволяет минимизировать кровопотерю и улучшить прогноз заболевания.
- Антикоагулянты. На любом этапе патологии рекомендуется принимать меры по нормализации работы свертывающей системы крови, с этой целью назначаются антикоагулянты прямого действия (например, гепарин). Схема, дозировки и длительность применения строго индивидуальны, определяются после изучения коагулограммы больного.
- Антиагрегантные средства. Антиагреганты (например, ацетилсалициловая кислота) редко используются в остром периоде заболевания. Их назначают через 1-2 недели после исчезновения гематурии для снижения риска рецидива и отдаленных осложнений. Дозировка и длительность курса лечения определяется с учетом функциональной активности выделительной системы.
В тяжелых случаях (например, тотальный инфаркт почки) проводят хирургическое лечение, которое на начальных стадиях болезни сводится к восстановлению проходимости магистральных артерий и почечного кровотока. При поздней диагностике и развитии некротических изменений в почке по показаниям осуществляют оперативное удаление зоны инфаркта вплоть до нефрэктомии (при наличии у больного второго здорового органа). В числе вспомогательных лечебных мероприятий используют гемодиализ (при почечной недостаточности), назначают диуретические, гипотензивные и другие средства по показаниям.
Прогноз и профилактика
Прогноз инфаркта почки определяется объемом пораженных тканей – обычно страдает относительно небольшой фрагмент органа, после рубцевания это слабо отражается на работе выделительной системы. При ишемии значительной области органа возможно развитие острой или хронической почечной недостаточности, кровотечения и прочих жизнеугрожающих состояний. Существует риск рецидива, особенно при сохранении провоцирующего фактора (эндокардитов, пороков сердца, атеросклероза магистральных сосудов).
Поскольку заболевание часто является осложнением болезней сердечно-сосудистой системы, его профилактика заключается в правильном лечении основной патологии – использовании антиагрегантных средств, антибиотиков при эндокардитах, антихолестеринемических средств в случае атеросклероза.
Источник
