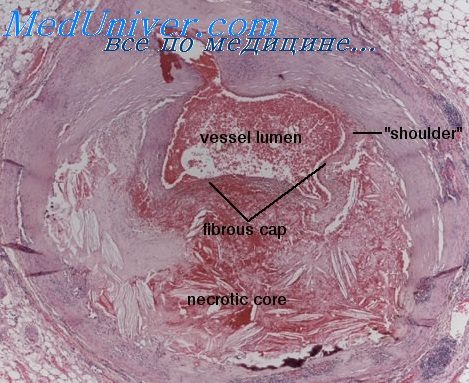
Врожденный порок сердца инфаркт миокарда
Причины инфаркта миокарда при врожденном пороке сердца. Кардиосклероз при врожденном пороке сердцаРазвитие инфарктов миокарда часто объясняют наличием атеросклероза, тромбоза и спазма коронарных артерий сердца (Н. Н. Горев и М. И. Гуревич, 1959; В, В. Парин и Ф. З. Меерсон, 1960). Какой же из перечисленных причин можно объяснить возникновение некрозов миокарда у маленьких детей при врожденных пороках сердца? За последние годы теория нарушения коронарного кровотока вследствие атероматоза оказалась в значительной мере поколебленной [С. С. Вайль, 1940; А. В. Смольянников и А. К. Апатенко, 1956; Б. А. Лапин, 1956; И. В. Давыдовский, 1958; А. В. Смольянников, 1958; Selye, 1958; А. И. Струков, 1959; Н. Н. Горев и М. И. Гуревич, 1959; Рааб (Raab, I960)]. А. И. Струков (1959) указывает, что при исследовании трупов людей старше 55 лет в 90% случаев можно обнаружить атеросклероз венечных артерий сердца без каких-либо последствий в виде инфаркта миокарда; в анамнезе у таких больных не имеется указаний на приступы стенокардии. А. В. Смольянников и Т. А. Наддачина (1960), изучив 301 сердце при В результате анализа приведенных выше наблюдений можно сделать следующее заключение: 3) инфаркты миокарда у маленьких детей при врожденных пороках сердца развиваются не только без поражения коронарных артерий, но и в условиях резкого увеличения количества новообразованных сосудов в гипертрофированных отделах миокарда;
Кардиосклероз при врожденном пороке сердцаОсобенно важным в практическом и теоретическом отношении является обнаружение в подавляющем большинстве наблюдений при врожденных пороках у маленьких детей и у молодых людей диффузного или очагового кардиосклероза. При диффузном кардиосклерозе имелось развитие грубой волокнистой соединительной ткани во всей толще мышцы, но преимущественно во внутренних слоях ее, в трабекулярных и в папиллярных мышцах. В некоторых случаях, например при тетраде Фалло, почти в каждой трабекуле был обнаружен рубец. При очаговом склерозе имелись единичные крупные и мелкие коллагеновые рубцы, располагавшиеся преимущественно во внутренних слоях миокарда. При этом в отличие от ревматизма сердца рубцы в миокарде не были территориально связаны с сосудами, т. е. не были периваскулярными. Лишь в виде исключения в 3 наблюдениях при тетраде Фалло, в 1 наблюдении при трехкамерном сердце и в 1 наблюдении при врожденном сужении артериального конуса левого желудочка мы обнаружили единичные мелкие периваскулярные очаги склероза. Диффузный кардиосклероз того или иного отдела сердца был обнаружен в 27 из 135 наблюдений (20%): при тетраде Фалло — в 16 наблюдениях, при пентаде Фалло — в 3 наблюдениях, при триаде Фалло — в 1 наблюдении, при транспозиции магистральных сосудов в сочетании с гипоплазией общего ствола легочной артерии—в 1 наблюдении, при изолированном сужении артериального конуса правого желудочка— в 1 наблюдении, при аорто-пульмональном свище — в 1 наблюдении, при болезни Лютембахера — в 1 наблюдении, при врожденном сужении артериального конуса левого желудочка — в 3 наблюдениях. Привлекает внимание, что в 25 из 27 наблюдений, в которых был обнаружен диффузный кардиосклероз, имелось сужение артериального конуса правого или левого желудочка. Таким образом, чаще всего и в наиболее резко выраженной, диффузной форме миофиброз развивается при тетраде, пентаде и триаде Фалло и при врожденном сужении устья аорты. При всем внешнем различии в клинической и анатомической картине между тетрадой, пентадой и триадой Фалло, с одной стороны, и врожденным сужением устья аорты, с другой стороны, эти пороки сердца имеют глубокое внутреннее сходство: диффузный кардиосклероз того желудочка, который выполняет главную работу по проталкиванию крови через суженный выходной тракт. При этом чем больше сужение выходного тракта, тем больше гипертрофия миокарда и кардиосклероз. Так, например, у больного Д., 25 лет, имелась крайняя степень сужения артериального конуса правого желудочка и отмечался диффузный кардиосклероз последнего, а также межжелудочковой перегородки. У больной И., 8 лет, аорта была сужена в трех местах («клапанное» сужение, гипоплазия восходящей аорты, коарктация аорты «инфантильного» типа), и у нее развился диффузный кардиосклероз левого желудочка и межжелудочковой перегородки. – Также рекомендуем “Диффузный кардиосклероза при пороках Фалло. Диффузный кардиосклероз при гипертрофии миокарда” Оглавление темы “Инфаркт миокарда и кардиосклероз при пороке сердца”: |
Источник
Клиника инфаркта миокарда при пороке сердца. Течение инфаркта миокарда при пороке сердца
Л. И. Фогельсон (1951) считает возникновение болей в сердце проявлением неадекватности коронарного кровотока у тяжелобольных. Гипоксия миокарда развивается при несоответствии сосудистого русла, питающего сердечную мышцу, с массой гипертрофированного миокарда желудочков, что особенно легко и быстро проявляется при физическом напряжении.
Возникновение болей в сердце может быть вызвано артериальной гипоксемией вследствие перекрестного или венозно-артериального сброса крови.
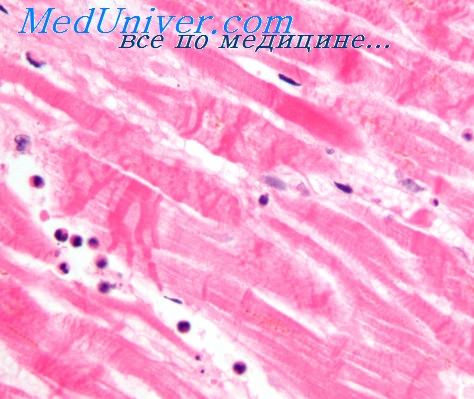
Впервые развитие инфаркта миокарда и микромиомаляции у детей описали Л. Д. Крымский (1961, 1962, 1963), Л. Д. Крымский и В. Д. Арутюнов (1963). Они наблюдали у маленьких детей деструктивные изменения от микромиомаляции до некрозов в разных стадиях развития.
Л. Д. Крымский описал патологоанатомическую картину обширного инфаркта миокарда у 2 больных в возрасте 4 и 5 лет, страдавших тетрадой Фалло. Кроме того, у 18 больных он отмечал разные стадии развития микроинфарктов миокарда: от свежих очагов до рубцов после них. Он установил, что микромиомаляции чаще всего развивались в наиболее гипертрофированной части миокарда, несущей большую часть функциональной нагрузки: например, при трикуспидальной атрезии — в левом желудочке, при тетраде Фалло — в правом.
Инфаркты миокарда возникали при минимальных изменениях коронарных сосудов, в условиях резкого увеличения количества новообразованных сосудов в гипертрофированных отделах миокарда; излюбленной локализацией их при врожденных пороках сердца является, по мнению автора, межжелудочковая перегородка. Кроме того, они могут быть одной из причин кардиосклероза при врожденных пороках сердца.
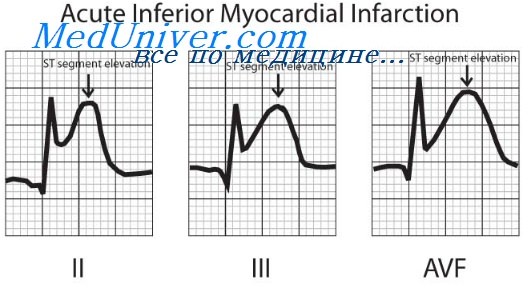
М. Р. Мордкович (1962) отмечал более тяжелое общее состояние больных с инфарктом миокарда, частые тяжелые «синюшно-одышечные» приступы у «синих» больных, изменения рентгенокимограммы и электрокардиограммы (удлинение электрической систолы и систолического показателя на 7—16%). Автор расценивал их как тяжелые дистрофические изменения миокарда. По данным электрокардиограммы, ни в одном случае он не отметил явлений коронарной недостаточности.
Развитие инфарктов миокарда у детей при минимальных изменениях коронарных артерий противоречит распространенной точке зрения о зависимости между анатомическими изменениями сосудов и инфарктом миокарда (Н. Н. Горев и М. И. Гуревич, 1959). В последнее время наряду с теорией нарушения коронарного кровотока вследствие атероматоза высказывается мнение о так называемых некоронарогенных инфарктах миокарда (А. Л. Мясников, 1962; А. Л. Мясников с соавт., 1963).
А. В. Смольянников и Т. А. Наддачина (1960) установили, что в 10% случаев всех летальных исходов от коронарной недостаточности последняя развивается при отсутствии стенозирующего атеросклероза. В 10% случаев всех обнаруженных облитераций крупных стволов коронарных артерий очаговые изменения не возникают.
Благодаря работам Bing (1955), Selye (1958), С. Е. Северина (1959) инфаркт миокарда рассматривается теперь как результат нарушения метаболизма в сердечной мышце, являющегося следствием нервных и гормональных воздействий как на коронарные сосуды, так и непосредственно на обмен веществ миокарда.
– Также рекомендуем “Инфаркты миокарда у детей. Пример инфаркта миокарда при пороке сердца”
Оглавление темы “Сопутствующая патология врожденных пороков сердца”:
1. Клиника инфаркта миокарда при пороке сердца. Течение инфаркта миокарда при пороке сердца
2. Инфаркты миокарда у детей. Пример инфаркта миокарда при пороке сердца
3. Микроинфаркты при пороке сердца. Боли в сердце при микроинфарктах
4. Частота болей в сердце при врожденных пороках. Ревмокардит при врожденных пороках сердца
5. Ревматизм при открытом артериальном протоке. Диагностика и течение ревматизма при врожденном пороке сердца
6. Легочная гипертензия при врожденном пороке сердца. Механизмы развития легочной гипертензии
7. Морфология легочной гипертензии. Частота легочной гипертензии при ВПС
8. Классификация легочной гипертензии. Клиника легочной гипертензии
9. Лечение пороков сердца с легочной гипертензией. Сердечная недостаточность при пороке сердца
10. Причины сердечной недостаточности при пороке сердца. Диастолическая перегрузка при пороке сердца
Источник
Инфаркт миокарда у детей. Инфракт при врожденном пороке сердцаВ литературе мы не нашли анатомических описаний инфаркта миокарда у детей при врожденных пороках сердца. Лишь Sones (1958), обсудивший результаты операций на «сухом» сердце у 80 больных врожденными пороками, обратил внимание на то, что у одного больного тетрадой Фалло, умершего через 20 часов после операции, был обнаружен свежий фокус некроза миокарда, причина возникновения которого осталась неизвестной. Автор лишь в одной фразе упоминает об очаге некроза миокарда. Он, к сожалению, не произвел гистологического исследования сердца. Конечно, фокус некроза миокарда мог развиться и после операции, поскольку от момента окончания последней до смерти прошел достаточно большой срок (20 часов). Однако известны трудности обнаружения очагов некроза в миокарде при макроскопическом исследовании, если от момента его возникновения до смерти прошло меньше суток. Везелл (Vesell, 1954) опубликовал клиническое наблюдение о сочетании дефекта межжелудочковой перегородки с инфарктом миокарда у мужчины 34 лет. Отмечались легкое течение и благоприятный исход заболевания. Автор указывает, что инфаркт миокарда у больного врожденным пороком сердца им описан впервые в литературе. Стуккей (Stuckey, 1955) обнаружил стенокардию у 28 из 480 (4,8%) больных врожденными пороками сердца и считает ангинозные боли у них показателем тяжести состояния. Возраст больных от 10 до 34 лет. Автор объясняет стенокардию при врожденных пороках механическим препятствием току крови в самом сердце либо за его пределами. Это обусловливает стойкое уменьшение минутного объема сердца и, следовательно, недостаточность коронарного кровотока во время физической нагрузки.
У людей со здоровым сердцем коронарный кровоток составлял 4—5% минутного объема сердца и мог достигать 12—15% после нагрузки. При отсутствии достаточного увеличения минутного объема во время физического напряжения коронарный кровоток не соответствует требованиям миокарда. При вскрытии 6 умерших, больных врожденными пороками сердца, страдавших при жизни стенокардией, не было обнаружено изменений коронарных артерий, что позволило исключить роль атеросклероза в происхождении ангинозных болей. Даунинг и Голдберг (1956) обнаружили, что 12% больных из 100, страдавших дефектом межжелудочковой перегородки, жалуются на боли в области сердца. Приведенные данные показывают, что в литературе не имеется достоверных анатомических описаний инфаркта миокарда при врожденных пороках сердца. Вследствие этого представляется целесообразным более подробно разобрать те 3 наблюдения, в которых мы обнаружили инфаркты миокарда у маленьких детей при врожденных пороках сердца. – Также рекомендуем “Пример инфаркта миокарда у ребенка. Инфаркт миокарда при тетраде Фалло” Оглавление темы “Инфаркт миокарда и кардиосклероз при пороке сердца”: |
Источник
Врожденные пороки сердца – группа заболеваний, объединенных наличием анатомических дефектов сердца, его клапанного аппарата или сосудов, возникших во внутриутробном периоде, приводящих к изменению внутрисердечной и системной гемодинамики. Проявления врожденного порока сердца зависят от его вида; к наиболее характерным симптомам относятся бледность или синюшность кожных покровов, шумы в сердце, отставание в физическом развитии, признаки дыхательной и сердечной недостаточности. При подозрении на врожденный порок сердца выполняется ЭКГ, ФКГ, рентгенография, ЭхоКГ, катетеризация сердца и аортография, кардиография, МРТ сердца и т. д. Чаще всего при врожденных пороках сердца прибегают к кардиохирургической операции – оперативной коррекции выявленной аномалии.
Общие сведения
Врожденные пороки сердца – весьма обширная и разнородная группа заболеваний сердца и крупных сосудов, сопровождающихся изменением кровотока, перегрузкой и недостаточностью сердца. Частота встречаемости врожденных пороков сердца высока и, по оценке различных авторов, колеблется от 0,8 до 1,2% среди всех новорожденных. Врожденные пороки сердца составляют 10-30% всех врожденных аномалий. В группу врожденных пороков сердца входят как относительно легкие нарушения развития сердца и сосудов, так и тяжелые формы патологии сердца, несовместимые с жизнью.
Многие виды врожденных пороков сердца встречаются не только изолированно, но и в различных сочетаниях друг с другом, что значительно утяжеляет структуру дефекта. Примерно в трети случаев аномалии сердца сочетаются с внесердечными врожденными пороками ЦНС, опорно-двигательного аппарата, ЖКТ, мочеполовой системы и пр.
К наиболее частым вариантам врожденных пороков сердца, встречающимся в кардиологии, относятся дефекты межжелудочковой перегородки (ДМЖП – 20%), дефекты межпредсердной перегородки (ДМПП), стеноз аорты, коарктация аорты, открытый артериальный проток (ОАП), транспозиция крупных магистральных сосудов (ТКС), стеноз легочной артерии (10-15% каждый).

Врожденные пороки сердца
Причины врожденных пороков сердца
Этиология врожденных пороков сердца может быть обусловлена хромосомными нарушениями (5%), генной мутацией (2-3%), влиянием факторов среды (1-2%), полигенно-мультифакториальной предрасположенностью (90%).
Различного рода хромосомные аберрации приводят к количественным и структурным изменениям хромосом. При хромосомных перестройках отмечаются множественные полисистемные аномалии развития, включая врожденные пороки сердца. В случае трисомии аутосом наиболее частыми пороками сердца оказываются дефекты межпредсердной или межжелудочковой перегородок, а также их сочетание; при аномалиях половых хромосом врожденные пороки сердца встречаются реже и представлены, главным образом, коарктацией аорты или дефектом межжелудочковой перегородки.
Врожденные пороки сердца, обусловленные мутациями единичных генов, также в большинстве случаев сочетаются с аномалиями других внутренних органов. В этих случаях сердечные пороки являются частью аутосомно-доминантных (синдромы Марфана, Холта-Орама, Крузона, Нунана и др.), аутосомно-рецессивных синдромов (синдром Картагенера, Карпентера, Робертса, Гурлер и др.) или синдромов, сцепленных с Х-хромосомой (синдромы Гольтца, Аазе, Гунтера и др.).
Среди повреждающих факторов внешней среды к развитию врожденных пороков сердца приводят вирусные заболевания беременной, ионизирующая радиация, некоторые лекарственные препараты, пагубные привычки матери, производственные вредности. Критическим периодом неблагоприятного воздействия на плод являются первые 3 месяца беременности, когда происходит фетальный органогенез.
Внутриутробное поражение плода вирусом краснухи наиболее часто вызывает триаду аномалий – глаукому или катаракту, глухоту, врожденные пороки сердца (тетраду Фалло, транспозицию магистральных сосудов, открытый артериальный проток, общий артериальный ствол, клапанные пороки, стеноз легочной артерии, ДМЖП и др.). Также обычно имеют место микроцефалия, нарушение развития костей черепа и скелета, отставание в умственном и физическом развитии.
Кроме краснухи беременной, опасность для плода в плане развития врожденных пороков сердца представляют ветряная оспа, простой герпес, аденовирусные инфекции, сывороточный гепатит, цитомегалия, микоплазмоз, токсоплазмоз, листериоз, сифилис, туберкулез и др.
В структуру эмбриофетального алкогольного синдрома обычно входят дефекты межжелудочковой и межпредсердной перегородки, открытый артериальный проток. Доказано, что тератогенное действие на сердечно-сосудистую систему плода оказывает прием амфетаминов, приводящий к транспозиции магистральных сосудов и ДМЖП; противосудорожных средств, обусловливающих развитие стеноза аорты и легочной артерии, коарктации аорты, открытого артериального протока, тетрады Фалло, гипоплазии левых отделов сердца; препаратов лития, приводящих к атрезии трехстворчатого клапана, аномалии Эбштейна, ДМПП; прогестагенов, вызывающих тетраду Фалло, другие сложные врожденные пороки сердца.
У женщин, страдающих преддиабетом или диабетом, дети с врожденными пороками сердца рождаются чаще, чем у здоровых матерей. В этом случае у плода обычно формируются ДМЖП или транспозиция крупных сосудов. Вероятность рождения ребенка с врожденным пороком сердца у женщины с ревматизмом составляет 25 %.
Кроме непосредственных причин, выделяют факторы риска формирования аномалий сердца у плода. К ним относят возраст беременной младше 15-17 лет и старше 40 лет, токсикозы I триместра, угрозу самопроизвольного прерывания беременности, эндокринные нарушения у матери, случаи мертворождения в анамнезе, наличие в семье других детей и близких родственников с врожденными пороками сердца.
Классификация врожденных пороков сердца
Существует несколько вариантов классификаций врожденных пороков сердца, в основу которых положен принцип изменения гемодинамики. С учетом влияния порока на легочный кровоток выделяют:
- врожденные пороки сердца с неизмененным (либо незначительно измененным) кровотоком в малом круге кровообращения: атрезия аортального клапана, стеноз аорты, недостаточность легочного клапана, митральные пороки (недостаточность и стеноз клапана), коарктация аорты взрослого типа, трехпредсердное сердце и др.
- врожденные пороки сердца с увеличенным кровотоком в легких: не приводящие к развитию раннего цианоза (открытый артериальный проток, ДМПП, ДМЖП, аортолегочный свищ, коарктация аорты детского типа, синдром Лютамбаше), приводящие к развитию цианоза (атрезия трехстворчатого клапана с большим ДМЖП, открытый артериальный проток с легочной гипертензией)
- врожденные пороки сердца с обедненным кровотоком в легких: не приводящие к развитию цианоза (изолированный стеноз легочной артерии), приводящие к развитию цианоза (сложные пороки сердца – болезнь Фалло, гипоплазия правого желудочка, аномалия Эбштейна)
- комбинированные врожденные пороки сердца, при которых нарушаются анатомические взаимоотношения между крупными сосудами и различными отделами сердца: транспозиция магистральных артерий, общий артериальный ствол, аномалия Тауссиг-Бинга, отхождение аорты и легочного ствола из одного желудочка и пр.
В практической кардиологии используется деление врожденных пороков сердца на 3 группы: пороки «синего» (цианотического) типа с веноартериальным шунтом (триада Фалло, тетрада Фалло, транспозиция магистральных сосудов, атрезия трехстворчатого клапана); пороки «бледного» типа с артериовенозным сбросом (септальные дефекты, открытый артериальный проток); пороки с препятствием на пути выброса крови из желудочков (стенозы аорты и легочной артерии, коарктация аорты).
Нарушения гемодинамики при врожденных пороках сердца
В результате выше названных причин у развивающего плода может нарушаться правильное формирование структур сердца, что выражается в неполном или несвоевременном закрытии перепонок между желудочками и предсердиями, неправильном образовании клапанов, недостаточном повороте первичной сердечной трубки и недоразвитии желудочков, аномальном расположении сосудов и т. д. После рождения у части детей остаются открытыми артериальный проток и овальное окно, которые во внутриутробном периоде функционируют в физиологическом порядке.
Ввиду особенностей антенатальной гемодинамики, кровообращение развивающегося плода при врожденных пороках сердца, как правило, не страдает. Врожденные пороки сердца проявляются у детей сразу после рождения или через какое-то время, что зависит от сроков закрытия сообщения между большим и малым кругами кровообращения, выраженности легочной гипертензии, давления в системе легочной артерии, направления и объема сброса крови, индивидуальных адаптационных и компенсаторных возможностей организма ребенка. Нередко к развитию грубых нарушений гемодинамики при врожденных пороках сердца приводит респираторная инфекция или какое-либо другое заболевание.
При врожденных пороках сердца бледного типа с артериовенозным сбросом вследствие гиперволемии развивается гипертензия малого круга кровообращения; при пороках синего типа с веноартериальным шунтом у больных имеет место гипоксемия.
Около 50% детей с большим сбросом крови в малый круг кровообращения погибают без кардиохирургической помощи на первом году жизни от явлений сердечной недостаточности. У детей, перешагнувших этот критический рубеж, сброс крови в малый круг уменьшается, самочувствие стабилизируется, однако постепенно прогрессируют склеротические процессы в сосудах легких, обусловливая легочную гипертензию.
При цианотических врожденных пороках сердца венозный сброс крови или ее смешение приводит к перегрузке большого и гиповолемии малого круга кровообращения, вызывая снижение насыщения крови кислородом (гипоксемию) и появление синюшности кожи и слизистых. Для улучшения вентиляции и перфузии органов развивается коллатеральная сеть кровообращения, поэтому, несмотря на выраженные нарушения гемодинамики, состояние больного может длительное время оставаться удовлетворительным. По мере истощения компенсаторных механизмов, вследствие длительной гиперфункции миокарда, развиваются тяжелые необратимые дистрофические изменения в сердечной мышце. При цианотических врожденных пороках сердца оперативное вмешательство показано уже в раннем детском возрасте.
Симптомы врожденных пороков сердца
Клинические проявления и течение врожденных пороков сердца определяется видом аномалии, характером нарушений гемодинамики и сроками развития декомпенсации кровообращения.
У новорожденных с цианотическими врожденными пороками сердца отмечается цианоз (синюшность) кожных покровов и слизистых оболочек. Синюшность усиливается при малейшем напряжении: сосании, плаче ребенка. Белые пороки сердца проявляются побледнением кожи, похолоданием конечностей.
Дети с врожденными пороками сердца обычно беспокойные, отказываются от груди, быстро устают в процессе кормления. У них появляется потливость, тахикардия, аритмии, одышка, набухание и пульсация сосудов шеи. При хроническом нарушении кровообращения дети отстают в прибавлении веса, росте и физическом развитии. При врожденных пороках сердца обычно сразу поле рождения выслушиваются сердечные шумы. В дальнейшем обнаруживаются признаки сердечной недостаточности (отеки, кардиомегалия, кардиогенная гипотрофия, гепатомегалия и др.).
Осложнениями врожденных пороков сердца могут стать бактериальный эндокардит, полицитемия, тромбозы периферических сосудов и тромбоэмболии сосудов головного мозга, застойные пневмонии, синкопальные состояния, одышечно-цианотические приступы, стенокардитический синдром или инфаркт миокарда.
Диагностика врожденных пороков сердца
Выявление врожденных пороков сердца осуществляется путем комплексного обследования. При осмотре ребенка отмечают окраску кожных покровов: наличие или отсутствие цианоза, его характер (периферический, генерализованный). При аускультации сердца нередко выявляется изменение (ослабление, усиление или расщепление) сердечных тонов, наличие шумов и пр. Физикальное обследование при подозрении на врожденный порок сердца дополняется инструментальной диагностикой – электрокардиографией (ЭКГ), фонокардиографией (ФКГ), рентгенографией органов грудной клетки, эхокардиографией (ЭхоКГ).
ЭКГ позволяет выявить гипертрофию различных отделов сердца, патологическое отклонение ЭОС, наличие аритмий и нарушений проводимости, что в совокупности с данными других методов клинического обследования позволяет судить о тяжести врожденного порока сердца. С помощью суточного холтеровского ЭКГ-мониторирования обнаруживаются скрытые нарушения ритма и проводимости. Посредством ФКГ более тщательно и детально оценивается характер, длительность и локализация сердечных тонов и шумов. Данные рентгенографии органов грудной клетки дополняют предыдущие методы за счет оценки состояния малого круга кровообращения, расположения, формы и размеров сердца, изменений со стороны других органов (легких, плевры, позвоночника). При проведении ЭхоКГ визуализируются анатомические дефекты перегородок и клапанов сердца, расположение магистральных сосудов, оценивается сократительная способность миокарда.
При сложных врожденных пороках сердца, а также сопутствующей легочной гипертензии, с целью точной анатомической и гемодинамической диагностики, возникает необходимость в выполнении зондирования полостей сердца и ангиокардиографии.
Лечение врожденных пороков сердца
Наиболее сложной проблемой в детской кардиологии является хирургическое лечение врожденных пороков сердца у детей первого года жизни. Большинство операций в раннем детском возрасте выполняется по поводу цианотических врожденных пороков сердца. При отсутствии у новорожденного признаков сердечной недостаточности, умеренной выраженности цианоза операция может быть отложена. Наблюдение за детьми с врожденными пороками сердца осуществляют кардиолог и кардиохирург.
Специфическое лечение в каждом конкретном случае зависит от разновидности и степени тяжести врожденного порока сердца. Операции при врожденных дефектах перегородок сердца (ДМЖП, ДМПП) могут включать пластику или ушивание перегородки, рентгенэндоваскулярную окклюзию дефекта. При наличии выраженной гипоксемии детям с врожденными пороками сердца первым этапом выполняется паллиативное вмешательство, предполагающее наложение различного рода межсистемных анастомозов. Подобная тактика улучшает оксигенацию крови, уменьшает риск осложнений, позволяет провести радикальную коррекцию в более благоприятных условиях. При аортальных пороках выполняется резекция или баллонная дилатация коарктации аорты, пластика аортального стеноза и др. При ОАП производится его перевязка. Лечение стеноза легочной артерии заключается в проведении открытой или эндоваскулярной вальвулопластики и т. д.
Анатомически сложные врожденные пороки сердца, при которых радикальная операция не представляется возможной, требуют выполнения гемодинамической коррекции, т. е. разделения артериального и венозного потоков крови без устранения анатомического дефекта. В этих случаях могут проводиться операции Фонтена, Сеннинга, Мастарда и др. Серьезные пороки, не поддающиеся оперативному лечению, требуют проведения пересадки сердца.
Консервативное лечение врожденных пороков сердца может включать в себя симптоматическую терапию одышечно-цианотических приступов, острой левожелудочковой недостаточности (сердечной астмы, отека легких), хронической сердечной недостаточности, ишемии миокарда, аритмий.
Прогноз и профилактика врожденных пороков сердца
В структуре смертности новорожденных врожденные пороки сердца занимают первое место. Без оказания квалифицированной кардиохирургической помощи в течение первого года жизни погибает 50-75% детей. В периоде компенсации (2-3 года) смертность снижается до 5%. Ранее выявление и коррекция врожденного порока сердца позволяет существенно улучшить прогноз.
Профилактика врожденных пороков сердца требует тщательного планирования беременности, исключения воздействия неблагоприятных факторов на плод, проведения медико-генетического консультирования и разъяснительной работы среди женщин групп риска по рождению детей с сердечной патологией, решения вопроса о пренатальной диагностике порока (УЗИ, биопсия хориона, амниоцентез) и показаниях к прерыванию беременности. Ведение беременности у женщин с врожденными пороками сердца требует повышенного внимания со стороны акушера-гинеколога и кардиолога.
Источник