Рекомендации ведению больных ишемическим инсультом
А.П. СКОРОХОДОВ, заведующий нейрососудистым отделением ГКБ СМП №1, доктор медицинских наук, профессор кафедры неврологии с нейрохирургией ИПМО ВГМА им. Н.Н. Бурденко
Острый инсульт является одной из ведущих причин заболеваемости и смертности во всем мире. По данным ВОЗ, инсульт является второй по частоте причиной смерти. В Европе каждый год возникает около 1 млн острых ишемических инсультов (ИИ). В России ежегодно регистрируется более 400 тысяч инсультов, из них ишемические составляют 80—85%. До недавнего времени во взглядах на проблему неотложной помощи больным с инсультом доминировал «терапевтический нигилизм». Однако улучшение понимания патофизиологических процессов и новые лечебные технологии изменили ведение больных с инсультом.
Основными этапами медицинской помощи при остром нарушении мозгового кровообращения (ОНМК) являются следующие: догоспитальный, госпитальный, амбулаторно-поликлинический.
1. Догоспитальный этап
Он включает диагностику ОНМК, неотложные лечебные мероприятия, а также экстренную госпитализацию больного. Здесь необходим вызов врача скорой помощи, который должен прежде всего осмотреть больного, собрать анамнез, исключить другие причины ухудшения состояния (ими могут быть гипергликемия, гипогликемия, отравление, инфекция, черепно-мозговая травма, обмороки, мигрень, почечная или печеночная недостаточность), наконец, установить диагноз инсульта пока не уточненного характера.
Основную роль при этом играет анамнез, тщательно собранный со слов род-ственников, окружающих или самого больного, а также характеристика развития неврологических нарушений во времени. Внезапное и острое, в течение нескольких секунд или минут, развитие неврологического дефицита в виде слабости и/или онемения конечностей, лица и, нередко, нарушения речи у лиц, как правило, среднего или пожилого возраста на фоне значительного эмоционального, физического напряжения или сразу после сна, приема горячей ванны, при высоком или, наоборот, низком артериальном давлении позволяет достаточно точно поставить диагноз ОНМК.
Основные этапы медицинской помощи при остром нарушении мозгового кровообращения:
1. Догоспитальный.
2. Госпитальный.
3. Амбулаторно-поликлинический.
Наступление инсульта, как правило, сопровождается внезапным появлением у пациента следующих симптомов:
Однако надо помнить и о возможном развитии других симптомов и их комбинаций. Это, например, различные виды нарушений уровня бодрствования от оглушения до сопора и комы, глотания или координации движений; появление двоения в глазах, головокружения.
Неотложные лечебные мероприятия
Неотложные мероприятия бригады врачей скорой медицинской помощи по прибытии к больному инсультом должны включать в себя комплекс обязательных мер, которые проводятся сразу же после общего осмотра больного.
Оценка адекватности оксигенации и ее коррекция
О неадекватности оксигенации свидетельствуют:
увеличение частоты и аритмичность дыхательных движений;
цианоз видимых слизистых оболочек и ногтевых лож;
участие в акте дыхания вспомогательной мускулатуры;
набухание шейных вен.
Наиболее простым способом улучшения оксигенации является подача больному через носовые ходы кислорода со скоростью 2—4?л/мин. Обеспечение эффективной оксигенации при необходимости осуществляется постановкой воздуховода и очищением дыхательных путей. При нарушениях дыхания противопоказаны: лобелин гидрохлорид (угнетает дыхание, может спровоцировать тонико-клонические судороги, снижает артериальное давление (АД) и вызывает рвоту); цитизин (обладает очень кратковременным действием и не стабилизирует нормальное дыхание); камфора, прокаин с сульфокамфорной кислотой, никетамид (способствуют развитию судорожного синдрома и угнетают дыхание).
Коррекция нарушений кровообращения
Осуществляется путем стабилизации АД на уровне 180/100 мм рт. ст. у больных с артериальной гипертонией и на уровне 160/90?мм?рт.?ст. у нормотоников. Снижать АД в тех случаях, когда оно превышает указанные величины, не следует более чем на 15—20% от исходных. Наиболее часто применяют каптоприл 6,25—12,5 мг или эналаприл 5—10 мг. При недостаточной эффективности возможно введение в/в 1—2?мл 1%-ного раствора проксодолола в течение 1?минуты, повторно каждые 5 минут до достижения эффекта, но не более 10 мл 1%-ного раствора. Не рекомендуется назначать нифедипин из-за риска резкого снижения АД.
При артериальной гипотензии рекомендуется применение симпатомиметиков, препаратов, улучшающих сократимость миокарда (сердечные гликозиды), объемовосполняющих средств (низкомолекулярные декстраны, крахмалы и кристаллоидные растворы).
Купирование психомоторного
возбуждения, судорог
С этой целью используются бензодиазепины короткого действия, вводимые внутривенно: диазепам 0,2—0,4мг/кг, мидазолам 0,2—0,4 мг/кг. При неэффективности применяют вольпроат натрия (в/в 6 мг/кг в течение 3 минут с последующим переходом на 1—2 мг/кг/ч); тиопентал натрия (флакон растворяют 10 мл физиологического раствора натрия и вводят внутримышечно из расчета 1 мл на 10 кг веса больного).
Определение уровня глюкозы в крови
и его коррекция
Определение уровня глюкозы в крови проводится с помощью стандартного экспресс-теста. Коррекция при высоких значениях глюкозы осуществляется простым инсулином, при низком содержании — с помощью в/в водимого 40%-ного раствора глюкозы. При отсутствии возможности провести определение глюкозы в крови, но подозрении на нарушение углеводного обмена следует руководствоваться правилом: гипогликемия более опасна для жизни, чем гипергликемия. Исходя из этого, рекомендуется внутривенное введение 50—60 мл 40%-ной глюкозы. При наличии гипогликемии этим можно спасти больного, в то же время при гипергликемии дополнительное введение данного количества глюкозы не приведет к трагическим последствиям.
Первостепенные задачи оказания медицинской помощи больным с острым тяжелым инсультом на догоспитальном этапе — это поддержание жизненно важных функций и немедленная доставка пациента в соответствующий стационар. Противопоказанием для госпитализации больного с ОНМК является только его агональное состояние.
2. Госпитальный этап
При поступлении больного в стационар все последующие мероприятия должны проводиться в максимально сжатые сроки. Это, прежде всего, касается пациентов, у которых инсульт развился менее 3-х часов назад и еще есть возможность определения характера инсульта и проведения тромболизиса при его ишемическом генезе.
Тромболитическая терапия при ИИ должна проводиться в стационарах скорой медицинской помощи, в условиях отделения нейрореанимации или блока интенсивной терапии, при условии обязательного наличия в структуре стационара круглосуточных служб нейровизуализации с использованием компьютерной или магнитно-резонансной томографии и лабораторной диагностики.
Тромболизис может проводиться только после исключения геморрагического характера поражения мозга. Желательным также является первичное проведение и мониторирование ультразвуковой транскраниальной допплерографии для уточнения факта окклюзии артерии, верификации локализации окклюзии и контроля за постепенным открыванием сосуда.
Важнейшие задачи оказания медицинской помощи больным с острым тяжелым инсультом на догоспитальном этапе — это поддержание жизненно важных функций и немедленная доставка пациента в стационар. Противопоказанием для госпитализации больного с ОНМК является только его агональное состояние.
Необходимо максимально стремиться к сокращению времени от момента поступления больного в стационар до начала внутривенного введения алтеплазы (время «от двери до иглы»).
- Врач скорой помощи должен по телефону сообщить в блок интенсивной терапии неврологического отделения о том, что он транспортирует больного с ишемическим инсультом, которому показана тромболитическая терапия.
- Врач-невролог блока встречает больного в приемном отделении и транспортирует вместе с медперсоналом приемного отделения на компьютерную томографию. За время транспортировки и проведения этого обследования уточняет анамнез у родственников или самого больного.
- Осмотр и оценка неврологического статуса по шкале NIHSS.
- Измерение уровня АД на обеих руках.
- Установка кубитального периферического венозного катетера.
- Измерение уровня глюкозы в сыворотке крови.
- Забор крови и выполнение следующих лабораторных анализов:
- количество тромбоцитов;
- активированное частичное тромбопластиновое время;
- международное нормализованное отношение (МНО).
- В случае, если больной соответствует критериям включения его в тромболитическую терапию, после осмотра неврологом и выполнения компьютерной томографии головного мозга необходимо обеспечить мониторирование следующих жизненно важных функций в блоке в течение как минимум 48 часов:
- уровня АД;
- частоты сердечных сокращений (ЧСС);
- частоты дыхания (ЧД);
- температуры тела;
- сатурации кислородом (SaO2).
Подчеркну, что введение алтеплазы должно быть начато как можно раньше от начала заболевания. Рекомендуемая доза — 0,9 мг/кг массы тела (максимальная доза 90 мг). 10% всей дозы для пациента вводится в виде болюса внутривенно струйно в течение 1 минуты. Оставшаяся доза вводится внутривенно капельно в течение 1 часа.
Во время и после проведения тромболизиса чрезвычайно важен мониторинг основных жизненно важных функций: АД, ЧСС,ЧД, температуры тела, SaO2 .Во время процедуры тромболитической терапии необходимо контролировать динамику неврологического статуса, наиболее оптимальным является использование шкалы для оценки неврологического дефицита (шкала NIHSS).
Комплекс мероприятий, обязательных для проведения в стационаре:
- общие медицинские мероприятия—наблюдение и уход за больным;
- профилактика и лечение основных неврологических осложнений;
- специальные методы лечения инсульта;
- профилактика и лечение экстрацеребральных осложнений;
- реабилитационные мероприятия;
- мероприятия по ранней профилактике повторного инсульта.
Наблюдение за больным
Наблюдение за больным необходимо для выработки адекватной тактики по его ведению и включает в себя ряд мероприятий: мониторинг неврологического статуса, оксигенации крови, АД, ЭКГ, внутричерепного давления и церебрального перфузионного давления, центрального венозного давления; контроль основных параметров гомеостаза.
Уход за больным
Уход за больными в острой стадии инсульта, которые часто не только не могут самостоятельно повернуться в кровати, но и находятся в бессознательном состоянии, также является крайне ответственным мероприятием. Он должен включать в себя ежедневное выполнение следующих действий:
- повороты с боку на бок;
- протирание тела;
- регулярные клизмы и опорожнение мочевого пузыря;
- введение адекватного объема жидкости;
- туалет рото- и носоглотки;
- санация трахеобронхиального дерева (при проведении искусственной вентиляции легких);
- контроль за глотанием и питанием;
- профилактика стрессорных язв желудочно-кишечного тракта;
- антибактериальная терапия по показаниям;
- профилактика ДВС-синдрома и тромбоэмболии легочной артерии;
- проведение пассивной гимнастики и массажа.
Лечение основных неврологических осложнений
К основным патогенетическим изменениям мозга в процессе развития инфаркта мозга, сопровождающимся характерными неврологическими нарушениями, относятся следующие: отек мозга и острая обструктивная гидроцефалия.
Для лечения отека мозга необходима гипервентиляция в условиях искусственной вентиляции легких, снижение РаСО2 до уровня 30 мм рт. ст. Из осмотических диуретиков чаще всего используется маннитол внутривенно капельно в первоначальной дозе 0,5—2,0 г/кг массы тела в течение 20—25 минут, а затем в дозе, составляющей половину от первоначальной, каждые 4—6?часов, не более 3—4 суток. В случае отсутствия маннитола или при невосполненной гиповолемии внутривенно каждые 3—6?часов вводится по 100—150 мл 3%-ного раствора натрия хлорида в течение того же периода.
Оптимальной является следующая модель
этапной реабилитации после инсульта:
1-й этап – реабилитация начинается в неврологическом отделении больницы, куда доставлен больной бригадой скорой помощи;
2-й этап – по окончании острого периода с полным восстановлением нарушенных функций больной выписывается на амбулаторное долечивание или переводится в санаторий, а больной с выраженным двигательным дефицитом переводится в реабилитационное отделение.
3-й этап – амбулаторная реабилитация, реабилитация на дому.
Основными методами лечения острой обструктивной гидроцефалии являются дренаж боковых желудочков, декомпрессия задней черепной ямы и/или удаление некротизированной ткани при инфаркте мозжечка.
Нейропротекция
Нейропротекция — комплекс универсальных методов защиты мозга от структурных повреждений. Она должна начинаться уже на догоспитальном этапе лечения и продолжаться в стационаре.
С целью метаболической защиты мозга при любом типе инсульта используют препараты, корригирующие энергетический обмен, антиоксиданты и средства, обладающие нейротрансмиттерным и нейромодуляторным действием:
- пирацетам 12 г внутривенно;
- глицин сублингвально по 1—2?г в сутки;
- семакс 1% по 3 капли эндонозально;
- депротеинизированный гемодериват внутривенно 10—20%-ный инфузионный раствор по 250 мл;
- сернокислая магнезия 25%-ная 20,2?мл в 200 мл изотонического раствора натрия внутривенно капельно 2 раза в день;
- метилэтилпиридинол по 15 мл 1%-ного раствора внутривенно;
- церебролизин 10—30 мл внутривенно;
- кортексин 10 мг внутримышечно;
- этилметилгидроксипиридин сукцинат по 200—300 мг внутривенно капельно;
- холин альфосцерат по 1 г внутривенно капельно и др.
Антитромбоцитарные препараты
- ацетилсалициловая кислота 1 мг/кг массы тела;
- дипиридамол 25 мг 3 раза в день;
- клопидогрель 75 мг 1 раз в день;
- пентоксифиллин 200 мг внутривенно капельно и др.
Вазоактивные препараты
- винпоцетин 10—20 мг внутривенно капельно;
- ницерголин 4 мг внутримышечно;
- аминофиллин 10 мл внутривенно и др.
Улучшение церебральной перфузии и улучшение реологических свойств крови
- реополиглюкин 200—400 мл внутривенно капельно;
- декстран 400 мл внутривенно капельно.
Антикоагулянты прямого действия — по показаниям
- гепарин 5000 ЕД 4—6 раз в сутки подкожно;
- фраксипарин 7500 ЕД подкожно 2 раза в сутки.
Антикоагулянты непрямого действия (оральные антикоагулянты)
- варфарин 2—5 мг в сутки под контролем МНО;
- фениндион 100 мг/сутки.
3. Амбулаторно-поликлинический этап
Реабилитация — комплекс мероприятий (медикаментозных, физических, педагогических, психологических, правовых), направленных на восстановление нарушенных в результате заболевания функций, социальной адаптации, качества жизни, а тогда, когда это возможно, и трудоспособности. Реабилитация также должна включать профилактику постинсультных осложнений и профилактику повторных инсультов. Длительность реабилитации определяется сроками восстановления нарушенных функций. Следует помнить, что максимальное улучшение двигательных функций отмечается в первые 6 месяцев, бытовых навыков и трудоспособности — в течение 1 года, речевых функций — на протяжении 2—3?лет с момента развития инсульта.
Оптимальной является следующая модель этапной реабилитации после инсульта:
- 1-й этап — реабилитация начинается в неврологическом отделении больницы, куда доставлен больной бригадой скорой помощи;
- 2-й этап — по окончании острого периода с полным восстановлением нарушенных функций больной выписывается на амбулаторное долечивание или переводится в санаторий, а больной с выраженным двигательным дефицитом переводится в реабилитационное отделение.
- 3-й этап — амбулаторная реабилитация, реабилитация на дому.
Источник
Драматическая статистика инсульта – пугающая распространенность (более полумиллиона человек ежегодно в России испытывают острое нарушение мозгового кровообращения), его высокая летальность (123 на 100 000 населения), значительная инвалидизация (56–81%) и социальная дезадаптация1 пациентов определили особое положение в современном здравоохранении и повышенное внимание со стороны медицинской общественности к его проблемам. И прежде всего к реабилитации пациентов, перенесших его, – справедливо считаемой чрезвычайно важной, сложной и дискуссионной.
Постинсультная реабилитация – совокупность мер и методов, нацеленных на продолжение лечения, начатого в остром периоде, и способствующих устранению или компенсированию повреждений после инсульта.
В последние годы появилось достаточно данных, подтвержденных серьезными исследованиями, ставших причиной отхода специалистов от разработанной ранее GRADE-концепции (модели преемственной помощи) и других рекомендуемых принципов2 в пользу новых, делающих ставку на грамотную организацию инсультного отделения, которая позволяет снижать смертность и инвалидизацию именно за счет того, что в таком отделении проводятся не только диагностика и терапия, но и всесторонние реабилитационные мероприятия.
Акцентируют внимание врачей на острую необходимость постинсультной реабилитации и последние международные рекомендательные документы – Rehabilitation 2030 (ВОЗ), Report on Stroke in Europe (Европейского альянса по инсульту). Еще один документ ВОЗ (Global Stroke Bill of Rights) представляет реабилитацию и социальную реинтеграцию как основное право пациента после инсульта.3
Новые отношения к ведению пациентов, перенесших острое нарушение мозгового кровообращения, отражают последние (2018 г.) Рекомендации Американской ассоциации сердца/Американской ассоциации инсульта (American Heart Association/American Stroke Association) по раннему уходу за пациентами с острым ишемическим инсультом.4
Интересным и значимым событием стал и выход в 2018 году Австрийского руководства (Клинические рекомендации по реабилитации после инсульта).5 Согласно этому документу, цель реабилитации – «начать общие и специфические методы лечения как можно раньше, сразу после терапии в реанимации, чтобы помочь пациенту быстрее вернуться к прежней жизни или заново адаптироваться к окружающему пространству, социальной среде».
Сегодня становится все более очевидным, что реабилитация должна начинаться в первые 24–48 часов от развития инсульта, проводиться в отделении неотложной терапии и основываться на индивидуальном подходе, комплексной оценке, обоснованности выбора диагностических, лечебных методов. Основная регламентация реабилитационных мероприятий сегодня связана с Международной классификацией функционирования, жизнедеятельности и здоровья (МФК). Реабилитационные активности различаются по уровню (структурный, функциональный), по целям, видам и степени активности пациента. Мероприятия должны быть релевантными состоянию больного (уровень доказательности A), легко измеряться и подстраиваться под пациента, иметь достаточный мотивационный компонент.

И конечно же она требует наличия мультидисциплинарной команды, в которую, помимо невролога и физиотерапевта, должны войти логопед, психолог, эрготерапевт, социальный работник, другие специалисты.
Важный аспект реабилитации – физическая активность. В постинсультном периоде она снижает инвалидизацию, повышает кардиореспираторную толерантность к ходьбе, улучшает когнитивные функции и настроение, повышает работоспособность, а также влияет на другие аспекты, связанные с инсультом (уровень В). Комплексы физических упражнений должны разрабатываться для всех перенесших инсульт пациентов (кто способен их выполнять) вместе с программами по кардиореабилитации. Пациентам также должны предлагаться способы логопедической коррекции и когнитивные тренинги.
Хорошие результаты дают различные виды реабилитации в поликлинике, дневном стационаре или на дому в течение первого года после выписки больного из клиники. Далеко не последнее место занимает здесь и активное вовлечение в реабилитационный процесс родственников, близких для больного людей.
Эти основополагающие принципы позволяют снижать степень инвалидизации, повышать качество жизни пациентов и помогают более быстрой адаптации – и личной, и бытовой, и социальной, и профессиональной.6
Важную роль в этом подходе играет также медикаментозная нейрореабилитация, выстроенная на принципах доказательной медицины. Последние годы дали достаточно доказательств того, что защита нейрососудистой структуры от ишемического повреждения имеет первостепенное значение. Появилась и возможность применения современных репаративных лекарственных средств (терапия стволовыми клетками, моноклональными антителами). К этой группе относятся и экстракты из биологических тканей животных, другие ускорители восстановления.7 Новые возможности сегодня позволяют изучать патофизиологические процессы на молекулярном уровне, а это означает, что необходимо переоценить те исследования эффективности существующих нейропротекторов, которые были проведены с менее высокой степенью точности.7
Серьезного внимания требует и поздняя реабилитация после инсульта (после года). Стойкое нарушение жизнедеятельности организма ведет к дальнейшему ухудшению и сопутствующим дисфункциям. Спастичность, болевой синдром, парестезии, изменения температурной чувствительности часто развиваются только на этапе хронизации. Целевые физические тренировки для верхних конечностей пациентов, для развития равновесия и ходьбы оказывали положительный эффект даже спустя год (и более) после инсульта.8 Важно отметить и значение профессиональной реабилитации, которая для работающих пациентов – необходимый фактор для возвращения к полноценной жизни.
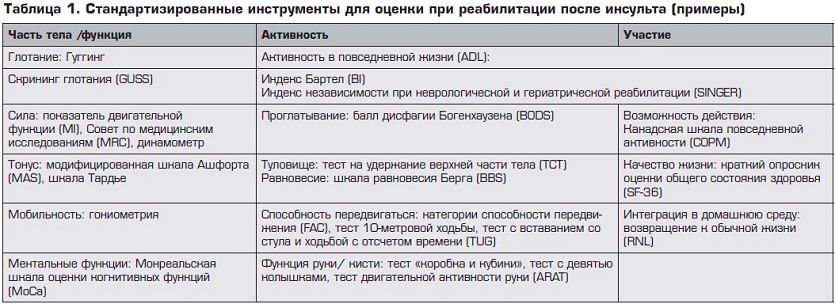
Перед началом реабилитации в течение первых 48 часов должна проводиться терапевтическая оценка. Оцениваются конкретные функциональные ограничения каждого пациента по отдельным системам организма и их функциональному состоянию, по уровню активности больного, его взаимодействию с социальной средой.9 После этого определяется набор соответствующих инструментов для достижения поставленных целей реабилитации (уровень B).
Медикаментозная терапия и нейровосстановление
С точки зрения экспертов, готовящих Австрийское руководство по реабилитации после инсульта,5 как и многих их зарубежных коллег, сегодня необходимо серьезное внимание обращать на такие понятия, как нейрорепарация, нейропластичность и нейровосстановление. Сам механизм развития заболевания ставит перед врачами важнейшую задачу – максимально раннее предотвращение смерти нейронов (нейропротекция) и затем реорганизацию нейрональных сетей, таким образом, обеспечивая преемственность между нейропротекцией и нейровосстановлением.
Медикаментозная терапия объективно способна ускорять нейровосстановление (нейропротективную терапию, цитопротекцию, метаболическую защиту мозга). Этот процесс сложен и разнообразен, отражает многогранность механизмов ишемического повреждения ткани мозга.10 Основные ее направления – антиоксидантная терапия, торможение местной воспалительной реакции (антагонисты провоспалительных цитокинов и молекул клеточной адгезии), улучшение трофического обеспечения мозга (нейротрофины), нейроиммуномодуляция (нейропептиды), регуляция рецепторных структур (ганглиозиды).11 Сегодня есть данные о положительном влиянии леводопы,12 специфических пептидных комплексов (Церебролизина).13–15
Действие последнего препарата стоит рассмотреть подробнее. В прошлом году он был включен в стандарты реабилитационных мероприятий после инсульта в Австрии.5
Институт инсульта Австрии признал возможности нейротрофической поддержки в реабилитации пациентов после инсульта. Клинические рекомендации по реабилитации содержат единственный нейротрофический препарат – Церебролизин (ЭВЕР Фарма Йена ГмбХ) (с уровнем доказательности II,B)5.
Особенность препарата, по мнению специалистов, заключается в том, что механизм его действия не ограничивается только нейропротекцией, его основное действие – модуляция эндогенного восстановления головного мозга после повреждения.
Как известно, естественная защитная реакция мозга в первые минуты ишемии – синтез нейротрофических факторов (и рецепторов к ним). Именно их высокий уровень обеспечивает регресс неврологического дефицита даже при сохранении вызвавшего его морфологического дефекта. Нейротрофическими и ростовыми свойствами обладают эндогенные низкомолекулярные нейрополипептиды, избирательно действующие на центральные холинергические нейроны, демонстрирующие нейропротективные, репаративные и пролиферативные эффекты. Они свободно преодолевают ГЭБ, их физиологическая активность во много раз выше, чем непептидных соединений. При этом они (в зависимости от места высвобождения) могут осуществлять разнообразные функции: медиаторную, модулятора реактивности определенных групп нейронов, регулятора тканевого метаболизма и многие другие.16
Нейротрофической активностью в полной мере обладает комплекс специфических пептидов – Церебролизин®. В его составе уникальное сочетание 24 нейропептидов и 17 L-аминокислот. Исследователи установили специфические трофическую и модуляторную функции каждого из этих компонентов,17 объясняющие способность препарата повышать выживаемость клеток мозга в условиях прекращения их нейротрофической поддержки со стороны клеток-мишеней, недостаточности кислорода и глюкозы (на уровне клеток – предотвращение повреждения дендритов).16,18
За более чем 60-летнюю историю (зарегистрирован в 1954 г. в Австрии) препарат участвовал в огромном числе клинических исследований, став единственным ноотропным пептидергическим препаратом с доказанной нейротрофической активностью, аналогичной таковой у естественных факторов роста нервов, но проявляющейся в условиях периферического введения.20 Большие и ограниченные, международные и отечественные исследования многократно доказывали его безопасность и эффективность при ишемическом инсульте как в острую стадию, так и в период реабилитации (а также при хронической нейродегенеративной и церебральной патологии).13-15, 17-26
И исследования продолжаются, в прошлом году профессором Натаном Борнштейном и его коллегами26 были опубликованы результаты большого метаанализа. Под их пристальное внимание попало 9 клинических исследований (по дизайну все: проспективные, рандомизированные, двойные слепые, плацебоконтролируемые) с оценкой эффективности этого ноотропного препарата в отношении улучшения общего неврологического состояния пациентов на ранних этапах после перенесенного инсульта (препарат в дозе 30–50 мл/1 раз в сутки в течение 10–21 дня).
В резюме проведенного метаанализа отмечены:
- Величина эффекта (непараметрический критерий MW) при проведении оценки с помощью шкалы тяжести инсульта NIHSS на 30 день (или 21) при обобщении результатов 9 РКИ указывала на большую эффективность данного препарата по сравнению с плацебо (MW 0,60; P
- Наиболее выраженные эффекты были отмечены в исследованиях с исходной высокой степенью тяжести инсульта – по шкале NIHSS: MW = 0,64; P = 0,0001.
- Совокупное NNT для клинически значимых изменений при проведении ранней оценки по шкале NIHSS составляло 7,7 (95% ДИ: 5,2–15,0).
- В предварительно запланированном развернутом ранговом анализе оценки по шкале mRS на 90-й день у пациентов с заболеванием умеренной и тяжелой степени был получен MW 0,61, свидетельствующий о статистически значимой большей эффективности препарата (95% ДИ 0,52-0,69; P = 0,0118; N = 314; процедура обобщения Вэй-Лачин [MERT]).
- Во всех анализах чувствительности подтверждены результаты анализа первой линии.
- В плане безопасности данный препарат был сопоставим с плацебо при наличии тенденции к уменьшению смертности (ОР 0,83). В целом препарат демонстрирует благоприятное соотношение «польза-риск».
Таким образом, предлагаемые в настоящее время основополагающие принципы и ранней, и отсроченной во времени реабилитации позволяют заметно снижать степень инвалидизации, повышать качество последующей жизни пациентов, способствовать более быстрому возвращению пациента к личной, бытовой, социальной и профессиональной активности. Важную роль в развитии этого подхода играет и современная медикаментозная нейрореабилитация, выстроенная на принципах доказательной медицины. При этом, как подчеркивают эксперты, успешность всех реабилитационных методик обеспечивается комплексным подходом, с учетом индивидуальных физических, эмоциональных, двигательных и когнитивных возможностей постинсультного пациента.
Ключевые слова: инсульт, реабилитация после инсульта, австрийские рекомендации по реабилитации больных после инсульта, нейропептиды, нейропротекция.
Литература
1 Пирадов М.А., Максимова М.Ю., Танашян М.М. Инсульт. Пошаговая инструкция. М. Гэлтар-Медиа, 2019, 272 с.
2 Wein T., Lindsay M.P., Cote R. et al. Canadian stroke best practice recommendations: Secondary prevention of stroke, sixth edition practice guidelines, update 2017. Int J Stroke. 2018, 13 (4), p. 420–443.
3 World Stroke Campaign. https://www.worldstrokecampaign.org/images/global_stroke_bill_of_rights/English_GlobalBO-Rights_web.pdf (zuletzt abgerufen 16.3.2018) 2018.
4 Powers W.J. et al. 2018 Guidelines for the Early Management of Patients With Acute Ischemic Stroke: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2018, Mar., 49 (3), e46-e110. doi: 10.1161/STR.0000000000000158.
5 https://neurologic.ru/nejroreabilitacija-posle-insulta/
6 United Nations Organisation. https://www.un.org/development/desa/disabilities/convention-on-the-rights-of-persons-with-disabilities/article-26-habilitation-and- rehabilitation.html. 2018.
7 Neuhaus A.A., Couch Y., Hadley G., Buchan A.M. Neuroprotection in stroke: the importance of collaboration and reproducibility. Brain 2017, 140 (8), p. 2079–2092.
8 Pollock A., Baer G., Campbell P. et al. Physical rehabilitation approaches for the recovery of function and mobility following stroke. Cochrane Database Syst Rev. 2014, (4):CD001920.
9 World Health Organisation. https://www.who.int/classifications/icf/en/ (zuletzt abgerufen 16.3.2018) 2018.
10 Одинак М.М., Вознюк И.А., Янишевский С.Н. Ишемия мозга. Нейропротективная терапия. Дифференцированный подход. СПб. ВМедА, 2002, 77 с.
11 Завалишин И.А., Захарова М.Н. Оксидантный стресс – общий механизм повреждения при заболеваниях нервной системы. Журнал неврологии и психиатрии. Т. 96, № 2, 1996, с. 111–114.
12 Scheidtmann K., Fries W., Muller F., Koenig E. Effect of levodopa in combination with physiotherapy on functional motor recovery after stroke: a prospective, randomised, double-blind study. Lancet. 2001, 358 (9284), p. 787–90.
13 Bornstein N.M., Guekht A., Vester J. et al. Safety and efficacy of Cerebrolysin in early post-stroke recovery: a meta-analysis of nine randomized clinical trials. Neurol Sci. 2018, 39(4), p. 629–640.
14 Muresanu D.F., Heiss W.D., Hoemberg V. et al. Cerebrolysin and recovery after stroke (CARS): a randomized, placebo-controlled, double-blind, multicenter trial. Stroke. 2016, 47, p. 151–159.
15 Guekht A., Vester J., Heiss W.D. et al. Safety and efficacy of Cerebrolysin in motor function recovery after stroke: a meta-analysis of the CARS trials. Neurol Sci. 2017, 38, p. 1761–1769.
16 Windisch M., Gschanes A., Hutter–Paier B. Neurotrophic activities and therapeutic experience with brain derived peptide preparation. J. Neural. Transm. 1998, vol. 53, p. 289–298.
17 Windisch M., Albrecht E., Eggenreich U., Paier B. Neurotrophic effects of the nootropic drug cerebrolysin – a summary. 3rd Int. Conf. on Alzheimer’s disease and related disorders. Padova. 1992, p. 4–5.
18 Watanabe Y., Gould E., McEwen B.S. Stress-induced atrophy of apical dendrites of hippocampal CA3 pyramidal neurons. Brain Res. 1992, vol. 588, p. 341–345.
19 Востриков В.В., Шишляников Г.З., Зеленцов К.Е., Востриков М.В., Шабанов П.Д. Церебролизин в практической медицине. Обзоры по клинической фармакологии и лекарственной терапии. Т. 7, № 4, 2009, с. 21–75.
20 Читаева Г.Е., Никифорова А.Н., Сапон Н.А. Общепринятые и новые аспекты применения препарата церебролизин. Український нейрохірургічний журнал. 2005, №3, с. 123–131.
21 Ladurner G., Kalvach P., Gmeinbauer R. et al. The MCA stroke trial: A multicentre, randomized, double-blind, placebo-controlled trial of cerebrolysin in patients with ischaemic stroke. Neuroprotection in ischaemic stroke. 26-th Intern. stroke conf. of Amer. Heart As soc. 2001.
22 Коппи С., Баролин Г. Применение церебролизина в терапии ишемического инсульта. Журнал неврологии и психиатрии. Т. 98, № 10, 1998, с. 30–33.
23 Скворцова В.И. Ишемический инсульт: патогенез ишемии, терапевтические подходы. Неврологический журнал. Т. 6, № 3, 2001, с. 4–9.
24 Скворцова В.И. Нейропротективная терапия ишемического инсульта. Врач. № 6, 2004, с. 26–32.
25 Гусев Е.И., Гехт А.Б., Гаптов В.Б., Тихопой Е.В. Реабилитация в неврологии. М. 2000, 52 с.
26 Bornstein Natan M., Guekht Alla, Vester Johannes, Heiss Wolf-Dieter, Gusev Eugene et al. Safety and efficacy of Cerebrolysin in early post-stroke recovery: a meta-analysis of nine randomized clinical trials. Neurological Sciences. April 2018, vol. 39, iss.4, p. 629–640.
Источник
