Перенесенный инсульт на ээг
Современные представления о механизмах повреждающего действия острой церебральной ишемии связаны с пониманием сложных соотношений между сосудистым обеспечением и морфофункциональным состоянием тканей головного мозга. Изучение показателей биоэлектрической активности коры головного мозга в оценке функционального состояния центральной нервной системы больных с поражениями мозга различного генеза хорошо известно. Применение метода количественного анализа электроэнцефалограммы (ЭЭГ) позволяет разработать математические модели церебрального инсульта различных локализаций и генеза, изучить их изменение в связи с применением стандартной терапии. Цель исследования. Изучение возможности использования количественной электроэнцефалографии (КЭЭГ) в исследовании функционального состояния мозга больных, перенесших ишемический инсульт (ИИ), в сопоставлении с данными нейропсихологического исследования.
Методы. В исследование были включены 30 больных ИИ в бассейне средней мозговой артерии (СМА). Запись ЭЭГ проводилась продолжительностью 30 минут в первые сутки заболевания. Результаты. В результате проведенного исследования установлено, что постинсультные когнитивные и тревожно-депрессивные расстройства выявляются уже в острейшем и остром периодах ИИ. При математическом анализе ЭЭГ у пациентов с ИИ в бассейне СМА выявлено снижение уровня мощностей всех ритмов как в пораженном, так и в интактном полушарии, снижение показателей межполушарной когерентности, повышение интегрального индекса, наиболее показательное в височной и центральной областях в пораженном полушарии. Уровень когерентности во всех диапазонах частот в височной области на стороне поражения коррелирует с данными нейропсихологического исследования. Заключение. Данные нейропсихологического исследования сопоставимы с таковыми ЭЭГ, что позволяет высказать суждение о преимущественном поражении медиобазальных структур височной области.
Введение
Современные представления о механизмах повреждающего действия острой церебральной ишемии связаны с пониманием сложных соотношений между сосудистым обеспечением и морфофункциональным состоянием тканей головного мозга. Изучение показателей биоэлектрической активности коры головного мозга в оценке функционального состояния центральной нервной системы лиц с поражениями мозга различного генеза хорошо известно [1]. Применение метода количественного анализа электроэнцефалограммы (ЭЭГ) позволяет разработать математические модели церебрального инсульта различных локализаций и генеза, изучить их изменение в связи с применением медикаментозной терапии.
В работе Е.А. Жирмунской (1987) показано, что изменения ЭЭГ при инсульте неспецифичны и выражаются в дизритмии альфа-ритма, преобладании медленноволновой активности, острых волн в зоне поражения. Работ, посвященных анализу биоэлектрической активности мозга при ишемическом инсульте (ИИ) в бассейне средней мозговой артерии (СМА) в острейшем и остром периодах ИИ, недостаточно, а сопоставление данных математического анализа с нейропсихологическим исследованием практически не проводилось, что и послужило основанием выполнения данной работы.
Цель исследования: изучение возможности использования количественной электроэнцефалографии (КЭЭГ) в исследовании функционального состояния мозга больных, перенесших ИИ в бассейне СМА, в сопоставлении с данными нейропсихологического исследования.
Материал и методы
В региональном сосудистом центре ГБУЗ РБ «Больница скорой медицинской помощи» г. Уфы было проведено исследование 30 больных ИИ в бассейне СМА. Средний возраст больных обоих полов составил 61,63±1,9 года. По гендерному признаку преобладали мужчины – 19 (63,3%), женщин было 11 (36,7%). Соотношение мужчин и женщин составило 1,7:1. Всем пациентам осуществлено комплексное клинико-нейропсихологическое, инструментальное и лабораторные исследования. Запись ЭЭГ проведена продолжительностью 30 минут в первые сутки заболевания на 19-канальном безбумажном электроэнцефалографе фирмы «Nicolet» с локализацией электродов, установленных по международной схеме «10-20» с референтным ушным электродом. Всем пациентам наряду с изучением фоновой записи проведен анализ межполушарной когерентности и интегрального индекса. За норму мощностей ритмов ЭЭГ средних уровней межполушарной когерентности использованы данные В.С. Русинова [2]. Для оценки типов и ЭЭГ-паттернов использовали классификацию Е.А. Жирмунской (1991) и Г. Людерса (2000) [3, 4]. Также были тщательно проанализированы и изучены амбулаторные карты больных с целью выявления в преморбиде эмоциональных и когнитивных нарушений.
Для оценки двигательной и повседневной активности использованы показатели шкалы Рэнкина, индекса мобильности Ривермид, Бартела. С целью определения наличия когнитивных и тревожно-депрессивных расстройств проведено нейропсихологическое исследование с использованием следующих шкал: краткой шкалы исследования психических функций, или Mini-Mental State Examination (MMSE), Монреальской шкалы оценки когнитивных функций МоСА (Montreal Cognitive Assessment), шкалы реактивной и личностной тревожности Спилберга–Ханина, шкалы депрессии Бэка, госпитальной шкалы тревоги и депрессии HADS (Hospital Anxiety and Depression Scale). Для исследования вегетативной устойчивости и оценки степени выраженности вегетативных дисфункций применен опросник А.М. Вейна.
Статистическая обработка полученных результатов осуществлена с использованием программного обеспечения Excel Worksheet из пакета Microsoft Office (2013). Вычислены средняя арифметическая, стандартное отклонение и критерий достоверности (t), корреляция. За достоверные принимались различия на уровне значимости 95% при р
Результаты исследования
В структуре соматической патологии преобладали артериальная гипертензия у 27 (90%) больных, ишемическая болезнь сердца у 25 (83,3%), сахарный диабет у 8 (26,7%), дислипидемия у 7 (23,3%), фибрилляция предсердий у 6 (20%), метаболический синдром у 3 (10%). Аортокоронарное шунтирование присутствовало в анамнезе у 1 (3,3%) больного. По подтипам ИИ различали: неуточненный подтип – у 16 (53,3%) пациентов, лакунарный подтип – у 6 (20%), кардиоэмболический – у 5 (16,7%); атеротромботический – у 3 (10%). Преобладали больные с очагами инсульта в зоне СМА в левом полушарии – 18 (60%), у 12 (40%) очаг находился в правом полушарии. По данным ультразвукового дуплексного сканирования (УЗДС), у 20 (66,7%) больных выявлен стенозирующий атеросклероз магистральных артерий головы, причем у 3 (10%) – стеноз более 50%, у 1 (3,3%) – окклюзия, у 8 (26,6%) – нестенозирующий атеросклероз. Лишь у 2 (6,7%) больных данные УЗДС были в пределах нормы.
Неврологический дефицит по шкале NIHSS (National Institutes of Health Stroke Scale) у больных в среднем составил 5,1±0,2 балла. При поступлении средний балл индекса мобильности Ривермид составил 5,4±0,6; по шкале Рэнкина – 2,0±0,3; по шкале Бартела – 69,1±5,0; по опроснику Вейна – 34,2±4,3.
В неврологическом статусе преобладали двигательные расстройства у 19 (63,3%) больных в виде гемипареза различной степени выраженности: легкий гемипарез – у 12 (40%), неравномерный гемипарез – у 4 (13,3%), пирамидная недостаточность – у 2 (6,7%), глубокий – у 1 (3,3 %). Речевые нарушения представлены в виде моторной афазии у 5 (16,7%) больных, дизартрии – у 4 (13,3%), сочетание амнестической и сенсорной афазии – у 2 (6,6%), элементы сенсомоторной афазии – у 1 (3,3%).
Нарушения чувствительности по гемитипу были у 9 (30%) больных.
Анализ исследования интеллектуально-мнестической, эмоционально-аффективной сфер с применением шкал выявил наличие когнитивных, тревожно-депрессивных расстройств различной степени выраженности в острейшем и остром периодах ИИ. При поступлении средний балл по тесту MMSE составил 22,7±1,3, по тесту МоСА – 19,7±1,5, по шкале Бэка – 16,3±1,4, по шкале HADS (уровень депрессии) – 7,3±0,6, по шкале HADS (уровень тревожности) – 8,0±0,5, по шкале Спилберга–Ханина (уровень реактивной тревожности) – 33,1±3,5. Только у 4 (13,3%) больных определены показатели шкалы личностной тревожности Спилберга–Ханина, остальные 26 (86,7%) отказались, ссылаясь на плохое самочувствие и нежелание отвечать на вопросы данной шкалы. Когнитивные функции выявлены по шкале MMSE у 24 (80%) больных, из них деменция – у 2 (6,7%), по шкале МоСА – у 23 (76,7%), из них деменция – у 4 (13,3%). Депрессивные расстройства по шкале HADS (депрессия) определены у 19 (63,3%) больных, тяжелая депрессия – у 3 (10%), по шкале Бэка – у 26 (86,7%) и у 2 (6,7%) соответственно. Тревожные расстройства по шкале Спилберга–Ханина определены у 12 (40%) больных, из них выраженная тревога – у 3 (10%), по шкале HADS (тревога) – у 20 (66,7%), выраженная тревога – у 4 (13,3%).
При анализе ЭЭГ оценивались спектры мощности и частоты альфа-, бета1-, тета- и дельта-ритмов, что отражено в табл. 1–5.

Из приведенных данных видно, что по сравнению с контралатеральным полушарием в пораженном полушарии в центральном и затылочном отведениях выявляется тенденция к снижению мощности ритмов, не достигающая достоверности, в то время как в лобных и височных отведениях отмечается тенденция к повышению мощности в пораженном полушарии, вероятно, за счет преобладания медленной активности. Зональные различия распределения мощности сохранены. Наименьшая суммарная мощность определена в височных отведениях. Снижение общей мощности ритмов, видимо, можно объяснить ишемией головного мозга, особенно выраженной в пораженном полушарии.
Как видно из табл. 3, при сравнении с контралатеральным полушарием мощность альфа-ритма в пораженном полушарии достоверно снижена в височных отведениях, Также выявлена тенденция к снижению мощности альфа-ритма в центральном и лобном отведениях, более выраженная на стороне поражения.

Как видно из приведенных данных, отмечается снижение частоты альфа-ритма как в пораженном, так и в контралатеральном полушарии по сравнению с нормой. Наиболее пораженными оказались центральные и височные области пораженного полушария. Достоверно снижена частота альфа-ритма в центральном и височном отведениях. Наиболее выражена асимметрия частоты альфа-ритма между пораженным и контралатеральным полушарием в центральном и височных отведениях, т.к. эти отведения соответствуют зоне проекции прецентральной извилины.
Амплитуда альфа-ритма у пациентов с ИИ в каротидном бассейне оказалась достоверно сниженной: средняя амплитуда альф-ритма в затылочных отведениях составила 29,7±7,1 мкВ.
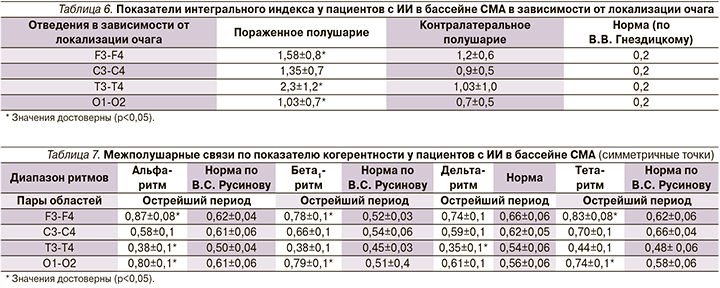
Для оценки степени изменений представительства спектральных составляющих в различных частотных диапазонах использованы полиспектральные индексы (отношение суммарных изменений в низкочастотной области ЭЭГ – тета+дельта к изменениям в высокочастотных областях – альфа+бета1), представленные в табл. 6, 7 (В.В. Гнездицкий, 2000) [4].
При анализе мощности бета1-ритма выявлена тенденция к снижению мощности данного ритма у пациентов по сравнению с нормой, не достигающая границ достоверности.
Мощность дельта-ритма оказалась сниженной во всех отведениях по сравнению с нормой. Выявилась асимметрия мощности дельта-ритма в пораженном и контралатеральном полушариях, особенно наглядная в лобных отведениях. С тяжестью инсульта коррелирует мощность дельта-волн на стороне очага. Выявлена умеренная обратная связь между мощностью дельта-волн и тяжестью инсульта (r=-0,29).
Из табл. 6 видно, что интегральный индекс повышен как в пораженном, так и в контралатеральном полушарии. Однако статистически значимые грубые нарушения выявляются в височных и центральном отведениях.
Межполушарные уровни когерентности характеризуются бóльшими значениями в лобных отделах коры, что свидетельствует о наиболее согласованной их деятельности по сравнению с другими корковыми зонами [5, 6]. Анализ межполушарных связей по показателю когерентности по различным диапазонам ритмов ЭЭГ у пациентов с ИИ в бассейне СМА представлены в табл. 7.
Как видно из представленной табл. 7, в острейшем периоде ИИ выявлено достоверное повышение межполушарной когерентности по альфа-, бета- и тета-диапазонам, в лобных и затылочных отведениях по альфа- и бета-диапазонам, в центральных отведениях тенденция к снижению межполушарной когерентности по всем диапазонам частот, достоверно снижена межполушарная когерентность по альфа- и тета-ритмам в височных отведениях. Отмечаются нарушения региональных различий у пациентов с ИИ: при достаточно высокой связи в лобных отведениях, выявлена также высокая связь по альфа-ритму и в затылочных отведениях (в норме когерентность в затылочных отведениях ниже). Общее снижение межполушарной когерентности в острейшем периоде ИИ и ее патологическое повышение в диапазоне низких частот (дельта и тета), вызывают нарушение функциональных связей электрических процессов коры головного мозга, обеспечивающих нормальную нервно-психическую деятельность человека [5, 6].
Обсуждение
Проведенный нами математический анализ ЭЭГ установил определенные корреляции между выраженностью нарушений электрогенеза коры и высшими мозговыми функциями. Выявлена умеренная прямая связь между когнитивной деятельностью и показателями частоты альфа-ритма: чем выше частота альфа-ритма, тем более выраженными были когнитивные нарушения (r=0,36). Выявлена умеренная обратная связь между амплитудой альфа-ритма и когнитивной деятельностью: чем ниже амплитуда альфа-ритма, тем более выраженными были когнитивные нарушения (r=-0,27). Установлена умеренная прямая связь между когнитивной деятельностью и показателями межполушарной когерентности по дельта-, тета- и альфа-ритмам в височных областях: чем ниже показатели межполушарной когерентности, тем более выраженными были когнитивные нарушения (r=0,27).
Заключение
Таким образом, в результате проведенного исследования установлено, что постинсультные когнитивные и тревожно-депрессивные расстройства выявляются уже в острейшем и остром периодах ИИ. Несомненно, депрессивные и когнитивные расстройства, влияющие на активную самостоятельную работу больных и их сотрудничество с членами мультидисциплинарной команды, негативно влияют на реабилитационный процесс. Кроме того, пациенты с легкими и умеренными когнитивными расстройствами имеют высокий риск развития деменции, что требует их диагностики и коррекции на раннем этапе заболевания.
При углубленном анализе ЭЭГ у пациентов с ИИ с локализацией очага в бассейне СМА выявлено, что наиболее выраженные изменения в виде преобладания медленноволновой активности, снижения уровня межполушарной когерентности регистрируются преимущественно в височных и центральной областях – на стороне поражения уже в острейшем периоде ИИ. Показатели межполушарной когерентности биоэлектрической активности мозга в височной области на стороне поражения коррелируют с данными нейропсихологического тестирования. Данные нейропсихологического исследования сопоставимы с таковыми ЭЭГ, что позволяет высказать суждение о преимущественном поражении медиобазальных структур височной области, играющих важную роль в мнестической деятельности, уже в остром периоде ИИ.
Определение полиспектральных индексов может быть рекомендовано для определения степени нарушения биоэлектрической активности мозга при мониторинге ЭЭГ-активности у больных с полушарным ИИ.
1. Зенков Л.Р. Клиническая электроэнцефалография. М., 2002. 368 с.
2. Русинов В.С. Биопотенциалы мозга человека. Математический анализ / Под ред. В.С. Русинова; АМН СССР. М., 1987. 256 с.
3. Жирмунская Е.А. Системы описания и классификация электроэнцефалограмм человека. М. 1984 г.
4. Luders H., Noachtar S., eds. Atlas and Classification of Electroencephalography. Philadelphia: WB Saunders. 2000.
5. Гнездицкий В.В. Обратная задача ЭЭГ и клиническая электроэнцефалография. Таганрог, 2000. 640 с.
6. Новикова Л.Б. Церебральные нарушения у больных геморрагической лихорадкой с почечным синдромом. Уфа. Здравоохранение Башкортостана. 2001. 251 с.
7. Новикова Л.Б., Сафина А.Г., Сафин Ш.М. Комплексная оценка состояния больного с черепно-мозговой травмой методом обобщения параметра. Уральский медицинский журнал. 2007;1(29):41–5.
Автор для связи: Л.Б. Новикова – д.м.н., проф., зав. кафедрой неврологии и нейрохирургии ИДПО Башкирского государственного медицинского университета, Уфа, Россия; тел. 8 (347) 255-10-38; e-mail: novicova@inbox.ru
Источник
В последние годы набирает актуальность проблема развития эпилептических состояний у пациентов пожилого возраста.
Основной причиной данного состояния являются различные цереброваскулярные заболевания – главная роль принадлежит последствиям перенесенного нарушения мозгового кровообращения (ишемический и геморрагический инсульт).

Внимание! После инсульта обязательно проведение ЭЭГ мониторинга, так как часто отмечаются бессудорожные приступы, которые определить клинически (увидеть без ЭЭГ) невозможно.
Вызвать ассистента врача для проведения ЭЭГ мониторинга можно по телефону:
+7 (495) 208-79-19
Эпилепсия после инсульта (постинсультная эпилепсия)
 Риск развития постинсультной эпилепсии по различным отечественным и зарубежным исследованиям колеблется от 3% до 9%.
Риск развития постинсультной эпилепсии по различным отечественным и зарубежным исследованиям колеблется от 3% до 9%.
Генерализованный судорожный приступ является нередким, а иногда и единственным симптомом острого или перенесенного инсульта.
По данным исследования SeuzuresAfterStrokeStudy (SASS) в течение первого года после перенесенного ишемического инсульта частота развития однократного эпилептического приступа составляет около 15%, а после геморрагического инсульта приступ наблюдался в каждом 5 случае (20%).
Повторные приступы случаются реже. Однако не при всех этих приступах есть необходимость ставить диагноз постинсультной эпилепсии, так как подобные состояния могут быть проявлением припадков острого периода инсульта (или острых симптоматических припадков).
Классификация эпилептических приступов после инсульта
Согласно классификации, предложенной G. Barolin и E. Sherzer, эпилептические приступы при цереброваскулярных заболеваниях по отношению к этапам развития инсульта можно разделить на следующие группы:
1. Приступы-предвестники
- Приступ наступает до развернутой клинической картины инсульта.
- Связаны с длительно протекающими изменениями мозгового кровообращения: сосудистая недостаточность основных артерий, питающих ткань головного мозга или преходящее нарушение кровообращения.
2. Ранние приступы
- Приступы, случившиеся в первую неделю острого нарушения мозгового кровообращения.
- Дисфункция нервных клеток, входящих в очаг.
- Изменение их биохимических реакций, накопление различных веществ приводит к гипервозбудимости клеток и высокому риску возникновения эпилептических разрядов.
3. Поздние приступы
- Приступы, возникающие позднее 7 суток от острого нарушения мозгового кровообращения.
- Связаны со структурными изменениями ткани мозга в месте случившейся сосудистой катастрофы.
- Формирование рубцовых и кистозных изменений, формирующий очаг повышенной возбудимости нейронов.

Если вы:
- Перенесли инсульт и наблюдаете у себя состояния, которые похожи на судороги.
- Перенесли инсульт и отмечаете у себя эпизоды потери сознания, падений, странного поведения (эпизоды выключения сознания, внезапного страха, агрессии, произошла какая-то ситуация, но «ничего не помню», что-то слышу, вижу, но этого на самом деле не происходит и так далее).
Вам необходима консультация невролога и проведение ЭЭГ мониторинга ночного сна.
Задать вопрос и записаться на исследование можно по телефону:
+7 (495) 208-79-19
Когда чаще встречаются приступы судорог после инсульта?
В настоящее время значительное внимание уделяется определению факторов риска развития постинсультной эпилепсии.
По результатам исследований, чаще других патологий, к развитию приступов приводят:
1. Геморрагический инсульт
- Нарушение мозгового кровообращения по геморрагическому типу чаще ишемического приводит к развитию генерализованных приступов.
- Отмечается их более раннее и тяжелое течение.
2. Геморрагическая трансформация
- Вторичное кровоизлияние в некротизированную ткань при ишемическом инсульте.
- Является предиктором развития ранних приступов.
- Чаще других ведет к развитию эпилептического статуса.
3. Кардиоэмболический инсульт (чаще других подтипов ишемического инсульта)
4. Обширный инсульт с тяжелым течением
Занимает большую часть головного мозга.
5. Тромбоз венозных синусов и центральных вен
- Приступы встречаются очень часто.
- Нередко являются первым и единственным проявлением заболевания.
Судороги после инсульта и исход заболевания
Развитие постинсультной эпилепсии оказывает большое влияние на исход заболевания. Неоднократно было доказано, что:
- Развитие приступов в раннем и позднем периодах связано с высокой летальностью у пациентов. В основном за счет развития эпилептического статуса.
- У выздоровевших пациентов наблюдается гораздо больший очаговый неврологический дефицит.Что связывают с расширением очага повреждения при повторяющихся приступах.
Обследования при возникновении судорог после инсульта (при постинсультной эпилепсии)
Постинсультная эпилепсия относится к симптоматическому виду эпилепсии в связи с наличием эпилептиформного очага по результатам лабораторно-инструментальных исследований (КТ, МРТ,контрастная МР-/КТ — ангиографии, лабораторной диагностики, люмбальной пункции и так далее).
В план обследования таких пациентов включен стандартный набор диагностических методов:
- общий анализ крови,
- биохимический анализ крови,
- коагулограмма,
- электрокардиография,
- суточный мониторинг артериального давления,
- методы нейровизуализации (компьютерная томография и магнитно-резонансная томография),
- электроэнцефалография (желательно под контролем видеомониторинга).
План обследования может быть расширен для каждого пациента индивидуально в зависимости от наличия определенных хронических заболеваний или по результатам проведенных исследований.

ЭЭГ при судорогах после инсульта
По данным электроэнцефалографии отмечаются изменения, вызванные структурным повреждением ткани мозга, вследствие острого нарушения мозгового кровообращения, так и изменения биоэлектрической активности мозга, вследствие эпилепсии.
В связи с измененным сознанием пациентов после перенесенного острого нарушения мозгового кровообращения проведение ЭЭГ-мониторинга ОЧЕНЬ ВАЖНО, так как приступы могут быть бессудорожными.
ЭЭГ мониторинг крайне нужен для правильной постановки диагноза и необходим для назначения соответствующей интенсивной терапии.
Противосудорожная терапия при судорогах после инсульта
Важное значение в лечении постинсультной эпилепсии имеет назначение антиэпилептических препаратов.
- Выбор препарата и режима его дозирования осуществляется индивидуально для каждого пациента совместно с врачом-эпилептологом.
- Значение имеет тип и частота приступов, возраст пациента, наличие сопутствующих заболеваний.
- У пожилых пациентов назначение антиэпилептической терапии затруднено в связи с высоким риском межлекарственных взаимодействий с другими принимаемыми препаратами.
В настоящее время существует мнение, что развитие ранних приступов не требует немедленного назначения антиэпилептических препаратов, необходимо в динамике наблюдать за пациентом и стабилизировать его состояние.
Повторяющиеся неконтролируемые и поздние приступы являются показанием для назначения противосудорожных препаратов.

Проконсультироваться с врачом по поводу очной консультации и ЭЭГ можно
по телефону: +7 (495) 208-79-19
Какие препараты рекомендованы при судорогах после инсульта?
В связи с имеющимися сходствами в патогенезах ишемических процессов и эпилептиформной активности, пожилым пациентам рекомендовано назначение антиэпилептических препаратов, обладающих нейропротекторным действием (топирамат, ламотриджин, леветирацетам).
Как дозировать и вводить противосудорожные препаратыпри судорогах после инсульта?
Подбор доз антиэпилептических препаратов происходит ступенчато, начиная с минимальных и титруя дозу до эффективной.
Нужны ли противосудорожные препараты пациентам после инсульта для профилактики эпилепсии?
Профилактическое назначение противосудорожных средств всем пациентам, перенесших острое нарушение мозгового кровообращения не показано.
Согласно рекомендациям Американской ассоциации инсульта профилактически они назначаются пациентам только с крупными, подтвержденными на КТ кровоизлияниями.
Можно ли самостоятельно подобрать препараты без консультации невролога и обследований человеку с судорогами после инсульта?
Самостоятельное неправильно подобранное лечение судорог после инсульта способно сильно навредить здоровью пациента и усугубить без того сложную ситуацию. Многие противосудорожные препараты провоцируют усиление ряда приступов, а сочетание их с другой терапией имеет право быть несовместимо.
Крайне важно обратиться за консультацией к неврологу, провести обследования для подбора и назначения препаратов для лечения.

Статья проверена зав. отделением, неврологом, нейрофизиологом, врачом УЗ диагностики, специалистом высшей квалификационной категории, стаж работы более 17 лет.
Гапоновой Ольгой Владимировной
Список литературы
- В. Данилова, Д.Р. Хасанова, И.Р. Камалов, «Постинсультная эпилепсия: предикторы, факторы риска, клинические варианты, лечение», 2019
- Т.В. Данилова, «клинические особенности постинсультных эпилептических припадков», 2015
- В.И. Гузеева, О.Н. Быкова и соавт. «Особенности течения постинсультной эпилепсии», 2018
- B. Sarecka-Hujar, I. Kopyta, “Poststrokeepilepsy: currentperspectivesondiagnosisandtreatment”, 2018
- M. Y Xu, “Poststroke seizure: optimising its management”, 2018
Источник
