Молекулярные механизмы сердечной недостаточности
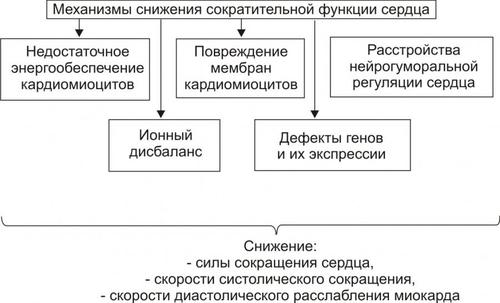
Снижение сократительной функции сердца является итогом развития сердечной недостаточности самой разной этиологии. Несмотря на различие причин и известное своеобразие начальных звеньев патогенеза сердечной недостаточности, её механизмы на клеточном и молекулярном уровне едины. К числу главных механизмов снижения сократительной функции сердца относят следующие (рис. 23–26):
• Недостаточность энергетического обеспечения клеток миокарда.Расстройство энергоснабжения основных процессов, происходящих в клетках миокарда (прежде всего его сокращения и расслабления), развивается вследствие нарушения:
– ресинтеза макроэргов;
– транспорта энергии к эффекторным структурам кардиомиоцитов,
– утилизации этими структурами энергии макроэргических фосфатных соединений. Эти звенья патогенеза рассмотрены в главе «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Расстройства энергетического обеспечения клетки»).
Нарушение обеспечения кардиомиоцитов энергией на этапах её продукции, транспорта и утилизации может быть как стартовым механизмом снижения сократительной функции сердца, так и существенным фактором нарастания её депрессии.
Ы Вёрстка Файл «ПФ Рис 22 27 Основные механизмы снижения сократительной функции миокарда при сердечной недостаточности»
Рис. 23–26. Основные механизмы снижения сократительной функции миокарда при сердечной недостаточности.
• Повреждение мембран и ферментов кардиомиоцитов. Общие механизмы овреждения клеточных мембран и ферментов рассмотрены в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Повреждение мембран и ферментов»).
•Альтерация мембран и ферментов клеток миокарда: главное, а нередко и инициальное звено патогенеза сердечной недостаточности.
•Изменение физико‑химических свойств и конформации молекул белка (структурных и ферментов), липидов, фосфолипидов и ЛП. Эти изменения сопровождается значительным обратимым, а часто необратимым повреждением структуры и функции мембран и ферментов, в том числе митохондрий, саркоплазматического ретикулума, миофибрилл, плазматической мембраны, обеспечивающих реализацию сократительной и ритмической функций сердца.
• Ионный дисбаланс.Нарушение содержания и соотношения между отдельными ионами внутри и вне клеток рассмотрены в главе «Патология клетки». Ниже приведены специфичные для развития сердечной недостаточности особенности ионного дисбаланса.
Ионный дисбаланс при сердечной недостаточности проявляется нарушением соотношения между отдельными ионами в разных секторах кардиомиоцитов: в органеллах (митохондриях, саркоплазматическом ретикулуме, миофибриллах), в цитозоле, по разные стороны плазматической мембраны кардиомиоцитов. В наибольшей степени это относится к ионам: K+, Na+, Ca2+. Именно эти катионы в основном определяют реализацию таких процессов, как возбуждение, электромеханическое сопряжение, сокращение и расслабление миокарда.
• Нарушения в генетической программ кардиомиоцитов. Эти механизмы опиманы в главе «Патология клетки». При сердечной недостаточности происходит активация генов, контролирующих процессы обновления субклеточных структур кардиомиоцитов, а также роста сосудов микроциркуляторного русла и нервных волокон. Так, при ишемическом и стрессорном повреждении сердца подавлена экспрессия мРНК, для Ca2+‑зависимой АТФазы саркоплазматической сети. Это потенцирует ингибирование процессов захвата и выброса Ca2+ ретикулумом миоцитов. В условиях ишемии и инфаркта миокарда, хронического эмоционально‑болевого стресса подавлен также процесс трансляции генетической информации, что сопровождается нарушением синтеза различных белков клеток миокарда.
• Расстройства нейрогуморальной регуляции сердца. Общая характеристика нарушений регуляции клеточных функций приведена в главе «Патология клетки». Ниже рассмотрены важные для развития сердечной недостаточности изменения симпатической и парасимпатической регуляции сердца.
Изменение механизмов симпатической регуляции сердечной деятельности.Оно заключается в уменьшение содержания нейромедиатора симпатической нервной системы норадреналина в ткани сердца. Причиной этого являются: – снижение синтеза норадреналина в нейронах симпатической нервной системы (в норме в этих нейронах образуется около 80% медиатора, содержащегося в миокарде) в результате подавления активности фермента тирозингидроксилазы и торможения захвата норадреналина нервными окончаниями; – снижение адренореактивных свойств сердца,т.е. выраженности ино-, хроно-, дромо- и батмотропных эффектов норадреналина и адреналина.
Изменение механизмов парасимпатической регуляции сердца.При сердечной недостаточности расстройства парасимпатической регуляции выражены вмменьшей мере, чем в симпатической, что является результатом более высокой резистентности этих механизмов к повреждающим факторам. Известно, что ацетилхолин через м‑холинорецепторы снижает частоту и силу сердечных сокращений (ингибируя образование цАМФ и активируя образование цГМФ, которая активирует цГМФ‑зависимую киназу, подавляющую активность потенциалозависимых Ca2+‑каналов).
Последствия нарушенных симпатических и парасимпатических влияний на миокард состоят в снижении степени управляемости и надёжности регуляции сердца. Это приводит к падению темпа и величины мобилизации сократительной функции сердца, особенно в чрезвычайных условиях.
Источник
Снижение сократительной функции сердца является итогом развития сердечной недостаточности самой разной этиологии. Несмотря на различие причин и известное своеобразие начальных звеньев патогенеза сердечной недостаточности, её механизмы на клеточном и молекулярном уровне едины. К числу главных механизмов снижения сократительной функции сердца относят следующие (рис. 23–26):
• Недостаточность энергетического обеспечения клеток миокарда.Расстройство энергоснабжения основных процессов, происходящих в клетках миокарда (прежде всего его сокращения и расслабления), развивается вследствие нарушения:
– ресинтеза макроэргов;
– транспорта энергии к эффекторным структурам кардиомиоцитов,
– утилизации этими структурами энергии макроэргических фосфатных соединений. Эти звенья патогенеза рассмотрены в главе «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Расстройства энергетического обеспечения клетки»).
Нарушение обеспечения кардиомиоцитов энергией на этапах её продукции, транспорта и утилизации может быть как стартовым механизмом снижения сократительной функции сердца, так и существенным фактором нарастания её депрессии.
Ы Вёрстка Файл «ПФ Рис 22 27 Основные механизмы снижения сократительной функции миокарда при сердечной недостаточности»
Рис. 23–26. Основные механизмы снижения сократительной функции миокарда при сердечной недостаточности.
• Повреждение мембран и ферментов кардиомиоцитов. Общие механизмы овреждения клеточных мембран и ферментов рассмотрены в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Повреждение мембран и ферментов»).
•Альтерация мембран и ферментов клеток миокарда: главное, а нередко и инициальное звено патогенеза сердечной недостаточности.
•Изменение физико‑химических свойств и конформации молекул белка (структурных и ферментов), липидов, фосфолипидов и ЛП. Эти изменения сопровождается значительным обратимым, а часто необратимым повреждением структуры и функции мембран и ферментов, в том числе митохондрий, саркоплазматического ретикулума, миофибрилл, плазматической мембраны, обеспечивающих реализацию сократительной и ритмической функций сердца.
• Ионный дисбаланс.Нарушение содержания и соотношения между отдельными ионами внутри и вне клеток рассмотрены в главе «Патология клетки». Ниже приведены специфичные для развития сердечной недостаточности особенности ионного дисбаланса.
Ионный дисбаланс при сердечной недостаточности проявляется нарушением соотношения между отдельными ионами в разных секторах кардиомиоцитов: в органеллах (митохондриях, саркоплазматическом ретикулуме, миофибриллах), в цитозоле, по разные стороны плазматической мембраны кардиомиоцитов. В наибольшей степени это относится к ионам: K+, Na+, Ca2+. Именно эти катионы в основном определяют реализацию таких процессов, как возбуждение, электромеханическое сопряжение, сокращение и расслабление миокарда.
• Нарушения в генетической программ кардиомиоцитов. Эти механизмы опиманы в главе «Патология клетки». При сердечной недостаточности происходит активация генов, контролирующих процессы обновления субклеточных структур кардиомиоцитов, а также роста сосудов микроциркуляторного русла и нервных волокон. Так, при ишемическом и стрессорном повреждении сердца подавлена экспрессия мРНК, для Ca2+‑зависимой АТФазы саркоплазматической сети. Это потенцирует ингибирование процессов захвата и выброса Ca2+ ретикулумом миоцитов. В условиях ишемии и инфаркта миокарда, хронического эмоционально‑болевого стресса подавлен также процесс трансляции генетической информации, что сопровождается нарушением синтеза различных белков клеток миокарда.
• Расстройства нейрогуморальной регуляции сердца. Общая характеристика нарушений регуляции клеточных функций приведена в главе «Патология клетки». Ниже рассмотрены важные для развития сердечной недостаточности изменения симпатической и парасимпатической регуляции сердца.
Изменение механизмов симпатической регуляции сердечной деятельности.Оно заключается в уменьшение содержания нейромедиатора симпатической нервной системы норадреналина в ткани сердца. Причиной этого являются: – снижение синтеза норадреналина в нейронах симпатической нервной системы (в норме в этих нейронах образуется около 80% медиатора, содержащегося в миокарде) в результате подавления активности фермента тирозингидроксилазы и торможения захвата норадреналина нервными окончаниями; – снижение адренореактивных свойств сердца,т.е. выраженности ино-, хроно-, дромо- и батмотропных эффектов норадреналина и адреналина.
Изменение механизмов парасимпатической регуляции сердца.При сердечной недостаточности расстройства парасимпатической регуляции выражены вмменьшей мере, чем в симпатической, что является результатом более высокой резистентности этих механизмов к повреждающим факторам. Известно, что ацетилхолин через м‑холинорецепторы снижает частоту и силу сердечных сокращений (ингибируя образование цАМФ и активируя образование цГМФ, которая активирует цГМФ‑зависимую киназу, подавляющую активность потенциалозависимых Ca2+‑каналов).
Последствия нарушенных симпатических и парасимпатических влияний на миокард состоят в снижении степени управляемости и надёжности регуляции сердца. Это приводит к падению темпа и величины мобилизации сократительной функции сердца, особенно в чрезвычайных условиях.
Источник
Снижение
сократительной функции сердца является
итогом развития сердечной недостаточности
самой разной этиологии. Несмотря на
различие причин и известное своеобразие
начальных звеньев патогенеза сердечной
недостаточности, её механизмы на
клеточном и молекулярном уровне едины.
Главные из этих механизмов приведены
на рис. 22–27.

Рис.
22–27. Основные механизмы снижения
сократительной функции миокарда при
сердечной недостаточности.
•
Недостаточность
энергетического обеспечения клеток
миокарда
Расстройство
энергоснабжения основных процессов,
происходящих в клетках миокарда (прежде
всего его сокращения и расслабления),
развивается вследствие нарушения:
ресинтеза макроэргов, транспорта их
энергии к эффекторным структурам
кардиомиоцитов, утилизации ими энергии
макроэргических фосфатных соединений.
Эти звенья патогенеза в общем виде
рассмотрены в главе 4 «Патология клетки»
(раздел «Общие механизмы повреждения»,
подраздел «Расстройства энергетического
обеспечения клетки»).
Нарушение
обеспечения кардиомиоцитов энергией
на этапах её продукции, транспорта и
утилизации может быть как стартовым
механизмом снижения сократительной
функции сердца, так и существенным
фактором нарастания её депрессии.
•
Повреждение
мембран и ферментов кардиомиоцитов
Повреждение
клеточных мембран и ферментов рассмотрено
в главе 4 «Патология клетки» (раздел
«Общие механизмы повреждения», подраздел
«Повреждение мембран и ферментов»).
Альтерация
мембран и ферментов клеток миокарда —
главное, а нередко и инициальное звено
патогенеза сердечной недостаточности.
Изменение физикохимических свойств и
конформации молекул белка (структурных
и ферментов), липидов, фосфолипидов и
ЛП сопровождается значительным обратимым,
а часто — необратимым повреждением
структуры и функции мембран и ферментов,
в том числе — митохондрий, саркоплазматического
ретикулума, миофибрилл, плазматической
мембраны, обеспечивающих реализацию
сократительной и ритмической функций
сердца.
•
Ионный
дисбаланс
Нарушение
содержания и соотношения между отдельными
ионами внутри и вне клеток рассмотрены
в главе 4 «Патология клетки» (раздел
«Общие механизмы повреждения», подраздел
«Дисбаланс ионов и воды в клетке»). Ниже
приведены специфичные для развития
сердечной недостаточности особенности
ионного дисбаланса.
Ионный
дисбаланс при сердечной недостаточности
проявляется нарушением соотношения
между отдельными ионами в разных секторах
кардиомиоцитов: в органеллах (митохондриях,
саркоплазматическом ретикулуме,
миофибриллах), в цитозоле, по разные
стороны плазматической мембраны
кардиомиоцитов. В наибольшей степени
это относится к ионам: K+,
Na+,
Ca2+.
Именно эти катионы в основном определяют
реализацию таких процессов, как
возбуждение, электромеханическое
сопряжение, сокращение и расслабление
миокарда.
•
Нарушения
в генетической программ кардиомиоцитов
Нарушения
в генетической программе клеток и/или
механизмов её реализации рассмотрены
в главе 4 «Патология клетки» (раздел
«Общие механизмы повреждения», подраздел
«Генетические нарушения»).
При
сердечной недостаточности происходит
активация генов, контролирующих процессы
обновления субклеточных структур
кардиомиоцитов, а также роста сосудов
микроциркуляторного русла и нервных
волокон. В частности, при ишемическом
и стрессорном повреждении сердца
подавлена экспрессия мРНК, для
Ca2+зависимой
АТФазы саркоплазматической сети. Это
и потенцирует ингибирование процессов
захвата и выброса Ca2+
ретикулумом миоцитов. В условиях ишемии
и инфаркта миокарда, хронического
эмоциональноболевого стресса подавлен
также процесс трансляции генетической
информации. Это сопровождается нарушением
синтеза различных белков клеток миокарда.
•
Расстройства
нейрогуморальной регуляции сердца
Общая
характеристика нарушений регуляции
клеточных функций приведена в главе 4
«Патология клетки» (раздел «Общие
механизмы повреждения», подраздел
«Расстройства регуляции внутриклеточных
процессов»). Ниже рассмотрены важные
для развития сердечной недостаточности
изменения симпатической и парасимпатической
регуляции сердца.
†
Изменение
механизмов симпатической регуляции.
‡
Уменьшение
содержания нейромедиатора симпатической
нервной системы — норадреналина в ткани
сердца.
Причины.
Снижение синтеза норадреналина в
нейронах симпатической нервной системы
(в норме в них образуется около 80%
медиатора, содержащегося в миокарде).
Является результатом подавления
активности фермент тирозин гидроксилазы
и торможение захвата норадреналина
нервными окончаниями.
‡
Снижение
адренореактивных свойств сердца, т.е.
выраженности ино-, хроно-, дромо- и
батмотропных эффектов норадреналина
и адреналина.
†
Изменение
механизмов парасимпатической регуляции.
‡
Ацетилхолин
через мхолинорецепторы вызывает
уменьшение частоты сердечных сокращений,
ингибируя образование цАМФ и активируя
образование цГМФ. цГМФ активирует
цГМФзависимую киназу, подавляющую
активность потенциалозависимых
Ca2+каналов.
‡
Изменение
механизмов парасимпатической регуляции
при сердечной недостаточности выражены
значительно меньше, чем симпатической.
Это является результатом более высокой
резистентности парасимпатических
механизмов к различным повреждающим
факторам.
Последствия
нарушенных симпатических и парасимпатических
влияний на миокард состоят в снижении
степени управляемости и надёжности
регуляции сердца. Это приводит к падению
темпа и величины мобилизации сократительной
функции сердца, особенно в чрезвычайных
условиях.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Снижение сократительной функции сердца является итогом развития сердечной недостаточности самой разной этиологии. Несмотря на различие причин и известное своеобразие начальных звеньев патогенеза сердечной недостаточности, её механизмы на клеточном и молекулярном уровне едины. К числу главных механизмов снижения сократительной функции сердца относят следующие (рис. 23–26):
• Недостаточность энергетического обеспечения клеток миокарда.Расстройство энергоснабжения основных процессов, происходящих в клетках миокарда (прежде всего его сокращения и расслабления), развивается вследствие нарушения:
– ресинтеза макроэргов;
– транспорта энергии к эффекторным структурам кардиомиоцитов,
– утилизации этими структурами энергии макроэргических фосфатных соединений. Эти звенья патогенеза рассмотрены в главе «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Расстройства энергетического обеспечения клетки»).
Нарушение обеспечения кардиомиоцитов энергией на этапах её продукции, транспорта и утилизации может быть как стартовым механизмом снижения сократительной функции сердца, так и существенным фактором нарастания её депрессии.
Ы Вёрстка Файл «ПФ Рис 22 27 Основные механизмы снижения сократительной функции миокарда при сердечной недостаточности»
Рис. 23–26. Основные механизмы снижения сократительной функции миокарда при сердечной недостаточности.
• Повреждение мембран и ферментов кардиомиоцитов. Общие механизмы овреждения клеточных мембран и ферментов рассмотрены в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Повреждение мембран и ферментов»).
•Альтерация мембран и ферментов клеток миокарда: главное, а нередко и инициальное звено патогенеза сердечной недостаточности.
•Изменение физико‑химических свойств и конформации молекул белка (структурных и ферментов), липидов, фосфолипидов и ЛП. Эти изменения сопровождается значительным обратимым, а часто необратимым повреждением структуры и функции мембран и ферментов, в том числе митохондрий, саркоплазматического ретикулума, миофибрилл, плазматической мембраны, обеспечивающих реализацию сократительной и ритмической функций сердца.
• Ионный дисбаланс.Нарушение содержания и соотношения между отдельными ионами внутри и вне клеток рассмотрены в главе «Патология клетки». Ниже приведены специфичные для развития сердечной недостаточности особенности ионного дисбаланса.
Ионный дисбаланс при сердечной недостаточности проявляется нарушением соотношения между отдельными ионами в разных секторах кардиомиоцитов: в органеллах (митохондриях, саркоплазматическом ретикулуме, миофибриллах), в цитозоле, по разные стороны плазматической мембраны кардиомиоцитов. В наибольшей степени это относится к ионам: K+, Na+, Ca2+. Именно эти катионы в основном определяют реализацию таких процессов, как возбуждение, электромеханическое сопряжение, сокращение и расслабление миокарда.
• Нарушения в генетической программ кардиомиоцитов. Эти механизмы опиманы в главе «Патология клетки». При сердечной недостаточности происходит активация генов, контролирующих процессы обновления субклеточных структур кардиомиоцитов, а также роста сосудов микроциркуляторного русла и нервных волокон. Так, при ишемическом и стрессорном повреждении сердца подавлена экспрессия мРНК, для Ca2+‑зависимой АТФазы саркоплазматической сети. Это потенцирует ингибирование процессов захвата и выброса Ca2+ ретикулумом миоцитов. В условиях ишемии и инфаркта миокарда, хронического эмоционально‑болевого стресса подавлен также процесс трансляции генетической информации, что сопровождается нарушением синтеза различных белков клеток миокарда.
• Расстройства нейрогуморальной регуляции сердца. Общая характеристика нарушений регуляции клеточных функций приведена в главе «Патология клетки». Ниже рассмотрены важные для развития сердечной недостаточности изменения симпатической и парасимпатической регуляции сердца.
Изменение механизмов симпатической регуляции сердечной деятельности.Оно заключается в уменьшение содержания нейромедиатора симпатической нервной системы норадреналина в ткани сердца. Причиной этого являются: – снижение синтеза норадреналина в нейронах симпатической нервной системы (в норме в этих нейронах образуется около 80% медиатора, содержащегося в миокарде) в результате подавления активности фермента тирозингидроксилазы и торможения захвата норадреналина нервными окончаниями; – снижение адренореактивных свойств сердца,т.е. выраженности ино-, хроно-, дромо- и батмотропных эффектов норадреналина и адреналина.
Изменение механизмов парасимпатической регуляции сердца.При сердечной недостаточности расстройства парасимпатической регуляции выражены вмменьшей мере, чем в симпатической, что является результатом более высокой резистентности этих механизмов к повреждающим факторам. Известно, что ацетилхолин через м‑холинорецепторы снижает частоту и силу сердечных сокращений (ингибируя образование цАМФ и активируя образование цГМФ, которая активирует цГМФ‑зависимую киназу, подавляющую активность потенциалозависимых Ca2+‑каналов).
Последствия нарушенных симпатических и парасимпатических влияний на миокард состоят в снижении степени управляемости и надёжности регуляции сердца. Это приводит к падению темпа и величины мобилизации сократительной функции сердца, особенно в чрезвычайных условиях.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Источник
