Каротидная эндартерэктомия в острый период инсульта

В статье приведены современные подходы к оценке эффективности каротидной эндартерэктомии в остром периоде ишемического инсульта

Введение
В настоящее время активно обсуждаются преимущества хирургического лечения перед применением консервативных методов у пациентов с гемодинамически значимым сужением сонных артерий [1–6]. Основными целями хирургического лечения являются как профилактика повторных нарушений мозгового кровообращения, так и улучшение реабилитационного прогноза у пациентов. Реваскуляризация головного мозга в остром периоде ишемического инсульта (ИИ) до сих пор является поводом для обсуждения среди специалистов и предметом исследований. Основными дискуссионными вопросами в настоящее время являются время от начала инсульта до проведения операции и критерии отбора пациентов для выполнения хирургического вмешательства [4–7]. В последние годы наибольшую актуальность приобрели нейрофизиологические методы исследования спонтанной и вызванной активности головного мозга, способные выявить функциональные нарушения, имеющие важное прогностическое значение, значительно влияющие на исход заболевания и определяющие возможности восстановления нарушенных при ИИ функций [8–11].
Таким образом, все изложенное обусловило актуальность изучения нейрофизиологических особенностей у больных ИИ в процессе восстановления нарушенных функций, которым в острейшем периоде была выполнена реваскуляризация головного мозга, что определило цель исследования.
Целью настоящего исследования явилось изучение динамики спектрально-когерентных показателей ЭЭГ и показателей соматосенсорных вызванных потенциалов у больных атеротромботическим ИИ, которым в острейшем периоде была выполнена каротидная эндартерэктомия на стороне поражения.
Материал и методы
В основу работы положены результаты обследования 54 пациентов с первым в анамнезе атеротромботическим ИИ с полушарной локализацией вследствие гемодинамически значимого поражения внутренней сонной артерии на стороне развития ишемии. Всем пациентам в течение 2 нед. от начала заболевания была выполнена каротидная эндартерэктомия. Среди них мужчин было 44 человека (81%), женщин – 10 (19%). Средний возраст пациентов – 69,14±7,4 года. Левополушарная локализация очага ишемии наблюдалась у 29 (53,7%) человек, правополушарная локализация – у 25 (46,3%). Суммарный балл по шкале NIHSS в 1-е сут составил 12,4±2,7. Средняя величина стенозирующего поражения внутренней сонной артерии на стороне поражения составила 81,2±3,1. Средние сроки оперативного лечения в этой группе составили 4,7±2,7 дня.
При определении показаний к операции на сонных артериях руководствовались известными положениями: диагноз «ишемический инсульт»; отсутствие данных за геморрагический инсульт; очаг ишемии, по данным СКТ или МРТ головного мозга, не превышающий 1/3 области полушарий (в среднем величина очага составила 3,2±0,2 см), кровоснабжаемого ипсилатеральной среднемозговой артерией; отсутствие грубого неврологического дефицита (non disabling – неинвалидизирующий инсульт), средний балл по шкале NIHSS не превышал 14; наличие гемодинамически значимого поражения экстракраниального отдела ипсилатеральной сонной артерии в виде стеноза более 60% просвета сосуда и/или признаки нестабильности, и/или изъязвления атеросклеротической бляшки. Противопоказаниями к оперативному лечению были: выраженный отек головного мозга, стойкая артериальная гипертензия, плохо поддающаяся медикаментозной терапии, обширная зона ишемии головного мозга, тяжелые сопутствующие заболевания (недавно перенесенный инфаркт миокарда, признаки острой и хронической недостаточности внутренних органов), наличие пенумбры менее 50% от размера ишемического очага по данным перфузионной КТ головного мозга.
Группу сравнения составили 52 пациента, прооперированных спустя 2 нед. после развития инсульта: 27 (51,9%) пациентов с левополушарной локализацией очага и 25 (48,1%) пациентов – с правополушарной. Среди них мужчин было 40 человек (76,9%), женщин – 12 (23,1%). Средний возраст пациентов составил 68,2±7,1 года. Средний балл на момент поступления по шкале NIHSS составил 12,7±2,8. Средняя величина стенозирующего поражения внутренней сонной артерии на стороне ишемии составила 84,1±3,5. Средние сроки оперативного лечения в этой группе составили 18,4±2,3 дня.
Для регистрации ЭЭГ использовали 19-канальный цифровой электроэнцефалограф-нейрокартограф фирмы Nicolet One (CША). Для количественной оценки спектра мощности использовали программу «Нейрокартограф», которая позволяла рассчитать мощности и показатели ВПК для основных диапазонов частот ЭЭГ: дельта (0–4 Гц), тета (4–8 Гц), альфа-1 (8–10 Гц), альфа-2 (10–13 Гц), бета (13–30 Гц). Исследование соматосенсорных вызванных потенциалов (ССВП) выполняли на 4-канальном электронейромиографе с функциями исследования вызванных потенциалов мозга «Нейро-МВП-4» фирмы «Нейрософт» (Россия). Выделялись основные пики вызванного потенциала: P18, N20, P23, N30, P45. Вычислялись латентные периоды пиков N20, P23, N30, P45 и амплитуда N20–P23 пиков. Для лучшей идентификации компонентов ССВП проводили сопоставление результатов при ипси- и контрлатеральной регистрации. Запись проводилась до операции и на 2, 7, 14, 21-е сут после операции. Статистическая обработка данных проводилась при помощи пакета статистических программ S-Plus 2005 (Math Soft Inc) с использованием методов непараметрической статистики. Для выявления достоверных различий между средними выборок использовались критерии Вилкоксона и Колмогорова.
Результаты
Динамика выраженности неврологического дефицита по шкале NIHSS у пациентов с неврологическим дефицитом средней степени тяжести, прооперированных в различные сроки от развития инсульта, представлена на рисунке 1.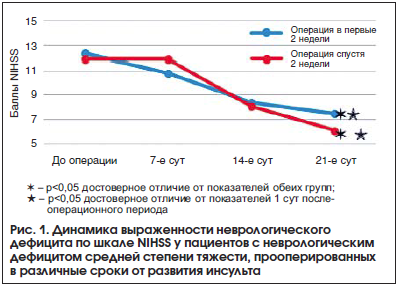
В 1-е сут после операции у пациентов основной группы выявлены достоверно более высокие (p<0,05) показатели мощности спектра медленноволновой активности во всех областях обоих полушарий, преимущественно в передних, центральных и теменных отделах, по сравнению с группой сравнения. Альфа-активность была дезорганизована с нарушением зональных различий. При количественном анализе отмечалось перераспределение мощности спектра альфа-активности с более низкими показателями мощности спектра в височно-затылочных отделах, преимущественно пораженного полушария. Бета-активность была распределена диффузно с некоторым преобладанием в лобно-центральных, центральных, теменных и лобно-височных отделах интактного полушария.
На 7-е сут после операции отмечалось достоверное (p<0,05) уменьшение медленноволновой активности, преимущественно тета-диапазона, в обоих полушариях с некоторым преобладанием ее в лобно-центральных, центральных, теменных и височных отделах пораженного полушария. Преимущественным изменением у больных в этот период было угнетение альфа-активности в обоих полушариях (p<0,05), и наиболее выраженными были изменения альфа-2-активности. При этом в группе сравнения альфа-активность, преимущественно альфа-1 диапазона, регистрировалась широко, наблюдали ее достоверное увеличение в лобно-центральных, теменных, височно-затылочных и затылочных отделах пораженного полушария (p<0,05). К концу 2-й нед. после операции у пациентов обеих групп выявлялось значительное уменьшение медленноволновой активности в обоих полушариях с преобладанием ее в пораженном полушарии по сравнению с предыдущим исследованием. В основной группе сохранялось общее угнетение альфа-активности в обоих полушариях, более выраженное на стороне очага поражения. Отмечалось уменьшение альфа-1-активности в лобно-центральных, центральных и лобно-височных отделах пораженного и клинически интактного полушарий (p<0,05). Эти данные коррелировали с тяжестью клинического состояния, оцениваемого по шкале NIHSS (p<0,05). В группе сравнения отмечали значительное нарастание (p<0,05) альфа-активности, преимущественно альфа-1 диапазона, в интактном полушарии в лобно-центральных, центральных, теменных, височных и затылочных отделах. В то же время в лобно-центральных, лобно-височных и затылочных отделах пораженного полушария имело место уменьшение альфа-активности, преимущественно альфа-1-диапазона (p<0,05). К 21 сут послеоперационного периода наблюдалось дальнейшее уменьшение медленноволновой активности у пациентов обеих групп. Выявлено достоверное (p<0,05) уменьшение тета- и дельта-активности в лобно-центральных и лобно-височных областях в сравнении с предыдущим исследованием. У больных обеих групп отмечалось увеличение альфа-активности во всех отделах, за исключением затылочных. Наиболее выраженное ее увеличение в основной группе наблюдалось в лобно-центральном, центральном и височном отделах пораженного полушария по сравнению с предыдущим исследованием (p<0,05). Эти данные коррелировали с тяжестью клинического состояния, оцениваемого по шкале NIHSS (p<0,05).
В 1-е сут после операции в обеих группах наблюдалось усиление внутриполушарных связей в интактном полушарии. Были выявлены достоверно более высокие (p<0,05) показатели ВПК во всех частотных диапазонах в лобно-височной, центрально-височной и центрально-затылочной областях. Усиление внутриполушарных взаимодействий в интактном полушарии наблюдалось в течение всего острейшего периода. Эти данные коррелировали с тяжестью клинического состояния, оцениваемого по шкале NIHSS (p<0,05).
У пациентов обеих групп к концу 1-й нед. после операции отмечалось повышение показателей ВПК в пораженном полушарии. Зарегистрировано статистически значимое увеличение (p<0,05) ВПК в лобно-височных и височно-затылочной областях пораженного полушария в альфа-, тета-диапазонах по сравнению с предыдущим исследованием. Кроме того, наблюдалось достоверное повышение (p<0,05) ВПК в центрально-височной и лобно-центральной областях интактного полушария в альфа- и тета-диапазонах. В остальных областях интактного полушария, по сравнению с показателями 1-х сут после операции, сохранялись высокими показатели ВПК в большинстве частотных диапазонов.
Анализ динамики показателей ВПК выявил, что в конце 2-й нед. после операции в основной группе происходило усиление внутриполушарных взаимосвязей в большинстве областей пораженного полушария (p<0,05). В клинически интактном полушарии отмечалось уменьшение показателей ВПК во всех частотных диапазонах, более выраженное в лобно-височных, центрально-височных и центрально-затылочных отделах, по сравнению с предыдущим исследованием (p<0,05). Эти данные коррелировали с тяжестью клинического состояния, оцениваемого по шкале NIHSS (p<0,05). В группе сравнения наблюдали выраженное увеличение показателей ВПК в лобно-центральных и, в большей степени, в лобно-височных областях обоих полушарий, преимущественно в клинически интактном полушарии (p<0,05). Эти данные коррелировали с изменениями тяжести неврологического дефицита по шкале NIHSS (p<0,05).
К концу 3-й нед. после операции в основной группе наблюдалось достоверное уменьшение показателей ВПК во всех частотных диапазонах в лобно-центральной и лобно-височной областях интактного полушария по сравнению с предыдущим исследованием (p<0,05) (рис. 2). В лобно-височных, лобно-центральных, центрально-височных областях на стороне очага поражения регистрировались высокие показатели ВПК во всех частотных диапазонах без динамики по сравнению со 2-й нед. после операции. Эти данные коррелировали с тяжестью клинического состояния, оцениваемого по шкале NIHSS (p<0,05). В группе сравнения отмечали увеличение показателей ВПК в передних областях обоих полушарий, преимущественно в альфа- и бета-диапазонах, по сравнению с предыдущим исследованием. Выявили достоверное увеличение (р<0,05) ВПК в лобно-височной области пораженного полушария. Эти данные также коррелировали с изменениями тяжести неврологического дефицита по шкале NIHSS (p<0,05).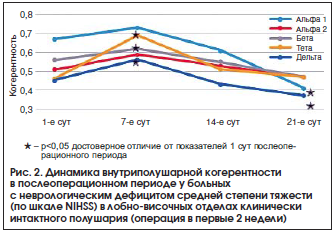
В 1-е сут после операции у пациентов обеих групп отмечалось достоверное уменьшение латентности всех пиков, наиболее выраженное для N30 и Р45 обоих полушарий, при этом изменения преобладали на стороне поражения (p<0,05). Однако к концу 1-й нед. послеоперационного периода у пациентов основной группы наблюдалось cтатистически значимое увеличение латентности пиков Р23, N30 и Р45 на стороне поражения и пиков N20, N30 и Р45 – на стороне клинически интактного полушария по сравнению с показателями 1-х сут (p<0,05). При этом увеличение показателей латентности пиков N30 и P45, по сравнению с показателями 1-х сут как на стороне поражения, так и на стороне клинически интактного полушария, сохранялось в течение первых 2 нед. после операции. На стороне клинически интактного полушария к концу 2–й нед. после операции латентность пиков Р23, N30 и Р45 были выше по сравнению с таковой в группе сравнения (p<0,05). В группе сравнения наблюдалось cтатистически значимое уменьшение латентности пиков N30 и Р45 на стороне обоих полушарий по сравнению с показателями основной группы (p<0,05). При этом уменьшение показателей латентности пиков N30 и P45 по сравнению с показателями основной группы на стороне пораженного полушария сохранялось в течение всех 3-х нед. после операции. К концу 3-й нед. послеоперационного периода отмечалось статистически значимое снижение латентности N20, Р23, N30 и Р45 на стороне поражения и латентности N30, Р45 на стороне клинически интактного полушария по сравнению с показателями 7 сут (p<0,05). При этом показатели латентностей на стороне пораженного полушария были ниже, а на стороне клинически интактного полушария – выше (достоверно ниже для Р45 (p<0,05)) по сравнению с группой сравнения (табл. 1).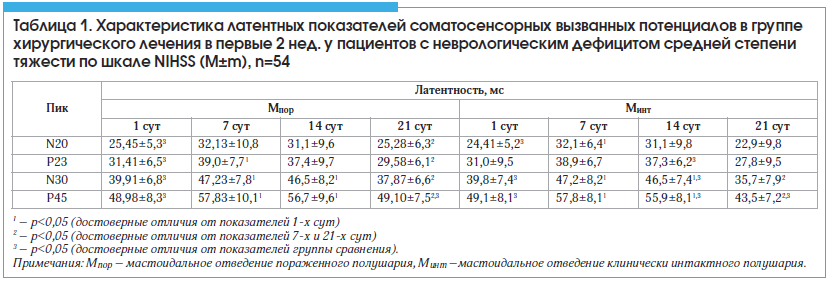
В первые 2 нед. после операции в обеих группах отмечалось достоверное увеличение показателей амплитуды комплекса N20-P23 как на стороне пораженного, так и на стороне клинически интактного полушария (p<0,05). Однако к концу 2-й нед. после операции в основной группе отмечалось значительное снижение амплитуды как на стороне пораженного, так и на стороне клинически интактного полушария по сравнению с показателями 1-х сут после операции. При этом снижение амплитуды на стороне поражения было также достоверным по сравнению с показателями 7-х сут после операции и показателями группы сравнения (p<0,05). К концу 3-й нед. послеоперационного периода отмечалось увеличение показателей амплитуды на стороне пораженного полушария по сравнению с контрольной группой и 1-ми сут после операции (p<0,05). Вместе с этим амплитуда комплекса N20-P23 на стороне клинически интактного полушария была ниже по сравнению с показателями группы сравнения (p<0,05) (табл. 2). 
Обсуждение
Таким образом, для пациентов с неврологическим дефицитом средней степени тяжести по шкале NIHSS вне зависимости от сроков оперативного вмешательства было характерным уменьшение патологических изменений ЭЭГ в виде снижения мощности спектра медленноволновой активности к концу 1-й нед. после операции. Наиболее выраженными эти изменения были в лобно-центральных и лобно-височных отделах обоих полушарий. У пациентов, прооперированных в первые 2 нед. после развития инсульта, начиная с 1-й и до конца 2-й нед. послеоперационного периода наблюдалось угнетение альфа-активности, преимущественно альфа-2-диапазона, в обоих полушариях. По нашим данным, редукция альфа-активности является важным функциональным признаком тяжести патологического процесса. Выраженная депрессия альфа-активности на стороне обоих полушарий является неблагоприятным прогностическим фактором для выполнения каротидной эндартерэктомии и восстановления нарушенных функций после операции. Наличие стадии увеличения мощности альфа-ритма на стороне клинически интактного полушария с одновременной депрессией альфа-ритма на стороне пораженного полушария в послеоперационном периоде является благоприятным прогностическим фактором для восстановления нарушенных функций и коррелирует со статистически значимым уменьшением выраженности неврологического дефицита. У пациентов с инсультом средней тяжести по шкале NIHSS, прооперированных в первые 2 нед. после развития инсульта, начиная со 2-й нед. послеоперационного периода, в клинически интактном полушарии отмечалось уменьшение показателей ВПК, что, по-видимому, связано с ослаблением межполушарного взаимодействия и «истощением» регуляторного воздействия стволовых отделов головного мозга. Это коррелировало (p<0,05) с отсутствием динамики выраженности неврологического дефицита (по шкале NIHSS) у пациентов данной группы в этот период.
Вне зависимости от сроков выполнения оперативного вмешательства у пациентов с неврологическим дефицитом средней степени тяжести по шкале NIHSS в 1-е сут после операции отмечается уменьшение показателей латентности основных пиков, преимущественно N30 и Р45, на стороне обоих полушарий, более выраженное на стороне пораженного полушария (p<0,05). Однако в конце 1-й нед. послеоперационного периода в основной группе мы наблюдали увеличение латентности пиков N20, N30 и Р45 на стороне обоих полушарий (p<0,05), которое сохранялось в течение первых 2-х нед. после операции.
Наряду с этим, начиная с 1-х сут и в течение 1-й нед. после операции, вне зависимости от сроков отмечалось увеличение амплитуды потенциала на стороне обоих полушарий. Это, по-видимому, является отражением улучшения кровоснабжения в зоне ишемии в 1-е сут после операции, которое затем плавно перерастает в развитие легкого гиперперфузионного синдрома вследствие развития вазогенного отека головного мозга, вызывающего угнетение функциональной активности головного мозга. Регистрация дальнейшего увеличения латентности пиков N30 и Р45 и снижение амплитуды комплекса N20–P23 как на стороне пораженного, так и на стороне клинически интактного полушария в основной группе к концу 2-й нед., вероятно, также подтверждают эту теорию.
Только к концу 3-й нед. после операции благодаря подключению компенсаторных механизмов, вероятно, коллатерального кровоснабжения происходит нормализация основных показателей в виде снижения показателей латентности и увеличения амплитуды потенциала на стороне поражения. При этом на стороне клинически интактного полушария показатели латентности были выше, а показатели амплитуды – ниже, чем в группе сравнения, что свидетельствует об «истощении» компенсаторного резерва.
Патологические изменения соматосенсорных вызванных потенциалов в виде увеличения латентности N30, Р45 и снижения амплитуды N20–P23 на стороне поражения являются более ранними динамическими показателями в послеоперационном периоде по сравнению с изменениями неврологического статуса и данными ВПК.
Заключение
Полученные результаты отражают функциональную дезинтеграцию коры головного мозга вследствие структурных изменений и разобщения функциональных связей на фоне ишемического повреждения. Динамика спектрально-когерентных показателей ЭЭГ и показателей соматосенсорных вызванных потенциалов обоснованно служит инструментом оценки прогредиентного течения цереброваскулярной патологии и эффективности применяемых лечебных стратегий. При проведении каротидной эндартерэктомии в остром периоде ИИ комплекс электронейрофизиологических характеристик (нарушение когерентности, снижение амплитуд вызванных потенциалов и т. п.) может быть использован в качестве прогностического маркера, определяющего период восстановления неврологического дефицита в послеоперационном периоде.
Источник
