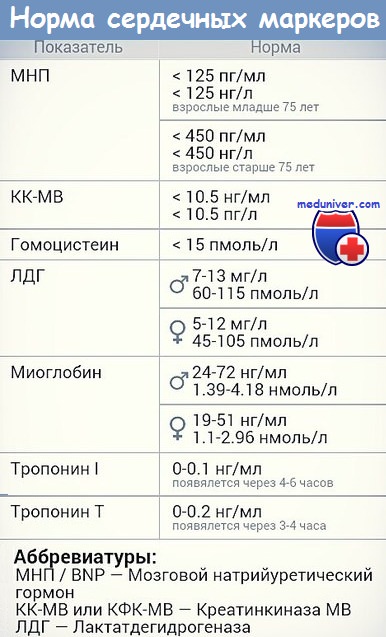
Энзимодиагностика острого инфаркта миокарда
Энзимодиагностика заключается в постановке диагноза на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики 1)при повреждении клеток в крови или других биологических жидкостях увеличивается концентрация внутриклеточных ферментов повреждённых клеток; 2)количество высвобождаемого фермента достаточно для его обнаружения; 3)активность ферментов, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени И отличается от нормальных значений; 4)ряд ферментов имеет органоспецифичность;
Причины, приводящие к увеличению количества ферментов в крови
Ферменты плазмы крови можно разделить на 2 группы. Первая группа ферментов активно секретируется в плазму крови определёнными органами. Ко второй относят большую группу ферментов, высвобождающихся из клеток во время их нормального функционирования. Обычно эти ферменты выполняют свою функцию внутри клетки и не имеют физиологического значения в плазме крови. У здорового человека активность этих ферментов в плазме низкая и достаточно постоянная.
При многих заболеваниях происходит повреждение клеток, и ферменты высвобождаются в кровь. К причинам, вызывающим высвобождение внутриклеточного содержимого в кровь, относят нарушение проницаемости мембраны клеток или нарушение целостности клеток. Используют для диагностики заболеваний сердца, печени, скелетной мускулатуры. появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например о некрозе.
Однако повышение концентрации ферментов не всегда связано с повреждением тканей. При избыточной клеточной пролиферации, например при онкопролиферативных процессах, при повышенной скорости синтеза некоторых ферментов в клетках или при нарушенном клиренсе наблюдают повышение концентрации в крови определённых ферментов.
Энзимодиагностика при инфаркте миокарда и заболеваниях печени.
При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения. Обнаружение повышенной активности КК в плазме крови – основной энзимодиагностический критерий инфаркта миокарда. Дополнительным подтверждением диагноза инфаркта миокарда служит обнаружение активностей ферментов ACT и ЛДГ в крови больных. Активность ACT в норме составляет 5-40 МЕ/л. При инфаркте миокарда повышается через 4-6 ч; максимум активности наблюдают в течение 2-3 дней. Уровень ЛДГ также увеличивается в плазме крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затей наступает постепенная нормализация активности.
Печень. Нормальная активность АЛТ в крови мужчин равна 10-40 Ед/л, у женщин – 12-32 Ед/л. Резкое повышение активности АЛТ в 5-10 и более раз является признаком острого заболевания печени. Активность АСТ возрастает при некрозе печеночных клеток, острый инфекционный и острый токсический гепатит . Соотношение активности АСТ/АЛТ называется коэффициент де Ритиса. Нормальное значение коэффициента 1,3. При повреждениях печени значение коэффициента снижается.
Для диагностики инфекционного гепатита используют определение активности изоформ ЛДГ 4 и 5. При остром гепатите активность ЛДГ5 повышается в первые недели желтушного периода. Повышение совокупной активности изоформ ЛДГ4 и ЛДГ5 выявляется у всех больных инфекционным гепатитом в первые 10 суток. При развитии обтурационной желтухи активность щелочной фосфатазы в сыворотке крови возрастает в 10 и более раз. Увеличение концентрации глутаматдегидрогеназы в крови является признаком начала дистрофических процессов в печени.
Коллаген
Фибриллярный белок с уникальной структурой. Обычно содержит моносаха-ридные(галактоза) и дисахаридные(галактоза-глюкоза) остатки, соединенные с ОН-группами некоторых остатков гидроксилизина. Составляет основу межклеточного вещества соединительной ткани сухожилий, кости, хряща, кожи, но имеется, конеч-но, и в других тканях. Полипептидная
цепь коллагена включает1000 амино-кислот и состоит из повторяющегося триплета[Гли-А-В], где А и В– любые, кроме глицина аминокислоты. В основ-ном это аланин, его доля составляет 11%, доля пролина и гидроксипролина– 21%. Таким образом, на оставшиеся аминокислоты приходится всего33%. Структура пролина и гидроксипролина
не позволяет образовать а-спиральную структуру, из-за этого образуется лево-закрученная спираль, где на один виток приходится3 аминокислотных остатка.
Гидроксилирование пролина осу-ществляет фермент пролилгидроксила-за, железо-содержащий фермент, для его полноценной работы необходим ви-тамин С(аскорбиновая кислота). Недос-таточность аскорбиновой кислоты в пи-ще обуславливает возникновение цинги. Приматы и морские свинки утратили способность синтезировать аскорбино-вую кислоту и, поэтому, должны полу-чать ее с пищей. Являясь сильным вос-становительным агентом, аскорбиновая кислота предохраняет от инактивации про-лилгидроксилазу, поддерживая восстановленное состояние атома железа в фер-менте. Коллаген, синтезированный в отсутствие аскорбиновой кислоты, оказывается недогидроксилированным и не может образовывать нормальные по структуре во-локна, что приводит к поражению кожи и ломкости сосудов.
Молекула коллагена построена из3 полипептидных цепей, сплетенных между
собой в плотный жгут– тропоколлагена(длина=ЗОО нм, d=1,6 нм). Полипептидные
цепи прочно связаны между собой через ε-аминогруппы остатков лизина. Тропокол-лаген формирует крупные коллагеновые фибриллы(d=10-300 нм). Фибриллы очень
прочны, они прочнее стальной проволоки равного сечения. Поперечная исчерчен-ность фибриллы обусловлена смещением молекул тропоколлагена друг относи-тельно друга на1/4 их длины.
В коже фибриллы образуют нерегулярно сплетенную и очень густую сеть–
выделанная кожа представляет собой почти чистый коллаген.
Время полужизни коллагена исчисляется неделями и месяцами. Ключевую
роль в его обмене играет коллагеназа, расщепляющая тропоколлаген на1/4 рас-стояния с С-конца между Гли и Лей.
В результате распада коллагена образуется гидроксипролин. При поражении
соединительной ткани(болезнь Пейджета, гиперпаратиреоидизм) экскреция гидро-ксипролина возрастает и имеет диагностическое значение. По мере старения орга-низма в тропоколлагене образуется все большее число поперечных связей, что делает фибриллы коллагена в соединительной ткани более жесткими и хрупкими. Это ведет к повышенной ломкости кости и снижению прозрачности роговицы глаза встарческом возрасте.
Источник
Оглавление темы “Лабораторная диагностика инфаркта миокарда.”:
Лабораторные методы диагностики инфаркта миокарда. Ферменты инфаркта миокарда.Помимо клинических данных и ЭКГ, в диагностике инфаркта миокарда существенное значение имеет резорбционно-некротический синдром — неспецифическая реакция миокарда, возникающая вследствие асептического некроза, всасывания продуктов некроза и эндогенной интоксикации. Его критерии: лихорадка, гиперферментемия (ферменты выходят из погибших миоцитов при разрушении их мембран) и изменения общего анализа крови. Верификация инфаркта миокарда базируется на существенном росте уровня кардиоспецифических ферментов в плазме. Весьма важны сроки определения уровня ферментов у больного ИМ. Ферменты «быстрого реагирования», которые выходят в периферический кровоток из зоны некроза: • тропонин-Т (специфический миокардиальный белок, отсутствующий в скелетных мышцах) имеет первый пик роста через 2—3 ч с максимумом через 8—10 ч, и высокий уровень сохраняется на протяжении 4-7 дней. Однократное измерение этого теста через 72 ч может быть показателем распространенности ИМ. Тропониновый тест имеет прогностическое значение: если у больного с НСт нет повышения тропонина (в начале ангинозного приступа и через 12 ч), то у него отсутствует свежий инфаркт миокарда. Обычно для верификации диагноза ИМ достаточно двух исследований тропонина-Т (в отличие от необходимости многократных исследований МВ-КФК и КФК). При мелкоочаговом инфаркте миокарда тропонин начинает повышаться с такой же скоростью, как и МВ-КФК, но возвращается к норме более длительно (до 7—14 дней начального периода).
• изофермент МВ-КФК более специфичен (в высоких концентрациях отмечен только в сердце, но в небольших концентрациях содержится в скелетных мышцах). Уровень менее 10 мкг/л указывает на мелкоочаговый ИМ, а более 10 мкг/л — на крупноочаговый. Чтобы исключить ИМ, МВ-КФК регистрируют каждые 8 ч (нужны минимум 3 отрицательных результата). Оценка МВ-КФК весьма полезна, когда имеется сопутствующее поражение мышц или мозга (в них есть КФК, но нет МВ-КФК); • суммарная КФК (норма – 20-80 усл. ед., или до 1,2 ммоль/л, в СИ) повышается через 4—6 ч (пик через 1—2 суток), а нормализуется на 4-й день. КФК содержится не только в сердце, но и в скелете, мышцах, мозге, потому рост ее может быть обусловлен травмами или болезнями мышц (полимиозит, миопатия); катетеризацией сердца; ИЭ и миокардитом (при которых интервал ST может повышаться во многих отведениях); ЭИТ; длительной иммобилизацией; шоком или алкогольной интоксикацией. Необходимо определять КФК в динамике (3-4 раза). Уровень КФК ее возрастает в ходе первых, суток, сохраняется стабильным в течение 3—4 суток и снижается к 6-7-м суткам. Пиковый уровень КФК (и МВ-КФК) на 2-е сутки после ИМ в большей мере, чем другие сывороточные маркеры, указывает на размер некроза. Ранняя диагностика инфаркта миокарда (6—8 ч от начала) с помощью этих кардиоспецифических тестов важна для «сортировки» больных с наличием боли в грудной клетке, для определения соответствующего лечения вследствие объективных трудностей разграничения кардиальной ишемии от ИМ на основе клинических данных. В целом, исследование биохимических специфических маркеров некроза миокарда весьма важно (особенно, если данные ЭКГ позволяют сомневаться в диагнозе инфаркта миокарда). На основе их величин выделяют ОКС с некрозом (ИМ) и без некроза (НСт). Диагностика кардиоспецифических сывороточных ферментов (находившихся в миокардиоцитах и при их разрушении оказавшихся в кровяном русле) имеет большое значение для верификации ИМ без Q.
Видео урок изменений в анализе крови при инфаркте миокардаПри проблемах с просмотром скачайте видео со страницы Здесь – Также рекомендуем “Трансаминазы при инфаркте миокарда. Лактатдегидрогеназы при инфаркте миокарда.” |
Источник
Примерно 30% больных инфарктом миокарда имеют атипичную клиническую картину этого заболевания. Поэтому необходимо проводить дополнительные методы исследования для подтверждения повреждения сердечной мышцы.
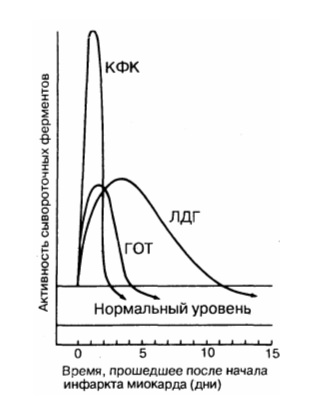
При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы – ACT, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения. Типичную кривую изменения активности этих ферментов можно видеть на рис. 2-37. После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы MB, однако фермент быстро удаляется из кровотока. Обнаружение повышенной активности КК в плазме крови – основной энзимодиагностический критерий инфаркта миокарда. Если у пациента с загрудинными болями не обнаружено изменения в активности КК, диагноз инфаркта миокарда маловероятен.
Дополнительным подтверждением диагноза инфаркта миокарда служит обнаружение активностей ферментов ACT и ЛДГ в крови больных. Динамика изменений этих активностей также представлена на этом рисунке. Активность ACT в норме составляет 5-40 МЕ/л. При инфаркте миокарда активность ACT повышается через 4-6 ч; максимум активности наблюдают в течение
Рис. 2-37. Изменение активности ферментов в плазме крови при инфаркте миокарда.
2-3 дней. Уровень ЛДГ также увеличивается в плазме крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затей наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы.
99. Коллаген: особенности аминокислотного состава, первичной и пространственной структуры. Особенности биосинтеза и созревания коллагена. Роль аскорбиновой кислоты в созревании коллагена.
Коллаген – основной структурный белок межклеточного матрикса. Он составляет от 25 до 33% общего количества белка в организме, т.е. -6% массы тела. Название “коллаген” объединяет семейство близкородственных фибриллярных белков, которые являются основным белковым элементом кожи, костей, сухожилий, хряща, кровеносных сосудов, зубов. В разных тканях преобладают разные типы коллагена, а это, в свою очередь, определяется той ролью, которую коллаген играет в конкретном органе или ткани. Например, в пластинчатой костной ткани, из которой построено большинство плоских и трубчатых костей скелета, коллагеновые волокна имеют строго ориентированное направление:
продольное – в центральной части пластинок, поперечное и под углом – в периферической. Это способствует тому, что даже при расслоении пластинок фибриллы одной пластинки могут продолжаться в соседние, создавая таким образом единую волокнистую структуру кости. Поперечно ориентированные коллагеновые волокна могут вплетаться в промежуточные слои между костными пластинками, благодаря чему достигается прочность костной ткани. В сухожилиях коллаген образует плотные параллельные волокна, которые дают возможность этим структурам выдерживать большие механические нагрузки. В хрящевом матриксе коллаген образует фибриллярную сеть, которая придаёт хрящу прочность, а в роговице глаза коллаген участвует в образовании гексагональных решёток десцеметовых мембран, что обеспечивает прозрачность роговицы, а также участие этих структур в преломлении световых лучей. В дерме фибриллы коллагена ориентированы таким образом, что формируют сеть, особенно хорошо развитую в участках кожи, которые испытывают сильное давление (кожа подошв, локтей, ладоней), а в заживающей ране они агрегированы весьма хаотично. Аминокислотный состав и конформация коллагена описаны в подразделе “Фибриллярные белки” раздела 1.
Здесь будут разобраны синтез и созревание коллагена, структуры, которые он образует, и их функции, а также заболевания, связанные с нарушением этих процессов.
Полиморфизм коллагена
Коллаген – ярко выраженный полиморфный белок. В настоящее время известно 19 типов коллагена, которые отличаются друг от друга по первичной структуре пептидных цепей, функциям и локализации в организме. Вариантов α-цепей, образующих тройную спираль, гораздо больше 19 (около 30). Для обозначения каждого вида коллагена пользуются определённой формулой, в которой тип коллагена записывается римской цифрой в скобках, а для обозначения α-цепей используют арабские цифры: например коллагены II и III типа образованы идентичными α-цепями, их формулы, соответственно [α1(II)]3 и [α1(III)]3; коллагены I и IV типов являются гетеротримерами и образуются обычно двумя разными типами α-цепей, их формулы, соответственно [α1(I)]2α2(I) и [α1(IV)]2α2(IV). Индекс за скобкой обозначает количество идентичных α-цепей. Распределение коллагенов по органам и тканям представлено в табл. 15-1.
Гены коллагена называются соответственно типам коллагена и записываются арабскими цифрами, например COL1 –ген коллагена I типа, COL2– ген коллагена II типа, COL7– ген коллагена VII типа и т.д. К этому символу приписываются буква А (обозначает α-цепь) и арабская цифра (обозначает вид a-цепи). Например, COL1A1и COL1A2кодируют, соответственно, α1 и α2-цепи коллагена I типа.
Источник
развивается по двум путям:
1) использование ферментов в качестве избирательных реагентов для открытия и количественного определения нормальных или аномальных химических веществ в сыворотке крови, моче, желудочном соке и др. (например, выявление при помощи ферментов глюкозы, белка или других веществ в моче, в норме не обнаруживаемых).
2) открытие и количественное определение самих ферментов в биологических жидкостях при патологии. Оказалось, что ряд ферментов появляется в сыворотке крови при распаде клеток (отсюда их название «некротические ферменты»).
Для диагностики органических и функциональных поражений органов и тканей широко применяются отдельные ферментные тесты, выгодно отличающиеся от других химических диагностических тестов, используемых в клинике, высокой чувствительностью и специфичностью. Известно около 20 тестов, основанных на количественном определении активности ферментов (и изоферментов), главным образом в крови (реже в моче), а также в биоптатах (кусочки тканей, полученные при биопсии). В практическом плане энзимологические тесты должны помогать в ранней постановке и дифференциации диагноза, информировать о возможном исходе болезни и эффективности применяемой терапии. Теоретические аспекты медицинской энзимологии сводятся, в основном, к выяснению наиболее полной и достоверной картины патогенеза и этиологии заболевания, т.е. в конечном итоге к познанию молекулярных механизмов нарушений метаболических процессов.
При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе и ферменты, высвобождаются в кровь. К причинам, вызывающим высвобождение внутриклеточного содержимого в кровь, относят нарушение проницаемости мембраны клеток (при воспалительных процессах) или нарушение целостности клеток (при некрозе. Уровень активности ферментов в плазме коррелирует со степенью повреждения клеток.
Для энзимодиагностики имеют большое значение знания о субклеточной локализации ферментов:появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например о некрозе.
Однако повышение концентрации ферментов не всегда связано с повреждением тканей. При избыточной клеточной пролиферации, например при онкопролиферативных процессах, при повышенной скорости синтеза некоторых ферментов в клетках наблюдают повышение концентрации в крови определённых ферментов. Врачам следует учитывать, что нормальные значения активности ферментов в крови детей и беременных женщин отличаются от показателей, характерных для взрослых здоровых людей.
Для правильной интерпретации результатов проведенных исследований обязательным является сопоставление энзимопоказателей с клинической картиной болезни в целом.При оценке выявленных нарушений необходима определенная осторожность, так как один и тот же энзиматический сдвиг может являться звеном патогенетической причинной цепи или характеризовать вторичные механизмы, сопутствующие данной форме патологии, или быть связанным со стереотипной, неспецифической реакцией организма на заболевание, такой, как реакция стресса.
В большинстве случаев клиницисты используют в энзимодиагностике комплекс прямых и косвенных методов исследования ферментов. Иногда появление в крови фермента, в норме в ней отсутствующего, позволяет сразу обнаружить поврежденный орган.Это возможно в том случае, когда фермент присутствует только в одном органе. Например, орнитинкарбомоилтрансферазанайдена только в печени. Однако таких высокоорганоспецифичных ферментов очень мало. Несколько больше ферментов, обнаруженных в двух органах или тканях. Большинство же ферментов широко распространены в организме, что затрудняет выяснение источника их происхождения.
Следует отметить, что из огромного числа ферментов (более 3500), открытых в природе (частично и в организме человека), в диагностической энзимологии используется лишь ограниченный набор ферментов и для весьма небольшого числа болезней (гепатиты, инфаркт миокарда, органические поражения почек, поджелудочной железы, печени и др.). Так, уровень липазы, амилазы, трипсина и химотрипсина в крови резко увеличен при сахарном диабете, злокачественных поражениях поджелудочной железы, болезнях печени и др. Резко повышается в сыворотке крови уровень двух аминотрансфераз, креатинкиназы (и ее изоферментов) и лактатдегидрогеназы (и ее изоферментов) при инфаркте миокарда; умеренно повышено их содержание при поражениях тканей мозга и печени. Определяют, кроме того, активность кислой фосфатазы (уровень повышен при карциноме предстательной железы), щелочной фосфатазы, холинэстеразы и других органоспецифических ферментов (например, гистидазы, глицинамидинотрансферазы, уроканиназы) в сыворотке крови при патологии костной ткани.
Использование изоферментов. При ряде заболеваний исследуют активность ЛДГ в плазме крови. В норме активность ЛДГ составляет
170-520 ЕД/л. Повышение активности наблюдают при острых поражениях сердца, печени, почек, а также при мегалобластных и гемолитических анемиях. Однако это указывает на повреждение лишь одной из перечисленных тканей. Для постановки диагноза необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. Выявление в плазме крови тканеспецифических изоформ ЛДГ используют в качестве диагностического теста повреждения данной ткани.
Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы – ACT, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения. После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы MB, однако фермент быстро удаляется из кровотока. Активность ACT в норме составляет 5-40 МЕ/л. При инфаркте миокарда активность ACT повышается через 4-6 ч; максимум активности наблюдают в течение 2-3 дней. Уровень ЛДГ также увеличивается в плазме крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затей наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы.
Источник