Ишемический инсульт черепно мозговая травма
На правах рекламы
В происхождении черепно-мозговой патологии (факторы первого порядка) при травме или инсульте решающее значение принадлежит механизму возникновения местного первичного очага деполяризации (объемного процесса — внутричерепной градиент давлений в результате вибрации, ротации, ликворного толчка, кровоизлияния). Реакция на травму проявляется местным реактивным отеком (в течение 24 часов) и первичной внутричерепной гипертензией.
Особенно часто повреждаются стволовые отделы, прилегающие к твердой мозговой оболочке, которая либо просто покрывает черепные кости, либо образует собственные фиксированные образования (серп, мозжечковый намет). Преобладание тех или иных признаков обеспечивается местной развитостью сосудистой сети; близостью расположения ядер; полисинаптическим характером нервной ткани, в частности — ретикулярной формации. Её выключение особенно заметно, поскольку одновременно выпадают ее активирующее и синхронизирующее влияния на выше- и нижележащие отделы ЦНС. Наоборот, наилучшие исходы имеют место при ограниченных инфарктах ствола, когда симптоматика выражается лишь в бульбарном или псевдобульбарном параличе (выживают до 47 % больных с изолированными нарушениями дыхания, т.е. без выпадений контроля других жизненно-важных функций).
Повреждающими факторами являются системные и местные гидродинамические нарушения (микроциркуляции крови, ликвора), приводящие одновременно и к новым механическим повреждениям мозговой ткани (ущемления под мозжечковым наметом, в большом затылочном или в трепанационном отверстии), и к обменным нарушениям (гипоксия, ацидоз, избыточные освобождения ацетилхолина, гистамина и других продуктов местного катаболизма).
Существенную роль в возникновении этих условий играет т.н. первичная центральная холинэргическая реакция. Её суть в том, что раздражение парасимпатических ядер ведет к массивной энерготропной противорегуляции с “дистонией”, с местными (вазоконстрикция со стазом и агрегацией кровяных телец), и системными расстройствами гидродинамики. В свою очередь, отклонения в гидродинамике и в эндокринно-гуморальном состоянии ведут к утяжелению нарушений внутричерепных водных состояний и водообменов. Так, при росте внутричерепного давления и параллельном затруднении кровообращения страдают функции коры мозга, и из-под ее влияния выпадают подбугровые центры — диенцефальный синдром. Он сопровождается всплеском гиперкатаболизма с гиперпноэ, с мышечной и артериальной гипертензией, с гипергликемией, гипертермией и проч. . На определенном этапе и в нетяжелых ситуациях они имеют компенсаторное значение: благодаря им мозг даже при уменьшенном кровотоке в состоянии извлечь максимально возможное количество питательных веществ и стимуляторов. Но затем с ростом АД, артериального притока к мозгу и внутричерепного давления возбуждаются механизмы контроля за внутричерепной гидродинамики. В частности, в этом же направлении действует гипокапния, сопутствующая усилению легочной вентиляции. Они вызывают сужение мозговых артериальный сосудов, чем хоть как-то сдерживается артериальный приток. Но при снижении рСО2 ниже 19 мм рт. ст. это сужение становится чрезмерным. Одновременное сладжирование форменных элементов, обусловленное их деполяризацией поврежденными тканями, усугубляет ишемические повреждения мозга (и миокарда). Наоборот, гиперкапния (например, при параллельных нарушениях проходимости дыхательных путей) сопровождается расширением сосудов и увеличением притока крови к мозгу. Исход, как всегда, определяется многими факторами. Так, при выраженном локальном первичном отеке, сопровождающем тяжелые повреждения, когда собственные механизмы стабилизации ВЧГ не справляются со своими функциями, -возникает новая волна теперь уже вторичного генерализованного отека. Он обеспечивается как гидродинамическим компонентом (преобладание артериального притока над венозным оттоком), так и метаболическим (преобладание распада над синтезом).
При этом все происходит, как в амортизаторах автомобиля при чрезмерной его загрузке, — из желудочков мозга в спинальное пространство вытесняются новые порции ликвора. Точно так же выдавливаются новые порции венозной крови из мозговых вен через синусы в систему верхней полой вены. По мере использования этих аммортизационных гидромеханических компенсаторных процессов и выдавливания содержимого желудочков за пределы черепной коробки, — возможности анатомических механизмов в стабилизации ВЧГ истощаются. К тому же нарушения трофики, сопутствующие застою и отеку, сопровождаются катастрофически быстрым повреждениям клеток с их отеком (набуханием) и трансминерализацией. При этом вторичный безбелковый транссудат пропитывает неклеточное пространство мозгового вещества (глиарная водная интоксикация), отдирая клетки и друг от друга, и от сосудов, разобщая эти образования анатомически и функционально (арефлексия разобщения). В тяжелых случаях трансминерализация с клеточным отеком может перерасти в состояние злокачественного декомпенсированного глиарного отека, когда разрушается миелиновое покрытие нейронов; фрагментируется глия; образуются периглиарные «озера», в которых плавают кровяные клетки и клеточные фрагменты.
Наиболее заметные нарушения и трофики, и функции возникают в местах прилегания мозга к твердым внутричерепным образованиям, — в коре мозга у внутренней поверхности черепной кости; в ножках мозга около острых передних краев мозжечкового намета; в передних отделах у серпа; в оливах мозжечка у затылочного отверстия; в черепномозговых нервах на бугристом основании черепа. Темп возникновения этих осложнений зависит от быстроты развития и локализации объемного процесса.
Как только внутричерепное давление приблизится к давлению в мозговых капиллярах (около 300 мм вод.ст.), кровоток в них прекращается. Соответственно выпадают стволовые функции и необратимо падает АД. Еще до этого перепады внутричерепного давления ведут к смещениям (дислокации) мозговой массы и сопровождаются возникновением вклинений (ущемленные мозговые грыжи) в естественных отверстиях и щелях черепа. В их возникновении принимают участие два механических компонента. Один обусловлен тяжестью самого мозга (гравитационный), а другой — градиентами гидродинамических давлений (гидродинамический). Направление силы тяжести всегда постоянно — к центру Земли, а гидродинамические — всегда в сторону наименьшего противодавления — под мозжечковый намет, к большому затылочному или трепанационному отверстию. В ходе этих смещений происходят сдавления и перегибы венозные сосуды. В большей степени это относится к месту впадения внутренних мозговых вен и нижнего сагитального синуса в прямой синус, проходящий по мозжечковому намету, а также сигмовидного синуса во внутреннюю яремную вену.
На данном этапе к спонтанным повреждающим факторам второго порядка присоединяется ятрогенный, связанный с «неисправимым» стремлением медицинских работников уложить пострадавшего на спину. В таком положении направленность гравитационного и гидродинамического компонентов совпадают, что обеспечивает катастрофически быстрое нарастание мозговых повреждений. Тяжестью мозга на острых краях мозжечкового намета «отдавливаются» нижне-наружные отделы ножек мозга, глазодвигательный, блоковидного и тройничный нервы. Параллельно под тяжестью мозга сдавливается сильвиев водопровод, отводящий ликвор через четвертый желудочек к спинальному пространству. Этим блокируется ликвородинамика и провоцируется бурное нарастание ВЧД. Оно вместе с тяжестью мозга «втискивают» ствол и мозжечковые оливы в большое затылочное отверстие.
Ущемляющиеся участки, как правило, ответственны за регуляцию важных, и потому легко наблюдаемых функций. Сдавлением ножек мозга обусловлена быстро прогрессирующая оглушенность переходящая в отсутствие внешних проявлений сознания. Но нередко пациент способен и слышать (слуховой нерв не повреждается), и запоминать происходящее вокруг себя. Диенцефальный отдел контролирует энергопродукцию. Продолговатый мозг полностью ответственен за управление дыхательным автоматизмом, сердечным ритмом и связью головным мозгом со спинным. Грубые и необратимые трофические нарушения, возникающие в ущемляющихся частях знаменуют собой терминальную стадию острой ЧМП.
Метаболический компонент при острой ЧМТ
Клеточные структуры очень ранимы. Эта ранимость определяется высокой скоростью их обмена. Причем наиболее интенсивно обмениваются ферментные белки, определяющие направление в чрезвычайно разветвленных метаболических путях. Наименее интенсивно — нуклеиновые кислоты клеточного ядра — своеобразные информационные хранилища клетки. Направленность обмена (анаболическая или катаболическая) в значительной степени определяется активностью внутриклеточных лизосомальных гидролаз, которая возрастает по мере переводнения и закисления (протонизации) внутриклеточной среды.
Значение чрезмерной протонизации описано выше в разделе о кислотно-щелочном равновесии. Напомним лишь, что баррикадирование метаболических трасс протонами ведет клетку к гибели, которая приходит через хорошо известные и понятные явления:
- прекращение энергообразования и вместе с этим энергозависимых процессов обновления, неспецифических и специфических клеточных функций;
- взаимную активацию клеточных гидролаз (аутолитических ферментов), внутриклеточного распада, клеточной гиперосмии и неудержимого клеточного переводнения.
И все же в этих условиях и аноксии, и обескровливания (ишемии), и застоя мозговая ткань в течение довольно длительного времени способна сохранять способность и к энергообразованию, и собственно жизнеспособность. “Животворную” роль играют:
- во-первых, количественный перевес концентраций субстратов (исходных продуктов для цепи метаболических процессов) над конечными продуктами (мозг не имеет существенных запасов) и
- во-вторых, тренированность протон-разгрузочных механизмов.
Естественно, что для функционирования этой многозвеньевой, конвейерной метаболической системы должен существовать достаточно емкий резерв субстратов-переносчиков, способных принять эти переносимые протоны и удерживать их (депонировать) до «лучших времен». Подобную функцию могут выполнить так называемые метаболические шунты и тупики (применительно к ситуации их лучше назвать протоновыми мешками, дивертикулами или ловушками, подобными стоянкам и ловушкам, которые обустраивают автодорожники на автомагистралях и при крутых поворотах горных автосерпантинов). Их возможности могут быть расширены путем предварительных тренировок соответствующих ферментных систем (Коростовцева Н.В.,1973).
Первым звеном в протонакцепторной системе является система НАД и НАДФ, обеспечивающая активный перенос протонов между субстратами. Наиболее известен в этой роли — лактатный тупик, емкость которого, по данным А. Лабори (1967), составляет около 7 мМ/л лактата. Мало, кто из врачей знает о существовании глицерофосфатного (Boxer G.E., Devlin T.M., 1961; Smith R.E., Holier D.J., 1962), глутаматного, аспартатногой, цис-аконитовогой, глиоксилевого и других шунтов. Между тем они также активно участвуют в освобождении от протонов и в реактивации НАД и НАДФ, которые способны затем вновь включаться в процессы энергообразования.
Однако по мере накопления промежуточных продуктов неизбежно сглаживается градиент концентраций между субстратами и продуктами реакций. Темп последних замедляется. Правда, замедляется и расход энергетических веществ. Таким образом, при подавленном аутолизе, умирание тем обратимее, чем больше энергетический резерв и емкость протоновых мешков (концентрация соответствующих ферментов). В первую очередь, это имеет профилактическое значение — для защиты мозга от последствий ПРЕДСТОЯЩИХ гипоксии или ишемии.
В условиях уже свершившейся ишемии (ПОСТИШЕМИЧЕСКИЙ период) и восстановленного орошения клетки (в том числе кислородом и доступными субстратами) возникает необходимость не в консервации, а в максимально быстром восстановлении митохондриального окислительного фосфорилирования. Понятно, что “сдвинуть с места” остановившееся «колесо Кребса», восстановить естественное направление и темп обмена при «обнуленных» концентрационных градиентах , да к тому же в максимально «запротоненной» среде, — можно только энергичным «метаболическим толчком» за счет субстратного «подпора» при одновременном активировании следующих двух механизмов:
- открытия шлюза (реокислением НАД и НАДФ);
- сброса «отработанных» субстратов с метаболической магистрали и из протоновых мешков за пределы клетки.
Актуальнейшее значение приобретает субстратная ценность, то есть «легкость» включения субстратов в нужную реакцию. В основном она определяется размерами их молекулы и независимостью от ферментов, катализирующих реакции на ключевых звеньях метаболического конвейера.
При гипоксии многие ферменты деградируют под действием активизирующихся лизосомальных протеаз. Гексокиназа и фосфофруктокиназа, катализирующие метаболизм глюкозы, относятся, по-видимому, к наиболее чувствительным. Кроме того, клеточные протеазы способны препятствовать связыванию гексокиназы с липопротеинами митохондриальных мембран, разрушать ферменты дыхательной цепи, содержащие флавиновые или геминовые группы, а также разрушать белок, содержащий негеминовое железо. В результате для «запротоненного» мозга становится непосильным окисление даже «привычной» глюкозы, и она с гораздо большей легкостью (особенно при параллельной «адекватной» инсулинотерапии) направляется «вверх» к превращению в гликоген, чем «вниз» — к окислению в пируват.
Метаболический толчок мог бы быть осуществлен резким повышением концентрации субстрата, обладающего способностью отдавать свои протоны непосредственно компонентам дыхательной цепи в ее последних звеньях. Именно такими свойствами обладают ГАМК, ацето-ацетатная и глицерат-диоксиацетон-фосфатная системы по отношению к цитохромам, а сукцинат — в отношении ФАД-звена (Раппопорт, 1964; Шумаков В.И. и др.,1975).
Оказывается, что и снижение субстратной ценности глюкозы при ишемии сравнительно легко обратимо. Во всяком случае, в эксперименте (Грушевский В.Е. и Грушевская О.А.,1973) мозговая ткань даже после 30-минутной полной ишемии вновь в присутствии ингибиторов протеиназ восстанавливала способность утилизировать кислород и неорганический фосфор.
Сдвоенные действия. Тот же результат, но без ингибиторов был получен нами при использовании ГЛИЦЕРИНА вместо глюкозы в качестве субстрата. Используя глицерин в реаниматологической практике, мы неоднократно наблюдали быстрое восстановление мозговых функций, особенно при комах «неясной этиологии». Несколько позднее к аналогичным выводам пришли также Wilson J.K. (1976) и другие.
Источник<!—->: https://neurologia.narod.ru/liter/inscmt.htm
Мой блог находят по следующим фразам
- психолог онлайн бесплатно
- талантливые дети от смешанных браков
- психологическая помощь on-line бесплатно
- чистка квартиры при помощи свечи
- Бесплатный реферат Патопсихологические аспекты нарушений личности
- дети от смешанного брака
Источник
Реабилитация пациентов после черепно-мозговой травмы и инсультаЧерепно-мозговая травма (ЧМТ) возникает при внезапной травме, повреждающей мозг. ЧМТ может возникнуть при внезапном и мощном ударе головы об объект или при проникновении объекта в череп и повреждении ткани головного мозга. Симптомы ЧМТ могут быть легкими, средней или тяжелой степени, в зависимости от степени повреждения головного мозга. Инсульт или острое расстройство мозгового кровообращения возникает при внезапном прекращении притока крови к части мозга из-за окклюзии (ишемия), разрыва сосуда (кровотечение) или по другим причинам. Ишемия — снижение кровотока чаще всего из-за обструкции сосуда. Геморрагический инсульт происходит при разрыве кровеносного сосуда в головном мозге с образованием внутримозговой гематомы или при разрыве мозговой аневризмы. Небольшая доля инсультов вызывается гипоперфузией при других сердечнососудистых заболеваниях, включая васкулит. При легкой черепно-мозговой травме (ЧМТ) сознание сохраняется или утрачивается на короткий промежуток времени. Симптомы легкой ЧМТ включают головную боль, спутанность сознания, головокружение, тошноту, помутнение зрения или усталость глаз, звон в ушах, неприятный привкус во рту, усталость или вялость, изменение режима сна, поведенческие изменения или изменения настроения, проблемы с памятью и концентрацией внимания. Жалобами при умеренной или тяжелой ЧМТ также является головная боль, которая усиливается или не проходит, многократная рвота и тошнота, конвульсии или судороги, неспособность проснуться, расширение одного или обоих зрачков, невнятная речь, слабость или онемение в конечностях, потеря координации и спутанность сознания, беспокойство или волнение. Инсульт является неотложной медицинской ситуацией. Большинство инсультов происходит, когда сгусток крови блокирует одну из артерий (сосудов), питающих мозг. Этот тип инсульта называют ишемическим инсультом. Транзиторная ишемическая атака (ТИА) является краткосрочным инсультом, который длится менее 24 часов. Доставка кислорода в мозг восстанавливается быстро, и симптомы инсульта полностью исчезают. При ТИА пациент нуждается в медицинской помощи, так как это предупреждение о серьезной опасности обширного инсульта. Тромбоз сосудов головного мозга возникает, когда сгусток крови (тромб) формируется в артерии (сосудах) питающих мозг. Сгусток прерывает кровоснабжение, и клетки мозга испытывают недостаток кислорода. Кровоизлияние в мозг, вызванное разрывом кровеносного сосуда, наносит дополнительное повреждение тканям мозга проникающей в них кровью, приводя к немедленной и отсроченной заболеваемости и летальности. а) Неотложное лечение. Любой пострадавший с ЧМТ должен получить медицинскую помощь как можно скорее. Медперсонал должен попытаться стабилизировать состояние пациента с ЧМТ, сосредоточив внимание на предотвращении дальнейших повреждений. Первые несколько дней после инсульта лечение включает в себя обеспечение хорошей гидратации и питания. Реабилитация помогает пациентам вернуться к нормальной жизни, по возможности быстро восстанавливая и корректируя повседневные навыки. Подход требует участия различных специалистов с общей задачей помощи пациенту. Она включает медицинский персонал и физиотерапию, трудотерапию, речевую и языковую терапию и, как правило, специалиста в области реабилитации. Некоторые коллективы могут включать психологов, социальных работников и фармацевтов. Физиотерапия (ФЗТ) и трудотерапия (ТТ) являются важными компонентами процесса реабилитации. ТТ включает в себя упражнения и тренинги, чтобы помочь пациенту заново обрести навыки повседневной деятельности, которые иногда называют насущными потребностями: такие как еда, питье, и глотание, одевание, купание, приготовление пищи, чтение и письмо, туалет. Речевая и языковая терапия подходят для пациентов с проблемами понимания речи или письменного слова, или с проблемами формирования речи. Пациенты могут иметь особые проблемы, такие, как неспособность глотать, или неправильно глотать, например, при проглатывании пища может попадать в легкие и вызвать аспирационную пневмонию. Функция глотания может улучшиться со временем, но в промежуточном периоде может быть установлен назогастральный зонд, позволяющий жидкой пище попадать непосредственно в желудок. Если через неделю функция глотания еще не восстановилась, то на неопределенный срок должна быть наложена гастростома. Реабилитация может длиться от нескольких дней до нескольких месяцев. Возвращение функций в основном проявляется в первые дни и недели, а затем снижается. Полное восстановление нетипично, но не исключается. У большинства пациентов отмечается улучшение определенной степени. б) Прогноз черепно-мозговой травмы (ЧМТ) и инсульта. Примерно половине всех пациентов с тяжелой черепно-мозговой травмой требуется операция, чтобы удалить гематомы или очаги ушибов. К обычным нарушениям относятся проблемы с познанием, сенсорной обработкой, коммуникацией и поведением или психическим здоровьем. Более серьезная травма головы может привести к ступору, из которого пациент может быть выведен сильным стимулом, например, острой болью, к коме, вегетативному состоянию или вегетативному статусу, при сохранении вегетативного состояния более месяца. Инсульт обычно влияет на весь организм. Возникающие в результате нарушения включают паралич, когнитивные нарушения, проблемы с речью, эмоциональные трудности, пролежни, пневмонию, невозможность участвовать в повседневной жизни и боль. Если инсульт является достаточно серьезным, возможны кома или смерть. У постинсультных больных нередко встречается депрессия. в) Восстановление функций верхних конечностей. Традиционная терапия при нарушении функции верхних конечностей включает фармакологические средства, физиотерапию и комплексную поведенческую и физическую терапию. Эффективным методом реабилитации является принудительная двигательная терапия (ПДТ). Клинические исследования показали, что ПДТ эффективна в улучшении функции конечностей для использования в реальных условиях. Лечение включает в себя ограничение движения менее пострадавшей руки с помощью повязки в течение двух недель (90% времени бодрствования), в это время интенсивно тренируют вторую руку. Общим терапевтическим фактором выступает усиленная индукция концентрации с частым использованием конечности. Методы нейровизуализации и другие исследования, в которых применяется транскраниальная магнитная стимуляция (ТМС), показали, что при ПДТ происходит обширная корковая реорганизация. Было доказано, что эффективность ПДТ выше у пациентов, у которых до терапии присутствовали рудиментарные движения пальцев и запястья. Авторы показали значительное улучшение объема и качества движения (запись двигательной активности, тест фактического объема движений, тест моторной функции Вольфа, тест двигательной возможности руки). Повторяющаяся двигательная терапия приводит к улучшению функции у пациентов с изначально умеренными нарушениями. В противоположность этому, и против теории двигательных навыков, подход к лечению пациентов, которых поощряли заниматься вне сеанса терапии, не показал преимуществ. Робот-автоматизированная терапия доказала, что интенсивные упражнения полезны. Робот предназначен для обеспечения интерактивной, целенаправленной двигательной активности и для клинической неврологической оценки восстановления движений конечности. В слепом рандомизированном исследовании у 20 пациентов, перенесших инсульт, традиционная терапия была дополнена или робот-автоматизированной терапией или робот-терапией с симуляцией движения. Функция улучшилась в обеих группах от момента госпитализации до выписки, однако пациенты в робот-группе показали большую степень восстановления двигательной функции. При рандомизированном исследовании 56 пациентов, перенесших инсульт, у которых сравнивалась стандартная постинсультная междисциплинарная роботизированная реабилитация с обучением (не менее 25 часов) и без обучения, лучшие результаты (оценка моторной функции верхней конечности по Fugl-Meyer, шкала двигательной активности, шкала мышечной силы и оценка функциональной независимости) были продемонстрированы в группе, использовавшей робота с обучением, но это не относилось к нетренированному запястью и кисти. Электрическая стимуляция на уровнях, где активируются только афферентные пути, способствует восстановлению сенсорно-двигательных нарушений. Проводилось исследование влияния электрической стимуляции на всю ладонь через проводную сетку перчатки для оценки остаточного двигательного контроля верхней конечности. Функциональный объем движений в паретичных конечностях при воздействии тока низкой интенсивности с низкой частотой (1,7 Гц), чрескожная электрическая стимуляция нервов (Low-TES) изучали через сравнительно короткое время после инсульта (6-12 месяцев) у 46 больных. Результаты показали значительное улучшение двигательной функции в группе лечения по сравнению с контрольной группой. Но это не уменьшает ни боли, ни спазмов. Терапевтическая электростимуляция (ТЭС) была оценена в ряде клинических исследований. Было выявлено улучшение функции верхних конечностей у хронических пациентов, перенесших инсульт, которые подверглись различным методам стимулирования разгибателей запястья в течение трех месяцев. Сравнение результатов проведения теста моторного восстановления после ишемии Fugl-Meyer путем тестирования с самого начала, после окончания лечения, через три месяца, и через девять месяцев показывали преимущества ТЭС. В слепом рандомизированном контролируемом многоцентровом исследовании 100 пациентов, перенесших инсульт, были включены в группу с дополнительной сенсорно-моторной стимуляцией или в контрольные группы в течение шести недель. Тест Brunnstrom-Fugl-Meyer активность руки и индекс Бартела до, в середине, после процедуры и в последующие 6 и 12 месяцев после инсульта показали, что пациенты TES группы улучшили свою двигательную активность, но статистически значимые различия выявлялись лишь при последующем наблюдении. В слепом рандомизированном исследовании 60 пациентов были разделены на две равные группы (40 сеансов в течение 8 недель). Наилучшие результаты были получены у пациентов с некоторыми остаточными двигательными функциями в самом начале. 46 пациентов, перенесших инсульт, были случайным образом распределены для получения либо нервно-мышечной стимуляции, либо плацебо. В группе, получающей лечение нервно-мышечной стимуляцией, проводились упражнения на растяжение запястья и пальцев. Контрольная группа получала плацебо-стимуляцию паретичного предплечья (один час в день, 15 сеансов). Результаты оценивались слепым методом по оценке двигательной активности по Fugl-Meyer и самостоятельной оценке по шкале функциональной независимости до лечения, сразу после лечения и через 4 и 12 недель после лечения. Анализ параметров показал значительное преимущество в группе, получавших лечение, по оценке двигательной активности по Fugl-Meyer после лечения, через 4 и 12 недель после лечения. Оценка измерения функциональной независимости не выявила различий между группами в любом из промежутков времени. ЭМГ-триггерная нервно-мышечная стимуляция усиливает двигательную функцию верхней конечности и способствует восстановлению функций больных с острым инсультом. Пациенты получали две 30-минутные сессии укрепляющих запястье упражнений в день с ЭМГ-стимуляцией (экспериментальная группа) или без нее (контрольная группа) в течение всего срока реабилитации. В одном случае оценивалась двигательная активность по Fugl-Meyer, питание, уход и самостоятельная оценка по шкале функциональной независимости, а в другом случае оценивалось ощущение силы. Пациенты, получавшие ЭМГ-стимуляцию, показывали значительно лучшие результаты, чем контрольная группа. Функциональная электрическая терапия (ФЭТ) заключается в комбинации электрической стимуляции и упражнений, которая позволяет выполнять функциональные движения. В ранних клинических исследованиях было проанализировано функционирование верхних конечностей после двухканальный электрической стимуляции, дополненной упражнениями на разгибание локтя и пальцев/кистей рук (три еженедельных занятий по 30 минут). После двух месяцев качество движение улучшилось у всех 8 пациентов. Улучшение было существенным у пяти пациентов, а у остальных улучшение было значительным только для мышц разгибателей локтя. В недавних исследованиях оценивалось восстановление достижений у пациентов в острой и подострой фазе инсульта по результатам теста функций верхней конечности, координации, спастичности, диапазону движений и анкете объема и качества пользования конечностью. Результаты были значительно лучше (р
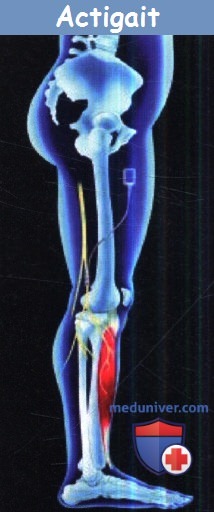
г) Восстановление функций нижних конечностей. На первом этапе восстановления функции ходьбы является обеспечение стояния. На сегодняшний день наиболее перспективным подходом является использование баланс-тренажеров. Одним из эффективных средств и методов является баланс Тренер®. Он позволяет безопасно вставать и стоять. Лица с ограниченным движением, которые не могут стоять безопасно и самостоятельно, поддерживаются в области таза, и они могут учиться равновесию. Эта система сочетает в себе эффективность классического обучения с тренировкой устойчивости в бедре и верхней части туловища. Использование беговой дорожки становится обычной практикой в восстановлении функции ходьбы. Ходьба на беговой дорожке подразумевает поддержку веса тела при ходьбе на моторной беговой дорожке. Основанием для такого подхода является факт, согласно которому частичная поддержка веса снижает некоторые биомеханические ограничения и помогает держать равновесие. Этот эффект переноса был доказан при гемиплегии. Девять пациентов с гемиплегией прошли обучение на беговой дорожке в течение 15 минут в 25 сессий с использованием частичной поддержки веса. После лечения у них значительно улучшились двигательные способности, а также скорость и частота ходьбы. В контролируемом исследовании эффекта обучения балансу, двигательным задачам и скорости походки у 100 пациентов были показаны преимущества частичной поддержки тяжести тела совместно с обучением на беговой дорожке над использованием беговой дорожки без поддержки. В последние годы беговая дорожка стала более доступной во многих отделениях лечебной физкультуры. Многие пациенты с гемиплегией в состоянии тренироваться на беговой дорожке без использования частичной поддержки веса на ранних стадиях в процессе реабилитации при условии, что начальная скорость беговой дорожки не превышает 0,2-0,4 км/час. Использование беговой дорожки становится проще с помощью роботов, которые обеспечивают поддержку тела и создание опорно-двигательного типа циклических движений (например, Locomat®; Hokoma, Volketswil, Швейцария). Locomat генерирует движение в тазобедренном и коленном суставах, в результате чего ходьба на беговой дорожке становиться простой и эффективной. Тренажер походки обеспечивает движение ноги, а тело частично поддерживается и контролируется механизмом. Электрическая стимуляция была протестирована у пациентов с гемиплегией для улучшения функции ходьбы. В большинстве случаев имела место только проблема падения стопы, хотя были испытаны и другие методы (например, стимуляции подвздошно-поясничной мышцы чрескожными электродами). Параллельно с этим развитие систем ходьбы для пациентов с параплегией привело к технологии, которая подходит для активации или ингибирования сенсорно-моторных систем. Была протестирована возможность использования той же технологии после ЧМТ и инсульта. В общем, электрическая стимуляция с помощью современных интерфейсов является приемлемым методом улучшения функций паретичных конечностей. Электрическая стимуляция активирует как афферентные, так и эфферентные пути, в результате прямого или рефлекторного двигательного ответа и прямой стимуляции центральной нервной системы. ТЭС для функции ходьбы ведется по протоколу, сочетающему активные интенсивные упражнения, но с участием электростимуляции, синхронизирующей активацию нескольких групп мышц, имитируя активность здорового человека. Роль этой стимуляции заключается в обеспечении усиления мышечной активации паретичных мышц, а также увеличении сенсорного потока к верхним двигательным нейронам. Недавно обнаружилось, что базовая функциональная электротерапия при стимуляции центральной нервной системы при параплегии вызывает нисходящие сигналы и активирует половинные центры, называемые центральными генераторными структурами. д) Ортезы для реабилитации пациентов с травмами и заболеваниями сосудов. У многих пациентов после ЧМТ и инсульта функции не восстанавливаются. В этих случаях полезны простые механические шины, которые могут обеспечить лучшее положение и, возможно, ограниченное движение. Технология, которая постепенно находит свое место в повседневной жизни, использует функциональную электростимуляцию. Функциональная электрическая стимуляция может быть применена через поверхностные электроды, однако окончательное решение заключается в использовании технологии имплантатов, которая максимизирует комфорт и уменьшает сложность использования (например, акти-походка ®; Neurodan, Ольборг, Дания). е) Заключение. Последние представленные мнения многих клинических исследований заключаются в том, что интенсивные упражнения в ранние сроки после начала травмы/болезни являются наиболее эффективным методом сенсорно-моторного восстановления. Эта процедура обеспечивает лучшее использование пластичности центральной нервной системы и предотвращает развитие компенсаторных механизмов и моделей неприменения, ведущих к инвалидности.
– Также рекомендуем “Хирургическая анатомия позвоночника” Оглавление темы “Реабилитация нейрохирургических больных.”:
|
Источник