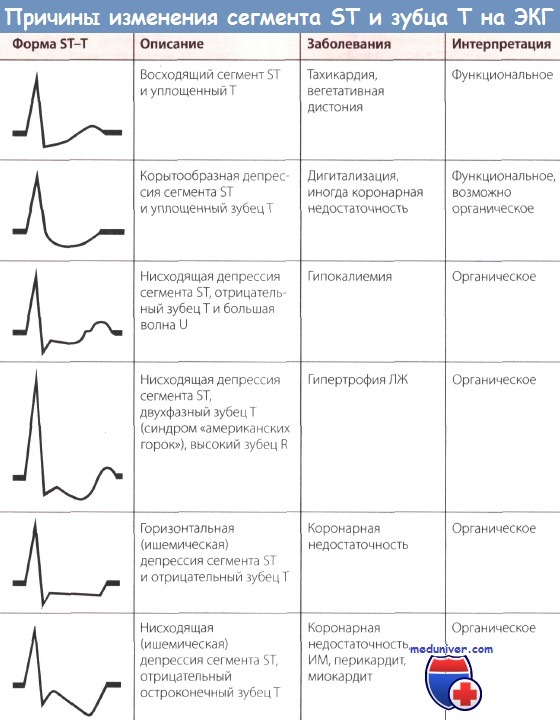
Инверсия т при инфаркте
Инверсия зубца Т. Варианты инверсии зубца TИногда физиологические варианты инверсии зубца Т ошибочно принимают за ишемию. Зубцы Т в правых грудных отведениях, чаще в V1 и V2, легко подвержены инверсии. У некоторых взрослых людей сохраняется ювенильная конфигурация зубца Т с достаточно выраженной его инверсией от правых до средних грудных отведений, демонстрирующих морфологию rS или RS. Такие морфологические признаки, особенно сопровождаемые желудочковой экстрасистолией с комплексами БЛН или соответствующим семейным анамнезом, серьезно повышают вероятность аритмогенной дисплазии ПЖ. Другой важный вариант нормы, который может быть связан с глубокой инверсией зубца Т, — признак ранней реполяризации. Некоторые пациенты с этим вариантом нормы имеют выраженные инвертированные двухфазные зубцы Т, сопровождаемые подъемом ST. Такая картина на ЭКГ, которую можно принять за начальную стадию развивающегося ИМ, наблюдается у большинства молодых афроамериканцев и атлетов. Эти функциональные изменения ST-T происходят, вероятно, из-за смещения времени начала процесса реполяризации в отдельных участках миокарда и исчезают при физической нагрузке. Первичные и вторичные инверсии зубца Т. Различные патологические факторы могут менять реполяризанию и служить причиной глубокой инверсии зубца Т. Как отмечалось ранее, изменения зубца Т обычно классифицируют как первичные или вторичные. Первичные изменения зубца Т происходят вследствие альтерации длительности или морфологии желудочковых ПД при отсутствии изменений в последовательности возбуждения. Примерами служат ишемия, влияние лекарственных препаратов и метаболических факторов. Глубокие первичные инверсии зубца Т (или, в некоторых случаях, высокие положительные зубцы Т) являются также хорошо известной особенностью ЭКГ при цереброваскулярных катастрофах, в частности при субарахноидальном кровоизлиянии. Так называемые цереброваскулярные зубцы Т представляют собой характерные диффузные, далеко отстоящие от QRS зубцы, которые обычно сопровождаются значительно удлиненными интервалами QT.
Такие изменения зубца Т некоторые исследователи связывают с органическим поражением сердца (миоцитолизом), вызванным, вероятно, высокой симпатической стимуляцией, проходящей через гипоталамус. Определенную роль в генезе таких альтераций зубца Т, которые обычно ассоциированы с брадикардией, играет также сопутствующая вагусная активность. Аналогичные изменения зубца Т были обнаружены после стволовой ваготомии, радикальных вмешательств на шее и билатеральной каротидной эндартерэктомии. Массивная диффузная инверсия зубцов Т, наблюдаемая у некоторых больных после приступа синкопе Stokes-Adams, может быть связана с аналогичным нейрогенным механизмом. У больных с субарахноидальным кровоизлиянием выявляют па ЭКГ преходящую элевацию ST, а также аритмии, включая полиморфную желудочковую пароксизмальную тахикардию torsades de pointes (эта аритмия имеет и другие названия: «пируэт», «сердечный балет», желудочковая фибрилляция-трепетание, полиморфное желудочковое трепетание, атипичная желудочковая тахикардия; в России прижились названия этой аритмии «двунаправленная веретенообразная тахикардия» и «полиморфная желудочковая тахикардия»). Может развиться даже дисфункция желудочков. В отличие от первичных нарушений зубца Т, вторичные его изменения происходят в результате альтерации в активации желудочков (без изменений в характеристиках их ПД), например: блокады ножек пучка Гиса, феномена предвозбуждения WPW и желудочковых эктопических импульсов или импульсов вследствие желудочковой стимуляции. Дополнительно модифицированное возбуждение желудочков (связанное с удлинением комплекса QRS) может вызывать стойкое изменение зубца Т, которое продолжается после возобновления нормальной деполяризации желудочков. Термин «изменения зубца Т вследствие памяти сердца» (cardiac memory T wave changes) в этом контексте используют для описания альтерации реиоляризации, следующей за изменением деполяризации, спровоцированным желудочковой стимуляцией, преходящими БЛН или предвозбуждением WPW, а также другими модификациями желудочкового возбуждения. Термин «идиоматическая глобальная инверсия зубца Т» (idiopathic global T wave inversion) используют в случаях, когда причины, приведшие к выраженным диффузным нарушениям реиоляризации, неясны. Существует необъяснимое преобладание таких изменений зубца Т у женщин.
Учебное видео нормы и изменений зубцов Т и U на ЭКГ
– Также рекомендуем “Влияние лекарственных препаратов, дигиталиса на сегмент ST-T. Влияние кальция на ЭКГ” Оглавление темы “Признаки ишемии на ЭКГ”: |
Источник
Д.А. Кужель, Г.В. Матюшин, Т.Д. Федорова Е.А., Савченко, Т.М. Задоенко
КГУЗ «Красноярская краевая больница № 2»
ГОУВПО «Красноярская государственная медицинская академия»
Электрокардиограмма в 12 стандартных отведениях является методом выбора в диагностике острого инфаркта миокарда (ОИМ). Быстрая и точная диагностика ОИМ жизненно необходима, поскольку дает возможность немедленно начать реперфузионную терапию, что позволяет сократить зону некроза и улучшить прогноз пациента. Одним из общепринятых критериев инфаркта миокарда является подъем сегмента ST в двух или более анатомически смежных отведениях [10]. Важность своевременной идентификации связанного с ОИМ подъема сегмента ST подчеркивает то обстоятельство, что ни депрессия сегмента ST, ни повышение биохимических маркеров кардиального некроза (МКН) в сыворотке крови не являются показаниями для тромболитической терапии [4, 9].
На ранних стадиях ОИМ диагностика может быть существенно затруднена, так как ЭКГ часто является нормальной или несет минимальные отклонения. Более того, только у половины пациентов с ОИМ на первой ЭКГ присутствуют явные диагностические изменения. В то же время примерно у 10% пациентов с доказанным ОИМ (на основании клинических данных и положительных МКН) на ЭКГ вообще не будут развиваться типичные изменения, такие, как подъем или депрессия сегмента ST [4]. Тем не менее в большинстве случаев на серии ЭКГ у лиц с ОИМ наблюдается характерная эволюция, которая обычно соответствует типичным изменениям, наблюдаемым при инфаркте миокарда. В отечественной школе кардиологии принято выделять четыре стадии течения ОИМ [1].
I. Острейшая стадия. В этой стадии, которая продолжается от нескольких часов до нескольких дней, изменения на ЭКГ затрагивают только сегмент ST и зубец Т. Самые ранние признаки острого инфаркта миокарда являются трудно различимыми и включают обычно увеличение амплитуды зубца Т в пораженной области, которые становятся симметричными и направленными (гиперострыми). Как правило гиперострые зубцы T наиболее очевидны в передних прекардиальных отведениях и наиболее заметны, когда доступна для сравнения старая ЭКГ. Изменения амплитуды зубцов T могут наблюдаться в течение нескольких минут от начала инфаркта и сопровождаются соответствующими изменениями сегмента ST. Оптимальным сроком доставки пациента до лечебного учреждения считается интервал до четырех часов от начала ОИМ. К сожалению, изменения на ЭКГ в острейшей стадии инфаркта миокарда нередко не получают должной оценки, что существенно увеличивает сроки доставки пациента до специализированного учреждения и продлевает начало реперфузионной терапии.
II. Острая стадия. В острую стадию, которая длится обычно до одной недели, регистрируется подъем сегмента ST и начинают формироваться зубцы Q. В практике подъем сегмента ST является часто самым ранним признаком ОИМ и становится заметным обычно в пределах нескольких часов от начала симптоматики. На начальных этапах утрачивается характерный для нормальной ЭКГ угол между зубцом Т и сегментом ST. Зубец Т становится широким, а сегмент ST повышается, теряя свою нормальную вогнутость. В течение дальнейшего подъема сегмент ST становится выпуклым вверх. Степень подъема сегмента ST варьирует между небольшими изменениями менее 1 мм до выраженного подъема более 10 мм. Иногда комплекс QRS, сегмент ST и зубец Т сливаются, формируя так называемую монофазную кривую.
III. Подострая стадия. Подострая стадия инфаркта миокарда продолжается до нескольких недель.В течение этой стадии сегмент ST начинает приближаться к изолинии, и формируются отрицательные зубцы Т. В случае трансмурального инфаркта миокарда процесс некроза сопровождается изменениями комплекса QRS, которые включают уменьшение амплитуды зубцов R и развитие патологических зубцов Q. Подобные изменения развиваются в результате утраты жизнеспособного миокарда под регистрирующим электродом, поэтому зубцы Q являются единственным ЭКГ критерием, верифицирующим миокардиальный некроз. Зубцы Q могут развиваться в течение 1-2 часов от начала симптоматики ОИМ, хотя для этого часто требуется от 12 до 24 часов. Наличие патологических зубцов Q, тем не менее, не обязательно указывает на завершенный инфаркт. Если подъем сегмента ST и зубцы Q выявляются на ЭКГ, а боль в груди имеет недавнее начало, пациент может все еще извлечь выгоду от тромболизиса или интервенционного вмешательства.
IV. Рубцовая стадия. Консолидация рубцовой ткани заканчивается в среднем через 8 недель от инфаркта миокарда. В эту стадию происходит реверсия сегмента ST к изолинии и уменьшение амплитуды отрицательных зубцов Т. В случае обширного инфаркта миокарда патологические зубцы Q являются стабильным маркером кардиального некроза. При небольших инфарктах рубцовая ткань может включать жизнеспособный миокард, что может сокращать размер электрически инертной области и даже вызывать исчезновение зубцов Q в перспективе.
Одной из любопытных особенностей ЭКГ при ОИМ является так называемый феномен псевдонормализации. Теория формирования зубцов Q по Вильсону подразумевает формирование так называемого электрического окна в случае некроза, через которое регистрирующий электрод фиксирует электрические потенциалы противоположной стенки. Тем не менее, несмотря на некроз, часть волокон миокарда в зоне инфаркта остается жизнеспособной, что объясняет характерную сглаженность зубцов Q при инфаркте миокарда. Однако потенциалы этих волокон остаются скрытыми за мощным электрическим вектором противоположной стенки. При повторном же инфаркте, который вовлекает противоположную стенку, этот вектор существенно уменьшается, что, в свою очередь, дает возможность регистрировать потенциалы волокон миокарда в области старого рубца. В результате этого в области старого рубца с патологическими зубцами Q (например, в передней стенке) в случае повторного инфаркта противоположной стенки (например, задней) начинают регистрироваться зубцы R. Таким образом, регистрация зубцов R в области, где ранее наблюдались патологические зубцы Q, настоятельно предполагает образование инфаркта в противоположной стенке.
Динамика изменений сегмента ST и зубца Т при ОИМ
ЭКГ картина при инфаркте миокарда имеет свое характерное развитие. Во-первых, подъем сегмента ST, как правило, приводит к формированию зубцов Q. Во-вторых, формирование отрицательных зубцов Т происходит на фоне характерного дугообразного подъема сегмента ST.
Подъем сегмента ST, связанный с инфарктом миокарда в области передней стенки, может сохраняться продолжительное время, если развивается дискинезия или аневризма левого желудочка (ЛЖ). Отрицательные зубцы Т также могут сохраняться в течение длительного периода и иногда оставаться постоянным признаком перенесенного инфаркта миокарда. Нужно отметить, что отсутствие формирования или «восстановление» предварительно инвертированных зубцов T в острую стадию инфаркта миокарда жестко предполагает развитие постинфарктного перикардита [11].
Реципрокная депрессия сегмента ST
Депрессия сегмента ST в отведениях, противоположных пораженной области, иначе называемая реципрокной, является высоко чувствительным индикатором ОИМ. Патогенез реципрокных изменений остается неизвестным. Реципрокные изменения обладают высокой чувствительностью и положительной прогностической ценностью до 90% и наблюдаются примерно в 70% нижних и до 30% инфарктов с поражение передней стенки ЛЖ, хотя, конечно, их отсутствие не исключает диагноз ОИМ [4, 5]. Как правило, депрессия сегмента ST носит горизонтальный или косонисходящий характер. Наличие реципрокных изменений особенно важно, когда имеются сомнения относительно клинического значения регистрируемого подъема сегмента ST. Особо отметим, что реципрокные изменения могут быть единственным признаком ОИМ на фоне еще неочевидного подъема сегмента ST. Подобные ситуации нередко встречаются в случаях инфарктов миокарда с поражением нижней стенки. Присутствие выраженной депрессии сегмента ST в прекардиальных отведениях на фоне нормальной ЧСС или брадикардии у пациента с ишемическим болевым приступом настоятельно требует исключения ОИМ.
Локализация области инфаркта
Подъем сегмента ST, в отличие от его депрессии или инверсии зубца Т, в случае ОИМ достаточно хорошо коррелирует с анатомической областью некроза [2].
Анатомическая взаимосвязь с отведениями [4]
Нижняя стенка – отведения II, III, aVF.
Передняя стенка – отведения V1-V4.
Боковая стенка – отведения I, aVL, V5, V6.
Нестандартные отведения
Правый желудочек – отведения правых отведениях V1R-V6R.
Задняя стенка – отведения V7-V9.
Изменения, зарегистрированные при ОИМ, позволяют ограничить область поражения и, таким образом, определить инфаркт связанную артерию, а в ряде случаев участок ее поражения. Стеноз коронарной артерии в проксимальных отделах, как правило, продуцирует наиболее выраженные нарушения на ЭКГ. В то же время специфичность ЭКГ изменений при ОИМ ограничена большими индивидуальными различиями в коронарной анатомии, а также присутствием существующей ИБС, особенно у пациентов с предыдущими инфарктами, наличием коллатерального кровообращения или операцией аортокоронарного шунтирования. Точность ЭКГ в диагностике ОИМ также ограничена неадекватным отражением на 12 стандартных отведениях задней, боковой и апикальной стенок ЛЖ [4].
Инфаркт миокарда передней стенки
Передне-перегородочный инфаркт с подъемом сегмента ST в отведениях V1-V3 является высокоточным индикатором поражения левой передней нисходящей коронарной артерии (ЛПНК). Подъем сегмента ST в этих трех отведениях и в отведении aVL в совокупности с депрессией сегмента ST более одного мм в отведении aVF указывает на окклюзию проксимального сегмента ЛПНКА. Подъем сегмента ST в отведениях V1, V2 и V3 без существенной депрессии сегмента ST в нижних отведениях предполагает окклюзию ЛПНКА после отхождения первой диагональной ветви.
В ряде случаев ЛПНКА оборачивается вокруг верхушки ЛЖ и кровоснабжает верхушечные отделы нижней стенки в дистальной части задней межжелудочковой борозды. Редко ЛПНКА простирается вдоль всей длины задней борозды, замещая заднюю нисходящую артерию. В случае подъема сегмента ST в отведении V1, V2 и V3 с подъемом ST в нижних отведениях можно предположить окклюзию ЛПНКА дистального отхождения первой диагональной ветви, в области, которая орошает нижнеапикальные отделы ЛЖ [7].
Нижний ИМ
ОИМ с изолированным подъемом сегмента ST в отведении II, III, и aVF обычно связан с поражением правой коронарной артерии (ПКА) или дистальной части огибающей артерии (ОА). Достаточно неприятной особенностью ОИМ с поражением нижней стенки является то, что связанный с инфарктом подъем сегмента ST может формироваться в течение длительного периода, вплоть до двух недель, чтобы стать явным на ЭКГ [4]. Нижняя стенка может кровоснабжаться от правой коронарной артерии (в 80% случаев) или от ОА, являющейся ветвью левой коронарной артерии.
Подъем сегмента ST в отведении III больший, чем в отведении II, а депрессия сегмента ST более одного мм в отведении I и aVL предполагает поражение ПКА, кровоснабжающей нижнюю стенку. В случае кровоснабжения нижней стенки от ОА подъем сегмента ST в отведении III не превышает подъема в отведении II. При этом наблюдается либо подъем сегмента ST в aVL, либо он располагается на изолинии [6, 7].
Инфаркт миокарда правого желудочка
ИМ правого желудочка обычно связан с окклюзией на уровне проксимальных отделов ПКА. Наиболее чувствительным ЭКГ признаком ИМ правого желудочка является подъем сегмента ST более одного мм в отведении V4R с положительным зубцом T в этом отведении [5]. Этот признак редко наблюдается более 12 часов от ОИМ, поэтому правые отведения должны быть зарегистрированы как можно скорее у всех пациентов с инфарктом нижней стенки. На стандартной ЭКГ в 12 отведениях признаками ОИМ с поражением правого желудочка являются подъем сегмента ST в отведении V1 в совокупности с подъемом сегмента ST в отведении II, III и aVF (STIII больше STII).
Инфаркт правого желудочка часто пропускается, так как ЭКГ в 12 стандартных отведениях не обладает высокой чувствительностью при его поражении. В то же время диагноз инфаркт правого желудочка важен, так как может быть связан с состоянием гипотензии, вызванным лечением нитратами или диуретиками. При этом, в отличие от кардиогенного шока, с которым приходится проводить дифференциальную диагностику, пациент хорошо отвечает на введение жидкости.
Примерно в 40% случаев ОИМ нижней стенки осложняется инфарктом правого желудочка [2, 6]. Менее часто правожелудочковый инфаркт связан с окклюзией огибающей артерии и, если эта ветвь доминирующая, может быть связан нижнебоковым инфарктом. Инфаркт правого желудочка может осложнять ОИМ передней стенки и редко может встречаться как изолированное явление [15].
Инфаркт миокарда задней стенки
Задняя нисходящая коронарная артерии (ЗНКА), кровоснабжающая задне-базальные отделы, может быть ветвью ПКА (в 85-90% случаев) либо ветвью ОА (12), что определяет правый или левый тип коронарного кровообращения. Диагноз ОИМ с поражением задне-базальных отделов часто затруднен при использовании ЭКГ в 12 стандартных отведениях, тогда как раннее выявление коронарного тромбоза очень важно с точки зрения назначения тромболитической терапии.
Изменения на ЭКГ при ОИМ задне-базальных отделов косвенным образом проявляются в передних прекардиальных отведениях. Отведения V1-V3 регистрируют потенциалы не только передней, но и противоположной (задней) стенки, и изменения кровоснабжения в этой области находят отражения в этих отведениях. Как правило, наблюдается увеличение зубцов R, которые становятся более широкими и доминирующими, а также депрессия сегмента ST и высоко амплитудные зубцы T, указывающие на заднюю стенку [3]. Использование отведений V7-V9, регистрирующих потенциалы задне-базальных отделов, покажет подъем сегмента ST у пациентов с ОИМ.
Эти дополнительные отведения обеспечивают ценную информацию и помогают в идентификации пациентов, которые могут извлечь пользу от срочной инвазивной терапии. В любом случае регистрация депрессии сегмента ST в отведениях V1-V2 должна служить поводом к исключению ОИМ задне-базальных отделов ЛЖ. В рубцовую стадию на перенесенный инфаркт миокарда задне-базальных отделов будут указывать отношения R/S > 1 в отведении V2 и RV2 > RV6, регистрируемые на фоне горизонтального положении электрической оси сердца [2].
Инфаркт боковой стенки. Поражение в проксимальной области огибающей артерии часто связано с боковым инфарктом и изменениями в отведениях I, aVL, V5-V6. Нередко ОИМ может проявлять себя изменениями, возникающими изолированно в отведении aVL. В таких случаях принято диагностировать ОИМ с поражением высоких боковых отделов ЛЖ [3].
ЭКГ предикторы реперфузии
Патогенетическая терапия ОИМ преследует цель – восстановление кровотока в пораженной артерии. Отсутствие восстановления кровотока (реперфузии) является наиболее мощным предиктором развития систолической дисфункции ЛЖ и риска смерти после ОИМ. В случае отсутствия реперфузии 30-дневная смертность может достигать 15% [14]. В свою очередь, разрешение подъема сегмента ST является индикатором улучшения краткосрочного (30 дневного) и долгосрочного (однолетнего) прогноза [5]. Оценка разрешения сегмента ST также полезна для решения вопроса о дальнейшей тактике ведения пациента.
Отсутствие разрешения сегмента ST в течение первых 90-120 минут после введения тромболитика должно служить причиной к рассмотрению вопроса о проведении ангиопластики. Специфичным маркером произошедшей реперфузии считается сокращение подъема сегмента ST более 50-70% в отведении с максимальным подъемом, что связано с наиболее благоприятным дальнейшим прогнозом. В то же время рядом авторов предлагается критерий 50% снижения подъема сегмента ST через 60 минут от реперфузионной терапии как предиктор хорошего прогноза у лиц с ОИМ [13]. Учитывая то, что максимальный эффект от последующей после тромболизиса ангиопластики достигается не позднее 6-8 часов от начала клиники ОИМ [14], сокращение срока оценки реперфузии имеет под собой веские основания.
Другие ЭКГ маркеры реперфузии включают инверсию зубца Т в течение четырех часов от начала ОИМ. Инверсия зубца Т, которая происходит в течение первых часов от реперфузионной терапии, является высоко специфичным признаком восстановления кровотока. Инверсия зубца Т, которая развивается более чем через четыре часа, связана с закономерной ЭКГ динамикой при ОИМ и не указывает на восстановление кровотока. Ускоренный идиовентрикулярный ритм 60-120 уд/мин, поздние, парные, желудочковые экстрасистолы также являются высоко специфичным маркером реперфузии. Эти ритмы считаются не опасными и, как правило, не требуют назначения антиаритмической терапии. Полиморфная желудочковая тахикардия и фибрилляция желудочков также может быть связана с реперфузией, однако является редкой и чаще следствие сохраняющейся коронарной окклюзии.
Заключение
В современную эру бурного развития новых технологий, несмотря на почти вековую историю применения ЭКГ в диагностике ОИМ [3], эта методика является надежным методом диагностики, доступным для всех без исключения учреждений здравоохранения.
Литература
1. Сыркин А.Л. Инфаркт миокарда. Москва. МИА. 1998.
2. де Луна А.Б. Руководство по клинической ЭКГ. М. «Медицина». 1993.
3. Костюк Ф.Ф. Инфаркт миокарда. Красноярск, 1993.
4. Edhouse J., Brady W.J., Morris F. ABC of clinical electrocardiography. Acute myocardial infarction. Part I. Clinical review. BMJ, 2002; 324:831-834.
5. Zimetbaum P. J., Josephson M.E.Use of the Electrocardiogram in Acute Myocardial Infarction.N Engl J Med, 2003; 348: 933-940.
6. Zimetbaum P., Krishnan S., Gold A., et al. Usefulness of ST – segment elevation in lead III exceeding that of lead II for identifying the location of the totally occluded coronary artery in inferior wall myocardial infarction. Am J Cardiol, 1998; 81: 918-919.
7. Herz I., Assali A.R., Adler Y., et al. New electrocardiographic criteria for predicting either the right or left circumflex artery as the culprit coronary artery in inferior wall acute myocardial infarction. Am J Cardiol, 1997; 80: 1343-1345.
8. Engelen D.J., Gorgels A.P., Cheriex E.C., et al. Value of the electrocardiogram in localizing the occlusion site in the left anterior descending coronary artery in acute anterior myocardial infarction. J Am Coll Cardiol, 1999; 34: 389-395.
9. Antman Е.М., et al. ACC/AHA Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction – Executive Summary.Circulation, 2004; 110: 588-636.
10. The Joint European Society of Cardiology/American College of Cardiology Committee. Myocardial infarction redefined – a consensus document of the joint European Society of Cardiology/American College of Cardiology committee for the redefinition of myocardial infarction. Eur Heart J, 2000; 21: 150-13.
11. MaischВ., et al. Guidelines on the Diagnosis and Management of Pericardial Diseases Executive Summary. The Task Force on the Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology. Eur Heart J, 2004; 25(7): 587-610.
12. Mill M.R., Wilcox B.R., Anderson R.H. Surgical Anatomy of the Heart. Cardiac Surgery in the Adult. New York: McGraw-Hill, 2003: 3152.
13. Johanson P., Jernberg Т., Gunnarsson G., et al.Prognostic value of ST-segment resolution – when and what to measure. Eur Heart J, 2003; 24(4): 337-345.
14. Belder M.A. Acute myocardial infarction: failed thrombolysis. Heart, 2001;85: 104-112.
15. Martin T.N., Dargie Н. Silent right ventricular myocardial infarction: the Q wave never lies. Heart, 2004; 90: 1002.
По материалам журнала “Первая краевая”
Читайте на эту тему:
Физическая активность после инфаркта миокарда
Источник