Инсульт после лучевой терапии

Материалы для сайта подготовлены сотрудниками лаборатории клинических проблем атеротромбоза Института Кардиологии им. А.Л.Мясникова


Ишемическая болезнь сердца
Ишемия миокарда, реже – инфаркт миокарда или аритмии, индуцированные ишемией, являются побочными эффектами ряда методов лечения онкозаболеваний. В основе этих осложнений лежит целый спектр механизмов: от прямого индуцирования вазоспазма, эндотелиального повреждения и развития артериального тромбоза до долгосрочных изменений метаболизма липидов и, соответственно, преждевременного развития атеросклероза (таблица 1). Лучевая терапия на область средостения может усугублять поражение коронарных артерий, вызванное химиопрепаратами.
Таблица 1. Патофизиологические механизмы развития ИБС на фоне лечения онкозаболеваний.
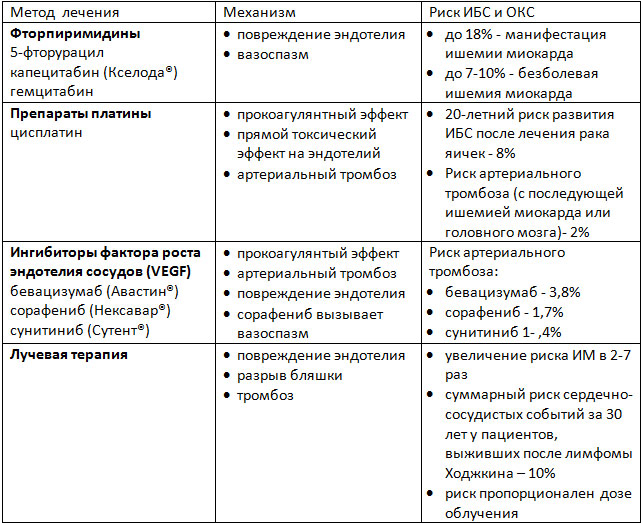
Фторпиримидины
Фторпиримидины (такие как 5-фторурацил и его пероральная форма капецитабин) используются для лечения онкозаболеваний ЖКТ и некоторых других локализаций. Риск развития ишемии миокарда зависит от дозы, пути введения и схемы химиотерапии. Боль в груди и изменения ЭКГ чаще возникают в покое в дни введения химиопрепарата. Иногда проявления ишемии сохраняются после отмены препаратов. Проблема ишемии миокарда, индуцированной фторпиримидинами, может быть недооценена клинически. Последние исследования показали, что у 5-6% пациентов, получавших 5-ФУ, при стресс-тестах выявлялась безболевая ишемия миокарда. Также применение 5-ФУ может приводить к развитию острого ИМ. Пациентам, получающим эти препараты, следует регулярно выполнять ЭКГ. При выявлении признаков ишемии миокарда следует прерывать терапию.
Иммунная и таргетная химиотерапия
Препараты этих групп, воздействующие на сигнальные пути фактора роста эндотелия сосудов (VEGF), увеличивают риск коронарного тромбоза. Эти сигнальные пути важны для поддержания жизнеспособности клеток эндотелия, а ингибирование этих путей приводит к повреждению клеток эндотелия и их гибели. Риск тромбоза зависит от исходного заболевания и конкретного препарата. Так, для моноклонального антитела к рецептору VEGF бевацизумаба, риск составляет менее 1% при адьювантной терапии рака молочной железы, а при лечении метастатических форм онкозаболеваний – 3,8%.
Лучевая терапия
Наддиафрагмальная (а при некоторых заболеваниях и поддиафрагмальная) лучевая терапия ассоциируется с высоким риском развития ИБС как за счет агрессивного течения атеросклероза, так и за счет других процессов, приводящих к разрывам бляшек и тромбозу коронарных артерий, а также, возможно, и за счет коронарного спазма. Для атеросклероза, вызванного лучевой терапией, характерно устьевое поражение коронарных артерий. Чаще всего затрагиваются передняя нисходящая артерия (при облучении левой молочной железы) и ствол левой коронарной артерии (при лечении лимфомы Ходжкина). Есть данные, что у женщин, которым проводилась лучевая терапия по поводу рака левой молочной железы, частота положительных стресс -тестов достоверно выше, чем у получавших лечение по поводу рака правой молочной железы.
Манифестация ИБС может быть быстрой (первое проявление болезни – ОКС или внезапная смерть), но чаще эффект бывает отсроченным. Например, изменения после лечения лимфомы чаще манифестируют через 15-20 лет (причем, молодые пациенты более восприимчивы к такому воздействию). Пациенты, выжившие после лечения лимфомы Ходжкина, характеризуются риском ИБС в 4-7 раз большим, чем вся популяция. Через 40 лет после лечения у 50% пациентов диагностируется ИБС.
Исходя из этих данных, оправдано проводить регулярное скрининговое обследование всех пациентов, которым проводилась лучевая терапия соответствующей локализации, начиная с момента 10-15 лет после лечения и далее пожизненно.
Дополнительными факторами риска возникновения или осложнений ИБС в результате лучевой терапии являются сопутствующий прием антрациклинов, молодой возраст, высокие дозы облучения (>30 Грей), отсутствие экранирования грудной клетки, классические факторы риска сердечно-сосудистых заболеваний и предсуществующая ИБС.
Внезапная сердечная смерть – явление, описанное у пациентов, подвергавшихся облучению. Связано оно было с диффузной гиперплазией интимы всех коронарных артерий или с гемодинамически значимым поражением ствола ЛКА.
Для предотвращения поражения сердца должны быть использованы такие методы, как максимально возможное снижение дозы облучения, тангенциальные поля облучения, экранирование структур сердца. В настоящее время существуют технологии, основанные на 3D планировании полей облучения с построением гистограмм доза-объем, а также различные симмуляционные программы. С помощью результатов КТ или МРТ можно достаточно точно идентифицировать контуры опухоли, а специальные программы рассчитывают распределение облучения.
Особенности диагностики и лечения
Перед началом химиотерапии или лучевой терапии важно выявить ИБС или другие сердечно-сосудистые заболевания, поскольку их исходное наличие значительно повышает риск дальнейших осложнений лечения онкозаболеваний.
Часто на фоне химио- и лучевой терапии развивается тромбоцитопения, поэтому лечение симптомной ИБС и ОКС крайне затруднено. Вообще, применение антитромботической терапии у получающих химио- или лучевую терапию часто противопоказано или очень ограничено. Пациентам, которым выполняется ЧКВ, необходимо использовать двойную антитромбоцитарную терапию как можно меньше по времени для минимизации риска кровотечений.
Клиника ИБС часто носит атипичный характер, зачастую развивается безболевая ишемия миокарда (за счет нейротоксических эффектов лучевой и химиотерапии).
В случае развития вазоспазма на фоне химиотерапии следует сменить используемый препарат. Если иных вариантов нет, продолжать терапию следует на фоне профилактического введения нитратов и/или антагонистов кальция под тщательным контролем.
В случае развития любых осложнений химио- и лучевой терапии со стороны сердечно-сосудистой системы пациенты подлежат длительному наблюдению кардиологом.
Тромбоэмболические осложнения фибрилляции предсердий
Для оптимизации антитромботической профилактики у пациентов с ФП обычно используют шкалы CHA2DS2-VASc и HAS-BLED. Однако обе эти шкалы не валидизировались у пациентов с онкозаболеваниями. У пациентов с онкозаболеваниями повышен риск как тромбоэмболических осложнений, так и кровотечений. Поэтому принятие решения о назначении антитромботической терапии может быть достаточно сложным и отличаться от общей популяции. Пациентам со значением CHA2DS2-VASc≥2 антикоагулянты могут быть назначены при числе тромбоцитов более 50 тыс/мкл (как правило, речь идет об АВК при условии хорошего контроля МНО – время пребывания в терапевтическом диапазоне МНО > 70%). В случае формально низкого риска ТЭО в соответствии со значениями CHA2DS2-VASc антикоагулянты все равно могут быть назначены, принимая во внимание риск венозной тромбоэмболии.
НМГ назначают в качестве краткосрочного лечения, либо как альтернатива варфарину у пациентов с высоким риском кровотечений или метастатическим поражением.
Данные по НОАК пока относительно ограничены. Кроме того, в исследования этих препаратов не включались пациенты с уровнем тромбоцитов менее 100 тыс/мкл. Однако мета-анализ исследований НОАК показал, что эти препараты безопасны для пациентов с онкозаболеваниями.
Артериальные тромбозы
Артериальные тромбозы достаточно редки у пациентов с онкозаболеваниями (около 1%). Чаще они развиваются у пациентов с метастазирующим раком поджелудочной железы, молочной железы, колоректальным раком или раком легких, а также у пациентов, получающих антрациклины, таксаны, химиопрепараты на основе платины, а также ингибиторы VEGF. Чаще всего речь идет о пациентах с неблагоприятным прогнозом. Протромботический статус может увеличивать риск ТЭО у пациентов с ФП.
У пациентов с раком молочных желез, получающих гормональную терапию, риск артериальных тромбозов выше у использующих ингибиторы ароматаз по сравнению с тамоксифеном (по- видимому, за счет несколько более благоприятного влияния тамоксифена на липидный профиль).
Особенности лечения артериальных тромбозов у онкологических пациентов плохо изучены.
В случае повторных эпизодов артериальных тромбозов следует исключить наличие антител к фосфолипидам.
ВТЭО
Венозный тромбоз и тромбоэмболия развиваются у 20% госпитализированных больных с раком (причем часто эти осложнения остаются не диагностированными). Помимо собственного влияния онкозаболевания, риск ВТЭО может повышаться на фоне химиотерапии (в том числе, с учетом использования неудаляемых венозных катетеров). Антитромботическая профилактика должна проводиться минимум в течение 4 недель после оперативного лечения.
У амбулаторных пациентов с раком мочевого пузыря, толстой кишки, яичников, легких, желудка и поджелудочной железы, получающих химиотерапию, риск ВТЭО также повышен, но целесообразность медикаментозной профилактики у таких пациентов неясна.
Таблица 2. Факторы риска венозной тромбоэмболии у онкологических пациентов.

Химиотерапия в комбинации с ингибиторами VEGF повышает риск ВТЭО в 6 раз, повторных ВТЭО – в 2 раза.
Выявление тромботических эпизодов в первую очередь основывается на наличии соответствующих симптомов. Ни одна из стратегий скрининга тромботических осложнений себя не оправдала. Часто при визуализации очага поражения находками являются бессимптомные тромбозы и даже ТЭЛА. Оптимальная стратегия лечения в этом случае не ясна, однако с целью профилактики повторных эпизодов такие тромбозы лечат как обычные.
Для лечения подтвержденного острого эпизода ВТЭО у гемодинамически стабильных пациентов следует назначать НМГ на 3-6 месяцев (такая терапия эффективнее варфарина при сходной частоте кровотечений и смертности). Риск геморрагических осложнений на фоне антикоагулянтной терапии ВТЭО у онкологических пациентов в 6 раз выше в сравнении с обычными пациентами с ВТЭО.
Онкозаболевания значительно повышают риск повторных ВТЭО, поэтому после окончания периода первоначального лечения антикоагулянтами следует оценить возможность назначения антикоагулянтной профилактической терапии (до того момента, когда рак будет считаться «вылеченным»).
Данные по НОАК у этой категории больных ограничены анализом в подгруппах в исследованиях, сравнивающих НОАК и варфарин (не было получено данных о различиях по частоте повторных ВТЭО и кровотечений). С НМГ НОАК не сравнивались. Разные НОАК могут отличаться между собой в связи с лекарственными взаимодействиями и разной чувствительностью к почечной и печеночной дисфункции.
Если повторное ВТЭО произошло на фоне антикоагулянтов, следует изменить терапию (перейти с АВК на НМГ, если пациент уже получает НМГ – увеличить дозу).
На настоящий момент нет четких доказательств целесообразности проведения тромболизиса в случае развития ТЭЛА с гемодинамической нестабильностью у этой категории пациентов, что связано со значительно повышенным риском кровотечений. Однако в ряде случаев (ориентируясь на ожидаемую продолжительность жизни) тромболизис может быть выполнен, принимая во внимание высокую смертность от такого типа ТЭЛА. Важно помнить о противопоказаниях к тромболизису у пациентов с опухолями ГМ и метастазами в ГМ. Также может быть выполнена хирургическая эмболэктомия, однако смертность во время этого вмешательства достаточно высока, и кардиопульмональное шунтирование требует агрессивной антикоагуляции.
Что касается профилактики ВТЭО у пациентов на химиотерапии, в настоящее время рекомендовано проводить медикаментозную профилактику (преимущественно, НМГ) амбулаторным пациентам с высоким риском ВТЭО (например, получающим анти-ангиогенные препараты по поводу множественной миеломы, либо химиотерапию по поводу местнораспространенного или метастатического рака поджелудочной железы или легких), но без высокого риска кровотечений.
У пациентов с центральным венозным катетером показано использование гепарина или АВК (причем применение гепарина ассоциировано с большей частотой тромбоцитопении и бессимптомных тромбозов глубоких вен).
Атеросклероз периферических артерий и инсульт
Тяжелое атеросклеротическое и неатеросклеротическое поражение артерий нижних конечностей может развиться у пациентов (до 30%), получающих нилотиниб, понатиниб или ингибиторы тирозин-киназы BCR-ABL (например, для лечения миелоидного лейкоза). Поражение может развиться даже в отсутствие факторов риска АПАНК, а в присутствии таких факторов риск поражения артерий нижних конечностей еще увеличивается. Поражение может развиться как в первый месяц терапии, так и отсрочено, в том числе – годы спустя после лечения. Ряд химиопрепаратов (например, L-аспарагиназа, цисплатин, метотрексат, 5-фторурацил и паклитаксел) может вызывать феномен Рейно.
Риск инсульта повышается (по меньшей мере, вдвое) после лучевой терапии на область средостения, шеи или головы. Происходит повреждение и тромбоз малых сосудов головного мозга. В сосудах среднего и крупного калибра описаны три патофизиологических механизма, повышающих риск инсульта – окклюзия vasa vasorum с последующим медианекрозом и фиброзом, фиброз адвентиции, а также прогрессирование атеросклероза (чаще развивается более чес через 10 лет после лучевой терапии). Похожие механизмы повреждения описаны для аорты и других периферических сосудов (включая подключичные и подвздошно-бедренные артерии, что приводит к ишемии конечностей).
Пациентам, которым проводилась лучевая терапия на область шеи или головы, а также лечение лимфомы, должно выполняться ультразвуковое исследование церебральных сосудов (особенно начиная с периода 5 лет после лучевой терапии). Исследование должно повторяться каждые 5 лет (или чаще, если при первом исследовании были обнаружены отклонения). Признаки постлучевых поражений других артерий выявляют при физикальном осмотре или по наличию соответствующих симптомов.
По материалам:
Jose Luis Zamorano, Patrizio Lancellotti, Daniel Rodriguez Muñoz, et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines. European Heart Journal (2016) 37, 2768–2801.
https://eurheartj.oxfordjournals.org/content/ehj/37/36/2768.full.pdf
Материал подготовлен сотрудником лаборатории клинических проблем атеротромбоза отдела ангиологии РКНПК им. А.Л. Мясникова к.м.н. Шахматовой О.О.
Источник
 Лучевая терапия разрушает злокачественные клетки в области тела, куда она направлена. Между тем, она оказывает воздействие и на некоторые здоровые клетки, расположенные поблизости. Радиотерапия может влиять на людей по-разному, поэтому трудно предсказать точно, как будет реагировать организм человека. У некоторых людей наблюдаются очень умеренные побочные действия, у других они являются более серьезными.
Лучевая терапия разрушает злокачественные клетки в области тела, куда она направлена. Между тем, она оказывает воздействие и на некоторые здоровые клетки, расположенные поблизости. Радиотерапия может влиять на людей по-разному, поэтому трудно предсказать точно, как будет реагировать организм человека. У некоторых людей наблюдаются очень умеренные побочные действия, у других они являются более серьезными.
Общие побочные эффекты лучевой терапии
Воздействие радиотерапии на кровь
В некоторых случаях лучевая терапия снижает количество клеток в костном мозге, продуцирующих клетки крови. Чаще всего это происходит, если облучению подвергается большая площадь тела, либо грудь, область живота и таза, кости нижних конечностей.
Если сокращается содержание красных клеток крови – эритроцитов, развивается анемия, человек будет чувствовать одышку и усталость. Возможно, для увеличения этих клеток потребуется переливание крови. В случае если есть противопоказания для этой процедуры, могут быть рекомендованы инъекции эритропоэтина. Это гормон, стимулирующий организм синтезировать эритроциты.
При существенном снижении количества лейкоцитов, что случается крайне редко в качестве побочного эффекта лучевой терапии, развивается нейтропения. Значительно повышается риск инфекций. Скорее всего, в такой ситуации врач сделает перерыв в лечении, чтобы состояние нормализовалось.
Пациенты, которым назначено общее облучение тела до пересадки костного мозга или стволовых клеток, будут иметь низкие показатели крови. Во время данного лечения с целью контроля состояния врачи регулярно исследуют кровь.
Усталость как побочный эффект лучевой терапии
Пациент может чувствовать повышенную утомляемость. Это связано с необходимостью организма направить силы на восстановление повреждений, вызванных радиотерапией в результате воздействия на здоровые клетки. Если возможно, необходимо выпивать ежедневно по 3 литра воды. Гидратация поможет организму восстанавливаться.
Усталость, как правило, возрастает по мере лечения. Пациент может не ощущать себя утомленным в начале терапии, но к концу, скорее всего, будет. В течение 1-2 недель после облучения больной может чувствовать повышенную усталость, слабость, отсутствие энергии. На протяжении ряда месяцев человек может находиться в таком состоянии.
Рекомендации для сохранения или повышения энергии
Некоторые исследования показывают, что важно сбалансировать физическую нагрузку и отдых. Попытаться ввести ежедневную прогулку на несколько минут. Постепенно можно будет увеличить дистанцию. Важно выбрать время, когда человек ощущает себя наименее уставшим.
Как сохранить энергию:
- Постараться не спешить.
- Когда возможно, планировать заранее.
- Не стоит куда-нибудь перемещаться в час пик.
- Важно получить профессиональную консультацию терапевта.
- Носить свободную одежду, которая не требует применения утюга, готовить ее заранее.
- Когда возможно, выполнять какие-то бытовые обязанности сидя.
- Организовать помощь с покупками, работой по дому и с детьми.
- Возможно, легче будет принимать пищу чаще, чем придерживаться трехразового питания.
- Для перекусов можно выбирать различные питательные закуски, напитки. Также покупать готовые блюда, которые требуют только разогрева.
Усталость как последствие после лучевой терапии головного мозга
При лучевой терапии мозга усталость может особенно проявляться, в особенности, если назначается прием стероидов. Она достигает своего максимума на 1-2 недели после завершения лечения. Небольшое количество людей спят практически весь день после длительного курса лучевой терапии.
Рацион питания во время лучевой терапии
Во время облучения важен здоровый рацион питания, насколько это будет возможно. Организм нуждается в белке и в большом количестве калорий для восстановления. Клинический онколог может дать рекомендации, как питаться. При возникновении проблем с питанием окажет помощь диетолог. Важно во время лечения не придерживаться никаких диет. Конкретный план лучевой терапии зависит от размера тела. Если вес серьезно измениться, необходимо будет дорабатывать план.
Если больной в состоянии употреблять нормальные продукты, важно, чтобы он выбирал пищу с высоким содержанием белка – мясо, рыбу, яйца, сыр, молоко, бобы, фасоль.
В случае если нет аппетита, можно отдать предпочтение высокоэнергетическим напиткам в виде молочных коктейлей или супов. Есть вариант добавить к нормальной пище протеиновые порошки.
По возможности необходимо употреблять около 3 литров жидкости. Гидратация ускоряет процесс восстановления.
Рекомендации по питанию во время лучевой терапии
Если возникли проблемы, могут быть полезны:
- Небольшие закуски вместо больших приемов пищи.
- При трудностях с глотанием мягкая или жидкая диета. Следует избегать острых продуктов.
- Исключение крепкого алкоголя, он усугубляет воспалительный процесс в полости рта или ухудшает пищеварение.
- При необходимости стоит проконсультироваться по поводу приема БАД.
Если есть сложности с питанием, можно отдать предпочтение пище с высоким содержанием жира вместо белка и углеводов. За время лучевой терапии человек может потерять некоторое количество веса.
Побочные эффекты лучевой терапии на коже
Радиотерапия способна спровоцировать покраснение или потемнение кожи в области лечения. У некоторых людей развиваются реакции, у других – фактические нет, зависит от типа кожи и области, которая подвергалась лечению.
Покраснение может сопровождаться болевыми ощущениями, похожими на боль при загаре. Иногда возникают волдыри, которые сходят. Такое состояние развивается после нескольких сеансов. Важно информировать о реакциях лечащего врача. Обычно симптомы проходят спустя 2-4 недели после окончания терапии.
Иногда наблюдаются кожные реакции на спине, откуда выходит облучение – покраснение или потемнение. Если они вызывают значительную боль, терапию временно останавливают, пока кожа не восстановиться.
Уход за кожей
В разных клиниках консультации могут отличаться. Лучше всего придерживаться инструкций, которые дает непосредственно лечащая команда врачей.
Обычно рекомендуют пользоваться теплой или прохладной водой, мягким мылом без запаха, мягким полотенцем. Не стоит использовать крема или повязки на область лечения, если не назначены онкологом. Не нужно применять тальк, поскольку он может содержать крошечные частицы металла и усиливать болезненность после лучевой терапии. Можно использовать дезодорант без запаха, если он не раздражает кожу. Можно попробовать детское мыло или жидкое детское мыло, но сначала проконсультироваться с врачами. Мужчинам при назначении лучевой терапии в области головы и шеи стоит использовать электрическую бритву вместо влажного бритья.
Одежда во время радиотерапии
В ходе лечения и некоторое время после него кожа бывает чувствительной. В этот период может быть удобным:
- Носить свободную одежду.
- Использовать одежду из натуральных волокон.
- Избегать узких воротников и галстуков, особенно если облучение затрагивает шею.
- При лучевой терапии в области груди женщинам не стоит использовать жесткие бюстгальтера, попробовать, например, спортивный бюстгальтер на размер больше обычного.
Пребывание на открытом воздухе
Области кожи, которые подвергались лечению, очень чувствительны, поэтому важно избегать пребывания на жарком солнце или на холодном ветру.
Находясь под воздействием солнечных лучей, рекомендуется:
- Использовать солнцезащитный крем с высоким коэффициентом защиты.
- Носить шляпу или рубашку с длинными рукавами.
- Если проводилась лучевая терапия головы или шеи, можно попробовать носить шляпу или шарф из шелка или хлопка, выходя на улицу.
Плавание
Если пациент любит плавание, необходима будет консультация с врачом. Плавание в хлорированной воде может вызывать раздражение в обработанной области.
Долгосрочные побочные эффекты лучевой терапии на коже
После завершения лечения человек может обнаружить, что оттенок загара является постоянным. Как такого вреда от него нет. Можно использовать макияж, чтобы скрыть.
Позже возможно появление такого состояния, как телеангиоэктазия, расширение мелких кровеносных сосудов – сосудистые сеточки. Также их можно скрыть посредством макияжа.
Последствия после лучевой терапии на фертильности и сексуальной жизни женщины
Лучевая терапия, воздействуя на нижнюю часть живота у женщин в период пременопаузы, как правило, приводит к менопаузе. Прекращается производство женских половых клеток и гормонов. Облучение также влияет на матку, есть вероятность, что впоследствии не будет детей.
Симптомы менопаузы
После радиотерапии в области таза в течение нескольких недель возможны следующие признаки менопаузы:
- приливы и потливость;
- сухая кожа;
- сухость влагалища;
- отсутствие энергии;
- нерегулярный менструальный цикл или отсутствие менструаций;
- снижение интереса к сексу;
- плохое настроение, перепады.
Перед началом лучевой терапии врач обсудит с пациенткой возможность бесплодия.
ЗГТ
Может быть назначена заместительная гормональная терапия, чтобы помочь преодолеть симптомы менопаузы. При возникновении проблем обязательно нужно поговорить с клиническим онкологом.
Лучевая терапия и сексуальная жизнь
Облучение в области таза может сделать ткани влагалища более жесткими и менее эластичными в течение длительного времени. Такое состояние называется фиброзом. Кроме того, лучевая терапия способна сузить и сделать влагалище более коротким, что повлияет на сексуальную жизнь. Помимо того, может наблюдаться сухость и боль при половом акте. Существуют способы, как снизить оба эти побочных эффекта лучевой терапии.
Сужение влагалища
Для предотвращения или минимизации сокращения и сужения влагалища важно использовать вагинальные расширители после лучевой терапии. Радиационный онколог объяснит, как применять. Если их не использовать, после лечения возможны трудности при половом акте.
Расширители изготавливают из пластика или металла, бывают разных размеров. Как правило, их начинают использовать между 2 и 8 неделей после окончания терапии.
Расширитель вставляют во влагалище на 5-10 минут 3 раза в неделю. Он растягивает орган и предотвращает его сужение. Но если у женщины есть занятия сексом, по крайней мере, два раза в неделю, нет необходимости использовать расширители.
Сухость влагалища и боль
После лучевой терапии в области таза возможна сухость влагалища и боль при половом акте. В этом случае необходима консультация врача. Может быть назначен гормональный крем или ЗГТ.
Последствия после лучевой терапии на фертильности и сексуальной жизни у мужчин
После облучения возможны некоторые проблемы с сексом:
- потеря интереса к сексу;
- острая боль при эякуляции;
- проблема с эрекцией.
Потеря интереса к сексу
Такая реакция может быть вызвана опасениями по поводу болезни или будущего. Также причиной может быть усталость, вызванная облучением. Потребуется время для восстановления после терапии.
Острая боль при эякуляции
Лучевая терапия может вызывать раздражение мочеиспускательного канала, что приводит к боли в процессе эякуляции. Спустя несколько недель состояние нормализуется.
После внутренней лучевой терапии при раке простаты (брахитерапии) в течение первого месяца после лечения необходимо использовать презервативы. Очень редко, но радиация может присутствовать в сперме.
Проблемы с эрекцией
Радиотерапия в области таза может вызывать временные или постоянные проблемы с эрекцией, воздействия на нервы в этой области. Некоторые лекарства или медицинские устройства могут помочь в решении этой проблемы. Необходима будет консультация врача.
Фертильность после лучевой терапии
Радиотерапия, как правило, не влияет на способность у мужчины иметь детей. У многих мужчин, которые перенесли облучение, рождены здоровые дети.
При радиотерапии в области таза врачи уведомят о необходимости использовать эффективную контрацепцию в течение следующего промежутка времени – от 6 месяцев – до 2 лет – мнения врачей расходятся. Это связано с тем, что после облучения сперматозоиды могут быть повреждены, это приведет к аномалии у ребенка.
При лечении рака яичек лучевую терапию редко дают на оба органа. Это может привести к временному или постоянному бесплодию. Перед таким лечением врач будет обсуждать этот риск с пациентом.
Если пациент молодой и планирует иметь детей, существует возможность сохранить сперму.
Банки спермы
В случае, когда облучение может стать причиной бесплодия, можно сохранить часть сперматозоидов в банке спермы. В течение ряда недель пациент сдает несколько образцов. Их замораживают и хранят. Позднее, когда приходит время, образцы подвергают разморозке и используют для осеменения партнера.
Последствия после лучевой терапии головного мозга
Усталость
Радиотерапия способна спровоцировать повышенную усталость. Такой вид облучения используется, если:
- Имеет место первичная опухоль головного мозга.
- В мозг проникли раковые клетки из другого очага – вторичное новообразование.
Усталость постепенно нарастает, программа лечения длится несколько недель. К концу курса пациент может чувствовать себя очень уставшим.
Усталость – прямое следствие лечения, вызванное необходимостью направлять энергетические запасы на ремонт поврежденных здоровых клеток. Прием стероидов еще более усугубляет недостаток сил. Состояние нормализуется, когда лечение заканчивается, примерно через шесть недель.
У некоторых людей спустя несколько недель после завершения терапии усталость очень серьезная, сочетается с сонливостью и чувством раздражительности. Это редкий побочный эффект, не требующий лечения, проходит сам по себе в течение нескольких недель.
Потеря волос как побочный эффект лучевой терапии
Лучевая терапия в области головы всегда вызывает определенное выпадение волос. Если облучению подвергается только определенная часть головы, волосы будут выпадать только на ней. Но бывает, что отмечается выпадение волос на противоположной стороне головы, откуда выходят лучи.
Когда лечение заканчивается, волосы возобновляют свой рост. Они могут быть другой толщины или неоднородными, иметь другой оттенок, либо измениться структура (были прямые – станут кудрявые).
Уход за волосами
Во время лечения нужно будет мыть волосы аккуратно, чтобы не ранить кожу. Стоит использовать теплую или холодную воду, детский или не парфюмированный шампунь.
Лучше не задействовать фен, осторожно сушить волосы с помощью мягкого полотенца, либо дать им высохнуть естественным путем.
В качестве головных уборов можно использовать шляпы, шарфы, банданы, парики.
Чтобы легче было справиться с выпадением волос, ситуация казалась менее драматичной, можно коротко постичь волосы перед началом лечения.
Тошнота как последствие после лучевой терапии
Облучение нижней части мозга может спровоцировать тошноту. Достаточно редко наблюдается этот побочный эффект лучевой терапии. Тошнота может длиться в течение нескольких недель после завершения терапии. Лекарства, рацион, а иногда и дополнительные методы лечения помогают улучшить состояние.
Лекарства
Тошноту успешно контролируют с помощью противорвотных препаратов. Радиационный онколог может назначить их. Некоторые принимают таблетки за 20-60 минут до начала лечения, другие регулярно в течение дня.
Если одни препараты будут не эффективны, могут помочь другие.
Дополнительные методы лечения
Для управления такими симптомами, как тошнота и рвота, успешно используют техники релаксации, гипнотерапию и акупунктуру.
Рекомендации по рациону
Пища может оказывать серьезное влияние на состояние:
- Следует избегать еды или приготовления пищи, когда человек ощущает тошноту.
- Не стоит употреблять жареных, жирных продуктов, имеющих сильный запах.
- Если запах или приготовление вызывают раздражение, можно употреблять холодную или слегка теплую пищу.
- Можно есть несколько небольших блюд и закусок каждый день, тщательно прожевывать пищу.
- Стоит есть в небольшом количестве за несколько часов до начала лечения.
- Нужно пить много жидкости, маленькими глотками, медленно в течение дня.
- Необходимо избегать заполнения желудка большим количеством жидкости перед едой.
Ухудшение симптомов как последствие после лучевой терапии
У некоторых людей симптомы, вызванные опухолью головного мозга, усиливаются после начала лечения на некоторое время. Это не должно приводить к мыслям, что лечение не работает или опухоль растет.
Лучевая терапия в области мозга может на короткий срок спровоцировать отек в зоне обработки, что приводит к повышению давления. Соответственно симптомы ухудшаются на время – возникают головные боли, тошнота, судороги. Врач назначает стероиды, и отек уходит. После окончания лечения дозу стероидов постепенно уменьшают. Если стероиды нельзя принимать по какой-либо причине, может быть предложена таргетная терапия – авастин, который понизит давление в головном мозге, изменяя развитие кровеносных сосудов вокруг опухоли.
Последствия после лучевой терапии молочной железы
Проблемы с глотанием во время и после радиотерапии
Облучение при раке груди может вызывать отек и болезненность в области горла. Появляются трудности с проглатыванием твердой пищи. Для решения этой проблемы используется мягкий, простой рацион. Исключаются продукты, раздражающие горло (сухари, пряные продукты, горячие напитки, алкоголь и пр.). Применяются лекарства для уменьшения болезненности – обезболивающие препараты, полоскание с аспирином.
Тошнота после лучевой терапии
Радиотерапия может стать причиной тошноты, есть облучение затрагивает область, близко расположенную к желудку. В основном тошнота проявляется в мягкой форме, может длиться несколько недель после окончания лечения. Состояние помогут контролировать лекарства, диета и некоторые дополнительные методы лечения, ранее упомянутые.
https://tlv.hospital/sites/thebestmedic.com/files/radiation-oncology-pobochnie-effekti.jpg
Источник
