Инсульт органов брюшной полости

Что такое ишемия кишечника?
Ишемия кишечника (ишемическая болезнь кишечника) является серьезным состоянием, вызванным недостаточным кровоснабжением части кишечника. Неважно где произошла ишемия, в тонкой или толстой кишке, главным симптомом будет является боль. Боль может быть сильной и внезапной, или это может быть более умеренная и прерывистая боль, которая обычно возникает после еды.
Если кишечное кровоснабжение становится достаточно нарушенным, кишечная ишемия может привести к разрыву кишечника, сепсису (тяжелой инфекции) и смерти. По этой причине важно диагностировать и лечить ишемию кишечника как можно быстрее.
Симптомы ишемической болезни кишечника

Ишемия кишечника может быть острой или хронической, с симптомами каждого, немного отличающимися.
Острая ишемия кишечная
Боль, вызванная острой сосудистой окклюзией кишечника, обычно располагается в области пупка. Симптомы и признаки достаточно серьезны, так что люди, имеющие это состояние, практически всегда будут обращаться за немедленной медицинской помощью.
Острая кишечная ишемия является неотложной медицинской ситуацией. Если кровоснабжение кишечника внезапно блокируется, возникающая боль чаще всего бывает очень острой и очень сильной и часто сопровождается тошнотой и рвотой.
Кишечная ишемия иногда вызывает гибель части тонкой или толстой кишки — состояние, называемое инфарктом кишечника. Инфаркт кишечника позволяет содержимому кишечника проникать в брюшную полость, распространяя воспаление и инфекцию (состояние, называемое перитонит). Перитонит — опасное для жизни заболевание, сопровождающееся тошнотой, рвотой, жаром и очень болезненным состоянием в животе.
Хроническая ишемия кишечная
Ишемия кишечника также может быть более легким, более хроническим заболеванием. Эта более легкая форма вызвана частичными закупорками, в результате атеросклеротических бляшек, в артериях, снабжающих кишечник.
Люди с хронической ишемией кишечника часто испытывают периодические, тупые, неописуемые боли в животе после приема пищи. Боль возникает после еды, потому что кишечник требует большего кровотока во время пищеварения, а частично заблокированные артерии не могут снабдить его кровью.
Люди с этой более легкой формой кишечной ишемии часто не обращаются за медицинской помощью сразу же, вместо этого они могут подсознательно сократить прием пищи, чтобы избежать дискомфорта. У них часто наблюдается значительная потеря веса, прежде чем они, наконец, обратятся к своему врачу за помощью. К сожалению, многие из них никогда не проходят медицинское обследование до тех пор, пока у них не разовьется острая ишемия кишечника.
Причины ишемической болезни кишечника
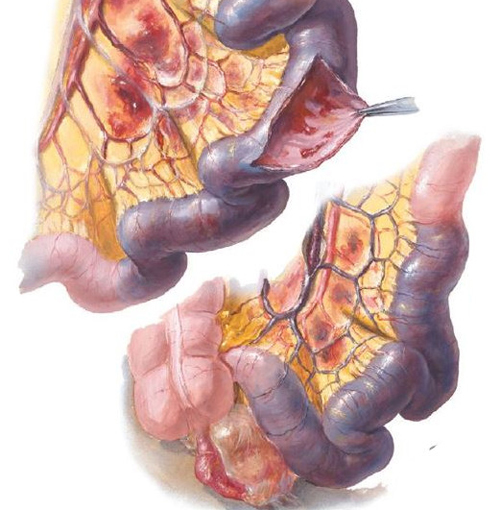
Ишемия кишечника обычно возникает, когда закупорена одна из двух основных артерий: верхняя брыжеечная артерия, которая снабжает большую часть тонкой кишки; или нижняя брыжеечная артерия, которая является основным снабженцем толстой кишки.
Иногда закупорка венозного оттока в кишечнике также может привести к ишемии кишечника.
Существует несколько общих сосудистых состояний, которые могут вызвать острую кишечную ишемию. Они включают:
- Артериальная эмболия: Эмболия — тромб, который открывается и перемещается через кровообращение, — может застрять в брыжеечной артерии, вызывая закупорку. Поскольку эмболия, как правило, возникает внезапно, симптомы обычно являются острыми и довольно тяжелыми. Эмболия, по оценкам, является причиной примерно половины случаев ишемии кишечника.
- Артериальный тромбоз: Тромб (тромб, который образуется в кровеносном сосуде), вероятно, составляет 25% случаев острой ишемии кишечника. Подобно тромбозу коронарной артерии, тромбоз брыжеечных артерий возникает, когда разрывается атеросклеротическая бляшка в слизистой оболочке артерии. Подобно тому, как люди с ишемической болезнью сердца часто испытывают перемежающуюся стенокардию при физической нагрузкой до того, как у них случится сердечный приступ, люди с тромбозом брыжеечной артерии часто описывают предшествующие симптомы перемежающейся болью в животе после еды — так называемая «кишечная стенокардия».
- Венозный тромбоз: Если одна из вен, дренирующих кровь из кишечника (брыжеечные вены), блокируется, кровоток через пораженную кишечную ткань заметно замедляется, что приводит к кишечной ишемии. Это состояние чаще всего наблюдается у людей, перенесших недавно операцию на брюшной полости или рак.
- Неокклюзионная ишемия кишечника. Иногда кровоток через брыжеечные артерии заметно падает без каких-либо локальных закупорок. Это состояние обычно наблюдается у людей, которые серьезно больны и находятся в шоке, чаще всего от тяжелой болезни сердца или сепсиса. В этих катастрофических условиях циркулирующая кровь отводится от «не жизненно важных» органов в пользу сердца и мозга, и в результате может возникнуть кишечная ишемия.
Факторы риска
Почти любая форма сердечной болезни, сосудистых заболеваний или нарушений свертываемости крови может увеличить риск развития ишемии в кишечнике.
В частности, риск кишечной ишемии увеличивается с:
- Заболеваниями сердца: Это могут быть заболевание клапана сердца, мерцательная аритмия или кардиомиопатия. Эти заболевания позволяют кровяным сгусткам развиваться в сердце, которое затем может эмболизировать. В то время как инсульт является основной проблемой врачей и пациентов, когда в сердце образуются тромбы, эмболия сердца также может вызвать острую кишечную ишемию.
- Заболевание периферических артерий (ЗПА): Если ЗПА затрагивает брыжеечные артерии, может возникнуть ишемия кишечника.
- Расстройства свертываемости крови: Унаследованные расстройства свертываемости крови, такие как фактор V Лейден, составляют большинство людей с кишечной ишемией без основного сосудистого заболевания.
- Гиповолемия или низкий объем крови. Уменьшение объема крови может быть вызвано чрезмерным кровотечением, сильным обезвоживанием организма или сердечно-сосудистым шоком и может привести к неокклюзивной кишечной ишемии.
- Воспаление кровеносных сосудов. Васкулит (воспаление кровеносных сосудов) может быть вызван инфекциями или аутоиммунными нарушениями, такими как красная волчанка. Воспаление сосудов может привести к тромбозу брыжеечных артерий и вызвать ишемию.
Диагностика
Ключом к диагностике острой кишечной ишемии является то, что врач подумает о диагнозе, на основании признаков, а затем проведет соответствующее обследование, чтобы подтвердить его или исключить.
Важно быстро поставить диагноз, чтобы можно было начать лечение до того, как кишечник нанесет катастрофический ущерб всему организму человека.
Ключевым симптомом кишечной ишемии является боль в животе. Тем не менее, существует множество медицинских состояний, которые вызывают боль в животе, поэтому, чтобы врач мог сосредоточиться на возможности кишечной ишемии, он должен быть всегда готов предположить о данном диагнозе.
Люди с кишечной ишемией часто имеют очень мало результатов при физикальном обследовании, и, фактически, молодых врачей учат думать об этом состоянии каждый раз, когда пациент жалуется на сильную боль, которая непропорциональна физическим результатам. Уровень беспокойства врача должно увеличиться при обследовании пациента с необъяснимой внезапной болью в животе, у которого также есть факторы риска кишечной ишемии, а также у пациентов, которые описывают боль в животе после еды.
Если ишемия кишечника считается разумной возможностью, следует немедленно провести специализированные визуализирующие исследования живота. Во многих случаях, КТ брюшной полости или МРТ может помочь поставить диагноз. КТ-ангиография (КТ в сочетании с введением красителя в вену) или обычная артериография (метод катетеризации, при котором краситель вводится в артерию и проводится рентген) часто необходимы для подтверждения диагноза.
Если подозрение на острую кишечную ишемию достаточно велико или есть признаки перитонита или сердечно-сосудистой нестабильности, может потребоваться немедленная предварительная операция, прежде чем будет поставлен окончательный диагноз.
Лечение ишемической болезни кишечника

При лечении острой ишемии кишечника важно максимально быстро стабилизировать состояние пациента, одновременно работая над восстановлением кровотока в его кишечнике.
Как правило, вводят жидкости для восстановления и поддержания кровообращения, с помощью опиоидов достигается обезболивание, чтобы попытаться предотвратить любую утечку кишечных бактерий в брюшную полость и предотвратить возникновения перитонита, вводят антибиотики и назначают антикоагулянтные препараты для предотвращения дальнейшего свертывания крови.
К сожалению, некоторая степень кишечного инфаркта часто возникает при острой ишемии.
При появлении признаков ухудшения состояния или перитонита необходимо немедленно выполнить операцию по удалению отмирающей части кишечника и хирургическому восстановлению кровотока через закупоренную верхнюю или нижнею брыжеечную артерию.
Если экстренная операция не требуется, варианты восстановления кровотока включают в себя применение антикоагулянтных препаратов, шунтирование, ангиопластику и стентирование или введение препаратов, разрушающих тромб. Оптимальный выбор может быть сложным и часто требует командного подхода с участием гастроэнтеролога, кардиолога и хирурга.
У человека, у которого диагностирована хроническая кишечная стенокардия, то есть частичная окклюзия верхней или нижней брыжеечной артерии, вызванная атеросклеротической бляшкой, лечение может быть выполнено либо с помощью шунтирования, либо с помощью ангиопластики и стентирования. Это лечение облегчит прием пищи без симптомов и поможет предотвратить возникновение острой ишемии кишечника.
Прогноз жизни
Острая кишечная ишемия является тяжелым заболеванием, которое может быть сложным для быстрой диагностики и трудно поддается лечению. К сожалению, риск умереть с этим заболеванием достаточно высок — приближен к 50%, но риск, по-видимому, значительно ниже у людей, у которых диагностируется быстро.
После того, как человек с острой кишечной ишемией лечится и стабилизируется, долгосрочный результат зависит в значительной степени от характера основной сердечно-сосудистой проблемы (или других заболеваний), которая в первую очередь привела к кишечной ишемии.
В любом случае, восстановление после острой ишемии кишечника может быть долгой и проблемой. Эти люди, как правило, старше, и обычно имеют серьезные сердечно-сосудистые заболевания. У них также может быть временная (или в некоторых случаях постоянная) колостома или илеостома, после проведения частичной кишечной резекции.
Во всех случаях врачам потребуется тщательное лечение любых основных сердечно-сосудистых заболеваний, которые способствовали ишемии. Им также потребуется полная оценка факторов риска, в том числе артериальной гипертензии (гипертонии), уровня холестерина, ожирения, курения и диабета, и они должны будут активно бороться с ними.
Заключение
Ишемическая болезнь кишечника является серьезным заболеванием, вызванным снижением кровотока в части кишечника. Хотя состояние может начинаться с легких симптомов, оно может привести к катастрофическим последствиям. Ранняя диагностика и лечение являются ключом к успешному результату.
Источник
При инсультах часто имеет место нарушение функций внутренних органов: сердца, легких, почек, желудочно-кишечного тракта, а также желез внутренней секреции. В результате нарушения центральной нервной регуляции развиваются трофические и вазомоторные расстройства, различно выраженные в зависимости от локализации очага.
Для возникновения острых вазомоторно-трофических расстройств имеет значение быстрое развитие инсульта, обширная поражения и локализация процесса в гипоталамической области или в мозговом стволе.
Иногда внутричерепные геморрагии осложняются кровотечением из пищеварительного тракта. Нередки микрогеморрагии и эрозии на слизистой оболочке желудочно-кишечного тракта, возникающие в результате нарушения диэнцефально-стволовой иннервации (по-видимому, поражение ретикулярной формации). Часто наблюдаются изменения в селезенке и надпочечниках.
Иногда развиваются геморрагии под эндокард, что проявляется внезапно возникающим коллапсом. Соотношения по времени возникновения мозгового инсульта и инфаркта миокарда может различным: свежий инфаркт миокарда, предшествовавший развитию инсульта (апоплектиформный синдром при инфаркте миокарда), инфаркт миокарда одновременно с инсультом, коронарный синдром, возникающий спустя несколько суток после расстройства мозгового кровообращения. Иногда трудно определить время развития острого нарушения коронарного и церебрального кровообращения.
При сочетании коронарных и церебральных расстройств при инфаркте миокарда могут возникать преходящие дисциркуляторные расстройства в мозгу, а после развития инфаркта миокарда в связи с ухудшением деятельности сердца, падением артериального давления выявляются очаговые размягчения головного мозга как результат коронарно-церебральной сосудистой недостаточности. При инсульте иногда остаются незамеченными изменения сердца, которые обусловлены скрыто протекающим инфарктом миокарда. На секции обнаруживаются некротические рубцовые изменения в миокарде, аневризмы сердца, тромбоз венечных артерий. Нарушение деятельности сердца при инсульте выявляется на электрокардиограмме в изменения зубцов снижения S—Т интервала, расщепления зубца Р, экстрасистолии. Клинически у некоторых больных выявляются признаки кардиосклероза и хронической коронарной недостаточности. Нарушения мозгового кровообращения сочетаются с нарушением кровоснабжения передней или задней стенки левого желудочка, реже—перегородки желудочков.
При мозговых инсультах нередко возникают пневмонии на стороне паралича (контралатеральноочагу). Вентрикулярные и стволовые геморрагии, имеющие быстрое острое течение, а также обширные размягчения нередко сопровождаются отеком легких. Пневмонии часто наблюдаются при очагах размягчения в полушариях в результате тромбоза мозговых сосудов. Для развития пневмонии имеет значение не только застой в легких в связи с лежачим положением больного и плохой экскурсией грудной клетки на парализованной стороне, нарушения вазомоторно-трофических функций. Пневмонии, как и пролежни, возникающие на стороне паралича, являются дистрофическим процессом в результате нарушения центральной регуляции вазомоторных и трофических функций.
Источник
К числу факторов риска развития мозгового инсульта относится операционная травма [1, 2, 14], в том числе при заболеваниях органов брюшной полости [8]. Несмотря на высокий технический уровень оперативных вмешательств и анестезиологических пособий, при экстренной операции на органах брюшной полости часто крайне сложно уменьшить глобальное стрессорное воздействие на организм пациента агрессивных факторов. Данные исследований свидетельствуют о том, что до и во время операции психоэмоциональный стресс, боль, гипоксия вызывают нарушения гемостаза, системной и церебральной гемодинамики, активируют перекисное окисление липидов [4, 12]. Показано [10], что ранний послеоперационный период является критическим в развитии различных осложнений, в том числе острых сосудистых поражений головного мозга, что требует участия в лечебном процессе невропатолога. Однако вопросы диагностики, профилактики и лечения церебральных инсультов при операциях на органах брюшной полости остаются недостаточно изученными.
Цель настоящего исследования — изучение частоты, клинических и патогенетических вариантов острой церебральной сосудистой патологии в раннем периоде после операций на брюшной полости, индивидуализация факторов риска у таких больных, разработка мероприятий для предупреждения острых сосудистых осложнений со стороны нервной системы в этом периоде. Основные задачи заключались в изучении динамики неврологических нарушений, исследовании системной и церебральной гемодинамики, кислотно-щелочного и газового состава крови, уровня эндогенной интоксикации, гемостаза у больных, оперированных на органах брюшной полости. Оценивались также липидный профиль и состояние экстремальных отделов магистральных сосудов головы.
Материал и методы исследования
Проведенное исследование основано на анализе наблюдений над 155 больными, а также изучении 2380 историй болезни пациентов, оперированных на органах брюшной полости в 1995–1998 гг. в Нижегородской областной клинической больнице им. Н.А. Семашко, областной клинической больнице и больнице скорой медицинской помощи г. Владимира.
Из наблюдавшихся 155 больных (100 мужчин и 55 женщин) основную группу составили 105 человек, у которых в послеоперационном периоде развилось острое сосудистое поражение головного мозга, контрольную группу — 50 больных без признаков сосудистого поражения мозга.
Экстренные операции были выполнены 107 пациентам, отсроченные — 48. Больным основной группы было произведено 11 аппендэктомий, 16 холецистэктомий, 12 резекций желудка, 9 ушиваний язвенного дефекта желудка или кишечника, 11 резекций кишки, 19 ушиваний травматических дефектов органов брюшной полости, 20 грыжесечений, 2 резекции печени, 5 резекций поджелудочной железы. Все операции выполнялись под комбинированной общей анестезией. Вводный наркоз осуществлялся барбитуратами или кетамином. В качестве основного анестезирующего средства использовались фторотан и закись азота в комбинации с фентанилом. Мышечная релаксация достигалась тубарином или дитилином.
Клинико-неврологическое исследование проводили всем больным перед операцией, а также в послеоперационном периоде: больным основной группы — в 1-е и 5-е сутки инсульта, в контрольной группе — на 3-и сутки после операции. Диагностика острых сосудистых поражений головного мозга была затруднена особенностями течения послеоперационного периода: остаточным действием наркотических анальгетиков и мышечных релаксантов, травматичностью хирургического вмешательства и развитием внемозговых послеоперационных осложнений, а также использованием искусственной вентиляции легких, что ограничивало объем неврологического исследования. В связи с этим мы применяли специальные неврологические тесты. При исследовании больных, находившихся под действием наркотических анальгетиков и мышечных релаксантов, обращали внимание на нарушения зрачковых фотореакций и анизокорию, а также наличие феноменов Боголепова и Гейльброннера [2]. В ряде случаев интраоперационная диагностика инсульта основывалась на факте углубления наркоза без соответствующего увеличения дозы наркотических препаратов. С целью выявления скрытых парезов применяли тесты на мышечную утомляемость, об экстрапирамидных нарушениях судили по наличию постуральных феноменов. Исследование атактических нарушений проводили в позиции сагиттального стояния или путем проверки мышечных реакций, предохранявших от падения. Координацию движений в ногах в ряде случаев в 1-е сутки инсульта не проверяли.
Величину кровопотери определяли до, во время и после операции. При гастродуоденальном кровотечении применяли номограмму Ю.А. Уманского, при травме — номограмму П.Г. Брюсова [9]. Во время операции объем кровопотери оценивали путем взвешивания салфеток.
Системную гемодинамику исследовали методом одномерной эхокардиографии на аппарате Vingmed SD у 100 больных обеих групп до и во время операции, а также в послеоперационном периоде: в основной группе — в 1-е сутки послеоперационного инсульта, в контрольной — на 3-и сутки после операции. По полученным на кардиокомпьютере данным минутного объема сердца рассчитывали ударный объем, сердечный индекс и общее периферическое сопротивление сосудов по общепринятым формулам [7].
Церебральную гемодинамику оценивали методом компьютеризированной реоэнцефалографии у больных обеих групп до и во время операции, а также у больных основной группы в 1-е и 5-е сутки послеоперационного инсульта, контрольной — на 3-и сутки после операции. Для записи реограмм использовали 4-канальный реограф Р4-О2 с применением компьютерной программы «Цереброваскулярное картирование. Версия 3.00» и реокартограф фирмы MBN. Анализировали следующие показатели [6]: реографический индекс, скорость быстрого и медленного кровонаполнения, коэффициент асимметрии, межамплитудный диастолический коэффициент.
Гемостаз изучали по показателям коагулограммы у больных обеих групп до операции, а также после операции: в основной группе — в 1-е сутки инсульта, в контрольной — на 3-и сутки после операции. Исследовали содержание фибриногена по Рутбергу, тромбиновое время по Biggs и McFar-lane, время рекальцификации плазмы по З.С. Баркагану, активированное парциальное тромбопластиновое время, время свертывания крови по унифицированным методикам [13]. Кислотно-щелочное состояние и газовый состав крови оценивали с помощью газового анализатора «Микро-Аструп» у больных обеих групп до и во время операции, а также в основной группе в 1-е сутки инсульта, в контрольной — на 3-и сутки после операции. Исследовали рН, избыток оснований, рО2 и рСО2 [13].
Уровень эндогенной интоксикации изучали путем определения молекул средней массы методом прямой спектрофотометрии при длине волны 280 нм [13].
Для оценки состояния экстракраниальных отделов магистральных сосудов головы проводили дуплексную ультразвуковую допплерографию (аппарат Acuson-128XP/10C, США, датчик 3,5 МГц) [6, 15].
Статистическую обработку результатов исследований проводили с использованием алгоритмов вариационной статистики [11]. Достоверность межгрупповых различий рассчитывали с помощью t-критерия Стьюдента. Для выявления связи между отдельными показателями применяли метод линейного корреляционного анализа. Различия считали достоверными при р < 0,05.
Исследование соматического состояния больных основной группы показало, что у большинства из них операционный риск по шкале Малиновского [3] соответствовал IV–V (высокой) степени, у больных контрольной группы — I–III (низкой) степени.
Анализ 2380 историй болезни показал, что острые сосудистые поражения головного мозга среди больных, оперированных экстренно или отсроченно на органах брюшной полости, имели место у 114 (4,78 %).
Из 105 больных основной группы в первые 3 суток инсульт развился у 91 (86,9 %): в 1-е сутки — у 18, во 2-е — у 31 и в течение 3-х — у 42. Наибольшее количество острых нарушений мозгового кровообращения (до 40 %) пришлось на 3-и сутки. Затем частота развития инсульта снижалась: на 4-е и 5–7-е сутки он возник у 10 и 4 больных соответственно. Высокую частоту развития инсульта в первые 3 суток после операции можно объяснить срывом системной и церебральной гемодинамики, а также максимальной выраженностью послеоперационной гиперкоагуляции [10].
Послеоперационные острые нарушения мозгового кровообращения у 92 (87,7 %) больных имели характер инсульта, у 13 (12,3 %) — преходящих нарушений мозгового кровообращения.
Чаще всего послеоперационное острое сосудистое поражение головного мозга протекало по типу ишемического инсульта у 50 (47,6 %) больных, причем у 29 (27,6 %) неврологический дефицит имел обратимый характер, а у 21 (20 %) был стойким. Особенности клинического течения инсульта соответствовали его различным патогенетическим вариантам [2, 5, 16]. Так, в 27 случаях постепенное развитие очаговой неврологической симптоматики, распространенное атеросклеротическое поражение магистральных артерий головы и выраженная гиперкоагуляция при относительном благополучии системной гемодинамики позволили предположить тромбоз сосудов. У 19 больных ишемический инсульт развился на фоне нарушения системной гемодинамики, у 2 — в результате гипоксии. У 2 больных внезапное развитие инсульта после пароксизмальных нарушений сердечного ритма дало основание предположить эмболию церебральных сосудов.
Преходящие нарушения мозгового кровообращения развились у 36 (34,3 %) больных. У 23 они протекали в форме транзиторной ишемической атаки, у 13 — острой гипертонической энцефалопатии. Транзиторные ишемические атаки, как правило, развивались у больных с сочетанием атеросклеротического поражения магистральных артерий головы и нарушений системной гемодинамики, вызванных токсическим или геморрагическим шоком, а также сердечными аритмиями. Острая гипертоническая энцефалопатия имела место при значительном повышении артериального давления в результате анафилактических реакций, интубации, выраженного болевого синдрома. У 3 (5,6 %) пациентов после операции развился смешанный инсульт.
Геморрагический инсульт после операции возник у 3 (5,6 %) больных при резком значительном повышении артериального давления на фоне гипокоагуляции; у 1 больного после массивного желудочно-кишечного кровотечения, у 1 пациента с панкреонекрозом и у 1 с гемангиомой печени.
Факторами риска развития послеоперационного инсульта являлись: возраст старше 45 лет (84,8 % наблюдений), атеросклеротическое поражение магистральных поражений головы (56,2 %), гипертоническая болезнь I–III стадии (29,5 %), анемия II–III степени (44,5 %), ишемическая болезнь сердца I–III функционального класса (41 %), злоупотребление алкоголем (16,2 %), курением (19 %), ожирение I–III степени (15,2 %), вегетативные кризы (14,3 %), перенесенный ранее инсульт (5,7 %). Из 72,3 % случаев сочетания двух и более факторов риска частыми были: гипертоническая болезнь, ишемическая болезнь сердца, пожилой и старческий возраст, атеросклеротическое поражение магистральных артерий головы. К редко встречавшимся факторам риска послеоперационного инсульта относились: мигрень (1,9 %), аномалии развития магистральных артерий головы (2,85 %) и шейного отдела позвоночника (0,95 % случаев).
Анализ результатов параклинических исследований показал, что в 1-е сутки послеоперационного инсульта у всех больных выявлялись грубые изменения показателей, значения которых достоверно отличались от величин в контрольной группе (р < 0,05). Так, уровень молекул средней массы, достигавший 0,403–0,010 ед., свидетельствовал о выраженной эндогенной интоксикации. Исследование кислотно-щелочного состояния и газового состава крови выявило метаболический ацидоз у 22 (21 %), респираторный алкалоз у 31 (29,5 %), респираторный ацидоз у 52 (49,5 %) больных. Показатели коагулограммы соответствовали грубой гиперкоагуляции у 97 (92,4 %), гипокоагуляции у 8 (7,6 %) больных. Системная гемодинамика из 76 обследованных основной группы имела выраженный гиперкинетический тип у 49 (64,5 %), гипокинетический — у 27 (35,5 %). Результаты анализа реоэнцефалограмм свидетельствовали о снижении кровонаполнения мозга на фоне повышения сосудистого тонуса в каротидном и вертебробазилярном бассейнах у 24 (43,6 %) больных, гипотонической реакции сосудов у 22 (40 %), при сочетании спастичности и атоничности церебральных сосудов у 9 (16,4 %).
Описанные нарушения возникали под влиянием различных интраоперационных и послеоперационных осложнений — кровотечений, анафилактических реакций, прессорной реакции во время интубации, остаточной кураризации, обострения хронической легочной патологии, рестриктивной дыхательной недостаточности, интенсивной боли, эндотоксикоза, а также на фоне предоперационного психоэмоционального стресса, массивного выброса прокоагулянтных факторов, применения гемостатических средств.
Больные основной группы методом случайной выборки [11] были разделены на две подгруппы. В 1-ю подгруппу вошли 55 больных, у которых по поводу развившегося послеоперационного инсульта применяли традиционный комплекс интенсивного лечения. 2-ю подгруппу составили 50 больных, которым с первого дня послеоперационного периода в комплекс интенсивной терапии включали препараты актовегин (в течение 5 суток внутривенно капельно по 1000 мг на 500 мл 5% раствора глюкозы со скоростью 30–40 капель в минуту, общая доза 5000 мг) и инстенон (2 раза в сутки внутривенно капельно по 2 мл на 300 мл физиологического раствора хлорида натрия со скоростью не более 15 капель в минуту, общая доза 20 мл).
Сравнительный анализ показал, что у больных 2-й подгруппы чаще определялись преходящие нарушения мозгового кровообращения (у 21) и варианты «малого» инсульта с обратимым неврологическим дефицитом (у 17), а также не выявлялось геморрагических и смешанных инсультов.
Согласно результатам анализа динамики общемозговой и очаговой симптоматики, к 5-м суткам инсульта во 2-й подгруппе было достоверно меньшим, чем в 1-й, число больных с нарушением сознания, головокружением, нистагмом, рефлексами орального автоматизма, парезами мимической и скелетной мускулатуры. При сравнении реоэнцефалограмм установлено, что если в 1-е сутки послеоперационного инсульта церебральный кровоток страдал в одинаковой степени у больных обеих подгрупп, то на 5-е сутки у больных 1-й подгруппы сохранялось выраженное снижение кровотока, в то время как во 2-й подгруппе он восстанавливался до исходного (предоперационного) состояния.
Таким образом, представленная методика применения комплекса нейрометаболических препаратов может быть рекомендована для защиты мозга больных, оперируемых по поводу острых заболеваний органов брюшной полости с операционным риском III степени и выше с первого дня послеоперационного периода, а возможно, и в предоперационном периоде. Необходимы дальнейшие исследования с целью разработки индивидуализированного комплекса мероприятий для коррекции послеоперационных сосудистых поражений головного мозга с учетом их патогенеза при операциях на органах брюшной полости.
Список литературы
1. Акимов Г.А. Изменения нервной системы при острой недостаточности кровообращения и дыхания (осложнения торакальных операций): Автореф. дис… д-ра мед. наук. — Л., 1961.
2. Бадалян Л.О. Расстройства мозгового кровообращения при хирургическом лечении пороков сердца: Автореф. дис… д-ра мед. наук. — М., 1964.
3. Васильков В.Г., Сафронов А.И. Осложнения анестезии и пути снижения их частоты // Анест. и реаниматол. — 1991. — 2. — 24-26.
4. Горностаева В.Г. Факторы риска мозгового инсульта у больных с висцеральной патологией: Автореф. дис… канд. мед. наук. — М,1988.
5. Гусев Е.И., Скворцова В.И., Чекнева Н.С. Лечение острого мозгового инсульта (диагностические и терапевтические алгоритмы). — М. — 1997.
6. Зенков Л.Р., Ронкин М.А. Функциональная диагностика нервных болезней. — М.: Медицина, 1991.
7. Коледенок В.И., Захаров В.П. Ультразвуковая диагностика в кардиологии: Метод. пособие. — М., 1992.
8. Комаровская Я.М. Расстройство мозгового кровообращения как осложнение резекции желудка // Мат-лы науч. конф. «Физиология и патология кровообращения». — Тернополь, 1964. — 179-181.
9. Королев Б.А., Яшанин Ю.В. Патогенез и лечение острой кровопотери: Метод. разработки. — Горький, 1987.
10. Магдиев Т.Ш., Кузнецов В.Д. Ранние осложнения после операций на желчных путях // Хирургия, 1981. — 1. — 52-56.
11. Митропольский А.К. Техника статистических вычислений. — М.: Физматгиз, 1961.
12. Реут А.А., Лебедева Л.С. Факторы риска при остром холецистите // Хирургия. — 1981. — 1. — 34-37.
13. Справочник по функциональной диагностике / Под ред. И.А. Кассирского. — М., 1970.
14. Шутов А.А., Желтиков И.Г. Факторы риска развития мозгового инсульта и хирургические вмешательства // Неврол. журн. — 1996. — 2. — 21-25.
15. Bouma G.J., Muizellar J.P. Cerebral blood flow in several clinical head injuiry // New Horisonts. — 1995. — 3. — 384-394.
16. Hart R.G., Hindman B.J. Mechanisms of perioperative cerebral infarction // Stroke. — 1982. — 13. — 766-773.
Источник
