Инфаркт миокарда ремоделирование левого желудочка
Несколько классических биомаркеров используются для диагностики ИМ или острого коронарного синдрома. В последнее время были выявлены новые маркеры для предоставления диагностической и прогностической информации, а также исхода инфаркта миокарда или острого коронарного синдрома, которые показали значительную связь с ремоделированием левого желудочка и плохим прогнозом после инфаркта миокарда.
Вступление
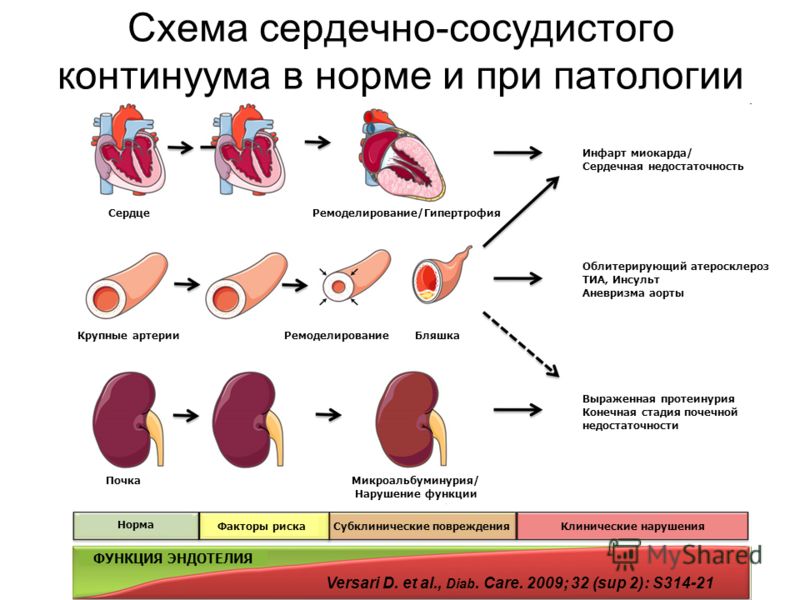
Инфаркт миокарда (ИМ) возникает в результате окклюзии коронарной артерии, которая препятствует кровоснабжению миокарда в левом желудочке (ЛЖ). Ремоделирование ЛЖ может быть описано как клеточные, интерстициальные, молекулярные и генетические изменения, которые проявляются клинически, что выражается в изменении размера, формы и функции ЛЖ после сердечной травмы, такой как инфаркт миокарда. Инфаркт миокарда приводит к миграции макрофагов, моноцитов и нейтрофилов в зону инфаркта; это инициирует внутриклеточную передачу сигналов и нейрогормональную активацию, которая локализует воспалительный ответ. Изменения в системе кровообращения определяются потерей миоцитов, возбуждением симпатической нервной системы, активацией ренин-ангиотензинальдостероновой системы или высвобождением натрийуретических пептидов .
Литературный обзор
Ремоделирование ЛЖ после ИМ было разделено на две фазы: ранняя фаза (через 72 часа) и поздняя фаза (после 72 часов). В ранней фазе ремоделирования расширение инфаркта происходит в результате деградации коллагеновых структур межмиоцитов сериновыми протеазами и активации матричных металлопротеиназ (ММР), высвобождаемых из нейтрофилов. Напряжение стенки ЛЖ стимулирует механорецепторы и передает внутриклеточные сигналы посредством высвобождения ангиотензина II (Ang II), что представляет собой усиленный синтез миофибрилл. Нарушение гемодинамики кровообращения запускает симпатическую адренергическую систему, которая стимулирует катехоламины, активирует систему ренин-ангиотензин-альдостерон и индуцирует выработку предсердных и мозговых натрийуретических пептидов (ANP, BNP). Поздняя фаза ремоделирования включает гипертрофию миоцитов и изменения в структуре желудочка, чтобы распределить увеличенное напряжения на стенке ЛЖ. На этом этапе гипертрофия миоцитов инициируется активацией нейрогормональной и ренин-ангиотензиновой систем, расширением миокарда и паракринно-аутокринными факторами.
Ремоделирование ЛЖ развивается через нескольких различных механизмах
1. Воспаление (С-реактивный белок, TNF-α, растворимые рецепторы TNF, Fas, интерлейкины (I, 6 и 18), остеопротегерин, адипонектин)
2. Гипертрофия / фиброз (матричные металлопротеиназы, коллагеновые пропептиды, галектин-3, растворимый ST2).
3. Апоптоз (GDF-15)
4. Разное (микроРНК, кивезин Q6, VEGFR-1)
Учитывая патогенетические механизмы ИМ, несколько классических биомаркеров были использованы для диагностики ИМ или острого коронарного синдрома. В последнее время были выявлены новые маркеры для предоставления диагностической и прогностической информации и исхода инфаркта миокарда или острого коронарного синдрома.
Классические Биомаркеры
Три биомаркера оценивают различные пути, вовлеченные в патогенез ремоделирования ЛЖ:
1. Увеличение тропонина I (TnI) указывает на повреждение миоцитов
2. Мозговой (B-тип) натрийуретический пептид (BNP) увеличивается в ответ на перегрузку LV
3. С-реактивный белок (СРБ) является маркером воспаления
Тропонин I (TnI)
Тропонин I входит в состав тропонинового комплекса. Тропониновый комплекс состоит из трех субъединиц, которые регулируют кальций-опосредованный сократительный процесс поперечно-полосатой мышцы. К ним относятся тропонин C, который связывает Ca2 +, тропонин I (TnI), который связывается с актином и ингибирует взаимодействия актин-миозин, и тропонин T (TnT), который связывается с тропомиозином, тем самым фиксируя комплекс тропонина. После повреждения миоцитов начальное высвобождение cTnT и cTnI происходит из цитозольного пула с последующим высвобождением из структурного (связанного с миофиламентом) пула. Для ИМ сердечный тропонин T (cTnT) и сердечный тропонин I (cTnI) считаются более чувствительными и специфичными, чем другие биомаркеры сердца. cTnT и cTnI остаются в кровотоке приблизительно более 10 дней, достигают пика приблизительно через 1-2 дня после повреждения миокарда, как это было предложено Thygesen и Alpert в 2000 г. Из-за длительного высвобождения в крови эти биомаркеры являются основными диагностическими критериями острого повреждения миокарда. Исследования показали, что у пациентов с повышенным уровнем cTnI частота сердечной смертности и сердечных осложнений была значительно выше, так чаще развивался летальный исход, нефатальный инфаркт миокарда, требовалась реваскуляризация сосуда-мишени.
Натрийуретические пептиды (bnp и nt-probnp)
Мозговой (B-тип) натрийуретический пептид (BNP) представляет собой пептид из 32 аминокислот, который синтезируется и высвобождается преимущественно из миокарда желудочков в ответ на растяжение миоцитов. Как и предсердный натрийуретический пептид (ANP), BNP, по-видимому, обладает почти исключительно полезными физиологическими свойствами, включая сбалансированное расширение сосудов, натрийурез и ингибирование как симпатической нервной системы, так и ренинангиотензин-альдостерона . Он синтезируется в желудочках миокарде и высвобождается в ответ на повышение давления на стенку желудочка.
В исследовании DETECT было показано, что повышенные уровни NT-pro-BNP в плазме крови на исходном уровне были связаны с повышенным 5-летним коэффициентом риска для смертности от всех причин (HR 5,02; CI 3,26-7,72; p <0,0001) и для серьезных сердечно-сосудистых событий ( ЧСС 4,38; ДИ 2,82-6,80; р <0,0001), состоящий из сердечно-сосудистых событий и смертности от инфаркта миокарда или внезапной сердечной смерти.
С-реактивный белок (СРБ)
С-реактивный белок (СРБ) является белком острой воспалительной фазы, который активирует макрофаги и окислительный стресс. Он считается фактором риска и биомаркером сердечно-сосудистых заболеваний. Повышенный уровень СРБ связан с дисфункцией левого желудочка (ЛЖ) и демонстрирует более высокий риск смертности и заболеваемости у пациентов с сердечной недостаточностью. Это независимый фактор риска и плохого прогноза при заболевания х миокарда ишемической или неишемической этиологии. Сообщается, что СРБ способствует фиброзу и воспалению при ремоделировании миокарда, вызванном ангиотензином II .
Исследование Orn et al. показали, что через два дня после ЧКВ уровни СРБ сильно коррелировали с уровнем NT-proBNP, размером инфаркта и ФВ ЛЖ. Не было никакой корреляции с объемами ЛЖ, но была обратная корреляция с не поврежденной массой ЛЖ. Сходная картина корреляции наблюдалась через 1 неделю, но не через 2 месяца. В отличие от С-реактивного белка, IL-6 коррелировал с размером инфаркта только через 2 дня, что оценивали по CMR (0,38, P = 0,01), но не ферментативными методами [11].
В исследовании Schoos MM et al. было указано, что СРБ в начале исследования был связан с размером инфаркта, LVEF и конечным систолическим объемом (ESV) в начале исследования и через 6 месяцев наблюдения .
Эти данные показывают, что сам СРБ может играть определенную роль в развитии дисфункции ЛЖ и ремоделировании.
Кроме того, новые исследования Hofmann et al. и Savvatis et al., показали, что дефицит воспалительных факторов, то есть дефект IL-13 или IL-23, вызывает неблагоприятное ремоделирование после ИМ и может ухудшать исходы после ОИМ .
Новые маркеры
Матричные металлопротеиназы (ММП):
Матричные металлопротеиназы (ММП) представляют собой большое семейство кальций-зависимых и цинксодержащих эндопептидаз. ММП инициируют ремоделирование ткани и деградацию внеклеточного матрикса (ЕСМ), таких как коллаген, эластины, матричные гликопротеины, протеогликан, желатин. Они контролируются гормонами, факторами роста и цитокинами и выводятся из организма различными тканевыми и провоспалительными клетками, то есть фибробластами, остеобластами, эндотелиальными клетками, макрофагами, нейтрофилами, лимфоцитами. До настоящего времени 28 типов металлопротеиназ матрикса человека были признаны и классифицированы как коллагеназы, желатиназы, стромелизины, матрилизины, мембранные типы. Исследования показали повышенный уровень нескольких ММП. Больше всего были повышены уровни ММП-1, -2, -3, -7, -8, -9, -13 и -14. ММП-2, -8, -9 и-13 были исследованы в образцах плазмы и тканей.
МикроРНК (микроРНК).
МикроРНК (микроРНК) представляют собой эндогенно экспрессируемые небольшие некодирующие молекулы РНК. Гены, кодирующие микроРНК, можно найти в геномах практически всех организмов, включая вирусы. Их основным механизмом действия является посттранскрипционная репрессия экспрессии генов . Предполагается, что короткая длина (22 нт) максимизирует специфичность гена-мишени и минимизирует неспецифические эффекты. Предполагается, что miRNAs регулируют примерно 30% генов в геноме человека. Всего насчитывается более 2000 кодируемых человеческих микроРНК.
Большинство видов микроРНК очень стабильны и выявляются в периферической крови или плазме, а уровни циркулирующих микроРНК варьируют у людей с различными патологическими состояниями, что делает их отличными диагностическими и прогностическими биомаркерами для различных заболеваний, например рака или диабета. В последние годы в исследованиях сообщалось о диагностической ценности микроРНК при развитии ОИМ. И в новых сообщениях изучалась связь между прогностической ценностью циркулирующих микроРНК и ремоделированием сердца после ОИМ.
Pin и соавт. Исследование показало, что плазменные miR-208b и miR-34a могут служить доступными предикторами ремоделирования ЛЖ после ОИМ и связаны с шестимесячной смертностью или развитием сердечной недостаточности. MiR-208b характеризуется как специфичная для сердца микроРНК в ранней диагностике ОИМ, так же обнаружена корреляция между уровнем miR-208b в плазме и дисфункцией ЛЖ после ИМ. Несмотря на то, что семейство miR-34 обладает защитным свойством против патологического ремоделирования сердца, избыточная экспрессия miR-34a демонстрирует индуцированное старение эндотелиальных клеток и атеросклероз.
В исследовании Devaux et al., низкие уровни miR-150 связаны с ремоделированием ЛЖ после первичного ОИМ. Согласно Devaux и соавт., низкие уровни miR-150, miR-101 или повышенные уровни miR-16 и miR-27a коррелировали с повышенным риском нарушения сократимости ЛЖ и были связаны с ремоделированием сердца после ИМ.
Несмотря на это, два исследования показали, что некоторые из miRNAs (то есть miR-133a и miR-423-5p) бесполезны в качестве биомаркеров для прогноза пациентов с ИМ или для частоты ремоделирования ЛЖ через 1 год после переднего ОИМ.
Галектин-3:
Галектин-3 представляет собой β-галактозид-связывающий лектин, секретируемый активированными макрофагами, который интересен как минимум как маркер или, возможно, даже потенциальный медиатор воспаления и фиброза, процессов, которые являются центральными в патофизиологии ремоделирования ЛЖ.
Tsai et al. предположили несколько важных клинических проявлений галектина-3: 1) циркулирующий галектин-3 был значительно выше у пациентов с ОИМ, чем у пациентов без ОИМ; 2) имелась значительная положительная корреляция высокого уровня циркулирующего галектина-3 с оценкой острой сердечной недостаточности по Киллипу, нестабильной гемодинамикой, требующей поддержки вазопрессорами, прогрессирующей сердечной недостаточностью и высокой оценкой риска CADILLAC; 3) повышенный галектин-3, как было доказано, является достаточно сильным независимым предиктором 30-дневной летальности среди пациентов с ИМ, перенесших первичную ЧКВ.
Хотя Вейр и соавт.продемонстрировали, что более высокие концентрации галектина-3 на исходном уровне были в значительной степени связаны с более низкой сократительной функцией ЛЖ при 24-недельном наблюдении, они не установил значимой связи между галектином-3 и ремоделированием как таковым.
Фактор дифференциации роста 15 (GDF-15):
Фактор дифференциации роста 15 (GDF-15) представляет собой белок, который кодируется этим геном и принадлежит к семейству трансформирующих факторов роста-бета (TGF-бета). Этот белок экспрессируется в клетках как ответ при клеточном повреждении и действует на плейотропию. Повышенные уровни белка связаны с воспалением тканей, гипоксией, острым повреждением клеток или окислительным стрессом. В нормальном состоянии ткани GDF-15 не экспрессируется, однако, во время «стресса» было показано, что его уровни повышаются.
Несколько клинических исследований показали, что GDF-15 является независимым предиктором ремоделирования ЛЖ, смерти и сердечной недостаточности у пациентов с ИМ. Эхокардиографические и GDF-15 измерения были выполнены в начале исследования и были повторены через 6 или 12 месяцев. Исследования показали, что пациенты с более высоким уровнем GDF-15 выше среднего имели более низкую фракцию выброса ЛЖ, повышенный риск сердечной недостаточности или смерти.
Статья добавлена 4 июля 2019 г.
Источник
Что такое концентрическое ремоделирование левого желудочка
Концентрическое ремоделирование миокарда левого желудочка считается наиболее распространенной формой данной болезни. Как правило, оно развивается в первую очередь у людей, имеющих артериальную гипертензию. Данный тип не имеет способности изменять внутреннее пространство левого желудочка, происходит лишь изменение стенок сердца и увеличение перегородки между сердечными отделами. Стоит сказать, что эта форма может начать свое развитие на фоне имеющейся гипертрофии левого желудочка. Кстати, гипертрофия, как правило, развивается при увеличенных физических нагрузках, либо же, как следствие гипертонии. Помимо стандартных причин возникновения, имеются и другие, которые не лучшим образом влияют на здоровье человека, а это могут быть пагубные привычки, такие как курение, злоупотребление алкоголем и др.

Начинается заболевание с гипертрофии левого желудочка и проявляется повышением толщины его стенки
Важно знать, что самостоятельная диагностика ремоделирования миокарда не приведет ни к чему хорошему, но, все-таки следует разбираться в первоначальных признаках, которые способствуют возникновению болезни, это такие, как:
- головная боль;
- сердечная боль;
- ухудшение общего состояния организма;
- скачки артериального давления;
- неравномерный сердечный ритм.
При первых же проявлениях подобных симптомов необходимо обратиться к специалисту, который должен назначить кардиограмму. Только этот метод исследования поможет определить наличие данной болезни. Следует сказать, что запущенная форма может привести к необратимым последствиям, например, к развитию хронической сердечной недостаточности.
Ремоделирование сердца
Нет ничего сложнее, нежели перенести тяжелую болезнь сердца, которая приводит также к определенным последствиям. Одной из таковых является ремоделирование сердца. Ремоделирование сердца — это структурные изменения органа, разрушающие его свойства в ответ на внешние воздействия и другие патологические процессы в организме человека.
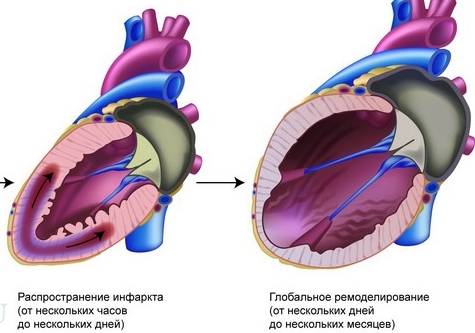
Ремоделирование сердца проишодит под воздействием негативных факторов и заболеваний
Причины возникновения
Необходимо уточнить, что данный недуг может развиваться и на почве других сердечных заболеваний, это и приводит к особенным формам развития. Помимо таких негативных факторов, как болезни, ремоделирование миокарда может проявиться и как следствие некачественного лечения. Важно знать, что абсолютно разные причины влияют на развитие той или иной физиологической особенности сердца. О важности правильного диагностирования причин возникновения говорить не стоит, ведь это и так понятно, что следует в первую очередь обращать внимание на фактор, который способствовал возникновению данного анатомического изменения.
Вследствие повышенного артериального давления возникают некоторые болезни, которые приводят к данным изменениям. Помимо этих деформаций сердца, можно также наблюдать и другие нарушения:
- толщина кардиомиоцитов имеет ускоренный рост;
- растет количество саркомеров;
- сердечные стенки увеличиваются в размере.
Внимание! Кардиомиоцитами называют одноядерные клетки, из которых состоит миокард. Они в свою очередь имеют поперечное расположение, и вызывают повышенную прочность мышечной массы.
Большое значение имеет масштабность ремоделирования миокарда, которое имеет разные значения и объясняется двумя основными причинами возникновения:
| активация нейрогормонов | Подобный случай возникает в результате поражения организма инфарктом миокарда. Стоит сказать, что данная активация обусловлена значительным повреждением сердечной мышцы. Кстати, данная повышенная активация должна работать над регулированием общей работы сердечного органа и нормализацией артериального давления. Но, если не принять вовремя меры предосторожности, то такая патология перерастает в более тяжелую форму ремоделирования миокарда |
| симпатическая нервная система и ее активация | Данная причина возникновения основного недуга объясняется увеличенным напряжением левого желудочка. Это приводит к тому, что данному отделу необходимо большее количество кислорода |
Если говорить об эксцентрическом ремоделировании миокарда, то оно может быть вызвано значительной перегрузкой данной мышечной ткани. Кроме того, это сопровождается удлинением одноядерных клеток и уменьшением в размерах стенок сердца.
Патофизиология болезни
Сегодня инфаркт миокарда звучит не так страшно, как несколько лет назад. В большинстве случаев пациенты имеют возможность продолжать свою стандартную жизнедеятельность, несмотря на перенесенный стресс для сердца, да и всего организма. Стоит сказать, что качественное лечение и хорошая реабилитация, дают свои плоды, но, к сожалению, помимо этого, все же остаются последствия перенесенного инфаркта. Ремоделирование миокарда патофизиология которого только обостряется, имеет достаточно неприятные последствия. В данном случае, если своевременно не проводить квалифицированные осмотры, можно придать свой организм осложнениям, таким как плохое кровообращение и хроническая сердечная недостаточность.
Важно! Проведение качественной реабилитации и соблюдение рекомендаций специалиста является обязательными условиями при данном недуге. Если этого не придерживаться, можно получить тяжелые осложнения, которые приводят к плачевным результатам.
Инфаркт миокарда, как правило, приводит к серьезным физиологическим изменениям левого желудочка, что не очень хорошо сказывается на общем состоянии пациента. Такое изменение структуры сердечного отдела приводит также к следующим изменениям:
- стандартная форма левого желудочка представляет собой овальную форму, которая может меняться после перенесенного инфаркта, и приобретать сферические параметры;
- сама мышечная ткань ухудшается в своих качественных показателях, имеет свойство растягиваться и уменьшаться в размерах;
- появление частей, которые отмирают, к тому же их размерность имеет свойство увеличиваться и др.
Если проследить данную особенность, то можно заметить, что все процессы в организме взаимосвязаны, и ничего не возникает просто так. Из-за того что постоянно повышается артериальное давление, наша сердечная мышца пытается приспособиться к данному явлению. Как следствие, происходит изменение в размерах мышечной ткани. Именно так возникает данное заболевание, которое сопровождается рядом других недугов.
Источник
