Диуретическая терапия у больных с сердечной недостаточностью
В соответствии с отечественными данными, полученными в результате исследования «Эпоха», распространенность хронической сердечной недостаточности (ХСН) в различных регионах России составляет 7–10%. При этом в России зарегистрировано более 4 миллионов пациентов с тяжелыми проявлениями ХСН; около 90% пациентов с ХСН ежегодно госпитализируют по поводу декомпенсации, и это состояние отмечается у каждого шестого пациента терапевтического стационара. ХСН в мире становится основной причиной смерти от болезней системы кровообращения.
Рассмотрим основные звенья патогенеза ХСН
Первоначальное повреждение миокарда (перегрузка давлением или объемом, инфаркт миокарда, миокардит и др.) приводит к снижению сердечного индекса и повышению конечного диастолического давления в левом желудочке, что провоцирует активацию симпатоадреналовой и ренин-ангиотензин-альдостероновой систем (норадреналин, ангиотензин II, повышение напряжения стенок желудочков, эндотелин-1, провоспалительные цитокины, радикалы кислорода). Повышается общее периферическое сосудистое сопротивление (вазоконстрикция), происходит задержка Nа и воды (возникает гиперволемия и электролитные нарушения), в результате чего возникает аритмия, прямое повреждение миокарда, усугубляются процессы ремоделирования миокарда (его гипертрофия и апоптоз, экспрессия фетальных генов, изменение межклеточного вещества), что приводит к прогрессированию сердечной недостаточности (ухудшение самочувствия, осложнения, смерть).
В рамках данной темы рассмотрим именно вопрос задержки жидкости в структуре патогенеза.
Клинические проявления задержки жидкости в организме при ХСН представлены одышкой при небольшой нагрузке или в покое (специфичность 51%), положением ортопноэ (специфичность 89%), набуханием шейных вен (специфичность 70%), периферическими отеками (специфичность 72%), влажными хрипами в легких (специфичность 81%), увеличением печени (специфичность 97%).
Методы лечения ХСН
– Немедикаментозные: диета (ограничение поваренной соли), режим физической активности, психологическая реабилитация, врачебный контроль, школы для больных ХСН.
– Медикаментозная терапия.
– Хирургические, механические, электрофизиологические методы (используются при неэффективности медикаментозной и немедикаментозной терапии).
Рассмотрим подробнее немедикаментозный метод, в частности, диету.
Диета подразумевает ограничение поваренной соли (1 молекула Na связывает 400 молекул воды). Избыток Na стимулирует образование антидиуретического гормона (АДГ), что способствует задержке воды в организме и развитию отечного синдрома.
В зависимости от функционального класса (ФК) ХСН, существует определенное ограничение в потреблении поваренной соли (Na):
- I ФК – до 3 г. Na = до 7,5 г. поваренной соли (не употреблять солёную пищу).
- II ФК – до 1,5 г. Nа = до 3,8 г. соли (не употреблять солёную пищу и не досаливать домашнюю еду при приготовлении).
- III ФК – менее 1 г. Na = менее 2,5 г. поваренной соли (употреблять продукты с уменьшенным содержанием соли, домашнюю еду готовить без соли).
Na (г) • 2,5 = поваренная соль (г)
В период активной диуретической терапии ограничение натрия и соли умеренное (натрий <3 г, соль <7 г), после достижения компенсации придерживаются ограничения согласно ФК ХСН.
Что касается медикаментозной терапии, лекарственные препараты для лечения ХСН (в первую очередь с фракцией выброса менее 40%) делятся на два класса:
– Доказавшие способность к снижению смертности и заболеваемости именно при ХСН (основные и применяемые в определенных клинических ситуациях);
– Не доказавшие влияния на прогноз при ХСН, улучшающие симптоматику в определенных клинических ситуациях.
Источник
Диуретики показаны пациентам с декомпенсированной сердечной недостаточностью при наличии симптомов, обусловленных задержкой жидкости (уровень доказанности В).
Назначение диуретиков пациентам с острой сердечной недостаточностью обусловлено способностью этих лекарственных средств увеличивать объём выделяемой жидкости и выводить большее количество ионов, в первую очередь натрия и хлора. Это приводит к уменьшению объёмов циркулирующей плазмы и снеклеточной жидкости. Это приводит, в свою очередь, к снижению давления в ЛЖ и ПЖ сердца, уменьшению депонирования жидкости на периферии и уменьшению отёка лёгких.
Внутривенное введение петлевых диуретиков приводит также к вазодилатационному эффекту. Этот эффект отчётливо виден на сосудах малого круга кровообращения уже через 5-30 мин после введения препарата. У пациента регистрируют достоверное снижение давления заклинивания лёгочной артерии и сосудистого сопротивления. Следует отметить, что введение высоких доз (более 1 мг/кг) болюсом может приводить к парадоксальным вазоконстрикторным реакциям. Короткий курс диуретической терапии, назначаемый пациентам с острым коронарным синдромом, в отличие от мочегонной терапии больных ХСН, может способствовать понижению активности ангиотензина II и норадреналина в плазме. Для пациентов с острым коронарным синдромом предпочтителен режим малых доз, что гарантирует помимо мочегонного эффекта вазодилатацию.
Общие принципы диуретической терапии пациентов с острой сердечной недостаточностью
Внутривенное введение петлевых диуретиков (фуросемида, торасемида) при острой сердечной недостаточности предпочтительнее других способов введения лекарственных средств, поскольку этот способ эффективнее и гарантирует быстрое наступление клинического эффекта.
Необходимо начинать терапию диуретиками как можно раньше (на догоспитальном этапе). Безопасность и эффективность ранней диуретической терапии на догоспитальном этапе доказана результатами многочисленных исследований.
Дозу диуретиков следует титровать. Критерий проведения титрации — объём выделяемой мочи и уровень снижения проявлений застоя. Нужно учитывать, что дозированное внутривенное введение диуретиков всегда более эффективно, чем болюсное введение препарата.
При сочетании внутривенно вводимого петлевого диуретика с тиазидным диуретиком или спиронолактоном может быть снижено число побочных реакций. В этой связи целесообразно на ранних этапах при неэффективности только внутривенной мочегонной терапии назначение тиазидных диуретиков или спиронолактона для получения клинического эффекта при малых дозах мочегонных препаратов. Для улучшения мочегонного эффекта при острой сердечной недостаточности возможна также комбинация петлевого диуретика с допамином или нитратами.
Таким образом, использование комбинированной диуретической терапии предпочтительнее, чем увеличение доз петлевого диуретика, вводимого внутривенно в режиме монотерапии.
Индивидуализация диуретической терапии при острой сердечной недостаточности
Выбор того или иного петлевого диуретика, комбинации препаратов и их доз для каждого пациента индивидуальны и в большой степени зависят от его состояния (табл. 1).
Таблица 1
Стартовые дозы диуретиков для в/в введения в зависимости от исходного состояния пациента с острой сердечной недостаточностью
| Состояние и индивидуальные особенности пациента | Диуретик | Доза, мг | Особые замечания |
| Состояние средней тяжести Состояние тяжелое Рефрактерность к петлевым диуретикам Рефрактерность к комбинированной мочегонной терапии Развитие алкалоза | Фуросемид Торасемид Фуросемид Петлевой диуретик+гидрохлортиазид Петлевой диуретик+допамин¹ | 20-40 per os 20-40 per os 40-100 болюсно (инфузия со скоростью 5-40 мг/ч) 25-50 2 раза в день 500 2 раза в сутки per os или 0,5 в/в | Титрация дозы в соответствии с клиническим состоянием. Постепенное в/в введение предпочтительнее, чем болюсное Комбинация препаратов возможна только при отсутствии хронической почечной недостаточности, нормальном или пониженном уровне калия Необходимо рассмотреть вопрос об ультрафильтрации или гемодиализе |
Примечания. ¹ Препарат добавляют для повышения фильтрации мочи в почке. ² Препарат добавляют для достижения положительного инотропного эффекта.
Титрация дозы обязательна в ситуациях, когда стартовая доза, выбранная на оценки исходного состояния, не приводит к уменьшению проявлений застоя. При развитии рефрактерности к препарату при увеличении доз диуретиков обязателен переход к комбинированной терапии.
При диуретической терапии острой сердечной недостаточности обязателен мониторинг уровня калия и натрия, креатинина каждые 24-48 ч. Необходимо восполнять потери калия и магния (объём восполнения и путь введения врач выбирает индивидуально).
Рефрактерность пациентов с острой сердечной недостаточностью к диуретической терапии
Под рефрактерностью к мочегонной терапии понимают состояние, когда реакция организма на введение диуретика минимальна и не нарастает в ответ на усиление мочегонной терапии. Это плохой прогностический признак. Явления застоя при рефрактерности усиливаются. Чаще всего рефрактерность развивается у пациентов с длительно существующей ХСН и предшествующей продолжительной мочегонной терапией. При осмотре пациента необходимо уточнить:
- фракцию выброса (низкая фракция выброса способствует развитию рефрактерности);
- количество потребляемой поваренной соли (развитию рефрактерности способствует потребление соли более 5 г в день);
- наличие мальабсорбции (при этом синдроме пероральное введение препарата неэффективно);
- уровень систолического и перфузионного давления (при снижении давления менее 80 мм рт.ст. мочегонная терапия становится неэффективной);
- продолжительность применения НПВС или приема нефротоксичных веществ (эти препараты провоцируют развитие тубулярной недостаточности);
- уровень нейрогормонов (повышение уровня ангиотензина II и норадреналина у пациентов с ХСН снижает эффективность мочегонной терапии);
- сопутствующие состояния (при сахарном диабете 2-го типа, сахарном диабете 1-го типа в стадии диабетической нефропатии, хронической почечной недостаточности, переходе в стадию терминальной почечной недостаточности диуретическая терапия неэффективна)
Индивидуальный подход к лечению рефрактерного к диуретической терапии пациента с острой сердечной недостаточностью
При ведении таких больных следует:
- сократить потребление пациентом поваренной соли и воды (желательно, чтобы её количество составляло менее 1,5 г/сут);
- при необходимости увеличить фракцию выброса, ударный объём, поднять уровни систолического и перфузионного давления;
- уменьшить дозу ингибиторов АПФ или перейти на дозы, меньшие либо равные половине стартовой;
- проводить только комбинированную терапию;
- отказаться от болюсного введения мочегонных препаратов.
Основные побочные эффекты у пациентов с острой сердечной недостаточностью при проведении мочегонной терапии
К таким побочным эффектам относят:
- активацию ренин-ангиотензин-альдостероновой и симпатоадреналовой системы;
- электролитные нарушения.
В случае активации ренин-ангиотензин-альдостероновой и симпатоадреналовой системы необходима коррекция мочегонной терапии, если курс лечения продолжается более 48 ч. С учётом нестабильной гемодинамики начинать терапию ингибиторами АПФ и β-адреноблокаторами необходимо крайне осторожно. Снижение уровней калия, магния, хлора приводит к тяжёлым нарушениям сердечного ритма.
Перспективы мочегонной терапии
Наибольшие надежды возлагают на новый класс мочегонных препаратов — акваретики. Эти препараты блокируют рецепторы к вазопрессину (V1 и V2), что приводит к выделению значительного количества жидкости, но не вызывает электролитных нарушений. Данные некоторых исследований свидетельствуют о клинической эффективности мозговых натрийуретических антагонистов аденозиновых рецепторов.
Опубликовал Константин Моканов
Источник
В статье с позиции клинического фармаколога обоснован выбор препарата для диуретической терапии. Основное внимание сосредоточено на эффективности и профиле безопасности петлевых диуретиков и наиболее современного препарата из данной группы — торасемида, обладающего дополнительными свойствами.
Введение
Диуретики — это препараты, применяемые для усиления образования мочи, выведения из организма избыточного количества воды и устранения отеков. Действие диуретических средств реализуется в нефроне. В нем происходит процесс мочеобразования — фильтрация первичной мочи из плазмы крови в клубочке нефрона и дальнейший процесс образования вторичной мочи в канальцевом аппарате нефрона за счет реабсорбции и секреции в мочу различных выделяемых веществ. Снижение скорости реабсорбции всего на 1% приводит к увеличению объема мочи в 2 раза. Поэтому лекарственные средства, обладающие даже незначительным влиянием на процессы обратного всасывания электролитов в канальцах нефрона, способны вызывать существенное изменение диуреза. Диуретики влияют на экскрецию калия, магния, хлора, фосфатов и бикарбонатов, что при длительном приеме проявляется возникновением различных побочных эффектов. С другой стороны, патологические процессы, приводящие к временному или постоянному изменению структуры клубочков и канальцев, способны вызывать серьезные изменения водно-электролитного баланса в организме [1–8].
Диуретики используются в комплексной терапии артериальной гипертонии (АГ) и занимают важное место в лечении ХСН. ХСН является одним из наиболее распространенных и прогностически неблагоприятных заболеваний современности, причем ХСН страдают 2–4% всего населения мира. По данным исследования ЭПОХА-ХСН, распространенность ХСН в РФ составляет 7% (7,9 млн человек). Несмотря на значительный прогресс в терапии ХСН за последние десяти-летия, смертность от этого заболевания остается крайне высокой, поэтому по-прежнему актуальны поиск новых и оптимизация существующих фармакологических подходов к терапии ХСН с целью достижения ее более высокой эффективности в облегчении клинических симптомов и исходов [1–12].
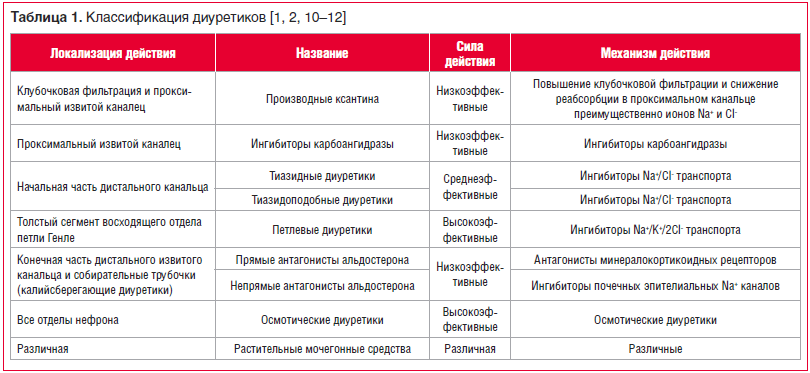
Классификация диуретиков
Диуретики различаются по механизму и силе действия, способности влиять на кислотно-щелочное равновесие, скорости наступления и продолжительности действия. Существуют несколько классификаций диуретиков, практически значимой представляется классификация, основанная на локализации и механизме действия (табл. 1) [1, 2, 10–12].![Таблица 1. Классификация диуретиков [1, 2, 10–12] Таблица 1. Классификация диуретиков [1, 2, 10–12]](https://www.rmj.ru/upload/medialibrary/8d1/115-1.png)
Принципы рациональной терапии и выбор диуретического препарата
Принципиальными моментами в лечении мочегонными средствами являются:
назначение слабейшего из эффективных у данного больного диуретиков;
назначение мочегонных средств в минимальных дозах, позволяющих добиться эффективного диуреза (для активного диуреза прибавка должна составлять 800–1000 мл/сут, для поддерживающей терапии — не более 200 мл/сут);
при недостаточной эффективности применение комбинаций диуретиков с разным механизмом действия;
мочегонная терапия осуществляется только в ежедневном режиме. Прерывистые курсы мочегонной терапии приводят к гиперактивации нейрогормональных систем и росту уровня нейрогормонов.
Выбор диуретика зависит от характера и тяжести заболевания. В неотложных ситуациях (например, при отеке легких) используют сильно и быстро действующие петлевые диуретики внутривенно. При выраженном отечном синдроме (например, у пациентов с декомпенсацией ХСН) терапию также начинают с внутривенного введения петлевых диуретиков, с последующим переходом на прием фуросемида или торасемида внутрь. При недостаточной эффективности монотерапии используют комбинации диуретиков с разными механизмами действия. Комбинацию фуросемида или гидрохлортиазида (ГХТ) с калийсберегающими диуретиками используют также для предупреждения нарушений электролитного баланса. Комбинация ГХТ с петлевыми диуретиками должна применяться с осторожностью из-за высокого риска электролитных нарушений. Для длительной терапии (например, при АГ) используют тиазидные и тиазидоподобные диуретики, в отдельных случаях — калийсберегающие диуретики и торасемид. Осмотические диуретики используют для увеличения водного диуреза и предупреждения развития анурии (например, при гемолизе), а также для уменьшения внутричерепного и внутриглазного давления. Ингибиторы карбоангидразы используют при повышенном внутричерепном давлении, глаукоме, эпилепсии, острой высотной болезни, для повышения выведения с мочой фосфатов при тяжелой гиперфосфатемии [1, 11, 12].
В таблице 2 представлены показания к назначению отдельных представителей данного класса препаратов.![Таблица 2. Ключевые показания к назначению диуретиков [1, 2, 12] Таблица 2. Ключевые показания к назначению диуретиков [1, 2, 12]](https://www.rmj.ru/upload/medialibrary/c5c/115-2.png)
Правила назначения диуретиков при ХСН
Терапия начинается только при наличии симптомов недостаточности кровообращения и признаках задержки жидкости.
Назначение диуретиков должно происходить на фоне уже применяемой терапии ингибиторами ангиотензинпревращающего фермента (АПФ) и бета-адреноблокаторами.
Мочегонная терапия осуществляется только в ежедневном режиме. Прерывистые курсы мочегонной терапии приводят к гиперактивации нейрогормональных систем и росту уровня нейрогормонов.
Назначение диуретиков идет «от слабейшего к сильнейшему».
При достижении клинического эффекта (уменьшение клинических проявлений НК, увеличение толерантности к физическим нагрузкам) начинается титрация «на понижение».
Тиазидные диуретики обладают высоким профилем безопасности только в комбинации с ингибиторами АПФ, блокаторами рецепторов ангиотензина (БРА) и бета-адреноблокаторами. В современных схемах роль тиазидных диуретиков в лечении ХСН умеренна. Следует особо помнить, что при низкой скорости клубочковой фильтрации (СКФ) и клинической картине хронической почечной недостаточности (ХПН) тиазидные диуретики неэффективны.
В лечении ХСН преимущество отдается петлевым диуретикам с большим периодом полувыведения (Т ½) и плейотропными эффектами. Комбинация диуретиков у пациентов с ХСН возможна только в ситуации, когда нет ХПН, а уровень калия — нормальный или пониженный. Строго обязателен лабораторный контроль уровня калия и креатинина. При уровне калия более 5,0–5,5 ммоль/л доза уменьшается на 50%. При более значимом отклонении от нормы — более 5,5 ммоль/л — проводится коррекция дозы вплоть до отмены препарата. После снижения дозы на 50% повторное увеличение дозы возможно спустя 1 мес. при условии стойкой нормокалиемии. При стабильном состоянии и отсутствии колебаний уровня креатинина контроль уровня калия должен осуществляться 1 раз в 3–6 мес. Необходимо помнить, что сочетание ингибиторов АПФ и калийсберегающих диуретиков всегда должно рассматриваться как приводящее к гиперкалиемии [11–13].
В таблице 3 представлены рекомендуемые начальные и поддерживающие дозы диуретиков, применяемых для лечения ХСН с сохранной и сниженной фракцией выброса (ФВ) [1, 3, 4].![Таблица 3. Дозы диуретиков, применяемых для лечения ХСН как с сохранной, так и со сниженной ФВ [1, 3, 4] Таблица 3. Дозы диуретиков, применяемых для лечения ХСН как с сохранной, так и со сниженной ФВ [1, 3, 4]](https://www.rmj.ru/upload/medialibrary/6c9/115-3.png)
Петлевые диуретики
Наиболее мощными и одними из наиболее часто применяемых из существующих сегодня мочегонных средств являются петлевые диуретики. Это препараты выбора во всех случаях, когда необходимо значительное увеличение диуреза. Данный класс препаратов используется как при хронических заболеваниях почек, так и при ХСН, в т. ч. декомпенсированной. Петлевые диуретики — единственная группа, применяющаяся при ХПН (СКФ < 40 мл/мин) [14, 15].
Петлевые диуретики могут стать причиной потери значительного количества ионов калия не только за счет блокады специфических транспортных систем, но и в связи с тем, что
эти препараты косвенно способствуют увеличению экскреции калия в дистальных канальцах. Кроме того, они снижают реабсорбцию ионов магния и кальция. Впрочем, гипокальциемия не развивается, т. к. ионы кальция активно реабсорбируются в дистальном извитом канальце. Что касается ионов магния, то при продолжительном применении петлевых салуретиков может развиться гипомагниемия [1, 2, 14, 15].
Большинство препаратов этой группы — сильные диуретики, активные как при приеме внутрь, так и при внутривенном введении.
Фуросемид — один из самых широко применяющихся петлевых диуретиков. Диуретический эффект наступает через 15–30 мин после приема; максимум действия — через 1–2 ч. Длительность действия составляет около
6 ч. Выводится почками (около 60% — в неизмененном виде). Принципиально важным правилом применения фуросемида является назначение утром натощак (не менее чем за 40 мин до еды). Следует помнить, что гипоальбуминемия, стойкое снижение СКФ и/или протеинурия обусловливают существенное уменьшение диуретического действия фуросемида, например, у пациентов с нефротическим синдромом и печеночно-клеточной недостаточностью.
При высокой протеинурии (большая часть пула белков, попадающих в первичную мочу, представлена именно альбумином) существенная часть фуросемида в связи с альбумином экскретируется с мочой, не взаимодействуя с апикальным полюсом эпителиоцитов толстого (восходящего) сегмента петли Генле и, следовательно, не оказывая диуретического действия [1, 2, 14, 15].
Способность фуросемида обусловливать значительное увеличение экскреции некоторых электролитов, например, магния, но особенно — калия, может в ряде случаев приводить к нарушениям сердечного ритма и другим сердечно-сосудистым осложнениям. Спровоцированная диуретиками гипокалиемия почти всегда определяет существенное ухудшение прогноза.
Способность большинства петлевых диуретиков увеличивать экскрецию калия далеко не всегда может быть рассмотрена как нежелательная составляющая их действия. У пациентов с ХПН (креатининемия > 2,0 мг/дл) назначение малых доз фуросемида одновременно с ингибиторами АПФ или БРА способствует уменьшению риска гиперкалиемии и тем самым позволяет продолжить применение последних [11, 12, 14, 15].
Возможности применения торасемида в клинической практике
Торасемид в меньшей степени, чем фуросемид, вызывает гипокалиемию, при этом он проявляет большую активность, и его действие более продолжительно. Диуретический эффект развивается примерно через 1 ч после приема препарата внутрь, достигая максимума через 3–6 ч, длится от 8 до 10 ч. Снижает систолическое и диастолическое АД. В настоящее время опыт применения торасемида основан на результатах крупных контролируемых исследований [16–18]. Особенности фармакокинетики и фармакодинамики, обеспечивающие торасемиду некоторые преимущества в эффективности в сравнении с другими диуретиками, представлены в таблице 4.![Таблица 4. Особенности фармакокинетики и фармакодинамики торасемида [16–20] Таблица 4. Особенности фармакокинетики и фармакодинамики торасемида [16–20]](https://www.rmj.ru/upload/medialibrary/b78/115-4.png)
Дополнительным преимуществом торасемида является его способность блокировать рецепторы альдостерона, тем самым тормозя процессы ремоделирования миокарда, играющего одну из ведущих ролей в прогрессировании ХСН. М. Yamato et al. (2003) продемонстрировали достоверное увеличение концентрации альдостерона в сыворотке крови больных ХСН II–III функционального класса (ФК) (NYHA) под действием торасемида, но не фуросемида. Эти данные могут быть объяснены с позиций механизма отрицательной обратной связи, активирующегося в условиях блокады альдостероновых рецепторов торасемидом. Под действием торасемида было также отмечено достоверное уменьшение конечного диастолического диаметра левого желудочка (ЛЖ) и индекса массы миокарда ЛЖ. Способность торасемида предупреждать нарастание нарушений сократимости миокарда ЛЖ подтверждало также уменьшение плазменной концентрации мозгового натрийуретического пептида [17, 21].
Устранением так называемым геномных, профиброгенных эффектов альдостерона, по-видимому, могут быть обусловлены продемонстрированные в экспериментальных и клинических работах возможности альдостерона в устранении миокардиального фиброза. Под действием торасемида удалось наблюдать:
на экспериментальной модели аутоиммунного миокардита — уменьшение площади миокардиального фиброза, экспрессии профиброгенного моноцитарного хемоаттрактантного протеина типа 1 (МСР-1), коллагена III типа и альдостерон-синтазы в миокарде ЛЖ;
у больных ХСН II–IV ФК (NYHA) — уменьшение количества проколлагена типа I и коллагена типа I в миокарде.
Фуросемид указанных изменений не вызывал.
Таким образом, торасемид — первый петлевой диуретик, способный прямо тормозить ремоделирование миокарда за счет уменьшения выраженности его фиброза, достигаемого с помощью блокады рецепторов альдостерона и устранения геномных эффектов последнего. Названные свойства могут обусловливать дополнительное положительное влияние торасемида на прогноз у больных ХСН [17–22].
В постмаркетинговом нерандомизированном исследовании TORIC (TOrasemide In Congestive Heart Failure) сравнивали эффективность и безопасность торасемида (10 мг/сут) и фуросемида (40 мг/сут) или других диуретиков у 1377 больных с ХСН II–III ФК (NYHA). Торасемид по эффективности превосходил фуросемид и другие диуретики. Так, уменьшение ФК по NYHA было отмечено у 45,8 и 37,2% больных двух групп соответственно (р=0,00017). Кроме того, торасемид реже вызывал гипокалиемию, чем фуросемид и другие диуретики (12,9% и 17,9% соответственно, р=0,013) [23].
Положительное влияние торасемида на прогноз у больных ХСН подтверждалось более чем в 2 раза меньшей величиной смертности по сравнению с группой, получавшей фуросемид и другие диуретики. Меньшая смертность пациентов, получавших торасемид, может быть связана как с его способностью тормозить миокардиальный фиброз, так и с более низкой частотой гипокалиемии [23].
В отличие от фуросемида эффективность торасемида практически не меняется в зависимости от степени снижения СКФ, что позволяет применять его в меньших дозах. При ХПН торасемид [24–26]:
не менее эффективен, чем фуросемид, в увеличении диуреза, экскреции натрия и снижении повышенного АД;
биодоступность не меняется при хронической болезни почек III (СКФ 30–60 мл/мин) и IV (СКФ < 30 мл/мин) стадий;
обеспечивает стабильную экскрецию натрия и хлорид-иона;
обладает хорошей переносимостью;
у больных на программном гемодиализе обеспечивает увеличение остаточного диуреза.
Отсутствие риска кумуляции и связанных с ней нежелательных явлений предопределяет применение торасемида при острой почечной недостаточности, в т. ч. у тех пациентов, которым был выполнен острый гемодиализ. Продемонстрировано, что в сопоставлении с фуросемидом торасемид обеспечивает большее увеличение диуреза (сохраняется дозозависимость диуретического эффекта препарата) у пациентов с острой почечной недостаточностью, возникающей после хирургических вмешательств на сердце [27–31].
При отечно-асцитическом синдроме, обусловленном печеночно-клеточной недостаточностью у больных циррозом печени, торасемид:
превосходит фуросемид по диуретическому действию (в т. ч. у пациентов с формирующейся резистентностью к фуросемиду);
у пациентов, получающих спиронолактон, торасемид в меньшей степени, чем фуросемид, вызывает увеличение экскреции кальция, калия и магния.
По сравнению с фуросемидом торасемид характеризуется лучшей переносимостью. При приеме торасемида пациент испытывает меньше ограничений в повседневной деятельности, в т. ч. за счет снижения числа императивных позывов на мочеиспускание и числа мочеиспусканий. Данные свойства торасемида особенно важны для пациентов, находящихся на амбулаторном режиме [17–31].
Заключение
Таким образом, торасемид может рассматриваться как препарат выбора у тех больных с отечным синдромом, у которых стандартные схемы применения диуретиков трудно применимы или неэффективны. Определенные преимущества торасемида связывают также с отсутствием изменений его фармакокинетических параметров при гипоальбуминемии, протеинурии и ХПН. Способность торасемида стимулировать диурез характеризуется четкой дозозависимостью и не зависит от приема пищи и времени суток. Кроме того, применение торасемида не сопровождается столь выраженными, как при использовании фуросемида, расстройствами электролитного гомеостаза, прежде всего значительным увеличением экскреции калия, кальция и магния. Обладая свойствами антагониста альдостерона, торасемид может также препятствовать прогрессированию процессов фиброгенеза в миокарде и сосудистой стенке. Торасемид, очевидно, следует рассматривать как наиболее предпочтительный препарат для лечения большинства вариантов отечного синдрома, в т. ч. резистентного к стандартным вариантам диуретической терапии. А появление на отечественном рынке препарата Тригрим («Польфарма» АО, Польша), биоэквивалентного оригинальному торасемиду, сделает эту терапию экономически благоприятной для пациента.
Источник
