Дефект межжелудочковой перегородки при инфаркте

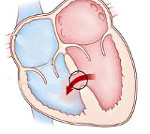
Дефект межжелудочковой перегородки – врожденная внутрисердечная аномалия, характеризующаяся наличием сообщения между правым и левым желудочками. Дефект межжелудочковой перегородки проявляется одышкой, отставанием в физическом развитии, быстрой утомляемостью, учащенным сердцебиением, наличием «сердечного горба». Инструментальная диагностика дефекта межжелудочковой перегородки включает проведение ЭКГ, ЭхоКГ, рентгенографии органов грудной клетки, вентрикулографии, аортографии, катетеризации камер сердца, МРТ. При дефектах межжелудочковой перегородки проводят радикальные (закрытие дефекта) и паллиативные (сужение легочной артерии) вмешательства.
Общие сведения
Дефект межжелудочковой перегородки (ДМЖП) – отверстие в перегородке, разделяющей полости левого и правого желудочка, наличие которого приводит к патологическому шунтированию крови. В кардиологии дефект межжелудочковой перегородки – наиболее часто встречающийся врожденный порок сердца (9–25% от всех ВПС). Частота критических состояний при дефекте межжелудочковой перегородки составляет около 21%. С одинаковой частотой порок обнаруживается у новорожденных мальчиков и девочек.
Дефект межжелудочковой перегородки может быть единственной внутрисердечной аномалией (изолированный ДМЖП) или входить в структуру сложных пороков (тетрады Фалло, общего артериального ствола, транспозиции магистральных сосудов, атрезии трехстворчатого клапана и др.). В ряде случаев межжелудочковая перегородка может отсутствовать полностью – такое состояние характеризуется как единственный желудочек сердца.
Дефект межжелудочковой перегородки
Причины дефекта межжелудочковой перегородки
Чаще всего дефект межжелудочковой перегородки является следствием нарушения эмбрионального развития и формируется у плода при нарушениях закладки органов. Поэтому дефекту межжелудочковой перегородки часто сопутствуют другие сердечные пороки: открытый артериальный проток (20%), дефект межпредсердной перегородки (20%), коарктация аорты (12%), стеноз устья аорты (5%), аортальная недостаточность (2,5—4,5%), недостаточность митрального клапана (2%), реже – аномальный дренаж легочных вен, стеноз легочной артерии и др.
В 25-50% случаев дефект межжелудочковой перегородки сочетается с пороками развития внесердечной локализации – болезнью Дауна, аномалиями развития почек, расщелиной твердого неба и заячьей губой.
Непосредственными факторами, вызывающими нарушение эмбриогенеза, выступают вредные воздействия на плод в I триместре гестации: заболевания беременной (вирусные инфекции, эндокринные нарушения), алкогольная и лекарственная интоксикации, ионизирующая радиация, патологическое течение беременности (выраженные токсикозы, угроза самопроизвольного прерывания беременности и пр.). Имеются данные о наследственной этиологии дефекта межжелудочковой перегородки. Приобретенные дефекты межжелудочковой перегородки могут являться осложнением инфаркта миокарда.
Особенности гемодинамики при дефекте межжелудочковой перегородки
Межжелудочковая перегородка образует внутренние стенки обоих желудочков и составляет примерно 1/3 площади каждого из них. Межжелудочковая перегородка представлена мембранозным и мышечным компонентами. В свою очередь, мышечный отдел состоит из 3-х частей – приточной, трабекулярной и отточной (инфундибулярной).
Межжелудочковая перегородка, наряду с другими стенками желудочков, принимает участие в сокращении и расслаблении сердца. У плода она полностью формируется к 4-5-ой неделе эмбрионального развития. Если этого по каким-либо причинам не происходит, в межжелудочковой перегородке остается дефект. Нарушения гемодинамики при дефекте межжелудочковой перегородки обусловлены сообщением левого желудочка с высоким давлением и правого желудочка с низким давлением (в норме в период систолы давление в левом желудочке в 4 – 5 раз выше, чем в правом).
После рождения и установления кровотока в большом и малом кругах кровообращения из-за дефекта межжелудочковой перегородки возникает лево-правый сброс крови, объем которого зависит от размеров отверстия. При небольшом объеме шунтируемой крови давление в правом желудочке и легочных артериях остается нормальным либо незначительно повышается. Однако при большом поступлении крови через дефект в малый круг кровообращения и ее возврате в левые отделы сердца, развивается объемная и систолическая перегрузка желудочков.
Значительное повышение давления в малом круге кровообращения при больших дефектах межжелудочковой перегородки способствует возникновению легочной гипертензии. Повышение легочно-сосудистого сопротивления взывает развитие сброса крови из правого желудочка в левый (обратного или перекрестного шунтирования), что приводит к артериальной гипоксемии (синдром Эйзенменгера).
Многолетняя практика кардиохиругов показывает, что наилучших результатов закрытия дефекта межжелудочковой перегородки можно добиться при сбросе крови слева направо. Поэтому при планировании операции тщательно учитываются гемодинамические параметры (давление, сопротивление и объем сброса).
Классификация дефекта межжелудочковой перегородки
Размер дефекта межжелудочковой перегородки оценивается, исходя из его абсолютной величины и сопоставления с диаметром аортального отверстия: маленький дефект составляет 1-3 мм (болезнь Толочинова–Роже), средний – равен примерно 1/2 диаметра аортального отверстия, большой – равен или превышает его диаметр.
С учетом анатомического расположения дефекта выделяют:
- перимембранозные дефекты межжелудочковой перегородки – 75% (приточные, трабекулярные, инфундибулярные) расположены в верхней части перегородки под аортальным клапаном, могут закрываться самопроизвольно;
- мышечные дефекты межжелудочковой перегородки – 10% (приточные, трабекулярные) – расположены в мышечном отделе перегородки, на значительном удалении от клапанной и проводящей систем;
- надгребневые дефекты межжелудочковой перегородки – 5% – расположены выше наджелудочкового гребня (мышечного пучка, отделяющего полость правого желудочка от его выносящего тракта), самопроизвольно не закрываются.
Симптомы дефекта межжелудочковой перегородки
Клинические проявления больших и малых изолированных дефектов межжелудочковой перегородки различны. Малые дефекты межжелудочковой перегородки (болезнь Толочинова—Роже) имеют диаметр менее 1 см и встречаются в 25-40% от числа всех ДМЖП. Проявляются нерезко выраженной утомляемостью и одышкой при нагрузке. Физическое развитие детей, как правило, не нарушено. Иногда у них определяется слабо выраженное куполообразное выпячивание грудной клетки в области сердца – «сердечный горб». Характерным клиническим признаком малых дефектов межжелудочковой перегородки служит аускультативно выявляемое наличие грубого систолического шума над областью сердца, который фиксируется уже на первой неделе жизни.
Большие дефекты межжелудочковой перегородки, имеющие размеры более 1/2 диаметра устья аорты или более 1 см, проявляются симптоматически уже в первые 3 месяца жизни новорожденных, приводя в 25-30% случаев к развитию критического состояния. При больших дефектах межжелудочковой перегородки отмечается гипотрофия, одышка при физической нагрузке или в покое, повышенная утомляемость. Характерны затруднения при кормлении: прерывистое сосание, частые отрывы от груди, одышка и бледность, потливость, пероральный цианоз. В анамнезе у большинства детей с дефектом межжелудочковой перегородки – частые респираторные инфекции, затяжные и рецидивирующие бронхиты и пневмонии.
В возрасте 3-4-лет, по мере нарастания сердечной недостаточности, у таких детей появляются жалобы на сердцебиение и боли в области сердца, склонность к носовым кровотечениям и обморокам. Транзиторный цианоз сменяется постоянным пероральным и акроцианозом; беспокоит постоянная одышка в покое, ортопноэ, кашель (синдром Эйзенменгера). На наличие хронической гипоксии указывают деформация фаланг пальцев и ногтей («барабанные палочки», «часовые стекла»).
При обследовании выявляется «сердечный горб», развитый в меньшей или большей степени; тахикардия, расширение границ сердечной тупости, грубый интенсивный пансистолический шум; гепатомегалия и спленомегалия. В нижних отделах легких выслушиваются застойные хрипы.
Диагностика дефекта межжелудочковой перегородки
К методам инструментальной диагностики дефекта межжелудочковой перегородки относятся ЭКГ, ФКГ, рентгенография грудной клетки, ЭхоКС, катетеризация камер сердца, ангиокардиография, вентрикулография.
Электрокардиограмма при дефекте межжелудочковой перегородки отражает перегрузку желудочков, наличие и степень выраженности легочной гипертензии. У взрослых больных могут регистрироваться аритмии (экстрасистолия, мерцание предсердий), нарушения проводимости (блокада правой ножки пучка Гиса, синдром WPW). Фонокардиография фиксирует высокочастотный систолический шум с максимумом в III-IV межреберье слева от грудины.
Эхокардиография позволяет выявить дефект межжелудочковой перегородки или заподозрить его по характерным нарушениям гемодинамики. Рентгенография органов грудной клетки при больших дефектах межжелудочковой перегородки обнаруживает усиление легочного рисунка, усиленную пульсацию корней легких, увеличение размеров сердца. Зондирование правых полостей сердца выявляет повышение давления в легочной артерии и правом желудочке, возможность проведения катетера в аорту, повышенную оксигенацию венозной крови в правом желудочке. Аортография проводится для исключения сопутствующих ВПС.
Дифференциальная диагностика дефекта межжелудочковой перегородки проводится с открытым атриовентрикулярным каналом, общим артериальным стволом, дефектом аортолегочной перегородки, изолированным стенозом легочной артерии, стенозом аорты, врожденной митральной недостаточностью, тромбоэмболией.
Лечение дефекта межжелудочковой перегородки
Асимптомное течение дефекта межелудочковой перегородки при его небольших размерах позволяет воздержаться от хирургического вмешательства и осуществлять динамическое наблюдение за ребенком. В ряде случаев возможно спонтанное закрытие дефекта межжелудочковой перегородки к 1-4 годам жизни или в более позднем возрасте. В остальных случаях показано хирургическое закрытие дефекта межжелудочковой перегородки, как правило, после достижения ребенком 3-х лет.
При развитии сердечной недостаточности и легочной гипертензии проводится консервативное лечение с помощью сердечных гликозидов, мочегонных препаратов, ингибиторов ангиотензинпревращающего фермента, кардиотрофиков, антиоксидантов.
Кардиохирургическое лечение дефекта межжелудочковой перегородки может быть радикальным и паллиативным. К радикальным операциям относятся ушивание малых дефектов межжелудочковой перегородки П-образными швами; пластика больших дефектов синтетической (тефлон, дакрон и др.) заплатой или биологической (консервированный ксеноперикард, аутоперикард) тканью; рентгенэндоваскулярная окклюзия дефекта межжелудочковой перегородки.
У грудных детей с выраженной гипотрофией, большим лево-правым шунтированием крови и множественными дефектами предпочтение отдается паллиативной операции, направленной на создание искусственного стеноза легочной артерии с помощью манжетки. Данный этап позволяет подготовить ребенка к радикальной операции по устранению дефекта межжелудочковой перегородки в более старшем возрасте.
Течение беременности при дефекте межжелудочковой перегородки
Женщины с небольшим дефектом межжелудочковой перегородки, как правило, в состоянии нормально выносить и родить ребенка. Однако, при больших размерах дефекта, аритмии, сердечной недостаточности или легочной гипертензии риск осложнений во время беременности значительно повышается. Наличие синдрома Эйзенменгера является показанием для искусственного прерывания беременности. У женщин с дефектом межжелудочковой перегородки имеется повышенная вероятность рождения ребенка с аналогичным или другим врожденным пороком сердца.
Перед планированием беременности пациентке с пороком сердца (оперированным или нет) необходимо проконсультироваться с акушером-гинекологом, кардиологом, генетиком. Ведение беременности у категории женщин с дефектом межжелудочковой перегородки требует повышенного внимания.
Прогноз при дефекте межжелудочковой перегородки
Естественное течение дефекта межжелудочковой перегородки в целом не позволяет надеяться на благоприятный прогноз. Продолжительность жизни при данном пороке зависит от величины дефекта и составляет в среднем около 25 лет. При больших и средних дефектах 50-80% детей умирают в возрасте до 6 мес. или 1 года от сердечной недостаточности, застойной пневмонии, бактериального эндокардита, нарушений ритма сердца, тромбоэмболических осложнений.
В редких случаях ДМЖП не оказывает существенного влияния на продолжительность и качество жизни. Спонтанное закрытие дефекта межжелудочковой перегородки наблюдается в 25-40% случаев, преимущественно при его малом размере. Однако даже в этом случае больные должны находиться под наблюдением кардиолога в связи с возможными осложнениями со стороны проводящей системы сердца и высоким риском возникновения инфекционного эндокардита.
Источник
Январь 23, 2019
Нет комментариев
Разрыв межжелудочковой перегородки (МЖП) является редким, но летальным осложнением инфаркта миокарда (ИМ). Событие наступает через 2-8 дней после инфаркта и часто провоцирует кардиогенный шок. Дифференциальный диагноз постинфарктного кардиогенного шока должен исключать свободный разрыв стенки желудочка и разрыв папиллярных мышц.

Чтобы избежать высокой заболеваемости и смертности, связанных с этим расстройством, пациенты должны проходить экстренное хирургическое лечение. В современной медицинской практике постинфарктный разрыв МЖП признана неотложной хирургической помощью, а наличие кардиогенного шока является показанием к вмешательству. Долгосрочная выживаемость может быть достигнута у пациентов, которые подвергаются оперативной хирургии. Может потребоваться сопутствующее шунтирование коронарной артерии (АКШ). Использование дополнительного АКШ позволяет улучшить долгосрочную выживаемость.
Операция выполняется с помощью трансинфарктного подхода, а вся реконструкция выполняется с использованием протезов, чтобы избежать напряжения. Достижения в области защиты миокарда и улучшенные материалы для протезирования внесли значительный вклад в успешное лечение разрыва МЖП. Улучшенные хирургические методы (например, инфарктэктомия) и лучшая периоперационная механическая и фармакологическая поддержка помогли снизить смертность. Кроме того, разработка хирургических методов для восстановления перфораций в различных областях перегородки привела к улучшению результатов.
В современной практике пациенты, подвергающиеся восстановлению шунта, как правило, старше и с большей вероятностью получали тромболитические средства, которые могут осложнить восстановление. После успешного восстановления выживаемость и качество жизни превосходны даже у пациентов старше 70 лет.
Патофизиология
Септальное кровоснабжение происходит из ветвей левой передней нисходящей коронарной артерии, задней нисходящей ветви правой коронарной артерии или периферической артерии, когда она является доминирующей. Инфаркт, связанный с разрывом МЖП, обычно трансмуральный и обширный. Около 60% случаев возникают при инфаркте передней стенки, 40% при инфаркте задней или нижней стенки. Задний разрыв МЖП может сопровождаться недостаточностью митрального клапана, вторичной к инфаркту или дисфункции папиллярной мышцы.
При вскрытии у больных с разрывом МЖП обычно наблюдается полная окклюзия коронарной артерии с небольшим или отсутствующим коллатеральным течением. Отсутствие коллатерального кровотока может быть вторичным по отношению к сопутствующим заболеваниям артерий, анатомическим аномалиям или отекам миокарда. Иногда возникают множественные перфорации перегородки. Это может произойти одновременно или в течение нескольких дней друг от друга.
Желудочковые аневризмы обычно связаны с разрывом межжелудочковой перегородки после инфаркта и вносят значительный вклад в нарушение гемодинамики у этих пациентов. Сообщаемая частота аневризм желудочков колеблется от 35% до 68%, тогда как частота только желудочковых аневризм после ИМ без разрыва МЖП значительно ниже (12,4%).
На естественный анамнез постинфарктного разрыва МЖП большое влияние оказывают гипертония , антикоагулянтная терапия, пожилой возраст и, возможно, тромболитическая терапия. Естественное течение у пациентов с разрывом межжелудочковой перегородки после инфаркта хорошо документировано и кратко. Большинство пациентов умирают в течение первой недели, и почти 90% умирают в течение первого года; В некоторых отчетах указывается, что менее 1% пациентов живы через 1 год.
Этот мрачный прогноз является следствием острой объемной перегрузки, вызванной обоими желудочками сердца, уже пораженного большим инфарктом миокарда и иногда обширным заболеванием коронарной артерии (ИБС) в местах, отличных от уже инфарктированных. Кроме того, может присутствовать наложенная ишемическая регургитация митрального клапана, желудочковая аневризма или комбинация этих состояний, что еще больше ухудшает работу сердца. Подавленная функция левого желудочка, как правило, приводит к нарушению перфузии периферических органов и смерти у большинства пациентов.
Несколько спорадических сообщений указывают на то, что некоторые лица с постинфарктным разрывом МЖП, получавшим медицинское лечение, живут в течение нескольких лет. Несмотря на то, что в нехирургическом лечении этих пациентов были достигнуты многие медицинские достижения, включая внутриаортальную баллонную контрпульсацию, данные методы не устранили необходимость в проведении хирургического вмешательства.
Разрыв межжелудочковой перегородки является редким осложнением инфаркта миокарда. Хотя исследования вскрытия показывают 11% случаев разрыва стенки миокарда после инфаркта миокарда, перфорация стенки перегородки встречается гораздо реже, встречаясь с частотой приблизительно 1-2%.
Диагностика
Рентгенография
По данным рентгенографии грудной клетки, 82% пациентов с разрывом межжелудочковой перегородки после инфаркта наблюдается увеличение левого желудочка, 78% имеют отек легких и 64% имеют плевральный выпот. Указанные данные неспецифичны и не исключают других причин, таких как разрыв папиллярной мышцы.
Трансторакальная эхокардиография в М-режиме и чреспищеводная эхокардиография также используются для диагностики постинфарктного разрыва МЖП. Результаты Эхо-КГ были улучшены с использованием цветных доплеровских методов визуализации. Помимо этого, эхокардиография позволяет изучить наличие любой патологии митрального клапана.
Электрокардиография
Никакие электрокардиографические (ЭКГ) признаки не могут служить диагностическими критериями для постинфарктного разрыва МЖП, хотя ЭКГ действительно может дать некоторую полезную информацию. Постоянное повышение сегмента ST, связанное с желудочковой аневризмой, является распространенным явлением. ЭКГ может выявить атриовентрикулярную блокаду у одной трети больных. ЭКГ также можно выполнять для прогнозирования анатомического расположения разрыва перегородки.
Катетеризация и измерение давления
Катетеризация левого сердца с коронарной ангиографией рекомендуется проводить для всех стабильных пациентов. Данная процедура отнимает много времени и имеет некоторую степень осложнений; соответственно, при назначении этого метода диагностики требуется здравый смысл.
Важным диагностическим тестом для дифференциации разрыва МЖП от недостаточности митрального клапана является катетеризация правого сердца с помощью катетера. При наличии разрыва межжелудочковой перегородки концентрация кислорода между правым предсердием и легочной артерией повышается. Помимо этого, отслеживание давления легочного капиллярного клина полезно для дифференциации острой митральной регургитации в результате разрыва МЖП.
Измерения давления слева и справа помогают исследовать степень бивентрикулярной недостаточности и полезны для мониторинга реакции на периоперационную терапию. В то время как правосторонняя недостаточность чаще встречается у больных с разрывом МЖП после инфаркта, левосторонняя недостаточность и рефрактерный отек легких более выражены у больных с разрывом папиллярной мышцы. Однако одна треть пациентов с постинфарктным разрывом МЖП также имеет некоторую степень МР, вторичную по отношению к дисфункции левого желудочка. Лишь в редких случаях разрыв МЖП также ассоциируется с разрывом папиллярной мышцы.
Лечение
Фармакологическая терапия
Начать фармакологическую терапию в попытке обеспечить гемодинамическую стабильность больного. Задача состоит в том, чтобы уменьшить постнагрузку на сердце и увеличить сердечный выброс вперед.
Вазодилататоры можно использовать для уменьшения шунтирования крови слева направо, связанного с механическим дефектом, и, следовательно, для увеличения сердечного выброса. Введение нитроглицерина внутривенно может быть использовано в качестве вазодилататора и может обеспечить улучшение кровотока миокарда у лиц с тяжелой ишемической болезнью сердца.
При отдельном применении, инотропные агенты могут увеличить сердечный выброс; однако, без изменений в соотношении легочного и системного кровотока (отношение Qp-к-Qs), они заметно увеличивают работу левого желудочка и потребление кислорода миокардом. Глубокий уровень кардиогенного шока у некоторых больных препятствует лечению вазодилататорами, что часто требует поддержки вазопрессоров.
Вазопрессоры заметно повышают работу левого желудочка и потребление кислорода миокардом. Кроме того, они увеличивают системную постнагрузку и дополнительно увеличивают отношение Qp к Qs, тем самым понижая сердечный выброс и значительно увеличивая потребление кислорода миокардом.
Внутриаортальная баллонная контрпульсация обеспечивает наиболее важные средства временной гемодинамической поддержки. Внутриаортальная баллонная контрпульсация уменьшает постнагрузку левого желудочка, таким образом увеличивая системный сердечный выброс и уменьшая отношение легочного и системного кровотока.
Хирургическая терапия
Показания и противопоказания
Ввиду плохого прогноза для больных, получающих медицинское лечение, диагноз постинфарктного разрыва межжелудочковой перегородки сам по себе является показанием для назначения операции. В настоящее время большинство хирургов согласны с тем, что ранняя операция эффективна для минимизации риска смертности и заболеваемости. Успех хирургического лечения зависит от быстрой медицинской стабилизации пациента и профилактики кардиогенного шока.
Установлена относительная безопасность ремонта через 2-3 недели и более после перфорации. Поскольку края дефекта стали более прочными и фиброзными, ремонт становится более безопасным и легко осуществимым. Успешный клинический результат связан с адекватностью закрытия МЖП; поэтому, если возможно, ищите множественные дефекты как до операции, так и во время операции.
Первоначально отсрочить восстановление следует только тогда, когда больной находится в гемодинамически стабильном состоянии, но должна быть высокая степень уверенности в том, что больной действительно стабилен. У таких больных может внезапно ухудшиться состояние и произойти летальный исход. Критерии задержки хирургического лечения включают в себя следующее:
Адекватный сердечный выброс
Нет признаков кардиогенного шока
Отсутствие признаков и симптомов застойной сердечной недостаточности (ЗСН) или минимальное использование прессорных агентов для контроля начальных симптомов
Отсутствие задержки жидкости
Хорошая почечная функция
Естественная история болезни такова, что немногие пациенты присутствуют с этими признаками и симптомами. У большинства больных разрыв межжелудочковой перегородки после инфаркта быстро приводит к ухудшению гемодинамического состояния, с кардиогенным шоком, выраженными и трудноизлечимыми симптомами ХСН и задержкой жидкости. Срочная операция обычно необходима. Высокий хирургический риск раннего восстановления принят из-за еще более высокого риска смерти без операции при таких обстоятельствах.
В отдельных случаях происходит задержка в постановке диагноза и назначении оперативного вмешательства. Хотя большинство пациентов с постинфарктным разрывом МЖП нуждаются в неотложной хирургии, случайный пациент из-за задержки в постановке диагноза или направления может находиться в состоянии полиорганной недостаточности и не может быть кандидатом на операцию. Шансы такого больного пережить операцию минимальны; в этих обстоятельствах поддерживающая медицинская терапия может быть адекватной. Больные, которые находятся в коме и имеют кардиогенный шок, имеют особенно плохой прогноз после операции, и хирургию лучше избегать в таких обстоятельствах.
Прогноз
Оперативная смертность напрямую связана с интервалом между ИМ и хирургическим вмешательством. В ретроспективном клиническом анализе 41 пациента, получавшего лечение постинфарктного дефекта межжелудочковой перегородки, подтвердили, что в то время как женский пол, пожилой возраст, артериальная гипертензия, острый инфаркт миокарда передней стенки, отсутствие предшествующего острого инфаркта миокарда и позднее прибытие в больницу были связанный с более высоким риском смертности от острого разрыва МЖП, время от возникновения острого инфаркта миокарда до операции было наиболее важным фактором, определяющим оперативную смертность и внутрибольничную выживаемость.
Если восстановление разрыва межжелудочковой перегородки после инфаркта выполняется через 3 недели или более после инфаркта, смертность составляет приблизительно 20%; если оно выполнено до этого времени, смертность приближается к 50%. Наиболее очевидная причина этого заключается в том, что чем выше степень повреждения миокарда и нарушения гемодинамики, тем острее необходимость в раннем хирургическом вмешательстве.
При использовании раннего оперативного подхода большинство исследований показывают общую смертность менее 25%. Смертность, как правило, ниже у больных с разрывом МЖП, расположенными спереди, и наименьшая у пациентов с апикальными разрывами МЖП. Для передних дефектов смертность колеблется от 10% до 15%; для задних дефектов смертность колеблется от 30% до 35%.
Загрузка…
Источник
