Апоптоз и инфаркт миокарда

Инфаркт миокарда – очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Клинически проявляется жгущими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Развившийся инфаркт миокарда служит показанием к экстренной госпитализации в кардиологическую реанимацию. При неоказании своевременной помощи возможен летальный исход.
Общие сведения
Инфаркт миокарда – очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Клинически проявляется жгущими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Развившийся инфаркт миокарда служит показанием к экстренной госпитализации в кардиологическую реанимацию. При неоказании своевременной помощи возможен летальный исход.
В возрасте 40-60 лет инфаркт миокарда в 3–5 раз чаще наблюдается у мужчин в связи с более ранним (на 10 лет раньше, чем у женщин) развитием атеросклероза. После 55-60 лет заболеваемость среди лиц обоего пола приблизительно одинакова. Показатель летальности при инфаркте миокарда составляет 30—35%. Статистически 15—20% внезапных смертей обусловлены инфарктом миокарда.
Нарушение кровоснабжения миокарда на 15-20 и более минут приводит к развитию необратимых изменений в сердечной мышце и расстройству сердечной деятельности. Острая ишемия вызывает гибель части функциональных мышечных клеток (некроз) и последующее их замещение волокнами соединительной ткани, т. е. формирование постинфарктного рубца.
В клиническом течении инфаркта миокарда выделяют пять периодов:
- 1 период – предынфарктный (продромальный): учащение и усиление приступов стенокардии, может продолжаться несколько часов, суток, недель;
- 2 период – острейший: от развития ишемии до появления некроза миокарда, продолжается от 20 минут до 2 часов;
- 3 период – острый: от образования некроза до миомаляции (ферментативного расплавления некротизированной мышечной ткани), длительность от 2 до 14 суток;
- 4 период – подострый: начальные процессы организации рубца, развитие грануляционной ткани на месте некротической, продолжительность 4-8 недель;
- 5 период – постинфарктный: созревание рубца, адаптация миокарда к новым условиям функционирования.
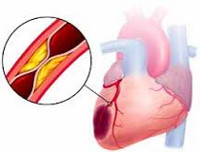
Инфаркт миокарда
Причины инфаркта миокарда
Инфаркт миокарда является острой формой ИБС. В 97—98% случаев основой для развития инфаркта миокарда служит атеросклеротическое поражение венечных артерий, вызывающее сужение их просвета. Нередко к атеросклерозу артерий присоединяется острый тромбоз пораженного участка сосуда, вызывающий полное или частичное прекращение кровоснабжения соответствующей области сердечной мышцы. Тромбообразованию способствует повышенная вязкость крови, наблюдаемая у пациентов с ИБС. В ряде случаев инфаркт миокарда возникает на фоне спазма ветвей венечных артерий.
Развитию инфаркта миокарда способствуют сахарный диабет, гипертоничесая болезнь, ожирение, нервно-психическое напряжение, увлечение алкоголем, курение. Резкое физическое или эмоциональное напряжение на фоне ИБС и стенокардии может спровоцировать развитие инфаркта миокарда. Чаще развивается инфаркт миокарда левого желудочка.
Классификация инфаркта миокарда
В соответствии с размерами очагового поражения сердечной мышцы выделяют инфаркт миокарда:
- крупноочаговый
- мелкоочаговый
На долю мелкоочаговых инфарктов миокарда приходится около 20% клинических случаев, однако нередко мелкие очаги некроза в сердечной мышце могут трансформироваться в крупноочаговый инфаркт миокарда (у 30% пациентов). В отличие от крупноочаговых, при мелкоочаговых инфарктах не возникают аневризма и разрыв сердца, течение последних реже осложняется сердечной недостаточностью, фибрилляцией желудочков, тромбоэмболией.
В зависимости от глубины некротического поражения сердечной мышцы выделяют инфаркт миокарда:
- трансмуральный – с некрозом всей толщи мышечной стенки сердца (чаще крупноочаговый)
- интрамуральный – с некрозом в толще миокарда
- субэндокардиальный – с некрозом миокарда в зоне прилегания к эндокарду
- субэпикардиальный – с некрозом миокарда в зоне прилегания к эпикарду
По изменениям, фиксируемым на ЭКГ, различают:
- «Q-инфаркт» – с формированием патологического зубца Q, иногда желудочкового комплекса QS (чаще крупноочаговый трансмуральный инфаркт миокарда)
- «не Q-инфаркт» – не сопровождается появлением зубца Q, проявляется отрицательными Т-зубцами (чаще мелкоочаговый инфаркт миокарда)
По топографии и в зависимости от поражения определенных ветвей коронарных артерий инфаркт миокарда делится на:
- правожелудочковый
- левожелудочковый: передней, боковой и задней стенок, межжелудочковой перегородки
По кратности возникновения различают инфаркт миокарда:
- первичный
- рецидивирующий (развивается в срок 8 недель после первичного)
- повторный (развивается спустя 8 недель после предыдущего)
По развитию осложнений инфаркт миокарда подразделяется на:
- осложненный
- неосложненный
По наличию и локализации болевого синдрома выделяют формы инфаркта миокарда:
- типичную – с локализацией боли за грудиной или в прекардиальной области
- атипичные – с атипичными болевыми проявлениями:
- периферические: леволопаточная, леворучная, гортанно-глоточная, нижнечелюстная, верхнепозвоночная, гастралгическая (абдоминальная)
- безболевые: коллаптоидная, астматическая, отечная, аритмическая, церебральная
- малосимптомную (стертую)
- комбинированную
В соответствии с периодом и динамикой развития инфаркта миокарда выделяют:
- стадию ишемии (острейший период)
- стадию некроза (острый период)
- стадию организации (подострый период)
- стадию рубцевания (постинфарктный период)
Симптомы инфаркта миокарда
Предынфарктный (продромальный) период
Около 43% пациентов отмечают внезапное развитие инфаркта миокарда, у большей же части больных наблюдается различный по продолжительности период нестабильной прогрессирующей стенокардии.
Острейший период
Типичные случаи инфаркта миокарда характеризуются чрезвычайно интенсивным болевым синдромом с локализацией болей в грудной клетке и иррадиацией в левое плечо, шею, зубы, ухо, ключицу, нижнюю челюсть, межлопаточную зону. Характер болей может быть сжимающим, распирающим, жгучим, давящим, острым («кинжальным»). Чем больше зона поражения миокарда, тем более выражена боль.
Болевой приступ протекает волнообразно (то усиливаясь, то ослабевая), продолжается от 30 минут до нескольких часов, а иногда и суток, не купируется повторным приемом нитроглицерина. Боль сопряжена с резкой слабостью, возбуждением, чувством страха, одышкой.
Возможно атипичное течение острейшего периода инфаркта миокарда.
У пациентов отмечается резкая бледность кожных покровов, липкий холодный пот, акроцианоз, беспокойство. Артериальное давление в период приступа повышено, затем умеренно или резко снижается по сравнению с исходным (систолическое < 80 рт. ст., пульсовое < 30 мм мм рт. ст.), отмечается тахикардия, аритмия.
В этот период может развиться острая левожелудочковая недостаточность (сердечная астма, отек легких).
Острый период
В остром периоде инфаркта миокарда болевой синдром, как правило, исчезает. Сохранение болей бывает вызвано выраженной степенью ишемии околоинфарктной зоны или присоединением перикардита.
В результате процессов некроза, миомаляции и перифокального воспаления развивается лихорадка (от 3-5 до 10 и более дней). Длительность и высота подъема температуры при лихорадке зависят от площади некроза. Артериальная гипотензия и признаки сердечной недостаточности сохраняются и нарастают.
Подострый период
Болевые ощущения отсутствуют, состояние пациента улучшается, нормализуется температура тела. Симптомы острой сердечной недостаточности становятся менее выраженными. Исчезает тахикардия, систолический шум.
Постинфарктный период
В постинфарктном периоде клинические проявления отсутствуют, лабораторные и физикальные данные практически без отклонений.
Атипичные формы инфаркта миокарда
Иногда встречается атипичное течение инфаркта миокарда с локализацией болей в нетипичных местах (в области горла, пальцах левой руки, в зоне левой лопатки или шейно-грудного отдела позвоночника, в эпигастрии, в нижней челюсти) или безболевые формы, ведущими симптомами которых могут быть кашель и тяжелое удушье, коллапс, отеки, аритмии, головокружение и помрачение сознания.
Атипичные формы инфаркта миокарда чаще встречаются у пожилых пациентов с выраженными признаками кардиосклероза, недостаточностью кровообращения, на фоне повторного инфаркта миокарда.
Однако атипично протекает обычно только острейший период, дальнейшее развитие инфаркта миокарда становится типичным.
Стертое течение инфаркта миокарда бывает безболевым и случайно обнаруживается на ЭКГ.
Осложнения
Нередко осложнения возникают уже в первые часы и дни инфаркта миокарда, утяжеляя его течение. У большинства пациентов в первые трое суток наблюдаются различные виды аритмий: экстрасистолия, синусовая или пароксизмальная тахикардия, мерцательная аритмия, полная внутрижелудочковая блокада. Наиболее опасно мерцание желудочков, которое может перейти в фибрилляцию и привести к гибели пациента.
Левожелудочковая сердечная недостаточность характеризуется застойными хрипами, явлениями сердечной астмы, отека легких и нередко развивается в острейший период инфаркта миокарда. Крайне тяжелой степенью левожелудочковой недостаточности является кардиогенный шок, развивающийся при обширном инфаркте и обычно приводящий к летальному исходу. Признаками кардиогенного шока служит падение систолического АД ниже 80 мм рт. ст., нарушение сознания, тахикардия, цианоз, уменьшение диуреза.
Разрыв мышечных волокон в зоне некроза может вызывать тампонаду сердца – кровоизлияние в полость перикарда. У 2-3% пациентов инфаркт миокарда осложняется тромбоэмболиями системы легочной артерии (могут стать причиной инфаркта легких или внезапной смерти) или большого круга кровообращения.
Пациенты с обширным трансмуральным инфарктом миокарда в первые 10 суток могут погибнуть от разрыва желудочка вследствие острого прекращения кровообращения. При обширном инфаркте миокарда может возникать несостоятельность рубцовой ткани, ее выбухание с развитием острой аневризмы сердца. Острая аневризма может трансформироваться в хроническую, приводящую к сердечной недостаточности.
Отложение фибрина на стенках эндокарда приводит к развитию пристеночного тромбоэндокардита, опасного возможностью эмболии сосудов легких, мозга, почек оторвавшимися тромботическими массами. В более позднем периоде может развиться постинфарктный синдром, проявляющийся перикардитом, плевритом, артралгиями, эозинофилией.
Диагностика инфаркта миокарда
Среди диагностических критериев инфаркта миокарда важнейшими являются анамнез заболевания, характерные изменения на ЭКГ, показатели активности ферментов сыворотки крови. Жалобы пациента при инфаркте миокарда зависят от формы (типичной или атипичной) заболевания и обширности поражение сердечной мышца. Инфаркт миокарда следует заподозрить при тяжелом и продолжительном (дольше 30-60 минут) приступе загрудинных болей, нарушении проводимости и ритма сердца, острой сердечной недостаточности.
К характерным изменениям ЭКГ относятся формирование отрицательного зубца Т (при мелкоочаговом субэндокардиальном или интрамуральном инфаркте миокарда), патологического комплекса QRS или зубца Q (при крупноочаговом трансмуральном инфаркте миокарда). При ЭхоКГ выявляется нарушение локально сократимости желудочка, истончение его стенки.
В первые 4-6 часов после болевого приступа в крови определяется повышение миоглобина – белка, осуществляющего транспорт кислорода внутрь клеток.Повышение активности креатинфосфокиназы (КФК) в крови более чем на 50% наблюдается спустя 8—10 ч от развития инфаркта миокарда и снижается до нормы через двое суток. Определение уровня КФК проводят через каждые 6-8 часов. Инфаркт миокарда исключается при трех отрицательных результатах.
Для диагностики инфаркта миокарда на более поздних сроках прибегают к определению фермента лактатдегидрогеназы (ЛДГ), активность которой повышается позже КФК – спустя 1-2 суток после формирования некроза и приходит к нормальным значениям через 7-14 дней. Высокоспецифичным для инфаркта миокарда является повышение изоформ миокардиального сократительного белка тропонина – тропонина-Т и тропонина-1, увеличивающихся также при нестабильной стенокардии. В крови определяется увеличение СОЭ, лейкоцитов, активности аспартатаминотрансферазы (АсАт) и аланинаминотрансферазы (АлАт).
Коронарная ангиография (коронарография) позволяет установить тромботическую окклюзию коронарной артерии и снижение желудочковой сократимости, а также оценить возможности проведения аортокоронарного шунтирования или ангиопластики – операций, способствующих восстановлению кровотока в сердце.
Лечение инфаркта миокарда
При инфаркте миокарда показана экстренная госпитализация в кардиологическую реанимацию. В остром периоде пациенту предписывается постельный режим и психический покой, дробное, ограниченное по объему и калорийности питание. В подостром периоде больной переводится из реанимации в отделение кардиологии, где продолжается лечение инфаркта миокарда и осуществляется постепенное расширение режима.
Купирование болевого синдрома проводится сочетанием наркотических анальгетиков (фентанила) с нейролептиками (дроперидолом), внутривенным введением нитроглицерина.
Терапия при инфаркте миокарда направлена на предупреждение и устранение аритмий, сердечной недостаточности, кардиогенного шока. Назначают антиаритмические средства (лидокаин), ß-адреноблокаторы (атенолол), тромболитики (гепарин, ацетилсалициловая к-та), антогонисты Са (верапамил), магнезию, нитраты, спазмолитики и т. д.
В первые 24 часа после развития инфаркта миокарда можно произвести восстановление перфузии путем тромболизиса или экстренной баллонной коронарной ангиопластики.
Прогноз при инфаркте миокарда
Инфаркт миокарда является тяжелым, сопряженным с опасными осложнениями заболеванием. Большая часть летальных исходов развивается в первые сутки после инфаркта миокарда. Насосная способность сердца связана с локализацией и объемом зоны инфаркта. При повреждении более 50% миокарда, как правило, сердце функционировать не может, что вызывает кардиогенный шок и гибель пациента. Даже при менее обширном повреждении сердце не всегда справляется нагрузками, в результате чего развивается сердечная недостаточность.
По истечении острого периода прогноз на выздоровление хороший. Неблагоприятные перспективы у пациентов с осложненным течением инфаркта миокарда.
Профилактика инфаркта миокарда
Необходимыми условиями профилактики инфаркта миокарда являются ведение здорового и активного образа жизни, отказ от алкоголя и курения, сбалансированное питание, исключение физического и нервного перенапряжения, контроль АД и уровня холестерина крови.
Источник
Завершающим этапом повреждений тканей организма является их гибель. Однако сами повреждения связаны не только с патологическими процессами, возникающими в организме, но и со старением функционирующих биологических структур. Вместе с тем механизмы гибели клеток и тканей в условиях нормы и в условиях патологии значительно отличаются друг от друга и имеют разное морфологическое выражение.
АПОПТОЗ
Апоптоз — физиологическая гибель клеток в живом организме.
Общая характеристика.
Все ткани организма имеют свой срок жизни, после истечения которого и прекращения функции они должны погибнуть и на их месте появляются новые, аналогичные погибшим, клетки и ткани. Сроки жизни у разных живых структур различны. Они определены в их геноме, т. е. генетически запрограммированы. Поэтому апоптоз является генетически запрограммированной гибелью клеток. Это важнейший физиологический процесс, позволяющий организму постоянно сохранять функции своих структур на определенном уровне. Кроме того, в процессе образования новых клеток и внеклеточных структур возникают генетические ошибки, происходят мутации и появляются клетки, отличающиеся от клеток организма. Они должны быть немедленно уничтожены, и их гибель также осуществляется с помощью апоптоза, который является и механизмом генетического контроля синтеза веществ и клеток организма. Таким образом, апоптоз как физиологический процесс протекает непрерывно на протяжении всей жизни человека, и биологический смысл его заключается в поддержании постоянства клеток и тканей организма, т. е. тканевого гомеостаза. С помощью апоптоза происходит инволюция органов и тканей после завершения ими своих физиологических функций, например атрофия вилочковой железы после окончания формирования иммунной системы, атрофия половой системы женщин после завершения детородной функции, атрофия органов и тканей при старении человека и др.
Вместе стем апоптоз может развиваться и в условиях патологии — в тех случаях, когда повреждающие факторы действуют на гены, контролирующие включение программы апоптоза. Обычно это происходит с помощью определенных веществ — цитокинов, различных факторов роста, гормонов, активизирующихся при заболеваниях и функционирующих на молекулярном уровне. Эту особенность апоптоза нередко пытаются использовать в клинике. Например, в онкологии постоянно идет поиск возможностей стимулировать апоптоз в злокачественных опухолях с тем, чтобы активизировать распад опухолевых клеток, и это весьма перспективный путь онкотерапии.
Морфология апоптоза.
Апоптоз развивается в отдельных клетках, которые вначале теряют контакты с соседними клетками, затем уменьшаются в размерах, в их ядрах конденсируется хроматин. ядра становятся изрезанными, плотными и фрагментируются на отдельные глыбки. Одновременно происходит распад цитоплазмы, в которой сохраняются в конденсированной форме внутриклеточные структуры. В результате клетка распадается на апоптозные тельца, каждое из которых окружено мембраной. Апоптозные тельца очень быстро поглощаются окружающими клетками, иногда макрофагами. Однако в ответ на апоптоз никогда не развивается воспалительная реакция и на месте погибших клеток воспроизводятся клетки той же ткани. Следует подчеркнуть, что апоптозу подвергаются лишь клетки, но не ткани в целом.
НЕКРОЗ
Некроз — гибель клеток и тканей в результате патологических воздействий.
Причины некроза разнообразны, однако их можно объединить в пять групп:
- травматический некроз, который является результатом прямого действия на ткань физических или химических факторов (механических, температурных, радиационных, кислот, щелочей и др.);
- токсический некроз развивается при действии на ткани токсических факторов бактериальной или иной природы;
- трофоневротический некроз, который связан с нарушениями иннервации тканей при заболеваниях центральной или периферической нервной системы;
- аллергический некроз — следствие иммунных реакций немедленной или замедленной гиперчувствительности;
- сосудистый некроз, обусловленный прекращением циркуляции крови в артериях, реже — в венах.
По консистенции мертвых масс некроз может быть коагуляционным, казеозным и колликвационным.
Коагуляционный (плотный) некроз возникает при коагуляции распавшегося белка, обычно в мышечных тканях и в большинстве внутренних органов.
Разновидностью коагуляционного некроза является казеозный (творожистый) некроз, массы которого имеют замазкообразную консистенцию; развивается при некоторых видах воспаления.
Колликвационный некроз развивается в тканях, богатых жидкостью, например в головном мозге.
По механизму действия фактора, вызвавшего некроз, выделяют:
- прямой некроз, который возникает при непосредственном действии на ткань причины, вызывающей ее гибель, — травма, токсины, высокая или низкая температура и т. п.;
- непрямой некроз, когда причина гибели ткани связана с нарушениями функций сосудов, нервов или с аллергическими реакциями.
Некрозу предшествует период умирания, он никогда не возникает мгновенно. Период умирания может быть длительным или быстрым. В этот период в клетках и во внеклеточном матриксе развиваются изменения, представляющие собой тот или иной вид дистрофии, чаще белковый. Эти изменения называются некробиозом, или парабиозом. Функции клеток и органов при этом ослабевают и прекращаются, но на начальных этапах процесса они могут восстановиться, если ликвидирована причина, вызвавшая некробиоз. Если же причина продолжает действовать, дистрофия становится необратимой, некробиоз переходит в некроз и какие-либо функции прекращаются. Некротизированные ткани под действием гидролитических ферментов подвергаются разложению — аутолизу. В области очага некроза развивается воспаление как ответная реакция организма на гибель его части.
Морфология некроза зависит от его причины, но общим является изменение цвета некротизированной ткани и ее консистенции. Цвет некротических масс зависит от наличия примесей крови и различных пигментов. Мертвая ткань бывает белой или желтоватой, нередко окружена красно-бурым венчиком. При гнилостном расплавлении мертвая ткань издает характерный дурной запах. Микроскопические признаки некроза складываются из необратимых изменений ядер и цитоплазмы клеток. В период некробиоза клетки теряют воду, поэтому при некрозе ядра сморщиваются и уплотняются — развивается кариопикноз. Затем нуклеиновые кислоты в виде отдельных глыбок выходят из ядра в цитоплазму клетки — происходит распад ядра — кариорексис. Наконец, ядерное вещество растворяется — наступает кариолизис. Исчезновение клеточных ядер — один из основных признаков некроза. Та же динамика гибели наблюдается в цитоплазме, в которой развиваются плазморексис и плазмолиз. Наконец, растворяется вся клетка — происходит цитолиз.
При некрозе интерстициальной и сосудистой тканей экстрацеллюлярный матрикс набухает и расплавляется, волокнистые структуры подвергаются фибриноидному некрозу и уплотняются. Образовавшиеся некротические массы носят название некротический детрит. Вокруг очага некроза, отграничивая его от живых тканей, развивается демаркационная линия, представляющая собой зону воспаления. Эта линия имеет большое значение в хирургической практике, так как указывает на возможные пределы иссечения погибших тканей или уровень ампутации конечности.
Исходы некроза.
Благоприятный, при котором происходит ферментативное расплавление некротизированных тканей, после чего они подвергаются организации, т. е. замещению дефекта соединительной тканью, обычно с образованием рубца, или инкапсуляции, т. е. отграничению некротизированного участка соединительной тканью. При этом нередко некротизированные массы подвергаются петрификации. На месте колликвационного некроза образуется полость — киста.
Неблагоприятный, когда некроз ткани или органа заканчивается смертью больного, например инфаркт миокарда или некроз поджелудочной железы. Кроме того, некротизированные ткани могут подвергаться гнойному расплавлению, при котором токсичные продукты некроза и аутолиза всасываются в кровь, развивается интоксикация, которая также может привести к смерти.
Клинико-морфологические формы некроза.
В зависимости от локализации и особенностей некроза выделяют его следующие клинико-морфологические формы.
Гангрена — некроз тканей, соприкасающихся с внешней средой. При этом железо гемоглобина, находящегося в некротизированных тканях, соединяется с сероводородом воздуха и образуется сульфид железа, придающий некротизированным тканям черный цвет. Гангрена развивается в коже, конечностях, кишечнике, легких, влагалище, матке и т. д. Имеется несколько разновидностей гангрены (рис. 12):
- сухая гангрена развивается в тканях с малым содержанием жидкости, при этом ткани могут подвергаться мумификации. Она характерна для конечностей, возникает на разных участках тела при их отморожении, ожогах, при тяжелых инфекциях;
- влажная гангрена обычно развивается в тканях, богатых жидкостью, поэтому встречается в легких, матке, кишечнике. У ослабленных детей, страдающих корью или скарлатиной, иногда развивается влажная гангрена щеки — нома;
- анаэробная или газовая гангрена возникает при тяжелых, обычно массивных ранениях или травмах конечностей при попадании врану бактерий — анаэробов. Внекротизированных мышцах развивается коагуляционный некроз, они становятся грязно-серыми, при надавливании из них выделяются пузырьки газа.
Пролежень имеет трофоневротическое происхождение, возникает на участках кожи, подкожной клетчатки или слизистых оболочек. подвергающихся давлению у ослабленных больных, страдающих онкологическими, сердечно-сосудистыми и некоторыми инфекционными заболеваниями. Пролежни могут возникать вобласти крестца, ягодиц, пяточных костей, а также в трахее или гортани от давления трахеостомической трубки после операции трахеостомии.
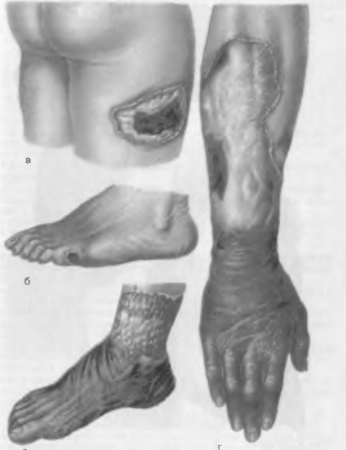
Рис. 12. Гангрена. Влажная гангрена кожи бедра (а) и стопы (б); сухая гангрена стопы (в), предплечья и кисти (г).
Секвестр — участок омертвевшей ткани, свободно располагающийся среди живых тканей, обычно сопровождающийся гнойным воспалением. Особенно часто секвестром является некротизированный фрагмент кости при остеомиелите.
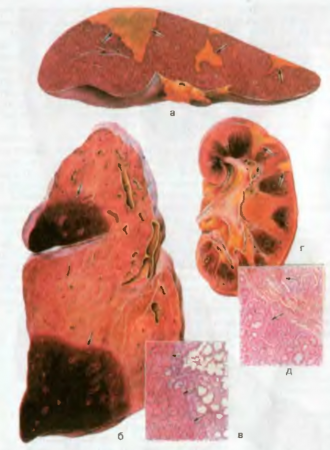
Рис. 13. Инфаркт. а — белые (ишемические) инфаркты селезенки; б — красные (геморрагические) инфаркты легкого; в — микроскопическая картина геморрагического инфаркта легкого; г — ишемические инфаркты почки; д — микроскопическая картина ишемического инфаркта почки. Участки некроза тканей показаны стрелками.
Инфаркт — некроз ткани внутренних органов, развивающийся в результате острого нарушения кровообращения в них при тромбозе, эмболии, длительном спазме артерий. Наиболее яркими примерами этого вида некроза являются инфаркты миокарда, головного мозга, легких, почек, селезенки (рис. 13). Инфаркты различают по форме и цвету, что зависит от особенностей органа и архитектоники его сосудистой системы:
- по форме
- — клиновидная;
- — неправильная.
- по цвету
- — белый;
- — красный;
- — белый с геморрагическим венчиком.
Сравнительная характеристика апоптоза и некроза
Отличия апоптоза от некроза связаны с различиями в их распространенности, генетических, биохимических, морфологических и клинических проявлениях:
- апоптоз — физиологический вид смерти, некроз возникает в условиях патологии;
- апоптоз генетически запрограммирован, некроз развивается под воздействием различных повреждающих причин и не связан с геномом клетки;
- апоптоз распространяется только на отдельные клетки, некроз развивается на территории ткани и даже целого органа;
- апоптоз не сопровождается дистрофическими изменениями клеток, некрозу предшествует дистрофия, имеющая характер некробиоза;
- апоптоз не сопровождается воспалением, вокруг некроза обязательно развивается воспалительная реакция;
- апоптоз заканчивается фагоцитозом апоптозных телец соседними клетками, некроз заканчивается аутолизом погибшей ткани;
- после апоптоза восстанавливаются клетки, аналогичные погибшим, на месте некроза обычно разрастается рубцовая соединительная ткань;
- апоптоз не сопровождается активацией внутриклеточных гидролитических ферментов, некроз развивается с помощью гидролаз;
- апоптоз не имеет клинических проявлений, некроз сопровождается выраженной клинической симптоматикой.
Апоптоз и некроз — два разных варианта гибели клеток и тканей в живом организме, хотя некоторые патогенные факторы, способные оказывать воздействие на генетический код, могут вызывать апоптоз. Однако при этом апоптоз все-таки остается физиологическим механизмом смерти, но активизирующимся в условиях определенной патологии.
Все описанные изменения — дистрофии, апоптоз и некроз — носят характер типовых (или стереотипных) реакций, которыми организм отвечает на различные воздействия, и те или иные их сочетания возникают при любых болезнях, что необходимо учитывать при назначении лечения.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Источник
