Зона ишемии зона некроза при инфаркте
Ишемическая болезнь сердца возникает при закупорке сосудов, вызванных атеросклерозом. В результате в сердечную мышцу перестает поступать кровь, и она начинает испытывать нехватку кислорода и питательных веществ (ишемию). Прогрессирование этого процесса приводит к инфаркту, при котором участок в сердечной мышце перестает снабжаться кровью, кислородом и отмирает.
Граница между тяжёлой формой ишемической болезни и инфарктом очень тонкая, поэтому столь серьезный диагноз обязательно нужно подтвердить лабораторными показателями. Но даже малейшее подозрение на инфаркт требует срочной медицинской помощи, поскольку может вызвать кардиогенный шок и остановку сердца.
Типы ИБС, определяемые на ЭКГ
Существует несколько типов ИБС, которым соответствуют определенные изменения на ЭКГ:
Субэндокардиальная ишемия, возникающая со стороны эндокарда – внутренней оболочки сердца. Характеризуется изменениями зубца Т, который может превышать свой максимальный размер в 0,5 мм. Иногда он может практически сравниваться по величине с зубцом R – самым высоким на кардиограмме, хотя в норме должен составлять примерно 1/4 – 1/8 его высоты.
Субэпикардиальная ишемия возникает с наружной стороны сердца, ближе к его внешней оболочке – эпикарду. Характерный признак такого нарушения – отрицательный зубец Т в основных отведениях, который в норме должен быть положительным.
Субэндокардиальная ишемия
Субэпикардиальная ишемия
При трансмуральной ишемии, захватывающей всю толщу миокарда также обнаруживается отрицательный зубец Т. Однако он более глубокий, чем при субэпикардиальном повреждении.
При более глубоких повреждениях миокарда наблюдаются другие изменения на ЭКГ:
- При выраженном ишемическом повреждении тканей в области эндокарда – внутреннего слоя сердца наблюдается депрессия сегмента ST, который опускается на всех основных отведениях.
- При повреждении тканей в области наружной части сердца – перикарда — сегмент ST будет приподнят.
- Для глубокого трансмурального повреждения, захватывающего всю толщину сердечной ткани, характерен следующий за зубцом R полукруглый сегмент ST, имеющий характерный вид “кошачьей спинки”.
- При повреждениях, захватывающих большую зону миокарда, может обнаруживаться сразу несколько признаков ишемии. Например, наблюдается отрицательный зубец Т в сочетании с изменениями на участке ST.
Инфаркт на ЭКГ – признаки инфаркта на кардиограмме
Инфаркты практически всегда сопровождаются изменениями на ЭКГ. Они настолько характерны, что по изменениям кардиограммы можно узнать тип инфаркта. А по отведению, каждое из которых отвечает за определенный участок миокарда, можно выяснить, где именно произошло омертвение тканей:
- При трансмуральном инфаркте, охватывающем всю толщу миокарда, от полного комплекса зубцов остается отрицательный зубец QS. Если гибель тканей произошла ближе к наружной стороне сердца, часть импульсов будет проходить, поэтому кардиограмма сохранит зубцы. Однако они будут изменены – зубец Q станет очень глубоким, практически равным по величине зубцу R. А зубец R в этом случае может быть уменьшен.
- При интрамуральном инфаркте, возникшем в глубине тканей, но не охватывающем всю их толщу, на кардиограмме пропадает зубец Q. Такая же картина может наблюдаться, если очаг вплотную прилегает к эндокарду.
Обычно инфаркт не бывает изолированным . Он, как правило, сочетается с признаками поражения тканей и их ишемии Поэтому на кардиограмме могут наблюдаться изменения и в других зубцах. Их локализацию можно увидеть на отведениях, отвечающих за определенный участок миокарда.
ЭКГ при крупноочаговом нижне-боковом инфаркте миокарда
Изменения на ЭКГ также зависят от стадии инфаркта:
- На первой острейшей стадии, длящейся несколько часов, вначале регистрируются изменения сегмента ST, который становится выгнутым, приобретая характерный вид «кошачьей спинки». Зубец Q на такой кардиограмме отсутствует. В этот момент некроза в миокарде еще нет, а имеется только зона поражения. Позже на ЭКГ виден отрицательный зубец Q, который также переходит в “кошачью спинку”.
- На следующий острой стадии инфаркта некроз миокарда сочетается с поражением тканей, поэтому кардиограмма имеет вид, характерный для обоих нарушений. Виден глубокий отрицательный рубец Q, за ним следует сниженный зубец R, поднятый фрагмент ST и отрицательный зубец T. Эта стадия длится до 3 недель.
- Подострая стадия характеризуется исчезновением зоны ишемии и наличием только зоны некроза. Это также отражается на кардиограмме. На ней виден глубокий отрицательный зубец Q, затем сниженный зубец R, потом после этого наблюдается линия ST, которая может быть выше или ниже нормы, а затем – нормальный положительный зубец Т. Глубокий отрицательный зубец Q может сохраняться много лет после инфаркта.
Некоторые случаи инфаркте миокарда не сопровождаются типичными изменениями на ЭКГ. Поэтому при любых болях в области сердца, особенно не снимаемых нитратами и другими препаратами, расширяющими сосуды миокарда, назначается кровь на биохимию (сердечные показатели) и общий анализ для определения количества лейкоцитов и СОЭ.
Продолжение статьи
- Текст 1. Расшифровка ЭКГ: как правильно расшифровать кардиограмму. Датчики, отведения ЭКГ.
- Текст 2. Основные элементы ЭКГ: что содержит график кардиограммы
- Текст 3. Расшифровка ЭКГ: наиболее важные показатели кардиограммы с примерами нарушений
- Текст 4. Изменения на кардиограмме при гипертрофических процессах в миокарде
- Текст 5. Изменения в кардиограмме при ишемической болезни сердца (ИБС) и инфаркте миокарда
- Текст 6. Изменения на ЭКГ при сердечных блокадах
Поделиться ссылкой:
Источник
Август 22, 2018
Нет комментариев
Некротические повреждения сердечной мышцы, т. е. гибель участков миокарда, бывают связаны или не связаны с нарушением коронарного кровообращения. В зависимости от этого они подразделяются на коронарогеннш и некоронарогенные некрозы.
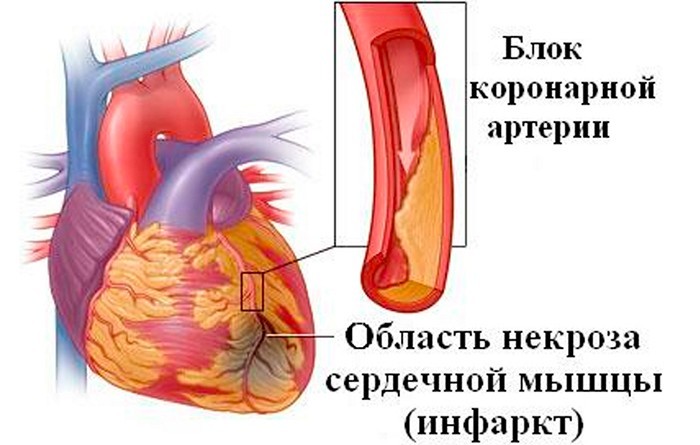
Коронарогенные (ишемические) некрозы миокарда
Некроз миокарда, возникающий вследствие ухудшения коронарного кровотока (ишемии), называется инфарктом миокарда.
Некроз инфаркт миокарда
представляет собой одну из острых форм ИБС, при которой доставка к сердцу кислорода и питательных веществ не удовлетворяет потребности сердца в этих веществах.
Этиология
В этиологии инфаркта миокарда играют важную роль атеросклероз коронарных артерий, их тромбоз, спазм и (достаточно редко) эмболия коронарных артерий. К факторам риска инфаркта миокарда можно отнести все те, которые указаны как факторы риска ИБС (см. начало данного раздела). Сочетание двух или трех факторов риска увеличивает вероятность возникновения инфаркта миокарда.
Патогенез
Выделяют следующие последовательно развивающиеся стадии в патогенезе инфаркта миокарда.
1. Выключение дыхательной цепи митохондрий и активация гликолиза как следствие начавшейся ишемии. Накопление недоокисленных продуктов метаболизма (прежде всего молочной кислоты) обусловливает появление боли.
2. Ингибирование основных метаболических путей, подавление гликолиза (из-за слишком большого снижения pH в ткани миокарда) и цикла Кребса, вследствие чего развивается дефицит аденозинтрифосфата. Наблюдается накопление жирных кислот вследствие угнетения их р. окисления, а также нарушение ионного равновесия в кардиомиоцитах
3. Разрушение мембран кардиомиоцитов в результате включения в патогенез инфаркта так называемой липидной триады. В нее входят активация липаз и фосфолипаз, активация свободнорадикального перекисного окисления липидов и детергентное действие на миокард избытка жирных кислот. Все указанные изменения происходят в мембранах сарколеммы, лизосом, саркоплазматического ретикулума и митохондрий и приводят к их повреждению и повышению проницаемости. Следствием этого является выход аутолитических ферментов лизосом в клетки миокарда, а также накопление в них избытка свободного Са++. Избыток Са++ вызывает контрактуру миофибрилл и приводит к дальнейшей активации липаз и фосфолипаз.
4. Заключительная стадия необратимых повреждений кардиомио-цитов и некроз ишемического участка миокарда.
Клинические проявления
Основными клиническими симптомами инфаркта миокарда являются:
1. Локализующаяся за грудиной сильнейшая боль, иррадиирующая в левое плечо, левую руку и межлопаточную область. Эта боль может возникать в покое днем или в ночное время.
В отличие от приступа стенокардии болевой синдром при инфаркте миокарда длится дольше и не купируется повторным приемом нитроглицерина. Следует отметить, что в тех случаях, когда болевой приступ длится более 15 мин, а принимаемые меры неэффективны, необходимо немедленно вызвать бригаду скорой медицинской помощи.
Встречаются и атипичные формы инфаркта миокарда, при которых характерные симптомы, в частности болевой синдром, могут отсутствовать (безболевая форма инфаркта миокарда).
2. Ослабление сократительной способности миокарда вследствие выпадения из акта сокращения поврежденного участка миокарда ведет к уменьшению сердечного выброса. При этом в зоне некроза с помощью эхокардиографии могут выявляться различные нарушения движения стенки поврежденного желудочка: акинезия, гипокинезия, дискинезия (выбухание участка инфаркта в момент систолы). Последнее может свидетельствовать о формировании острой аневризмы сердца-
3. Аритмии. В связи с изменением в зоне инфаркта биоэлектрических свойств кардиомиоцитов возникают нарушения сердечного ритма (вплоть до развития фибрилляции сердца), что приводит к значительным расстройствам системной гемодинамики и усугубляет нарушение контрактильной функции сердца. Источником эктопической активности на ранних стадиях развития инфаркта служит, как правило, окржающая зону некроза так называемая паранекротическая зона.
4. Появление типичных изменений ЭКГ. К ним относятся смещение сегмента ST выше или ниже относительно изоэлектрической линии, появление патологического комплекса QS (свидетельствует о наличии в миокарде очага глубокой ишемии или некроза), а также появление гигантского зубца Т. Он может быть положительным или отрицательным. Если подобный зубец Т появляется в раннем периоде инфаркта миокарда, его трактуют (как и смещение сегмента ST) как проявление острой ишемии миокарда. Если же он появляется на поздних стадиях, его связывают с формированием в миокарде рубцовых изменений.
В зависимости от особенностей изменений ЭКГ различают следующие формы инфаркта миокарда:
• Q-образующий инфаркт, или Q-инфаркт (с формированием патологического глубокого зубца Q, что может свидетельствовать о крупноочаговом трансмуральном инфаркте);
• Q-необразующий инфаркт, или He-Q-инфаркт (сопровождается не появлением зубца Q, а появлением отрицательного зубца Т, что свидетельствует о мелкоочаговом инфаркте миокарда).
5. В крови повышается содержание так называемых маркеров инфаркта миокарда: миокардиальной фракции креатинфосфокиназы, миоглобина, а также тропонина-Т, который имеет на сегодняшний день наиболее важное значение в диагностике инфаркта миокарда.
6. Одно из важных проявлений инфаркта миокарда – ухудшение реологических свойств крови, что способствует тромбообразованию. При инфаркте миокарда венозный тромбоз диагностируется у 10-15 % больных.
7. Кроме описанных выше изменений могут наблюдаться расстройства мозгового кровообращения, нарушения функции желудочно-кишечного тракта. Через несколько часов от начала инфаркта миокарда развивается лейкоцитоз. Весьма характерно для инфаркта появление так называемого симптома перекреста между числом лейкоцитов в крови и СОЭ, когда в конце 1-й недели выраженность лейкоцитоза снижается, а СОЭ увеличивается.
Осложнения
К ранним осложнениям относят острую сердечную недостаточность, кардиогенный шок, отек легких, механические осложнения (разрыв папиллярных мышц, перегородки и стенок миокарда), тампонаду сердца, перикардит, тромбоэмболию легочной артерии, являющуюся одной из наиболее частых причин внезапной смерти.
К поздним осложнениям (возникают через 2-3 нед. и более от начала инфаркта) относят постинфарктный синдром Дресслера, хроническую недостаточность кровообращения, развитие аневризм сердца, тромбоэмболию легочной артерии и повторные инфаркты миокарда. Что касается синдрома Дресслера, то он возникает через 2-6 нед. от начала инфаркта и проявляется перикардитом, плевритом и пневмонией. В его патогенезе играет роль образование аутоантител к деструктивно измененным при инфаркте белкам миокарда — миокардиальным аутоантигенам.
Принципы патогенетической терапии
1. Ликвидация болевого приступа с помощью сильнодействующих анальгетиков и наркотических средств.
2. Использование антиагрегантов и тромболитических препаратов. В качестве доврачебной помощи рекомендуется использовать аспирин.
3. Уменьшение потребности сердца в кислороде, улучшение его доставки и снижение риска возникновения аритмий ф-адреноблокаторы).
Рекомендуется также использовать:
• ингибиторы ангиотензинпревращающего фермента;
• седативные и снотворные препараты;
• противоаритмические средства.
4. Важное значение имеют и хирургические методы лечения, в частности аортокоронарное шунтирование и баллонная ангиопластика со стентированием коронарных артерий.
Некоронарогенные (неишемические) некрозы миокарда
Поражения сердца этого типа возникают как результат нарушения метаболизма в сердечной мышце в связи с действием на сердце избытка электролитов, гормонов, токсических продуктов обмена, кардиальных аутоантител. Различают следующие виды некоронарогенных некрозов миокарда.
Электролитно-стероидные некрозы
Образование данного вида некрозов связано с патогенным действием на миокард избытка вводимых в организм гормонов коры надпочечников (прежде всего минералокортикоидов) в сочетании с солями натрия. Такое воздействие приводит к увеличению проницаемости мембран кардиомиоцитов для натрия и накоплению его в сердце. Развивающийся впоследствии отек и «осмотический взрыв» клеток миокарда сопровождается возникновением очагов некроза.
Катехоламиновые некрозы миокарда
Повреждающее действие избыточных концентраций катехоламинов на сердце объясняется следующими механизмами.
Во-первых, сами катехоламины, и прежде всего адреналин, обладают прямым повреждающим действием на миокард.
Во-вторых, несмотря на то что катехоламины расширяют коронарные сосуды, они в значительно большей степени увеличивают потребность сердца в кислороде, т. к. повышают частоту сердечных сокращений и артериальное давление. Поэтому при прохождении крови по венечным сосудам кислород утилизируется раньше, чем кровь достигнет прекапиллярного отдела микрососудистого русла. Это приводит к тому, что в миокарде появляются участки, получающие кровь, обедненную кислородом.
В-третьих, под влиянием избытка катехоламинов в миокарде происходит активация перекисного окисления липидов, продукты которого повреждают мембраны кардиомиоцитов.
Токсические и воспалительные некрозы миокарда
Данные виды некрозов возникают при интоксикации или поражении миокарда воспалительным процессом. Токсический миокардит может возникать вследствие воздействия некоторых химических соединений и фармакологических препаратов, например кокаина, лекарственных средств, применяемых при лечении злокачественных опухолей. Эти токсические вещества оказывают прямое повреждающее действие на миокард, приводя к развитию необратимой дистрофии и появлению мелкоочаговых некрозов.
Примером воспалительных некрозов миокарда служат различные миокардиты: ревматические и дифтерийные. При любом воспалительном процессе, как и в данном случае, наблюдается альтерация (повреждение) миофибрилл. Развивающийся воспалительный отек также способствует альтерации. Все это ведет к развитию микронекрозов миокарда.
Аутоиммунные некрозы
Одним из примеров аутоиммунных некрозов миокарда служит синдром Дресслера, о котором было сказано выше.
Поврежденные белки при инфаркте миокарда могут стать аутоантигенами, к которым в организме вырабатываются антитела. Повторное развитие некротического процесса обусловливает запуск реакции «антиген-антитело» во многих участках сердечной мышцы, что вызывает множественные микронекрозы.
Загрузка…
Источник
ИМ может быть обнаружен с очень высокой чувствительностью при использовании метода МРТ с поздним накоплением содержания гадолиния (Gd) (рис. 1). ИМ может быть выявлен через 10 мин или больше после в/в инъекции гадолиния как контрастного вещества при МРТ. Контрастное вещество поступает во внеклеточное пространство и, из-за кинетического эффекта и эффектов разделения, концентрируется в омертвевшем миокарде после инъекции, где внеклеточное место расширено из-за некроза ткани (острый инфаркт) или фиброзной замены (хронический инфаркт). При использовании последовательности восстановления инверсии интенсивность сигнала от нормального миокарда стимулируют до нуля, регулируя время инверсии. Это приводит к получению высокоинтенсивного сигнала в зонах некроза, которые обладают более коротким T1 из-за накопления гадолиния. Таким образом, МРТ дает картины миокардиального поражения в живом организме, близкие к гистологическим изображениям (рис. 2). Зоны в области окклюзированной венечной артерии, которые являются недостаточно кровоснабжаемыми, но не являются некротическими, не усиливают МРТ-сигнал.
Рис. 1. Использование в/в введения гадолиния при МРТ для обнаружения патологии зависит от времени, прошедшего после инъекции. Болюс гадолиния введен в пункте времени 0, а красная линия указывает концентрацию гадолиния в крови (отброшено для ясности рециркуляции).
После короткой задержки гадолиний поступает в венечные артерии, которые питают миокард (синяя линия). При этом для измерения миокардиальной перфузии можно использовать сверхбыстрый МРТ (фаза 1). Спустя 1-3 мин получают первые изображения с усилением от гадолиния: в это время самая низкая концентрация гадолиния находится в аваскулярных областях, таких как капиллярная обструкция (МВО, оранжевая линия) при образовании острого инфаркта.
Однако этим методом также очень хорошо визуализируется тромб: оба кажутся очень темными на изображениях (фаза 2). Когда присутствует МВО, она окружает зону инфаркта, который ярко представлен на изображениях позднего отсроченного усиления от гадолиния через 10-20 мин.
При этом гадолиний находится в самой высокой концентрации в зонах некроза (синяя линия, фаза 3) или при кардиомиопатиях в областях расширенного внеклеточного места из-за фиброза или инфильтрации. Эти данные приведены для иллюстрации принципов накопления контрастного вещества и зависят от дозы введенного гадолиния и других факторов.
Рис. 2. Сравнение трифенилтетразолин хлорида (TTC), использованного вне организма: усиленная контрастом часть ЛЖ (слева) с высокой разрешающей способностью визуализации при МРТ (справа) показывает некротический миокард (N) как бледную, не усиленную контрастом ткань (слева) и область высокоинтенсивного сигнала (справа). Отметьте детальное соответствие между этими двумя изображениями.
Изменено (с разрешения): Kim R.J., Fieno D.S., Parrish T.B. et al. Relationship of MRI delayed contrast enhancement to irreversible injury, infarct age, and contractile function // Circulation. – 1999. – Vol. 100. – P. 1992-2002.
В некоторых случаях острых инфарктов есть центральная некротическая зона в области накопления Gd, которая представляет капиллярную обструкцию с очень медленным проникновением гадолиния из-за ограничения диффузии (рис. 3). Инфаркты с капиллярной обструкцией имеют более плохой прогноз, так как независимый показатель выше фракции изгнания. Область капиллярной обструкции медленно уменьшается в течение недели и не наблюдается при образовании хронических инфарктов. Область накопления Gd (зона инфаркта) также существенно уменьшается в течение длительного времени и в объеме, и в трансмуральном направлении. Уменьшение зоны инфаркта происходит с формированием инволюции или гипертрофии смежных отделов миокарда. Поскольку МРТ обеспечивает высокое пространственное разрешение, используют повторные исследования. Принимая во внимание атравматичность метода, МРТ является идеальным инструментом для изучения образования острого инфаркта и его заживления у живых людей. В хронической стадии ИМ рубец хорошо видно накопление Gd, хотя интенсивность сигнала уменьшена из-за более низкого внеклеточного пространства, чем во время острой фазы. Метод с накоплением Gd МРТ значительно более чувствителен для обнаружения инфаркта, чем перфузия SPECT (рис. 4).
Рис. 3. Пациент через 5 дней после первичной транслюминальной коронарной ангиопластики со стентированием венечной артерии по поводу предшествующего ИМ. Временные изменения в интенсивности сигнала после в/в введения гадолиния в дозе 0,2 ммоль/кг.
Отмечается замедление накопления в области инфаркта через 2 мин (A), что указывает на наличие капиллярной обструкции.
Через 15 мин (Б) отмечается медленное вымывание контраста – в области с более умеренным повреждением по сравнению с окружающими областями с неповрежденной микроциркуляцией.
Через 30 мин (В) отмечается вымывание контраста – в областях, показывающих замедление накопления через 15 мин (стрелки Б и В). У сегментов с темными зонами в пределах обследуемых областей при отсроченном исследовании отмечается слабое контрастирование в острой стадии инфаркта с очень низкой вероятностью выздоровления.
Изменено (с разрешения): Beek A.M., Kьhl H.P., Bondarenko O. et al. Delayed contrast-enhanced magnetic resonance imaging for the prediction of regional functional improvement after acute myocardial infarction // J. Am. Coll. Cardiol. – 2003. – Vol. 42. – P. 895-901.
Рис. 4. А – сравнение МРТ и перфузии миокарда SPECT для обнаружения ИМ у животных. Нижний ряд показывает срезы экспериментально вызванного инфаркта с окрашиванием TTC. Вне организма изображения накопления гадолиния (средний ряд) показывают большее соответствие с “золотым стандартом” TTC. Но перфузия SPECT (верхний ряд) не в состоянии идентифицировать маленькие области инфаркта.
Б – график оценивает количество случаев, исследуемых каждой методикой в оценке трансмурального расширения инфаркта в квартилях. Светло-оранжевая колонка показывает результаты гистологии и ее сравнение с МРТ (синяя колонка). Однако пропорция пропущенных случаев инфаркта сцинтиграфией (темно-оранжевая колонка) увеличивается по мере того, как случаи инфарктов становятся субэндокардиальными.
Источник (с разрешения): Wagner A., Mahrholdt H., Holly T.A. et al. Contrast-enhanced MRI and routine single photon emission computed tomography (SPECT) perfusion imaging for detection of subendocardial myocardial infarcts: an imaging study // Lancet. – 2003. – Vol. 361. – P. 374-379.
Используя метод с накоплением Gd при МРТ, ранее невыявленные ИМ обычно находили у 70-летних пациентов. Такие пациенты представляют группу риска для дальнейших сердечно-сосудистых изменений. После проведения МРТ с накоплением Gd идентифицирует скрытый бессимптомный ИМ у пациентов, выявляет присутствие трансплантата при ИБС и необходимость в активном медицинском вмешательстве. У больных со сложным коронарным поражением наблюдается последующее повышение тропонина, а МРТ показывает место расположение зоны некроза и позволяет различить эмболию и боковое ответвление.
МРТ может также отобразить региональное сокращение толщины стенки и утолщение стенки при инфаркте. Степень измененной систолической функции является ненадежным показателем степени проникновения инфаркта. Миокардиальное повреждение способствует наблюдаемой потере региональной систолической функции, и невозможно отличить это влияние от сократительной дисфункции, вызванной рубцом, используя одно только изображение деформации.
Dudley J. Pennell, Udo P. Sechtem, Sanjay Prasad и Frank E. Rademakers
Магнитно-резонансная томография сердца
Опубликовал Константин Моканов
Источник
