Введение антикоагулянтов при геморрагическом инсульте
Из 5000 первичных или повторных инсультов, диагностируемых в Республике Беларусь ежегодно, 80% составляют инфаркты мозга. Подбор адекватного лечения при ишемических цереброваскулярных заболеваниях зависит от точности определения причин инсульта. Гетерогенная структура инфаркта мозга в настоящее время подразумевает следующие варианты заболевания:
- инсульты вследствие стеноза или окклюзии крупных артериальных сосудов каротидного или вертебрального бассейна;
- закупорка мелких церебральных артерий;
- кардиогенные эмболии;
- инфаркты зон смежного кровоснабжения (так называемые гемодинамические);
- васкулопатии неатеросклеротического генеза (диссекции артерий, церебральный васкулит, фибромускулярная дисплазия, болезнь мойя-мойя и др.);
- инсульты вследствие гиперкоагулянтных состояний;
- ишемические инсульты неизвестной этиологии.
В международных научных исследованиях распределение подтипов ишемического инсульта проводят согласно критериям TOAST: атеротромботический, кардиоэмболический, лакунарный и смешанный/неуточненный.
У большинства больных инфарктом мозга имеют место атеросклероз магистральных и внутримозговых артерий и артериальная гипертензия. Локальная ишемия мозговой ткани развивается вследствие атеротромботической закупорки сосудов, артерио-артериальной эмболии оторвавшимися атеросклеротическими бляшками или гипоперфузионных гемодинамических нарушений.
Помимо клинического неврологического осмотра и тщательного сбора анамнеза, основными методами подтверждения диагноза ишемического инсульта служит компьютерная и магнитно-резонансная томография головного мозга, так как внутримозговые кровоизлияния в ряде случаев могут давать клиническую симптоматику, схожую с симптомами инфаркта мозга. Для выявления патологии экстра- и интракраниальных артерий, уточнения состояния сердца выполняют ультразвуковое исследование сердца и сосудов.
Больным, госпитализированным в отделение интенсивной терапии, проводят базисную терапию инсульта. После исключения внутричерепных геморрагий начинают дифференцированную медикаментозную терапию, основным направлением которой является использование антитромботических средств следующих групп: антикоагулянтов, фибринолитических средств и антиагрегантов.
Необходимо подчеркнуть, что, по данным современной научной литературы, общепринятых схем антикоагулянтной терапии в остром периоде инфаркта мозга нет. Антикоагулянты инактивируют тромбин, предотвращают образование нитей фибрина внутрисосудистого тромба.
Наибольшее распространение как в нашей стране, так и в зарубежных неврологических клиниках получила антикоагулянтная терапия гепарином.
Гепарин является основным представителем антикоагулянтов прямого действия. Это эндогенное вещество синтезируется в организме человека в печени, легких, слизистой оболочке кишечника, мышцах; является смесью гетерогенных фракций гликозаминогликанов, состоящих из сульфатированных остатков D-глюкозамина и D-глюкуроновой кислоты, с разной длиной полимерной цепи и молекулярной массой от 2000 до 50 000 дальтон. Для клинического применения препарат получают из слизистой оболочки кишечника свиней, а также из легких крупного рогатого скота.
В ангионеврологи используют ведущее действие гепарина, проявляющееся в ингибировании тромбина – основного фермента свертывания крови. Для осуществления антикоагулянтного действия гепарина необходим его кофермент – антитромбин III. Гепарин, изменяя конформацию молекулы антитромбина III, значительно ускоряет связывание кофермента с активными центрами ряда факторов свертывающей системы крови. Торможение тромбообразования развивается в результате инактивации IXa, XIa, XIIa факторов свертывания крови, калликреина, тромбина и фактора Xa. Препарат подавляет агрегацию и адгезию тромбоцитов, эритроцитов, лейкоцитов, уменьшает проницаемость сосудистой стенки, тем самым улучшает коллатеральное кровообращение, угнетает липопротеид-липазу, что сопровождается умеренным снижением уровня холестерина и триглицеридов сыворотки крови.
Основными осложнениями медикаментозной терапии гепарином являются кровотечения, тромбоцитопения, а также остеопороз, алопеция и гиперкалиемия при длительном применении. Полагают, что высокие цифры АД существенно увеличивают риск возникновения геморрагий у больных с инсультом. В исследованиях TAIST по лечению гепарином больных с инфарктом мозга показано, что частота развития внутримозговых кровоизлияний достигает 1-7%. При этом риск геморрагических осложнений коррелирует с величиной инфарктного очага.
Вторым опасным осложнением гепаринотерапии у 1-2% больных является гепарининдуцированная тромбоцитопения вследствие повышенной агрегации тромбоцитов. В связи с этим в инсультных отделениях введение гепарина пациентам должно проводиться на фоне систематического (каждые 2 дня) контроля числа тромбоцитов в общем анализе крови. Это связано с тем обстоятельством, что в ряде случаев на 6-8-е сутки антикоагулянтной терапии гепарином может развиться тромбоцитопения иммунного генеза, вызванная иммуноглобулинами IgG и IgM.
Противопоказаниями к введению гепарина служат кровотечения любой локализации, гемофилия, геморрагические диатезы, повышенная проницаемость сосудов, кровоточащие язвенные поражения желудочно-кишечного тракта, подострый бактериальный эндокардит, тяжелые нарушения функции печени и почек, острые и хронические лейкозы, острая аневризма сердца, венозная гангрена, аллергические реакции.
Требует осторожности проведение гепаринотерапии, назначаемой по жизненным показаниям, при высоком артериальном давлении (200/120 мм рт. ст.), беременности, варикозном расширении вен пищевода, в ближайшем послеродовом и послеоперационном периоде.
Растворы гепарина вводят внутривенно или под кожу (в околопупочную жировую клетчатку живота). Дозы и способы применения гепарина подбирают индивидуально в зависимости от патогенетического варианта инфаркта мозга, клинических и лабораторных показателей, результатов нейровизуализации, наличия сопутствующих заболеваний.
При внутривенном способе гепаринотерапии вводят внутривенно струйно 5000 ЕД препарата, после чего переходят к внутривенному струйному введению со скоростью 800-1000 ЕД/ч. При внутривенном введении гепарина антикоагулянтное действие развивается сразу и длится 4-5 ч. При подкожной инъекции гепарина антикоагулянтный эффект начинается через 4060 мин и длится до 8 ч.
Активность гепарина выражается в единицах действия и определяется спектрофотометрически или по способности удлинять частичное тромбопластиновое время свертывания крови (АЧТВ). Для достижения терапевтического эффекта АЧТВ поддерживают на уровне, в 1,5-2 раза превышающем нормальные значения показателя. При титровании дозы гепарина забор крови для определения АЧТВ проводят каждые 6 ч, в последующем – ежедневно в течение всего периода гепаринотерапии.
Антагонистом гепарина является протамина сульфат. При развитии кровоизлияний на фоне гепаринотерапии 5 мл 1%-ного протамина разводят в 20 мл физиологического раствора хлорида натрия и медленно вводят внутривенно. Максимальная доза протамина не должна превышать 50 мг в течение 10-минутного времени введения или 200 мг в течение 2 ч.
В 1980-е гг. разработаны низкомолекулярные гепарины (НМГ) – специальные лекарственные средства, отличающиеся от нефракционированного гепарина (НФГ) постоянством молекулярной массы (4000-5000 дальтон) и обладающие высокой антитромботической активностью. НМГ в большей степени, чем нефракционированный гепарин, инактивируют фактор Ха, в то же время НМГ в меньшей степени, чем НФГ, инактивируют тромбин, поэтому риск геморрагических осложнений при их применении снижается. Кроме того, не наблюдаются тромбоцитопения и остеопороз. Период полувыведения НМГ составляет 1,5-4,5 ч, что позволяет назначать их 1-2 раза в сутки.
Одним из основных представителей НМГ является фраксипарин (надропарин кальция). Он представляет собой гликозаминогликан со средней молекулярной массой 4300 дальтон и характеризуется высокой анти-Ха-факторной активностью, сохраняющейся около суток после введения препарата. Фраксипарин отличают высокая биодоступность (98%), быстрое развитие антикоагулянтного действия и его пролонгированный эффект, комплексный механизм действия, меньшая связь с белками крови, эндотелием и макрофагами.
В настоящее время опубликованы результаты международных исследований TAIST, HAEST, TOPAS, убедительно свидетельствующих об эффективном применении фраксипарина в остром периоде ишемического инсульта. Препарат можно назначать уже в первые 24 ч заболевания. В мультицентровом рандомизированном триале FISS (Fraxiparine in Ischemic Stroke Study) установлено, что в группе лиц, леченных фраксипарином по поводу инфаркта мозга, доля лиц с летальным исходом или тяжелым неврологическим дефицитом была на 20% меньше, чем в группе больных, получавших плацебо.
Значительным преимуществом фраксипарина и других препаратов из группы НМГ (клексан, фрагмин и др.) является их более избирательное влияние на процесс образования сгустка крови. По сравнению с НФГ они в меньшей степени влияют на содержание тромбоцитов и тромбина и, соответственно, реже провоцируют тромбоцитопению и кровотечения. Поэтому фраксипарин в настоящее время рекомендован к применению у пациентов с гепарининдуцированной тромбоцитопенией, которые должны получать терапию прямыми антикоагулянтами по поводу инфаркта мозга. Высокая биодоступность и длинный период полувыведения НМГ по сравнению с НФГ были подтверждены при профилактике и лечении венозного тромбоза у больных с инсультом.
К настоящему времени опубликованы результаты рандомизированного контролируемого исследования по применению фраксипарина при остром инфаркте мозга. В качестве первой точки был определен неблагоприятный исход – общая летальность и неспособность к самообслуживанию в течение 6 месяцев после рандомизации. В качестве второй точки был установлен неблагоприятный исход в течение последующих 3 месяцев. Через 6 месяцев отмечено значительное дозозависимое уменьшение частоты неблагоприятных исходов ишемического инсульта у больных, леченных фраксипарином.
В январе 2006 г. широкой медицинской общественности доложены результаты испытания PROTECT, в котором больным с ишемическим инсультом для профилактики тромботических и эмболических осложнений назначали новый низкомолекулярный гепарин – Certoparin.
При анализе летальных случаев, обусловленных инфарктом мозга, показано, что 20% больных погибают в течение первых 30 дней. При этом у половины умерших причиной смерти являются потенциально курабельные медицинские причины. Частота развития пневмонии, тромбоза глубоких вен и эмболии легочной артерии составляет соответственно 30%, 10 и 5%. В исследованиях зарубежных неврологов установлено, что при лечении больных с инсультом фраксипарин существенно лучше, чем НФГ, предупреждает развитие тромбоза глубоких вен и эмболии легких.
Проводится многоцентровое испытание гепариноида органон 10 172 при инфаркте мозга. Опубликованы результаты I и II фаз исследований. В процессе лечения у нескольких пациентов наблюдались геморрагические осложнения, но в целом лекарственный препарат признан безопасным, в течение 3 месяцев у пациентов наблюдалась положительная динамика клинических симптомов инсульта.
Крупные рандомизированные исследования позволили сократить показания к лечению ишемического инсульта НФГ. Полагают, что сразу после диагностики ишемического инсульта больному должна быть назначена ацетилсалициловая кислота (аспирин) в дозе 50-325 мг один раз в день.
При малом или среднем размере инфаркта мозга антитромботическую терапию начинают с немедленного внутривенного введения гепарина или фраксипарина, если есть угроза существенного нарастания первичного неврологического дефицита. В 2004 г. опубликованы рекомендации VII Международной конференции по антитромботической и тромболитической терапии по лечению пациентов с острым инфарктом мозга. Всех пациентов предлагают стратифицировать по степени риска тромбоэмболических осложнений. С профилактической целью при высоком риске эмболии (Grade 1A) показано подкожное введение НФГ, НМГ или гепариноида.
О. Д. Виберс и др. (2005) основными показаниями к назначению прямых антикоагулянтов считают:
- состояние после перенесенной транзиторной ишемической атаки (ТИА);
- учащение ТИА, увеличение продолжительности и степени тяжести;
- прогрессирующий инсульт при стенозе крупных артерий;
- наличие тромба в просвете магистральной или внутримозговой артерий;
- при операциях на артериях головы и шеи;
- церебральный венозный синус-тромбоз;
- инсульты вследствие гиперкоагуляции.
Рядом авторов показано, что назначение гепарина или НМГ (фраксипарина и др.) может быть особенно эффективно при кардиоэмболическом инсульте.
При кардиоэмболическом ишемическом инсульте эффективность применения гепарина еще не доказана. Более того, в 1994 г. Совет по инсульту Американской кардиологической ассоциации рекомендовал избегать использования гепарина при кардиоэмболическом инсульте. В то же время есть данные об относительной безопасности применения гепарина у больных с небольшими и средними по величине эмболическими инфарктами мозга, главным условием которой должен быть тщательный контроль АЧТВ. В случае обширного кардиоэмболического инфаркта мозга (который захватывает всю зону кровоснабжения средней мозговой или внутренней сонной артерий), в первые дни инсульта внутривенное лечение гепарином не используют. Через несколько дней проводят повторное компьютерно-томографическое сканирование головного мозга. При отсутствии геморрагической трансформации инфаркта начинают внутривенное введение гепарина в дозе 1000 мг/ч, обеспечивая тщательное мониторирование АЧТВ.
В отечественной неврологии наряду с инфузионным капельным введением гепарина применяют подкожные инъекции гепарина в дозе 5000 ЕД 2-4 раза в день или фраксипарин подкожно 1 раз в сутки в дозе 0,3-0,6 мл в течение 10 дней, что соответствует 2850-5700 МЕ анти-Ха-фактора.
С 10-14 дня после кардиоэмболического инсульта при отсутствии противопоказаний назначают лечение непрямыми антикоагулянтами (варфарином). Целесообразность предварительного назначения НМГ в течение 5-7 дней до назначения варфарина в настоящее время является предметом клинических исследований. Первичная и вторичная профилактика инсульта у больных с фибрилляцией предсердий без поражения клапанов, с ревматическим поражением клапанного аппарата или протезированными клапанами сердца подразумевает собой прием прямых и непрямых антикоагулянтов. При приеме пероральных антикоагулянтов у взрослого пациента средняя доза варфарина составляет 5,0-7,5 мг в первые 2 суток, затем – по 2,5-5,0 мг в день. Ежедневно контролируют международное нормализованное отношение (МНО). Рекомендуемый уровень МНО для первичной или повторной профилактики инфаркта мозга составляет от 2,0 до 3,0 единиц. При высоком риске повторного кардиоэмболического инсульта у больных с искусственными клапанами сердца, повторными кардиогенными эмболиями – от 3,0 до 4,5 единиц МНО. Введение гепарина продолжают 5-7 дней на фоне приема варфарина до достижения терапевтических значений МНО. В течение первой недели варфаринотерапии контроль показателей свертываемости осуществляют ежедневно или через день, при стабилизации показателя МНО – 1 раз в месяц. В случае длительного лечения антикоагулянтами риск развития геморрагических осложнений равен 0,5-1,5% в год. Превышение рекомендуемых уровней гипокоагуляции, преклонный возраст больных и высокие значения АД повышают риск возникновения кровоизлияний на фоне варфарина.
В исследовании European Atrial Fibrillation Trial (1994) было продемонстрировано, что у пациентов с малыми инсультами или ТИА на фоне мерцательной аритмии антикоагулянты на 62% эффективнее снижают риск повторного инфаркта мозга, чем аспирин.
К экспериментальным методам нормализации кровотока в окклюзированных церебральных сосудах при ишемическом инсульте относится тромболизис с помощью урокиназы, стрептокиназы, активатора тканевого плазминогена, применение фибринолитических препаратов (анкрод), ингибиторов миграции/адгезии нейтрофилов (анти-ММА антитела), ингибиторов тромбина (ксимегалатран). В мультицентровых испытаниях изучают эффективность этих препаратов при инфаркте мозга.
Таким образом, вопрос о целесообразности назначения гепарина в остром периоде инфаркта мозга до сих пор является спорным. В то же время признано, что антикоагулянтная терапия – один из немногих реальных способов профилактики и лечения тромбоэмболического инсульта. Установленными показаниями к терапии прямыми антикоагулянтами являются случаи инфаркта мозга, когда существует угроза нарастания неврологического дефицита. Исследования последних лет характеризуются применением при инфаркте мозга НМГ (фраксипарина и др.) в связи с их более избирательным действием на механизм гемокоагуляционного каскада и низким количеством геморрагических осложнений. Особые перспективы применения фраксипарина могут быть связаны с профилактикой и лечением кардиоэмболических ишемических инсультов у больных с нарушением сердечного ритма, острым коронарным синдромом и застойной сердечной недостаточностью.
Гончар И. А., Лихачев С. А., Недзьведь Г. К. РНПЦ неврологии и нейрохирургии МЗ РБ.
Опубликовано: журнал «Медицинская панорама» № 6, декабрь 2006 года.
Источник
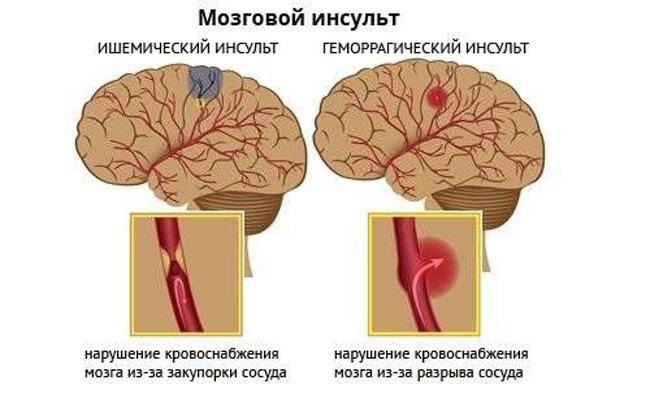
Геморрагический инсульт (ГИ) – клинический синдром, при котором происходит резкое развитие очаговой и/или общемозговой неврологической симптоматики по причине спонтанного кровоизлияния в вещество головного мозга или в подоболочечные участки. Патологический процесс запускают факторы нетравматического генеза. Этот вид кровоизлияния имеет самую высокую инвалидизирующую способность и сопряжен наивысшими рисками раннего смертельного исхода.
Факты статистики из достоверных источников
В общей структуре всех типов инсультов геморрагический занимает 10%-15%. Частота его распространения среди мирового населения составляет порядка 20 случаев на 100 тыс. человек. Специалисты, базируясь на ежегодную динамику, оповещают, что примерно через 50 лет все эти показатели увеличатся в два раза. Конкретно в Российской Федерации ежегодно диагностируют около 43000-44000 случаев ГИ. Что примечательно, приблизительно в 1,5 раза он чаще возникает у мужчин, однако летальность от его последствий преобладает у женщин.
Согласно клиническим наблюдениям, при данном диагнозе смерть наступает у 75% людей, которые находятся на ИВЛ, и у 25% людей, не нуждающихся в ней. Проведенные консолидированные исследования показали, что в среднем 30%-50% больных погибает в течение 1-го месяца с момента приступа геморрагии, причем 1/2 из них умирает уже в течение первых 2-х суток. Инвалидизация (из-за паралича лица и конечностей, афазии, слепоты, пр.) среди выживших пациентов достигает 75%, из них 10% остаются прикованными к постели. И лишь 25% больных спустя 6 месяцев независимы в повседневной жизни.
Патология представляет огромную социальную проблему, поскольку эпидемиологический пик приходится на трудоспособные годы – 40-60 лет. Геморрагические инсульты существенно «помолодели», сегодня они достаточно распространены даже среди молодежной группы людей (20-30 лет). Однозначно в категорию риска входят люди, страдающие артериальной гипертонией, так как в большинстве случаев подобного рода кровоизлияния случаются именно на почве хронически повышенного АД.
Первоочередной фактор, который влияет на прогноз исхода, – оперативность оказания адекватной медицинской помощи больному.
Провокаторы геморрагического инсульта
Пусковым механизмом появления ГИ могут послужить достаточно разнообразные факторы, оказывающие негативное воздействие на внутричерепную гемодинамику и состояние церебральных сосудов:
- стойкая артериальная гипертония (в 50% случаев);
- церебральная амилоидная ангиопатия (12%);
- оральный прием лекарств из спектра антикоагулянтов (10%);
- внутричерепные новообразования (8%);
- другие причины – артериовенозные и кавернозные мальформации, тромбозы синусов головного мозга, аневризмы, васкулиты интракраниальных сосудов и пр. (20%).
Многие из пациентов с геморрагическим ударом в анамнезе имеют сахарный диабет. Доказанный факт, что диабетики, как и гипертоники, входят в группу риска. При сахарном диабете с долгим сроком течения сосуды, включая церебральные, разрушаются из-за модификации химии крови с преобладанием глюкозы. Если на фоне повышенного сахара в крови есть склонность к постоянным повышениям АД, вероятность геморрагического инсульта возрастает в 2,5 раза.
Патогенетически геморрагический эффект может развиться вследствие разрыва сосуда (преобладающий механизм) или просачивания элементов крови в окружающие ткани мозга сквозь стенки капилляров из-за нарушенного их тонуса и проницаемости. Во втором варианте разрыва нет и как такового обильного кровоизлияния тоже. Просто мелкий сосуд пропускает кровь точечно. Но и мелкоточечные геморрагии, сливаясь, способны превратиться в весьма обширные очаги, с не меньшими роковыми последствиями, чем после разрыва артерии или вены.
Клинические проявления ГИ
Незадолго до приступа могут предшествовать предынсультные клинические симптомы-предвестники (не всегда), по которым можно заподозрить надвигающуюся опасность:
- покалывания, онемение одной лицевой половины;
- онемение пальцев рук или ног;
- внезапная слабость, головокружение, шум в голове;
- резкая болезненность в глазах, мушки, двоение, видение в красном цвете;
- внезапное пошатывание при ходьбе;
- беспричинная тахикардия;
- приступы гипергидроза;
- повышение артериального давления;
- необоснованное появление тошноты;
- заторможенность в общении и восприятии чужой речи;
- прилив крови к лицу, гипертермия.
Для мозгового удара с кровоизлиянием все же характерен мгновенный острый дебют без предвестников, который случается в процессе или почти сразу же после активной деятельности, стрессовой ситуации, волнения. О геморрагическом инсульте свидетельствуют классические симптомы, которые развиваются внезапно, они ярко выражены и бурно прогрессируют:
- резкая и сильная головная боль;
- неукротимая рвота;
- длительное угнетение сознания, кома;
- кровяное давление выше 220 мм.рт.ст.
Распространенными признаками состоявшегося шока также являются шумное дыхание, эпилептические припадки, отсутствие реакции зрачков на свет, спастический миоз. В зависимости от расположения очага может присутствовать поворот головы и обращение глазных яблок в направлении пораженного полушария или контрлатерально. Обнаружив признаки ГИ у пострадавшего, рядом находящийся человек обязан немедленно вызвать скорую помощь!
Остро развившаяся геморрагия приводит к тому, что кровь свободно поступает в определенные структуры мозга, пропитывая их и образуя полость с гематомой. Излитие крови длится несколько минут или часов, пока не образуется тромб. За небольшой отрезок времени гематома быстро увеличивается, оказывая на затронутые зоны механическое воздействие. Она растягивает, давит и смещает нервную ткань, вызывает ее отек и гибель, что ведет к интенсивному нарастанию неврологического дефицита (угнетению дыхания, выпадению чувствительности одной половины тела, речевым нарушениям, утрате зрения, парезу глотательных мышц и пр.).
По размерам кровяное скопление может быть небольшим (до 30 мл), средним (от 30 до 60 мл) и большим (более 60 мл). Объемы излившейся жидкости могут достигать и критических масштабов, вплоть до 100 мл. Клинические наблюдения показывают, что при внутричерепных кровоизлияниях, превышающих 60 мл, патология оканчивается смертью у 85% больных в течение 30 суток.
Типичная локализация кровоизлияний
Наиболее часто, а это порядка в 55% случаев, геморрагии происходят в путаментальной зоне. Путаментальное кровотечение образуется вследствие разрыва дегенерированных лентикулостриарных артерий, из-за чего кровь попадает в скорлупу мозга. Виновником патогенеза с такой локализацией обычно становится длительно существующая гипертония. В ряде случаев кровотечения путамента прорываются в желудочковую систему, что чревато тампонадой ЖС и острым окклюзионно-гидроцефальным кризом.
Следующей по распространенности локализацией является субкортикальная область (подкорковая). Субкортикальные ГИ наблюдаются в 17%-18% случаев. Как правило, ведущими источниками такого кровоизлияния являются разорвавшиеся АВМ и аневризмы на фоне повышенного давления. Подкорковые зоны, вовлеченные в геморрагический процесс, – лобная, теменная, затылочная или височная доля.
Третье по встречаемости место, где в 14%-15% случаев определяют геморрагию мозга, – это зрительный бугор, или таламус. Таламические геморрагии наступают по причине выхода крови из кровеносного сосуда вертебробазиллярного бассейна. Патогенез может быть связан с любым этиологическим фактором, однако, как всегда, достоверно чаще отмечена причастность гипертензивного синдрома.
На четвертом месте (7%) по частоте развития встречаются мостовые ГИ. Они концентрируются в задней части ствола мозга, то есть в варолиевом мосту. Через мост осуществляется связь коры с мозжечком, спинным мозгом и другими главнейшими элементами ЦНС. Этот отдел включает центры контроля над дыханием и сердцебиением. Поэтому мост – самая опасная локализация кровоизлияния, практически несопоставимая с жизнью.
Принципы диагностики заболевания
Золотым стандартом в установлении диагноза является метод компьютерной томографии (КТ). В раннем периоде после приступа (1-3 сутки) этот способ нейровизуализации наиболее информативен, чем МРТ. Свежий геморрагический материал, включающий 98% гемоглобина, на КТ отображается высокоплотным, хорошо очерченным, ярко-светлым включением на фоне более темной мозговой ткани. На основании компьютерной томограммы определяются зона эпицентра, объемы и форма образования, уровень поражения внутренней капсулы, степень дислокации мозговых структур, состояние ликворной системы.
С началом подострой фазы (через 3 суток) красные клетки гематомы по периферии разрушаются, в центре железосодержащий белок окисляется, очаг становится ниже по плотности. Поэтому наряду с КТ в сроки от 3 дней и позже обязательным является проведение МРТ. В подострой и хронической форме МР-сигнал, в отличие от КТ, лучше визуализирует гематому с производными окисления гемоглобина (метгемоглобином), переходящую в изоденсивную стадию. Ангиографические методы обследования применяются у пациентов с неопределенной причиной развития геморрагического инсульта. Ангиографию в первую очередь проводят лицам молодого возраста с нормальными показателями АД.
Для адекватного ведения пациентов после приступа внутримозгового кровоизлияния обязательно проводятся ЭКГ и рентген органов дыхания, берутся анализы на электролиты, ПТВ и АЧТВ.
Медицинская помощь в стационаре
Все больные на раннем этапе получают интенсивную терапевтическую помощь в нейрореанимационном стационаре. Первоначальные лечебные мероприятия направлены на:
- нормализацию микроциркуляции, гемореологических нарушений;
- купирование мозгового отека, лечение обструктивной гидроцефалии;
- коррекцию кровяного давления, температуры тела;
- функциональную регуляцию сердечно-сосудистой системы;
- поддержание водно-электролитного баланса;
- предупреждение возможных судорог;
- профилактику внечерепных последствий воспалительной и трофической природы (пневмонии, эмболии, отека легких, пиелонефрита, кахексии, ДВС-синдрома, эндокардита, пролежней, мышечной атрофии и др.);
- проведение респираторной поддержки (если больной в ней нуждается);
- устранение внутричерепной гипертензии при ГИ с дислокацией.
Операция при гемморагическом инсульте
Вторым этапом лечебного процесса выступает нейрохирургическое вмешательство. Его целью является удаление жизнеугрожающей гематомы для повышения выживаемости и достижения максимально возможного удовлетворительного функционального исхода. Чем скорее проведут операцию, тем лучших прогнозов можно будет ожидать. Однако ранняя операция, как правило, предполагает выполнение хирургических манипуляций не раньше чем через 7-12 часов после инсульта. В ультра-раннем периоде она может привести к повторным кровотечениям.
В какой срок разумнее приступить к удалению сгустков крови, решается сугубо компетентными нейрохирургами. Отмечено, что к положительному эффекту могут приводить и операции, совершенные даже спустя 2-3 недели (включительно) после состоявшегося ГИ. Так что вопрос, когда прооперировать пациента, полностью берется под ответственность врача. Рассмотрим основополагающие методы операций, широко применяемые при геморрагических инсультах.
- Открытая декомпрессивная краниотомия показана при средних и крупных подкорковых, а также больших путаментальных и мозжечковых кровоизлияниях. К ней обращаются и при выраженном смещении и нарастающем отеке мозгового компонента, ухудшении неврологического статуса больного. Открытая операция выполняется под полной общей анестезией с применением микрохирургической оптики. Извлечение скопившегося сгустка реализуется через классический трепанационный доступ. Далее делается экономная энцефалотомия, затем патологический компонент отсасывается специальным прибором. Плотные скопления удаляются окончатым пинцетом. В конце операционное поле досконально промывается раствором хлорида натрия, выполняется тщательный гемостаз посредством коагуляции и антигеморрагических средств.
- Пункционно-аспирационная процедура рекомендуется при небольших геморрагиях таламического, путаментального, мозжечкового расположения. Способ заключается в создании маленького отверстия в черепной коробке, пункции гематомы с последующим освобождением мозга от ее жидкой массы посредством аспирации. Такая технология может быть реализована одним из двух миниинвазивных приемов: по принципу стереотаксической или нейроэндоскопической аспирации. Иногда их целесообразно сочетать с локальным фибринолизом. Фибринолиз подразумевает установку дренажа после пункции и аспирации в полость гематомы. Через дренаж в течение нескольких дней вводят фибринолитики для активации растворения (разжижжения) кровяного сгустка и выведения лизированных элементов крови.
Функции аппарата ЦНС, к сожалению, после геморрагических инсультов полностью восстановить невозможно. Но в любом случае, в интересах больного будет обращение в клинику, где работают врачи международного уровня по диагностике и хирургическому лечению внутримозговых поражений.Только так можно рассчитывать на организацию адекватного и безопасного хирургического обеспечения. Следовательно, минимизацию осложнений, более продуктивные результаты в восстановлении качества жизни.
Акцентируем, что идеальное исполнение операции в правильные сроки в 2-4 раза повышает процент выживаемости. Грамотный послеоперационный уход сокращает вероятность рецидива. Нельзя не предупредить, что повторный инсульт с кровоизлиянием у 99,99% пациентов приводит к летальному исходу.
В качестве рекомендации считаем важным сказать, что в уровне развития сферы нейрохирургии мозга на территории Европы Чехия показывает хорошие результаты. Чешские медцентры славятся безупречной репутацией и отличными показателями благополучного восстановления даже самых тяжелых пациентов. И это не все: в Чехии минимальные цены на нейрохирургическую помощь и одна из лучших послеоперационная реабилитация. Выбор медучреждения для прохождения оперативного вмешательства, безусловно, остается за пациентом и его родственниками.
Источник
