Тромболитическая и антикоагулянтная терапия инфаркта миокарда

Антикоагулянтная терапия при инфаркте миокарда. Антиаггрегантная терапия при инфаркте миокарда.Гепарин назначают при инфаркте миокарда любого типа — больным с повышением сегмента ST и без такового в следующих случаях: на ЭКГ нет зубца Q; депрессия сегмента ST; высокий риск тромботических осложнений (для их профилактики); предупреждение новой окклюзии коронарной артерии; для повышения эффективности ТЛТ; реинфаркт; ХСН; фибрилляция предсердий (ФП) и тромбоз глубоких вен голеней. Больной, которому тромболизис не проводился, должен получать внутривенно НФГ с первых часов инфаркта миокарда болюсом 60 ЕД/кг (максимально 4000 ЕД), потом со скоростью 12 ЕД/кгч (максимальная доза — 1000 ЕД/ч) или лучше НМВГ, обладающие большей биодоступностью и более длительным эффектом (дальтепарин 100 МЕ/кг подкожно 2 раза в сутки или фрагмин 120 МЕ/кг подкожно 2 раза в сутки, или надропарин 86 МЕ/кг внутривенно болюсом, потом подкожно 86 МЕ/кг 2 раза в сутки), плюс аспирин в малой дозе (0,1 г/сут) для профилактики тромбоза глубоких вен голеней (в последующем — и ТЭЛА) и формирования тромбов в ЛЖ. НМВГ не используют у больных с ИМ с повышением интервала ST, в возрасте старше 75 лет и при патологии почек. Лечение гепарином проводят 5—8 дней. Он вводится подкожно (под контролем АЧТВ, оно не должно превышать 90 с), лучше в переднюю брюшную стенку, так как она — наиболее безопасное место для введения гепарина. Если вводить его в других областях, то имеется очень большой риск попадания в мышцу и развития массивных внутримышечных гематом. Терапия малыми дозами НФГ уменьшает агрегацию тромбоцитов. В последующем переходят на антиагрегантную терапию аспирином (в суточной дозе 100 мг). Больные передним обширным инфарктом миокарда (с тромбами в полости ЛЖ, верифицированными на ЭхоКГ) имеют высокий риск мозговых эмболии и должны получать гепаринотерапию минимум еще 3 недели после ИМ (целевое MHO 2,0—3,0). При необходимости проведения длительной антикоагулянтной терапии на амбулаторном этапе (невозможность приема аспирина, наличие внутрисердечного тромба и флеботромбоза, эпизод ФП длительностью более 48 ч) назначают варфарин под контролем MHO (целевое 2,0-4,0). Если у больного возникла возвратная ишемия (ранняя постинфарктная Ст в первые дни инфаркта миокарда) вследствие повторной закупорки коронарной артерии, то опять вводятся тромболитики. В целом назначение тромболитика с аспирином — «золотой стандарт» лечения ИМ с подъемом интервала ST. Учитывая недостаточно высокую эффективность тромболитической терапии (ТЛТ), в настоящее время широко используются интервенционные методы лечения инфаркта миокарда. Так, альтернативой ТЛТ является «спасательная» ПЧКА, которая лучше (в 90%), чем ТЛТ, восстанавливает коронарный кровоток и дает мало геморрагических осложнений. ПЧКА проводят (на фоне приема аспирина и внутривенного введения НФГ) для реперфузии пораженной зоны всем больным (любого возраста): со сроком ИМ менее 12 ч (или 24 ч при сохранении симптоматики) и с типичными изменениями ЭКГ; которым противопоказана ТЛТ или она оказалась неэффективной (через 90 мин после ТЛТ нет признаков восстановления реперфузии); при наличии опытного медицинского персонала и соответствующего оборудования. ПЧКА проводится с помощью раздувающегося баллончика, в котором катетером создается давление в 5 атм, бляшка разрушается и просвет пораженной артерии механически увеличивается (но обломки бляшки могут, двигаясь дистально по току крови, вызывать микроинфаркт). При необходимости в просвет пораженной артерии ставят стент («пружинку»). Если нельзя в течение 90 мин осуществить ПЧКА, делают тромболизис. Больные инфарктом миокарда с зубцом Q и мультисосудистым поражением коронарных артерий (или Kill) или те, у кого были неэффективными ТЛТ и/или ПЧКА в течение 6 ч от начала симптоматики, должны подвергаться АКШ. – Также рекомендуем “Улучшение кровообращения зон инфаркта. Нитраты при лечении инфаркта миокарда.” Оглавление темы “Принципы лечения инфаркта миокарда. Осложнения инфаркта миокарда.”: |
Источник
Реабилитация после инфаркта миокардаМихаил Шальнов
Антикоагулянтная и тромболитическая терапия при инфаркте миокарда
Целью антикоагулянтной терапии являются ограничение начинающегося тромбоза, профилактика нового тромбоза и тромбоэмболических осложнений. Если тромбоэмболические осложнения уже возникли, то антикоагулянтная терапия уменьшает число рецидивов осложнения.
По механизму действия антикоагулянты делятся на две группы : прямого (гепарин) и непрямого действия. К антикоагулянтам непрямого действия относятся производные оксикуморина (дикумарин, неодикумарин, фепромарон, синкумар и др.) и фенилиндандиона (фенилин, омефен). Все антикоагулянты непрямого действия являются антагонистами витамина К, необходимого для образования в печени протромбина. Действие их связано с нарушением биосинтеза протромбина, проконгвертина (фактора VII и факторов IХ, Х). Все непрямые антикоагулянты действуют медленно и обладают комулятивными свойствами. Одним из основных условий успешного лечения больных инфарктом миокарда является правильный режим физической активности. В остром периоде ее следует свести к минимуму. Обычно с такой целью предписывают строгий постельный режим.
Лечение гепарином следует начинать как можно раньше, с созданием достаточной терапевтической концентрации его в крови. Первая доза гепарина должна быть не менее 10 000—15 000 ЕД. Предпочтителен внутривенный путь введения, действие начинается немедленно и продолжается 4—6 ч.
Данный текст является ознакомительным фрагментом.
Похожие главы из других книг:
Фитотерапия при инфаркте миокарда
В реанимационном отделении никто не позволит поить больного приготовленными растительными настоями и отварами. А вот сразу после перевода его в обычную палату можно посоветоваться с лечащим врачом по поводу применения фитотерапии в
3. Физиология миокарда. Проводящая система миокарда. Свойства атипического миокарда
Миокард представлен поперечно-полосатой мышечной тканью, состоящей из отдельных клеток – кардиомиоцитов, соединенных между собой с помощью нексусов, и образующих мышечное волокно
ДИСТРОФИЯ МИОКАРДА
Арсеникум альбум 6, калькарея арсеникоза 3, 6, хининум арсеникозум 3, 6 — показаны при дистрофии миокарда, вызванной длительной хронической инфекцией либо хрониосепсисом, а также гипоксии миокарда в связи с гипертонической болезнью II–III стадии с
Дополнительная антитромбоцитарная и антикоагулянтная терапия
Эффективность тромболизиса повышается при одновременном использовании аспирина. При фибринолизе его целесообразно назначать следующим образом: первая доза – 150–325 мг в таблетках, (первую таблетку
II. Мануальная терапия внутренних органов, или Старославянская терапия живота
«Бог помогает тому больше,
кто помогает себе чаще».
Английская пословица
Мануальная терапия живота
До настоящего времени ученые считали, что у человека есть два мозга — головной и спинной.
Фитотерапия при инфаркте миокарда
* Плоды боярышника, корневище валерианы, травы донника и лабазника, цветы клевера, листья мелиссы и кипрея, лепестки цветов розы – всего поровну. Взять 10 г измельченного в порошок сбора на 500 мл воды, нагревать на водяной бане в закрытой
Внезапная смерть при инфаркте миокарда
Инфаркт миокарда – очень распространенное заболевание, является самой частой причиной внезапной смерти. Проблема инфаркта до конца не решена, смертность от него продолжает увеличиваться. Сейчас все чаще инфаркт миокарда
Инфаркт миокарда
345. Как можно распознать начало инфаркта?Удушающая боль при инфаркте обычно начинается внезапно, она не проходит после отдыха или приема лекарств и все время усиливается. Эти приступы не всегда связаны с физическим напряжением или стрессом, как при
Настой сбора с листьями облепихи при инфаркте миокарда
– 2 столовые ложки сбора из? 50 г листьев смородины красной,? 50 г листьев смородины черной,? 30 г листьев облепихи крушиновидной,? 40 г листьев земляники лесной,? 10 г соплодий хмеля обыкновенного,? 30 г травы володушки
Питание и диеты при инфаркте
При инфаркте миокарда после приступа больным назначают диету, которая должна создать наиболее благоприятные условия для успешного лечения и восстановления функциональной способности мышцы сердца, способствовать улучшению обменных
Источник
Оглавление темы “Внезапная коронарная смерть (первичная остановка сердца). Инфаркт миокарда. Неотложная помощь при ИБС. Неотложная помощь при инфаркте миокарда.”:
1. Этиология ( причины ), патогенез внезапной коронарной смерти ( первичной остановки сердца ). Асистолия. Клиника внезапной оставновки сердца. Неотложная помощь при внезапной коронарной смерти.
2. Стенокардия. Стабильная стенокардия напряжения. Приступ стенокардии. Прогрессирующая стенокардия напряжения ( нестабильная стенокардия ).
3. Спонтанная ( особая ) стенокардия ( стенокардия Принцметала ). Инфаркт миокарда. Клиника ( клиническая картина ) инфаркта миокарда. ЭКГ при инфаркте миокарда.
4. Токсико-резорбционный синдром. Дифференциальный диагноз острой ишемии миокарда ( оим, инфаркта миокарда ).
5. Неотложная помощь при ИБС. Неотложная помощь при стенокардии напряжения. Неотложная помощь при нестабильной стенокардии Принцметала.
6. Неотложная помощь при инфаркте миокарда. Принципы оказания первой помощи ( этап скорой помощи ) при инфаркте миокарда.
7. Неотложная помощь при инфаркте миокарда в стационаре. Тактика оказания первой помощи больному ОИМ ( стационарный этап лечения ). Нейролептанальгезия (НЛА).
8. Тактика проведения нейролептанальгезии (НЛА) при инфаркте миокарда ( оим, ОИМ ). Варианты динамики болевого синдрома после обезболивания при инфаркте миокарда ( ИМ ).
9. Возможные осложнения нейролептанальгезии (НЛА) при инфаркте миокарда ( оим, ОИМ ).
10. Терапия антикоагулянтами при инфаркте миокарда ( оим, ОИМ ). Тромболитическая терапия при инфаркте миокарда ( оим, ОИМ ). Стрептокиназа. Урокиназа.
Терапия антикоагулянтами при инфаркте миокарда ( оим, ОИМ ). Тромболитическая терапия при инфаркте миокарда ( оим, ОИМ ). Стрептокиназа. Урокиназа.
Терапия антикоагулянтами
После определения исходной свертываемости крови (на этапе скорой помощи можно не делать), больному в/в вводится 10-15 тысяч ЕД гепарина. В последующем, в течение 7—10 суток, его назначают 4—6 раз в сутки. Доза гепарина перед каждым введением подбирается так, чтобы добиться увеличения времени свертывания крови в 2—3 раза по сравнению с нормой.
Примечание. I. При терапии антикоагулянтами прямого действия, помимо определения свертываемости крови, один раз в сутки следует проводить исследование мочи на форменные элементы крови (эритроциты). Допускается умеренная микрогематурия (6—8 эритроцитов в поле зрения), а при значительной (20—30 эритроцитов в поле зрения), следует снизить суточную дозу гепарина.
2.Определение кровоточивости при использовании гепарина является неинформативным исследованием.
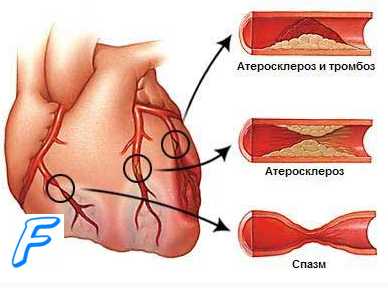
Тромболитическая терапия
Перед проведением данного лечения необходимо уточнить сроки начала ОИМ. Если с момента его развития прошло более 3 часов, тромболитнческая терапия не проводится из-за опасности возникновения синдрома реканализации и развития его осложнений: коллапса, сложных нарушений ритма.
Тромболитическая терапия осуществляется при помощи препаратов, активирующих фибринолиз: стрептокиназой, стрептодеказой, урокиназой и другими препаратами.
При лечении стрептокиназой в течение первых 30 мин. в/в вводят 250—300 тыс. ЕД, растворенных в изотоническом растворе хлорида натрия или глюкозы. В последующие 72 часа продолжается инфузия данного препарата со скоростью 100—150 тыс. ЕД в час. Для купирования возможных аллергических реакций с первой дозой стрептокиназы рекомендуется ввести в/в 60—90 мг преднизолона.
Стрептодеказа представляет собой иммобилизованный тромболитический фермент стрептокиназы на биосовместимом и биодеградуируемом водорастворимом декстране. После проведения биологической пробы (300 000 фибринолитических единиц (ФЕ), препарат вводится в/в струйно, в дозе 2,7 млн. ФЕ. Он действует мягче, чем стрептокиназа, его использование реже сопровождается осложнениями. Лечение стрептодеказой сочетают с гепаринотерапией.
Урокиназа — наиболее физиологичный активатор фибринолиза. После проведения биологической пробы (4400 ЕД/кг/10 мин.) вводится в/в капельно, в течение 12—72 часов с момента возникновения ОИМ, в дозе 4400 ЕД/кг/час. Применяется в сочетании с гепарином и без него. При правильно проводимом лечении про-тромбиновый индекс должен уменьшиться в 2—4 раза.
Тромболитическая терапия должна осуществляться под постоянным контролем времени свертывания крови, фибриногена, коа-гулограммы, содержания эритроцитов в моче.
При использовании активаторов фибринолиза возможно появление геморрагических осложнений; в этом случае показана их отмена и назначение эпсилон-аминокапроновой кислоты (5% раствор эпсилон-аминокапроновой кислоты 100—200 мл в/в кап.), тра-силола, протаминсульфата.
Учебное видео тромболизис при инфаркте миокарда
При проблемах с просмотром скачайте видео со страницы Здесь
– Вернуться в оглавление раздела “Скорая помощь. Неотложные состояния.”
Источник
Независимые и дополнительные благоприятные эффекты ацетилсалициловой кислоты описаны выше.

Таблица 1.6
Точно неизвестно, способствует ли ацетилсалициловая кислота фибринолизу, предотвращению реокклюзии или ограничению микрососудистых эффектов активации тромбоцитов. В исследованиях поздней реокклюзии ацетилсалициловая кислота была более эффективным средством в предотвращении последующих клинических событий, чем в поддержке проходимости коронарной артерии. Сначала пациент должен разжевать первую дозу 150–325 мг (не применять ацетилсалициловую кислоту в защитной оболочке!), затем ежедневно применять более низкую дозу (125–175 мг)перорально. Если пероральный прием невозможен, ацетилсалициловую кислоту можно ввести внутривенно (250 мг). В случае ее непереносимости показано назначение клопидогрела. При комбинации клопидогрела с ацетилсалициловой кислотой доза последней может составлять 75–100 мг.
Агрегация и адгезия тромбоцитов подавлялась ацетилсалициловой кислотой лишь частично, прогресс был достигнут благодаря разработке ингибиторов гликопротеиновых рецепторов тромбоцитов IIb/IIIa, которые блокируют конечный этап агрегации тромбоцитов и их адгезию к участкам поврежденного эндотелия. Ангиографические исследования доказали способность этих препаратов вместе с половинной дозой фибринолитиков и уменьшенной дозой гепарина улучшать коронарный кровоток подобно полной дозе фибринолитиков, но с более полной тканевой реперфузией. Применение этих препаратов в двух больших исследованиях не снижало летальность в течение 30 дней и количество внутричерепных кровотечений, хотя уменьшало количество рецидивов инфарктов. Также на фоне их применения отмечено увеличение количества немозговых кровотечений (преимущественно спонтанных), особенно у пациентов пожилого возраста. Поэтому не рекомендуют рутинное применение уменьшенной дозы фибринолитического средства вместе с абсиксимабом или другими парентеральными ингибиторами гликопротеиновых рецепторов тромбоцитов IIb/ IIIa. Необходима дальнейшая оценка возможных благоприятных эффектов такой комбинированной терапии у пациентов отдельных подгрупп, например у больных с наивысшей степенью риска или планируемым выполнением ЧТКА.
В последние годы подтвердили высказанную ранее теорию о том, что фибринолитические агенты (в первую очередь стрептокиназа) обладают собственной прокоагулянтной активностью вследствие активации высвобождения тромбина, глобального повреждения эндотелия с развитием его дисфункции. Было отмечено, что системная ТЛТ стрептокиназой повышает активность тромбина в 3 раза и производит протромбиногенные сдвиги в калликреин-кининовой системе. Это привело к необходимости разработки адъювантной терапии, которая могла бы компенсировать постфибрино-литический всплеск тромбиновой активности.
Эффективность применения гепарина изучали во многих исследованиях во время или после фибринолиза, особенно вместе с применением тканевого активатора плазминогена.

Таблица 1.7
Гепарин не улучшает результатов лизиса сгустка фибринолитиком, болюсное введение даже больших доз (до 300 МЕ/кг), по данным ангиографии, не приводит к увеличению частоты спонтанного открытия коронарной артерии. Тем не менее проходимость коронарной артерии через часы и дни после тромболитической терапии тканевым активатором плазминогена лучше при одновременном внутривенном применении гепарина. Длительное внутривенное назначение гепарина не позволяло предотвратить реокклюзии после достижения успешного коронарного фибринолиза, подтвержденного ангиографическим методом. Суммируя приведенные факты, можно заключить, что, не обладая собственной тромборазрушающей активностью, гепарин (по крайней мере при контролируемом внутривенном инфузионном введении) обладает профилактическими свойствами в отношении коронарного ретромбоза, особенно в период прокоагулянтного сдвига в системе свертывания, вызванного системным фибринолизом. Во время внутривенной терапии гепарином необходимо тщательное мониторирование показателя АЧТВ (который не должен превышать 70 с, так как сверхвысокие его значения ассоциируются с большей вероятностью смерти, кровотечения и реинфаркта).
Следует отметить, что в большинстве исследований по применению внутривенно гепарина у больных в острый период ИМ средние показатели АЧТВ не достигали целевых значений в течение первых 48 ч заболевания, с чем может быть связан ряд негативных результатов, полученных в вышеупомянутых исследованиях. Несмотря на отсутствие прямых доказательств развития клинически значимого синдрома «рикошета» при резкой отмене гепарина у больных с острым ИМ, теоретические предпосылки для использования схемы лечения с постепенным уменьшением дозы препарата (и возможным переходом на подкожное введение) все же достаточно убедительны. Таким образом, инфузию гепарина после терапии фибринолитиком можно прекратить через 48 ч и перейти на подкожное введение низкомолекулярного или обычного гепарина. Продление терапии гепарином внутривенно может быть сопряжено с развитием специфического осложнения — «гепарининдуцируемой» тромбоцитопении и увеличением количества геморрагий, что следует принимать во внимание. Поводом для принятия такой тактики может быть длительно сохраняющаяся ишемия (особенно при отсутствии возможности осуществить механическую или повторную фармакологическую реперфузию).
Низкомолекулярный гепарин — подфракция стандартного гепарина с молекулярной массой около 4500 Да (молекулярная масса нефракционированного гепарина 12 000–15 000 Да). Характеризуется рядом теоретических преимуществ по сравнению со стандартным гепарином. Среди них — лучшее предотвращение нового образования тромбина в результате большей степени подавления фактора Ха, лучший предполагаемый фармакокинетический профиль, меньшее связывание с протеинами, меньшая активация тромбоцитов, более низкая частота возникновения тромбоцитопении, отсутствие необходимости контроля АЧТВ.
Низкомолекулярные гепарины изучены в больших исследованиях у пациентов с острым коронарным синдромом без элевации сегмента ST, но лишь недавно их применение начали исследовать в комбинации с фибринолитическими средствами при остром ИМ. Ранее выолненные клинические исследования позволяют допустить, что низкомолекулярный гепарин по сравнению с нефракционированным гепарином может уменьшить риск возвратной ишемии и формирования тромбов в желудочках, хотя и за счет большей частоты кровотечений.
В трех недавно проведенных ангиографических исследованиях применение эноксапарина натрия или дальтепарина натрия ассоциировалось с тенденцией к уменьшению риска реокклюзии и/или более длительным сохранением проходимости инфарктобусловившего сосуда. В ASSENT-3, первом большом исследовании с применением низкомолекулярного гепарина на фоне TNK-tPA, эноксапарин натрия (30 мг внутривенно болюсно и 1 мг/кг подкожно каждые 12 ч) в течение 7 дней уменьшал риск внутригоспитального реинфаркта или внутригоспитальной рефрактерной ишемии по сравнению с гепарином. При этом в исследовании не отмечали увеличения частоты внутричерепных кровотечений (за исключением незначительного увеличения количества немозговых кровотечений по сравнению с гепарином). Тенденция к уменьшению летальности через 30 дней свидетельствовала в пользу эноксапарина натрия, хотя в течение 1 года наблюдения не была выявлена разница в смертности между группами пациентов, получающих нефракционированный и низкомолекулярный гепарины.
В исследовании ASSENT-3 PLUS (2002) догоспитальное назначение эноксапарина натрия сопровождалось существенным увеличением риска внутричерепных кровотечений по сравнению с применением гепарина у пациентов в возрасте ≥75 лет. Результаты исследования ExTRACT TIMI-25 свидетельствуют, что эноксапарин натрия, назначаемый в качестве адъювантной терапии у больных с острым ИМ и элевацией сегмента ST, получавших реперфузионную терапию, уже через 48 ч приводил к снижению частоты развития рецидива ИМ на 36% и случаев проведения ургентной реваскуляризации на 22% по сравнению с инфузионной терапией нефракционированным гепарином. Через месяц от начала лечения данные соотношения сохранялись, тогда как снижение 30-дневной смертности в группе эноксапарина натрия носило лишь характер тенденции.
Кроме того, терапия эноксапарином натрием ассоциировалась с существенным (на 50%) повышением частоты больших кровотечений к 30-м суткам лечения, что, безусловно, следует учитывать при выборе антикоагулянта и схемы лечения у больных с острым ИМ и высоким риском кровотечений. В данном исследовании применяли апробированную ранее у больных с острым ИМ схему введения: 30 мг эноксапарина натрия внутривенно болюсно в начале тромболитической терапии, затем подкожные инъекции из расчета 1 мг/кг массы тела (но не более 100 мг) каждые 12 ч в течение 5 дней.
Существенное дополнение к схеме терапии касалось уменьшения дозы препарата на 25% и исключения внутривенного болюса у пациентов в возрасте старше 75 лет, что позволило избежать увеличения частоты внутричерепных кровоизлияний во время терапии эноксапарином натрием. С учетом убедительных доказательств пользы от применения приведенной схемы лечения эноксапарином натрием ее можно рекомендовать для применения в лечении острого ИМ. Тем не менее представляется целесообразной ее модификация у пациентов с высоким риском кровотечений (в первую очередь у больных с обострениями гастрита и пептической язвой желудка в анамнезе) с уменьшением дозы препарата на 25% и исключением внутривенного болюса. С целью дополнительного снижения риска геморрагии у таких пациентов оправдано включение в сопутствующую терапию блокаторов протонного насоса (омепразол, ланзопразол и др.).
В ранее проведенных исследованиях в дополнение к фибринолитикам применяли прямые ингибиторы тромбина — бивалирудин, лепирудин, аргатробан, эфегатран. Эти препараты улучшали проходимость коронарных артерий и снижали частоту кровотечений по сравнению с гепарином. Невзирая на это, в двух крупномасштабных исследованиях применение гирудина на фоне фибринолитической терапии не давало четких клинических преимуществ по сравнению с гепарином. В исследовании HERO-2 бивалирудин в комбинации со стрептокиназой не снижал смертность в течение 30 дней по сравнению с применением гепарина внутривенно. При внутривенном введении бивалирудина в течение 48 ч случаи реинфаркта отмечены реже, но при этом недостоверно увеличилось количество нецеребральных кровотечений. Рекомендованные дозы гепарина приведены в табл. 1.8.
Относительно проблемы антикоагулянтной терапии при ОКС следует отметить, что в последние годы появилась новая группа препаратов, с которой связаны надежды в отношении оптимизации лечения этих больных. Это селективные ингибиторы Ха-фактора, по химической структуре представляющие собой пентасахаридную последовательность, которая составляет активную в отношении указанного фактора часть молекулы гепарина. Проведено большое рандомизированное исследование MICHELANGELO: OASIS 5, в котором принимали участие свыше 20 тыс. пациентов с ОКС без элевации сегмента ST.
В этом исследовании пентасахарид фондапаринукс натрия в дозе 2,5 мг 1 раз в сутки был так же эффективен, как и эноксапарин натрия в предотвращении смерти, нефатального ИМ и рефрактерной ишемии в течение 9 сут после включения в исследование. Но применение пентасахарида на 17% снизило 30-дневную летальность, на 11% — 6-месячную летальность и на 47% — частоту больших геморрагических осложнений. Более того, при применении пентасахарида значительно снизилась частота возникновения гепарининдуцируемой тромбоцитопении. Были получены первые результаты исследования MICHELANGELO: OASIS 6, в котором участвовали более 12 тыс. больных с острым ИМ и элевацией сегмента ST.
Данное исследование показало, что пентасахарид, назначаемый в дозе 2,5 мг 1 раз в сутки по 9-е сутки при остром ИМ, позволил снизить частоту развития смерти и реинфаркта к 30-м суткам на 18% у больных, которым не проводили ургентную ангиопластику, а частота геморрагических осложнений при его применении была даже несколько ниже, чем у больных контрольной группы, получавших нефракционированный гепарин. Согласно данным пилотных исследований, у пациентов с острым ИМ и элевацией сегмента ST на фоне введения альтеплазы применение пентасахарида по сравнению с вводимым внутривенно нефракционированным гепарином привело к снижению частоты реокклюзий и реваскуляризаций в течение первой недели заболевания.
М.И. Лутай, А.Н. Пархоменко, В.А. Шумаков, И.К. Следзевская “Ишемическая болезнь сердца”
Опубликовал Константин Моканов
Источник
