Трансаминазы в диагностике инфаркта миокарда
Оглавление темы “Лабораторная диагностика инфаркта миокарда.”:
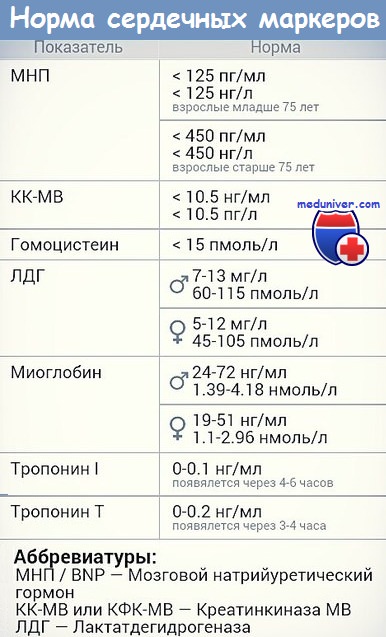
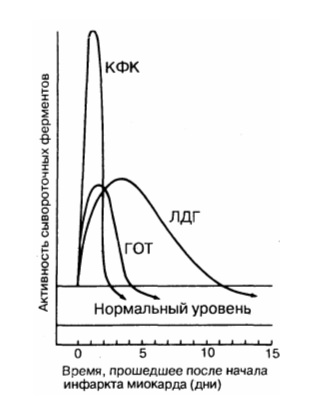
Трансаминазы при инфаркте миокарда. Лактатдегидрогеназы при инфаркте миокарда.Трансаминазы – ACT и АЛТ – обладают весьма низкой специфичностью и чувствительностью в диагностике ИМ и не рекомендуются к использованию как маркеры ИМ. К примеру, рост ACT часто выявляется и при поражениях печени, и при панкреатитах, и при ТЭЛА, после приема больших доз алкоголя, после внутримышечного введения ЛС. Определение трансаминаз — дешевый метод, но требуется выполнять такие правила: анализ крови должен быть сделан в течение первых 6 ч, а затем в динамике (через 12, 18 и 24 ч). В этих условиях значительно чаше регистрируется увеличение трансаминаз, имеющее диагностическое значение. Если сделан только один анализ (при поступлении больного в стационар), то его результатам не следует доверять. Надо помнить о том, что выход трансаминаз происходит дискретно, в связи с расширением зоны некроза (который имеет определенный темп нарастания). Так, ACT (ее много в скелетных мышцах) повышается через 6—12 ч, пик наблюдают на 2-е сутки, а нормализацию — в конце 1-й (а то даже и в начале 2-й) недели. Лактатдегидрогеназа (ЛДГ) также содержится во многих органах (и в немалом количестве). Суммарная ЛДГ (имеется 5 изоэнзимов) — поздний маркер ИМ, она реагирует позже, чем остальные ферменты. Ее определение обычно производят у больных, поздно поступающих в стационар (через 48—72 ч от начала ИМ). Изофермент ЛДГ] (его много в сердце) информативнее, ибо его уровень повышается раньше, чем суммарная ЛДГ, а кроме того, может увеличиваться на фоне ее нормальных значений. Обычно ЛДГ определяют, когда видят, что повышена КФК. Уже с 4—6-го ч (а иногда и со 2-го ч) инфаркт миокарда на фоне нормальных значений СОЭ начинает появляться лейкоцитоз — обычно до 12—15-10 /л, нередко со сдвигом формулы влево. Уровень лейкоцитоза лучше, чем лихорадка, отражает размеры некротического очага. Высокий лейкоцитоз (более 20-10 /л) — неблагоприятный прогностический признак. Лейкоцитоз обычно сохраняется 3—4 дня и к концу 1-й недели снижается, если нет осложнений. В тяжелых случаях он длится более 10 дней (особенно, если появляются осложнения).
Со 2-го дня инфаркт миокарда постепенно, медленно начинает повышаться СОЭ (максимум до 30 мм/ч). Пик ее значений отмечается между 12-м днями (к этому времени число лейкоцитов нормализуется — феномен «ножниц»), потом СОЭ нормализуется. Если она превысила 30 мм/ч — «жди осложнений ИМ». Со 2-го дня инфаркт миокарда (иногда уже через 4—8 ч) начинает увеличиваться и температура тела (как неспецифический ответ на некроз миокарда) до невысоких цифр (37,3—38,0 °С), держится в течение 5—6 дней и нормализуется обычно к 6—10-му дню. Интенсивность лихорадки и ее длительность индивидуальны, зависят от обширности ИМ и реактивности организма в целом. Температурной кривой, характерной для ИМ, нет. Обычно (но не всегда) чем больше зона ИМ, тем выше лихорадка (кроме КШ, когда лихорадки нет). Появление лихорадки после ангинозного приступа является важным диагностическим симптомом инфаркта миокарда (отличает его от Ст) и должно настораживать врача. Длительное сохранение ее указывает на формирование осложнений ИМ (тромбоэндокардит, затяжное течение). Регистрация изменений числа лейкоцитов, СОЭ и температуры тела имеет значение в диагностике мелкоочагового инфаркта миокарда, если нельзя опредечить ферменты. Сохраняет свое некоторое диагностическое значение и рост показателей острой фазы воспаления — СРП, фибриногена, сиаловых кислот, альфа2- и у-глобулинов. Для достоверного диагноза инфаркта миокарда необходимо иметь 2 или 3 надежных критерия. Возможны разные комбинации трех ведущих критериев ИМ, поэтому в каждом конкретном варианте необходим свой минимум обследований. ЭКГ-признаки ИМ могут и отсутствовать, поэтому ИМ нужно ставить всегда с учетом динамики клинических симптомов.
Видео урок изменений в анализе крови при инфаркте миокардаПри проблемах с просмотром скачайте видео со страницы Здесь – Также рекомендуем “Дифференциальный диагноз инфаркта миокарда. Острый перикардит. Гипертрофическая кардиомиопатия.” |
Источник
Оглавление темы “Лабораторная диагностика инфаркта миокарда.”:
Лабораторные методы диагностики инфаркта миокарда. Ферменты инфаркта миокарда.Помимо клинических данных и ЭКГ, в диагностике инфаркта миокарда существенное значение имеет резорбционно-некротический синдром — неспецифическая реакция миокарда, возникающая вследствие асептического некроза, всасывания продуктов некроза и эндогенной интоксикации. Его критерии: лихорадка, гиперферментемия (ферменты выходят из погибших миоцитов при разрушении их мембран) и изменения общего анализа крови. Верификация инфаркта миокарда базируется на существенном росте уровня кардиоспецифических ферментов в плазме. Весьма важны сроки определения уровня ферментов у больного ИМ. Ферменты «быстрого реагирования», которые выходят в периферический кровоток из зоны некроза: • тропонин-Т (специфический миокардиальный белок, отсутствующий в скелетных мышцах) имеет первый пик роста через 2—3 ч с максимумом через 8—10 ч, и высокий уровень сохраняется на протяжении 4-7 дней. Однократное измерение этого теста через 72 ч может быть показателем распространенности ИМ. Тропониновый тест имеет прогностическое значение: если у больного с НСт нет повышения тропонина (в начале ангинозного приступа и через 12 ч), то у него отсутствует свежий инфаркт миокарда. Обычно для верификации диагноза ИМ достаточно двух исследований тропонина-Т (в отличие от необходимости многократных исследований МВ-КФК и КФК). При мелкоочаговом инфаркте миокарда тропонин начинает повышаться с такой же скоростью, как и МВ-КФК, но возвращается к норме более длительно (до 7—14 дней начального периода).
• изофермент МВ-КФК более специфичен (в высоких концентрациях отмечен только в сердце, но в небольших концентрациях содержится в скелетных мышцах). Уровень менее 10 мкг/л указывает на мелкоочаговый ИМ, а более 10 мкг/л — на крупноочаговый. Чтобы исключить ИМ, МВ-КФК регистрируют каждые 8 ч (нужны минимум 3 отрицательных результата). Оценка МВ-КФК весьма полезна, когда имеется сопутствующее поражение мышц или мозга (в них есть КФК, но нет МВ-КФК); • суммарная КФК (норма – 20-80 усл. ед., или до 1,2 ммоль/л, в СИ) повышается через 4—6 ч (пик через 1—2 суток), а нормализуется на 4-й день. КФК содержится не только в сердце, но и в скелете, мышцах, мозге, потому рост ее может быть обусловлен травмами или болезнями мышц (полимиозит, миопатия); катетеризацией сердца; ИЭ и миокардитом (при которых интервал ST может повышаться во многих отведениях); ЭИТ; длительной иммобилизацией; шоком или алкогольной интоксикацией. Необходимо определять КФК в динамике (3-4 раза). Уровень КФК ее возрастает в ходе первых, суток, сохраняется стабильным в течение 3—4 суток и снижается к 6-7-м суткам. Пиковый уровень КФК (и МВ-КФК) на 2-е сутки после ИМ в большей мере, чем другие сывороточные маркеры, указывает на размер некроза. Ранняя диагностика инфаркта миокарда (6—8 ч от начала) с помощью этих кардиоспецифических тестов важна для «сортировки» больных с наличием боли в грудной клетке, для определения соответствующего лечения вследствие объективных трудностей разграничения кардиальной ишемии от ИМ на основе клинических данных. В целом, исследование биохимических специфических маркеров некроза миокарда весьма важно (особенно, если данные ЭКГ позволяют сомневаться в диагнозе инфаркта миокарда). На основе их величин выделяют ОКС с некрозом (ИМ) и без некроза (НСт). Диагностика кардиоспецифических сывороточных ферментов (находившихся в миокардиоцитах и при их разрушении оказавшихся в кровяном русле) имеет большое значение для верификации ИМ без Q.
Видео урок изменений в анализе крови при инфаркте миокардаПри проблемах с просмотром скачайте видео со страницы Здесь – Также рекомендуем “Трансаминазы при инфаркте миокарда. Лактатдегидрогеназы при инфаркте миокарда.” |
Источник
Аминотрансферазы (трансаминазы) — ферменты, катализирующие межмолекулярный перенос аминогруппы от соответствующих аминокислот на a‑кетокислоты (2‑оксокислоты) с образованием новых кето- и аминокислот без образования свободного аммиака, в качестве кофермента используется витамин В6 (пиридоксин). Эти ферменты играют центральную роль в обмене белков, осуществляя окислительное дезаминирование аминокислот опосредованно через глутаминовую кислоту. Образующаяся глутаминовая кислота дезаминируется глутаматдегидрогеназой с освобождением свободного аммиака и 2‑оксоглутаровой кислоты.
В организме человека наибольшее значение имеют две аминотрансферазы: аспартатаминотрансфераза (АСТ или АсАТ) (L‑аспартат:2‑оксоглутарат-аминотрансфераза, КФ 2.6.1.1.) и аланинаминотрансфераза (АЛТ или АлАТ), (L‑аланин:2‑оксоглутарат-аминотрансфераза, КФ 2.6.1.2.). В клинической практике чаще всего определяют именно активность этих двух ферментов. Существует также другое название указанных ферментов: для АСТ — глутаматоксалоацетатаминотрансфераза (ГОАТ), для АЛТ — глутаматпируватаминотрансфераза (ГПАТ). Ниже приведены реакции, катализируемые этими ферментами:
2-Оксоглутарат + Аспартат ↔ Глутамат + Оксалоацетат
2-Оксоглутарат + Аланин ↔ Глутамат + Пируват
Наибольшая активность АСТ обнаружена в миокарде, затем в порядке убывания в печени, скелетных мышцах, головном мозге, почках. Активность фермента в миокарде в 10000 раз выше, чем в сыворотке крови. Фермент является димером, имеет изоферменты: положительно заряженный митохондриальный с ММ=93 кД и отрицательно заряженный цитозольный с ММ=92 кД. Активность АЛТ максимальна в печени, среди других органов убывает в последовательности: поджелудочная железа, сердце, скелетные мышцы, селезенка, легкие. Фермент также имеет цитозольный и митохондриальный изоферменты, однако последний содержится в минимальном количестве и нестабилен. Избирательная тканевая локализация позволяет считать трансаминазы маркерными ферментами: АСТ для миокарда, АЛТ для печени. Соотношение активности аминотрансфераз позволяет судить о глубине повреждения клеток: АЛТ преимущественно локализована в цитоплазме, АСТ — в цитоплазме и в митохондриях.
Существующие методы определения активности трансаминаз в сыворотке крови можно разделить на две основные группы: колориметрические и спектрофотометрические:
1. В основе спектрофотометрических методов лежит использование оптического теста Варбурга (см выше). Эти методы являются наиболее специфичными и точными для исследования активности трансаминаз сыворотки крови, основаны на различии поглощения окисленной и восстановленной форм НАД при 340 нм и требуют постановки индикаторных реакций, в которые вовлекаются продукты основной реакции:
Оксалоацетат + НАДH ↔ Малат + НАД
Пируват + НАДH ↔ Лактат + НАД
Активность ферментов в данном случае будет выражаться в нмоль НАДH/с×л.
| Сыворотка | АЛТ | 30‑420 нмоль/с·л или 2‑25 МЕ |
| АСТ | 30‑340 нмоль/с·л или 2‑20 МЕ | |
| Коэффициент де Ритиса (АСТ / АЛТ) | 1,33±0,40 |
2. Группа колориметрических методов:
- основанные на образовании окрашенного динитрофенилгидразона пировиноградной кислоты. Наибольшее применение нашел метод Райтмана‑Френкеля, являющийся технически простым и дающим воспроизводимые результаты.
- азометоды, основанные на образовании цветного соединения между щавелевоуксусной кислотой и 6‑бензамидо-4‑метокситолуидиндиазониевым хлоридом. Эти методы используются для определения активности АСТ, просты в исполнении, но требуют редких реактивов.
Унифицированными методами определения активности этих ферментов являются непрямой оптический тест Варбурга по накоплению НAДH и колориметрический метод Райтмана‑Френкеля.
Основан на образовании в щелочной среде окрашенного комплекса 2,4‑динитрофенилгидразина с оксалоацетатом и пируватом. Активность ферментов выражают в микромолях пирувата, т.к. оксалоацетат спонтанно декарбоксилируется до пирувата.
| Сыворотка (указанный метод) | АЛТ | 28‑190 нмоль/с·л или 0,1‑0,68 ммоль/ч·л или 1,7‑11,3 МЕ |
| АСТ | 28‑130 нмоль/с·л или 0,1‑0,45 ммоль/ч·л или 1,7‑7,5 МЕ | |
| Коэффициент де Ритиса (АСТ / АЛТ) | 1,33±0,40 |
Определение активности АСТ и АЛТ является чувствительным тестом для диагностики инфаркта миокарда, который не выявляется на ЭКГ, активность АСТ возрастает через 4‑6 часов от начала ангинального приступа, спустя 24‑36 часов достигает максимума и нормализуется на 3‑7 день. Вторичное повышение свидетельствует о повторном инфаркте. Величина активации фермента зависит от обширности поражения миокарда: в тяжелых случаях установлено 20‑кратное повышение активности АСТ и 10‑кратная активация АЛТ.
Особенно важное значение имеет определение активности аминотрансфераз для диагностики заболеваний печени. Некроз или повреждение печеночных клеток любой этиологии (острый и обострения хронического гепатита, холестатическая и обтурационная желтуха, лекарственно-индуцированное поражение) сопровождаются повышением активности обоих ферментов, преимущественно АЛТ, коэффициент де Ритиса = АСТ/АЛТ
Читайте также:
- I. Определение и измерение безработицы.
- II. Определение количества групп.
- II. Определение показателей по выбранным критериям.
- N определению активности холинэстеразы
- N Регуляция каталитической активности ферментов белок-белковыми взаимодействиями
- А. Определение темы.
- Активность и коэффициент активности электролитов. Ионная сила раствора. Распределение ионов в растворе
- Активность и коэффициент активности электролитов. Средняя ионная активность и средний ионный коэффициент активности
- Активность радионуклида. Единицы активности
- Алгоритмическое определение булевских операций
- Аналептики, определение.
- Анализ деловой активности предприятия
Диагностическое значение изоферментов ЛДГ
Изоферменты ЛДГ и их диагностическое значение
Активность ЛДГ возрастает также при хронических лимфогранулематозах, лейкозах, пернициозной анемии и других заболеваниях
Клиническое значение определения активности ЛДГ сыворотки крови
Определяют спектрофотометрическими и колориметрическими методами.
ЛДГ— гликолитический фермент, обратимо катализирующий окисление лактата в пировиноградную кислоту.
L-лактат + НАД ↔ пируват + НАДФ + Н +
Активность в тканях: практически во всех органах, нааибольшая активность в почках, сердечной мышце, скелетной мускулатуре и печени. Много в эритроцитах.
Требования к материалу: полное отсутствие гемолиза (ЛДГ в эритроцитах ↑ в 100 раз, чем в сыворотке).
Норма в сыворотке – до 195 МЕ (при 25 0 С).
Инфаркт миокарда. ↑ЛДГ спустя несколько часов после ИМ , max через 36_48 ч (в 10—15 раз по сравнению с нормой). У больных стенокардией не повышается. Диагностическая точность при трансмуральном инфаркте 97±1,7% .
Заболевания печени. ↑ЛДГ в сыворотке при поврежедении целостности гепатоцитов- паренхиматозная желтуха. При механической желтухе в начале заболевания активность ЛДГ в норме, а на более поздних стадиях ↑ ЛДГ.
Прогрессирующая мышечная дистрофия ↑ЛДГ
Активность изоферментов ЛДГ в сыворотке крови в порядке убывания: ЛДГ2 > ЛДГ1 > ЛДГ3 > ЛДГ4 > ЛДГ5.
Изоферменты ЛДГ в лейкоцитах в норме: ЛДГ3 > ЛДГ2, > ЛДГ4 > ЛДГ1 > ЛДГ5.
Инфаркт миокарда: ↑↑↑ ЛДГ1, ↑ ЛДГ2. ЛДГ1/ЛДГ2 > 1. Изменения в активности изоферментов сохраняются дольше, чем суммарной активности фермента. При неясной клинической картине и нормальной общей активности ЛДГ повышение активности ЛДГ1 указывает на мелкие некротические очаги в миокарде, не регистрируемые другими способами.
Паренхиматозная желтуха: ↑↑↑ ЛДГ5 и ЛДГ4, ↓ЛДГ1 и ЛДГ2.
Мышечные дистрофии: в мышечной ткани ↓↓ЛДГ4 и ЛДГ5 (степень снижения коррелирует с тяжестью заболевания), ↑↑ ЛДГ1, ЛДГ2, и ЛДГ3. В сыворотке крови ↑↑ ЛДГ1, ЛДГ2 и ЛДГ3.
Острый лейкоз: ↑↑↑ ЛДГ2, ↑ЛДГ3 . Прямо пропорциональная зависимость между увеличением ЛДГ2 и количеством незрелых клеток.
Опухолевые заболевания: ↑↑ ЛДГ3 ЛДГ4 и ЛДГ5 в опухолевой (приближение к эмбриональному типу). Различия между злокачественными и доброкачественными максимальны по ЛДГ5. Степень изменения спектра изоферментов коррелирует с ростом опухоли.
Заболевания легких: ↑↑ ЛДГ3 при пневмониях. При выраженной гипоксии ↑ЛДГ4 и ЛДГ5 (активация гликолиза в связи с перестройкой метаболизма на анаэробный тип).
Трансаминазы –(аминотрансферазы) АлАТ и АсАТ катализируют процессы переаминирования, т.е. обратимого переноса аминогруппы (– NH2) от АК на кетокислоту, с образованием новой АК.
АсАТ катализирует реакцию:
e NYtFU/xE8kVZdUoIaZD/k46L8u90crlRZwVelXxtVPYaPXUUyD69E+k0dpz0WTNbK04bj9WhAkC6 KfhyzfBuvNynqOefwfwXAAAA//8DAFBLAwQUAAYACAAAACEArUze1t8AAAAJAQAADwAAAGRycy9k b3ducmV2LnhtbEyPwU7DMAyG70i8Q2QkbiztVCpamk4IgcQJwYaQuGWNacsapyTZWnh6PHGAo+1P v7+/Ws12EAf0oXekIF0kIJAaZ3pqFbxs7i+uQISoyejBESr4wgCr+vSk0qVxEz3jYR1bwSEUSq2g i3EspQxNh1aHhRuR+PbuvNWRR99K4/XE4XaQyyTJpdU98YdOj3jbYbNb762CYjNduie/e83S/vPt ++4jjg+PUanzs/nmGkTEOf7BcNRndajZaev2ZIIYFGRpkjGqYFnkIBjIipy7bH8Xsq7k/wb1DwAA AP//AwBQSwECLQAUAAYACAAAACEAtoM4kv4AAADhAQAAEwAAAAAAAAAAAAAAAAAAAAAAW0NvbnRl bnRfVHlwZXNdLnhtbFBLAQItABQABgAIAAAAIQA4/SH/1gAAAJQBAAALAAAAAAAAAAAAAAAAAC8B AABfcmVscy8ucmVsc1BLAQItABQABgAIAAAAIQCkRbQbMAIAAFQEAAAOAAAAAAAAAAAAAAAAAC4C AABkcnMvZTJvRG9jLnhtbFBLAQItABQABgAIAAAAIQCtTN7W3wAAAAkBAAAPAAAAAAAAAAAAAAAA AIoEAABkcnMvZG93bnJldi54bWxQSwUGAAAAAAQABADzAAAAlgUAAAAA » o:allowincell=»f»> Аспарагиновая кислота + Глютаминовая кислота + ЩУК
+ L- кетоглутаровая кислота
АлАТ катализирует реакцию:
L-аланин +L-кетоглутаровая Глютаминовая кислота + ПК
Отличаются по названиям аминокислоты, от которой отщепляется аминогруппа. Поскольку в названии фермента присутствует аминокислота аланин, это означает, что данный фермент переносит именно аминокислоту аланин. Коферментом АСТ является витамин В6. АЛТ синтезируется в клетках, поэтому в норме его активность в крови невысока.
Коферментом АСТявляется витамин В6. АСТ является внутриклеточным ферментом, то есть в норме находиться в клетках. В клетках фермент может присутствовать в цитоплазме и митохондриях.
Процесс переаминирования был открыт русскими учёными Крицман и Браунштейн (муж и жена) в 1937 году. Впервые в 1954 году Врублевский и Карман обнаружили подъем АсАТ в сыворотке крови у больного с острым инфарктом миокарда. Причем повышение активности фермента наблюдалось через 4 – 6 часов, держалось весь острый период и спадало при начале рубцева-ния; Было замечено, что чем больше очаг поражения, тем выше активность АсАТ.
Содержание АсАТ в тканях (по убывающей) – сердечная мышца, печень, скелетная мускулатура, головной мозг, почки, семенники. Активность в сердечной мышце в 10000 раз выше, чем в сыворотке. В эритроцитах – в 10 раз больше, чем в сыворотке. Поэтому сыворотка не должна содержать даже следов гемолиза.
Содержание АлАТ в тканях (по убывающей)– печень, поджелудочная, сердце, скелетная мускулатура.
Норма в сыворотке: АсАТ — 10-30 МЕ/л при 30˚С; АлАТ — 7-40 МЕ/л при 30˚С.
Снижение активности беременности и др АсАТ, АлАТ наблюдается при:
— снижение в организме Vit B6 (т.к. это кофермент)
Методы определения: спектрофотометрические, колориметрические, хроматографические.
Диагностическое значение определения АсАТ и АлАТ в сыворотке
Инфаркт миокарда ↑↑↑ АсАТ (в 2-20 раз), ↑↑ АлАТ в 98% случаев. Ч/з 6-12 час., максимум – 24-48 часов, нормализация ч/з 4-5 дней. Степень повышения коррелирует с прогнозом. При стенокардии– в норме.
Заболевания печени: ↑↑↑ АлАТ, ↑ АсАТ при поражении гепатоцитов. Максимум на 6-10 день, нормализуется на 15-20 день. ↑↑↑ АлАТ отмечается рано (уже в инкубационом периоде) и даже при безжелтушных формах.
Снижение АсАТ и АлАТ — при недостаточности пиридоксина (витамина В6), процедуры гемодиализа; ХПН, Беременность.
Коэффициент де — Ритиса — это отношение АсАт/АлАТ, который в сердце здорового человека равен 1,33. Увеличение коэффициента де Ритиса выше 1,3 характерно для инфаркта миокарда, и снижение его ниже 1,3 – выявляется при заболеваниях печени.
Поэтому определение активности данных ферментов используется для ранней диагностики заболеваний (определение активности АлАТ в дожелтушный период при паренхиматозной желтухе назначается всем контактным), а также для дифференциальной диагностики: (при паренхима-тозной желтухе активность АлАТ, АсАТ выше нормы, при механической – в норме).
Коэффициент Шмидта: для дифференциальной диагностики заболеваний печени — АсАТ + АлАТ /ГлДГ (глютамат дегидрогеназа). При паренхиматозном гепатите ГлДГ меняется незначительно, а при механических желтухах – ↑↑↑ ГлДГ, но АсАТ + АлАТ ↑
α- амилаза сыворотки и мочи
Гидролазы, катализирующие гидролиз полисахаридов. В плазме амилаза двух изоэнзимных типов — панкреатическая – Р-тип (составляет 40%) и слюнная – S-тип (60%). С мочой выделяется в основном Р-тип.
Норма в сыворотке 16-30 г/ч х л, в моче – до 160 г/ч х л.
Клиническое значение определения α- амилазы
Ø Диагностика заболеваний поджелудочной железы (особенно уроамилаза в суточной моче). При о. панкреатите амилаза крови и мочи ↑↑↑ через 4-6 часов от начала заболевания, максимум 12-24 часа (в 10-30 раз), затем быстро снижается и приходит к норме на 2-6 день. Диагностическая чувствительность амилазы сыворотки для острого панкреатита – 95%, специфичность – 88%. Уровень повышения сывороточной амилазы не коррелирует с тяжестью панкреатита.
Ø Дополнительный диагностический признак при о. почечной недостаточности с олигурией, прободной язве, диабетическом кетоацидозе (↑ в 5-10 раз);
ХПН, паротит — ↑ менее чем в 5 раз
| | | следующая лекция ==> | |
| ЛАКТАТДЕГИДРОГЕНАЗА | | | Опухолевый рост в печени |
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Норма (варьирует в зависимости от метода):
аспартатная трансаминаза (ACT) — 6-25 МЕ/л при 30C), аланиновая трансаминаза (АЛТ) — 3-26 МЕ/л при 30° С.)
А. Предосторожности.Избегать гемолиза, быстро отделять сыворотку от сгустка.
Б. Физиологическая основа.Аспартатная трансаминаза (ACT), аланиновая трансаминаза (АЛТ) и лактатдегидрогеназа — это внутриклеточные ферменты, участвующие в обмене аминокислот и углеводов. В высокой концентрации содержатся в мышцах, печени, мозге. Повышение концентрации этих ферментов в крови свидетельствует о некрозе или поражении прежде всего этих тканей. В. Интерпретация.
1. Повышениепоказателя имеет место при инфаркте миокарда (особенноACT); при остром инфекционном гепатите (АЛТ обычно повышена больше, чемACT); циррозе печени (ACTповышена больше, чем АЛТ); при метастазах в печень или первичной опухоли печени. При поражении опухолевым процессом серозных полостей уровень ферментов повышается в транссудатах.ACTповышается при мышечной дистрофии, дер-матомиозите и па-роксизмальной миоглобинурии.
2. Снижениепоказателя имеет место при недостаточности пиридоксина (витамина В,), часто в результате повторных процедур гемодиализа; при почечной недостаточности, при беременности.
Норма (по методу Конвея): 10-110 мкг% в цельной крови (СИ 12-65 мкмоль/л).
А. Предосторожности.Не использовать антикоагулянты, содержащие аммиак. В качестве антикоагулянтов следует применять оксалат калия, кальцийдвунатриевую соль ЭДТА и гепарин, свободный от аммиака. Определение должно проводиться немедленно после забора крови или в течение часа, если образец хранился на льду.
Б. Физиологическая основа.Аммиак поступает в кровь из двух основных источников: 1) большое количество аммиака освобождается в толстом кишечнике при разложении азотсодержащих веществ гнилостными бактериями; 2) аммиак выделяется в процессе белкового обмена. Поступающий в воротную систему или в общий кровоток аммиак быстро превращается в печени в мочевину. Печеночная недостаточность может приводить к повышению аммиака в крови, особенно если она сопровождается высоким потреблением белка или кишечным
В. Интерпретация.Аммиак повышается в крови при печеночной недостаточности или при шунти-ровании кровотока в печени вследствие портака-вального анастомоза, особенно нафоневысокого содержания белка в пище или при кишечном кровотечении.
БЕЛКИ СЫВОРОТКИ ИЛИ ПЛАЗМЫ (В ТОМ ЧИСЛЕ, ФИБРИНОГЕН)
Норма: см. «Интерпретация»
А. Предосторожности.Нельзя использовать сыворотку или плазму со следами гемолиза. Поскольку фибриноген удаляется при свертывании крови, определение его в сыворотке невозможно.
Б. физиологическая основа.Концентрация белка определяет коллоидно-осмотическое давление плазмы. На концентрацию белка в плазме влияют питание, функция почек и печени, ряд заболеваний (множественная миелома), метаболические нарушения. Изменения в соотношении белковых фракций могут свидетельствовать об определенных заболеваниях.
В. Интерпретация 1. Общий белок сыворотки.Норма: 6-8 г%. (СИ:
60—80г/л). См.ниже «Альбумин и фракции глобулинов» и табл. 4.
Таблица 4. Фракции белков, определяемые при электрофорезе
Источник