Срок полной организации инфаркта миокарда по воз

Инфаркт миокарда – очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Клинически проявляется жгущими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Развившийся инфаркт миокарда служит показанием к экстренной госпитализации в кардиологическую реанимацию. При неоказании своевременной помощи возможен летальный исход.
Общие сведения
Инфаркт миокарда – очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Клинически проявляется жгущими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Развившийся инфаркт миокарда служит показанием к экстренной госпитализации в кардиологическую реанимацию. При неоказании своевременной помощи возможен летальный исход.
В возрасте 40-60 лет инфаркт миокарда в 3–5 раз чаще наблюдается у мужчин в связи с более ранним (на 10 лет раньше, чем у женщин) развитием атеросклероза. После 55-60 лет заболеваемость среди лиц обоего пола приблизительно одинакова. Показатель летальности при инфаркте миокарда составляет 30—35%. Статистически 15—20% внезапных смертей обусловлены инфарктом миокарда.
Нарушение кровоснабжения миокарда на 15-20 и более минут приводит к развитию необратимых изменений в сердечной мышце и расстройству сердечной деятельности. Острая ишемия вызывает гибель части функциональных мышечных клеток (некроз) и последующее их замещение волокнами соединительной ткани, т. е. формирование постинфарктного рубца.
В клиническом течении инфаркта миокарда выделяют пять периодов:
- 1 период – предынфарктный (продромальный): учащение и усиление приступов стенокардии, может продолжаться несколько часов, суток, недель;
- 2 период – острейший: от развития ишемии до появления некроза миокарда, продолжается от 20 минут до 2 часов;
- 3 период – острый: от образования некроза до миомаляции (ферментативного расплавления некротизированной мышечной ткани), длительность от 2 до 14 суток;
- 4 период – подострый: начальные процессы организации рубца, развитие грануляционной ткани на месте некротической, продолжительность 4-8 недель;
- 5 период – постинфарктный: созревание рубца, адаптация миокарда к новым условиям функционирования.
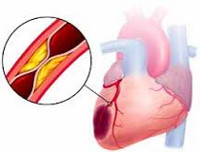
Инфаркт миокарда
Причины инфаркта миокарда
Инфаркт миокарда является острой формой ИБС. В 97—98% случаев основой для развития инфаркта миокарда служит атеросклеротическое поражение венечных артерий, вызывающее сужение их просвета. Нередко к атеросклерозу артерий присоединяется острый тромбоз пораженного участка сосуда, вызывающий полное или частичное прекращение кровоснабжения соответствующей области сердечной мышцы. Тромбообразованию способствует повышенная вязкость крови, наблюдаемая у пациентов с ИБС. В ряде случаев инфаркт миокарда возникает на фоне спазма ветвей венечных артерий.
Развитию инфаркта миокарда способствуют сахарный диабет, гипертоничесая болезнь, ожирение, нервно-психическое напряжение, увлечение алкоголем, курение. Резкое физическое или эмоциональное напряжение на фоне ИБС и стенокардии может спровоцировать развитие инфаркта миокарда. Чаще развивается инфаркт миокарда левого желудочка.
Классификация инфаркта миокарда
В соответствии с размерами очагового поражения сердечной мышцы выделяют инфаркт миокарда:
- крупноочаговый
- мелкоочаговый
На долю мелкоочаговых инфарктов миокарда приходится около 20% клинических случаев, однако нередко мелкие очаги некроза в сердечной мышце могут трансформироваться в крупноочаговый инфаркт миокарда (у 30% пациентов). В отличие от крупноочаговых, при мелкоочаговых инфарктах не возникают аневризма и разрыв сердца, течение последних реже осложняется сердечной недостаточностью, фибрилляцией желудочков, тромбоэмболией.
В зависимости от глубины некротического поражения сердечной мышцы выделяют инфаркт миокарда:
- трансмуральный – с некрозом всей толщи мышечной стенки сердца (чаще крупноочаговый)
- интрамуральный – с некрозом в толще миокарда
- субэндокардиальный – с некрозом миокарда в зоне прилегания к эндокарду
- субэпикардиальный – с некрозом миокарда в зоне прилегания к эпикарду
По изменениям, фиксируемым на ЭКГ, различают:
- «Q-инфаркт» – с формированием патологического зубца Q, иногда желудочкового комплекса QS (чаще крупноочаговый трансмуральный инфаркт миокарда)
- «не Q-инфаркт» – не сопровождается появлением зубца Q, проявляется отрицательными Т-зубцами (чаще мелкоочаговый инфаркт миокарда)
По топографии и в зависимости от поражения определенных ветвей коронарных артерий инфаркт миокарда делится на:
- правожелудочковый
- левожелудочковый: передней, боковой и задней стенок, межжелудочковой перегородки
По кратности возникновения различают инфаркт миокарда:
- первичный
- рецидивирующий (развивается в срок 8 недель после первичного)
- повторный (развивается спустя 8 недель после предыдущего)
По развитию осложнений инфаркт миокарда подразделяется на:
- осложненный
- неосложненный
По наличию и локализации болевого синдрома выделяют формы инфаркта миокарда:
- типичную – с локализацией боли за грудиной или в прекардиальной области
- атипичные – с атипичными болевыми проявлениями:
- периферические: леволопаточная, леворучная, гортанно-глоточная, нижнечелюстная, верхнепозвоночная, гастралгическая (абдоминальная)
- безболевые: коллаптоидная, астматическая, отечная, аритмическая, церебральная
- малосимптомную (стертую)
- комбинированную
В соответствии с периодом и динамикой развития инфаркта миокарда выделяют:
- стадию ишемии (острейший период)
- стадию некроза (острый период)
- стадию организации (подострый период)
- стадию рубцевания (постинфарктный период)
Симптомы инфаркта миокарда
Предынфарктный (продромальный) период
Около 43% пациентов отмечают внезапное развитие инфаркта миокарда, у большей же части больных наблюдается различный по продолжительности период нестабильной прогрессирующей стенокардии.
Острейший период
Типичные случаи инфаркта миокарда характеризуются чрезвычайно интенсивным болевым синдромом с локализацией болей в грудной клетке и иррадиацией в левое плечо, шею, зубы, ухо, ключицу, нижнюю челюсть, межлопаточную зону. Характер болей может быть сжимающим, распирающим, жгучим, давящим, острым («кинжальным»). Чем больше зона поражения миокарда, тем более выражена боль.
Болевой приступ протекает волнообразно (то усиливаясь, то ослабевая), продолжается от 30 минут до нескольких часов, а иногда и суток, не купируется повторным приемом нитроглицерина. Боль сопряжена с резкой слабостью, возбуждением, чувством страха, одышкой.
Возможно атипичное течение острейшего периода инфаркта миокарда.
У пациентов отмечается резкая бледность кожных покровов, липкий холодный пот, акроцианоз, беспокойство. Артериальное давление в период приступа повышено, затем умеренно или резко снижается по сравнению с исходным (систолическое < 80 рт. ст., пульсовое < 30 мм мм рт. ст.), отмечается тахикардия, аритмия.
В этот период может развиться острая левожелудочковая недостаточность (сердечная астма, отек легких).
Острый период
В остром периоде инфаркта миокарда болевой синдром, как правило, исчезает. Сохранение болей бывает вызвано выраженной степенью ишемии околоинфарктной зоны или присоединением перикардита.
В результате процессов некроза, миомаляции и перифокального воспаления развивается лихорадка (от 3-5 до 10 и более дней). Длительность и высота подъема температуры при лихорадке зависят от площади некроза. Артериальная гипотензия и признаки сердечной недостаточности сохраняются и нарастают.
Подострый период
Болевые ощущения отсутствуют, состояние пациента улучшается, нормализуется температура тела. Симптомы острой сердечной недостаточности становятся менее выраженными. Исчезает тахикардия, систолический шум.
Постинфарктный период
В постинфарктном периоде клинические проявления отсутствуют, лабораторные и физикальные данные практически без отклонений.
Атипичные формы инфаркта миокарда
Иногда встречается атипичное течение инфаркта миокарда с локализацией болей в нетипичных местах (в области горла, пальцах левой руки, в зоне левой лопатки или шейно-грудного отдела позвоночника, в эпигастрии, в нижней челюсти) или безболевые формы, ведущими симптомами которых могут быть кашель и тяжелое удушье, коллапс, отеки, аритмии, головокружение и помрачение сознания.
Атипичные формы инфаркта миокарда чаще встречаются у пожилых пациентов с выраженными признаками кардиосклероза, недостаточностью кровообращения, на фоне повторного инфаркта миокарда.
Однако атипично протекает обычно только острейший период, дальнейшее развитие инфаркта миокарда становится типичным.
Стертое течение инфаркта миокарда бывает безболевым и случайно обнаруживается на ЭКГ.
Осложнения
Нередко осложнения возникают уже в первые часы и дни инфаркта миокарда, утяжеляя его течение. У большинства пациентов в первые трое суток наблюдаются различные виды аритмий: экстрасистолия, синусовая или пароксизмальная тахикардия, мерцательная аритмия, полная внутрижелудочковая блокада. Наиболее опасно мерцание желудочков, которое может перейти в фибрилляцию и привести к гибели пациента.
Левожелудочковая сердечная недостаточность характеризуется застойными хрипами, явлениями сердечной астмы, отека легких и нередко развивается в острейший период инфаркта миокарда. Крайне тяжелой степенью левожелудочковой недостаточности является кардиогенный шок, развивающийся при обширном инфаркте и обычно приводящий к летальному исходу. Признаками кардиогенного шока служит падение систолического АД ниже 80 мм рт. ст., нарушение сознания, тахикардия, цианоз, уменьшение диуреза.
Разрыв мышечных волокон в зоне некроза может вызывать тампонаду сердца – кровоизлияние в полость перикарда. У 2-3% пациентов инфаркт миокарда осложняется тромбоэмболиями системы легочной артерии (могут стать причиной инфаркта легких или внезапной смерти) или большого круга кровообращения.
Пациенты с обширным трансмуральным инфарктом миокарда в первые 10 суток могут погибнуть от разрыва желудочка вследствие острого прекращения кровообращения. При обширном инфаркте миокарда может возникать несостоятельность рубцовой ткани, ее выбухание с развитием острой аневризмы сердца. Острая аневризма может трансформироваться в хроническую, приводящую к сердечной недостаточности.
Отложение фибрина на стенках эндокарда приводит к развитию пристеночного тромбоэндокардита, опасного возможностью эмболии сосудов легких, мозга, почек оторвавшимися тромботическими массами. В более позднем периоде может развиться постинфарктный синдром, проявляющийся перикардитом, плевритом, артралгиями, эозинофилией.
Диагностика инфаркта миокарда
Среди диагностических критериев инфаркта миокарда важнейшими являются анамнез заболевания, характерные изменения на ЭКГ, показатели активности ферментов сыворотки крови. Жалобы пациента при инфаркте миокарда зависят от формы (типичной или атипичной) заболевания и обширности поражение сердечной мышца. Инфаркт миокарда следует заподозрить при тяжелом и продолжительном (дольше 30-60 минут) приступе загрудинных болей, нарушении проводимости и ритма сердца, острой сердечной недостаточности.
К характерным изменениям ЭКГ относятся формирование отрицательного зубца Т (при мелкоочаговом субэндокардиальном или интрамуральном инфаркте миокарда), патологического комплекса QRS или зубца Q (при крупноочаговом трансмуральном инфаркте миокарда). При ЭхоКГ выявляется нарушение локально сократимости желудочка, истончение его стенки.
В первые 4-6 часов после болевого приступа в крови определяется повышение миоглобина – белка, осуществляющего транспорт кислорода внутрь клеток.Повышение активности креатинфосфокиназы (КФК) в крови более чем на 50% наблюдается спустя 8—10 ч от развития инфаркта миокарда и снижается до нормы через двое суток. Определение уровня КФК проводят через каждые 6-8 часов. Инфаркт миокарда исключается при трех отрицательных результатах.
Для диагностики инфаркта миокарда на более поздних сроках прибегают к определению фермента лактатдегидрогеназы (ЛДГ), активность которой повышается позже КФК – спустя 1-2 суток после формирования некроза и приходит к нормальным значениям через 7-14 дней. Высокоспецифичным для инфаркта миокарда является повышение изоформ миокардиального сократительного белка тропонина – тропонина-Т и тропонина-1, увеличивающихся также при нестабильной стенокардии. В крови определяется увеличение СОЭ, лейкоцитов, активности аспартатаминотрансферазы (АсАт) и аланинаминотрансферазы (АлАт).
Коронарная ангиография (коронарография) позволяет установить тромботическую окклюзию коронарной артерии и снижение желудочковой сократимости, а также оценить возможности проведения аортокоронарного шунтирования или ангиопластики – операций, способствующих восстановлению кровотока в сердце.
Лечение инфаркта миокарда
При инфаркте миокарда показана экстренная госпитализация в кардиологическую реанимацию. В остром периоде пациенту предписывается постельный режим и психический покой, дробное, ограниченное по объему и калорийности питание. В подостром периоде больной переводится из реанимации в отделение кардиологии, где продолжается лечение инфаркта миокарда и осуществляется постепенное расширение режима.
Купирование болевого синдрома проводится сочетанием наркотических анальгетиков (фентанила) с нейролептиками (дроперидолом), внутривенным введением нитроглицерина.
Терапия при инфаркте миокарда направлена на предупреждение и устранение аритмий, сердечной недостаточности, кардиогенного шока. Назначают антиаритмические средства (лидокаин), ß-адреноблокаторы (атенолол), тромболитики (гепарин, ацетилсалициловая к-та), антогонисты Са (верапамил), магнезию, нитраты, спазмолитики и т. д.
В первые 24 часа после развития инфаркта миокарда можно произвести восстановление перфузии путем тромболизиса или экстренной баллонной коронарной ангиопластики.
Прогноз при инфаркте миокарда
Инфаркт миокарда является тяжелым, сопряженным с опасными осложнениями заболеванием. Большая часть летальных исходов развивается в первые сутки после инфаркта миокарда. Насосная способность сердца связана с локализацией и объемом зоны инфаркта. При повреждении более 50% миокарда, как правило, сердце функционировать не может, что вызывает кардиогенный шок и гибель пациента. Даже при менее обширном повреждении сердце не всегда справляется нагрузками, в результате чего развивается сердечная недостаточность.
По истечении острого периода прогноз на выздоровление хороший. Неблагоприятные перспективы у пациентов с осложненным течением инфаркта миокарда.
Профилактика инфаркта миокарда
Необходимыми условиями профилактики инфаркта миокарда являются ведение здорового и активного образа жизни, отказ от алкоголя и курения, сбалансированное питание, исключение физического и нервного перенапряжения, контроль АД и уровня холестерина крови.
Источник
БСК — болезни системы кровообращения
ИБС — ишемическая болезнь сердца
ИМ — инфаркт миокарда
ОКС — острый коронарный синдром
ССЗ — сердечно-сосудистые заболевания
Сердечно-сосудистые заболевания (ССЗ) — ведущая проблема здравоохранения и общества в целом, так как 50% всех случаев смерти в Российской Федерации происходит в результате этих заболеваний. В последние десятилетия в экономически развитых странах отмечается неуклонное снижение смертности от болезней системы кровообращения (БСК) [1—5]. В нашей стране наметилась положительная тенденция к снижению смертности от БСК, начиная с 2004 г. [6], однако этот показатель остается в 2—3 раза выше, чем в экономически развитых странах. Лидирующее место среди причин смертности от БСК занимает ишемическая болезнь сердца (ИБС), которая в 2011 г. в структуре смертности от БСК составила 52,8% [7]. Смертность от ИБС в России выше, чем в США, в 3 раза [8], и выше, чем в Японии, — в 9 раз [9]. Большой вклад в смертность от ИБС вносит смертность от инфаркта миокарда (ИМ).
Целью данного анализа явилось изучение динамики заболеваемости и смертности от ИМ за период с 2000 по 2011 г. в Российской Федерации.
Для анализа заболеваемости и смертности от ИМ среди городского и сельского населения использованы данные официальной статистики Росстата и Минздрава России за период с 2000 по 2011 г. [7, 10]. Оценка смертности от ИМ проведена по половозрастным признакам. Число случаев заболевания ИМ и смерти от него проанализировано в абсолютных значениях и в расчете на 100 тыс. населения (коэффициенты). Приведены также данные по ряду показателей для БСК и ИБС. Кодирование причин заболеваемости и смертности проводилось по Международной классификации болезней 10-го пересмотра.
В действующих статистических формах ИМ подразделяется на острый и повторный. В данной статье термин «острый» заменен термином «первичный», что представляется более целесообразным, поскольку повторный ИМ также проходит острую стадию.
В Российской Федерации общее число больных (старше 18 лет), страдающих БСК, в 2000 г. составляло около 19,5 млн; начиная с 2003 г. отмечался существенный рост числа этих больных, которое к 2011 г. достигло 31,8 млн. Данная тенденция сопровождалась увеличением числа больных с впервые установленным диагнозом БСК с 2,2 млн в 2000 г. до 3,5 млн в 2011 г. Общее число больных ИБС за этот период также увеличилось с 5,4 млн в 2000 г. до 7,4 млн в 2011 г. Особенно заметный подъем заболеваемости ИБС наблюдался в 2004 г. (рис. 1). Рисунок 1. Число больных (18 лет и старше) ИБС, в том числе с впервые установленным диагнозом, в Российской Федерации в 2000—2011 гг. Увеличение заболеваемости скорее свидетельствует об улучшении диагностики ИБС, поскольку этот показатель в нашей стране определяется в основном обращаемостью населения за медицинской помощью.
Рисунок 1. Число больных (18 лет и старше) ИБС, в том числе с впервые установленным диагнозом, в Российской Федерации в 2000—2011 гг. Увеличение заболеваемости скорее свидетельствует об улучшении диагностики ИБС, поскольку этот показатель в нашей стране определяется в основном обращаемостью населения за медицинской помощью.
При оценке заболеваемости ИМ установлено, что число больных с этой патологией за прошедшее десятилетие оставалось практически стабильным и лишь в 2004 г. отмечался некоторый подъем данного показателя. Это касается как случаев первичного, так и повторного ИМ. Первичный ИМ преобладал и регистрировался в 87% случаев, а повторный ИМ в 12,5—13% случаев. Относительно стабильным также оставалось соотношение числа случаев первичного и повторного ИМ среди всех зарегистрированных случаев ИМ (рис. 2). Рисунок 2. Число больных первичным и повторным ИМ в Российской Федерации в 2000—2011 гг. В 2011 г. наблюдались снижение доли первичного ИМ до 83,8% и увеличение доли повторного ИМ до 16,2% в общем числе случаев ИМ.
Рисунок 2. Число больных первичным и повторным ИМ в Российской Федерации в 2000—2011 гг. В 2011 г. наблюдались снижение доли первичного ИМ до 83,8% и увеличение доли повторного ИМ до 16,2% в общем числе случаев ИМ.
Обращает внимание, что в структуре заболеваемости ИБС на долю ИМ приходилось лишь от 2,5 до 3,2%, а в структуре смертности — от 10,1 до 11,6%. Следует отметить, что на протяжении 9 лет доля зарегистрированных больных ИМ в числе больных ИБС снижалась, в то время как доля умерших от ИМ в структуре числа случаев смерти от ИБС ежегодно увеличивалась (табл. 1).
Смертность от ИМ (первичного и повторного) с 2000 по 2011 г. увеличилась на 3,8%. При этом число умерших от первичного ИМ сократилось на 5,3%, в то время как число умерших от повторного ИМ увеличилось на 33,7% (табл. 2). Большее число случаев смерти от первичного ИМ происходит вследствие его преобладания над повторным ИМ.
Большее число случаев смерти от первичного ИМ происходит вследствие его преобладания над повторным ИМ.
За анализируемый период существенной положительной динамики в смертности от первичного ИМ не отмечено, за исключением 2011 г., когда регистрировалось снижение данного показателя на 4,9% по сравнению с уровнем 2010 г.
В виду того что за последние 2 года коэффициенты смертности по половозрастным признакам в официальной статистике отсутствуют, смертность от ИМ у мужчин и женщин мы анализировали по абсолютным показателям. При этом выявлено увеличение числа смертей с 2004—2005 гг. по 2011 г. у женщин на 9,7%, а у мужчин — на 1,3% (рис. 3). Рисунок 3. Число умерших мужчин и женщин от ИМ в Российской Федерации в 2003—2011 гг.
Рисунок 3. Число умерших мужчин и женщин от ИМ в Российской Федерации в 2003—2011 гг.
Проведенный анализ смертности от ИМ (абсолютные показатели) у мужчин и женщин показал, что смертность мужчин в трудоспособном возрасте выше, чем у женщин. В 2003 г. число умерших мужчин превышало число умерших женщин от первичного ИМ в 7,5 раза, в 2011 г. — в 8,3 раза, от повторного ИМ — соответственно в 12 и 17,4 раза. В пенсионном возрасте число умерших женщин превышало число умерших мужчин от первичного ИМ в 2003 г. в 1,3 раза, а в 2011 г. — в 1,4 раза. Число умерших от повторного ИМ мужчин превысило число умерших женщин в 2003 г. в 1,2 раза, а в 2011 г. — в 1,1 раза (табл. 3).
Анализ особенностей смертности от ИМ (коэффициенты) в зависимости от пола также показал высокую смертность мужчин трудоспособного возраста, уровень которой превышал смертность женщин от первичного ИМ в 8,1 раза, а от повторного ИМ — в 13,7 раза (табл. 4).
При анализе смертности от ИМ в разных возрастных группах выявлены увеличение данного показателя у мужчин начиная 35—39 лет в 2,7 раза, у женщин — с 45—49 лет в 2,7 раза (2003 г.) по сравнению с предыдущей возрастной группой и прогрессивное его увеличение в последующих возрастных группах как у мужчин, так и у женщин. В 2009 г. наблюдалась аналогичная тенденция (табл. 5). Превышение смертности мужчин над аналогичным показателем у женщин в большей степени определялось в трудоспособном возрасте, а в пенсионном возрасте было значительно менее выраженным. Обращает внимание повышение смертности женщин в старших возрастных группах в 2009 г. по сравнению с 2003 г.
Превышение смертности мужчин над аналогичным показателем у женщин в большей степени определялось в трудоспособном возрасте, а в пенсионном возрасте было значительно менее выраженным. Обращает внимание повышение смертности женщин в старших возрастных группах в 2009 г. по сравнению с 2003 г.
Смертность от ИМ среди городских и сельских жителей значительно различалась: среди городского населения она была в 1,6 раза выше, чем среди сельского (2009 г.).
Анализируя больничную летальность от ИМ, следует отметить, что этот показатель с 2000 по 2011 г. составил 15—16%. Среди всех умерших больных от ИМ начиная с 2003 г. в стационаре умерли почти 60% (табл. 6), из них в первые 24 ч после поступления в стационар 40,4%, среди которых 33% — моложе 65 лет.
из них в первые 24 ч после поступления в стационар 40,4%, среди которых 33% — моложе 65 лет.
В первом десятилетии XXI века (2000—2011 гг.) в Российской Федерации, по данным официальной статистики, отсутствует существенная динамика заболеваемости ИМ и увеличивается смертность от него на 3,8%.
При анализе заболеваемости и смертности от ИМ в структуре ИБС становится очевидным, что столь невысокий процент, который занимает ИМ в структуре заболеваемости (около 3) и смертности (около 11) от ИБС, по-видимому, не отражает реально существующую ситуацию в нашей стране. Малая доля смертности от ИМ в структуре смертности от ИБС с относительно стабильным количеством случаев заболевания и низкой вариабельностью заболеваемости ИМ может свидетельствовать о том, что статистика оперирует с недостаточно верифицированными данными, о плохой диагностике ИМ вне медицинских организаций и, по-видимому, об ошибках врачей в кодировании заболеваемости и смертности от ИМ и ИБС в нашей стране. При сравнении заболеваемости ИБС и ИМ в Российской Федерации с другими странами оказалось, что в США показатели заболеваемости ИБС значительно ниже, чем в нашей стране. При этом около 50% всех случаев ИБС составляет ИМ [8], в то время как в России среди всех случаев ИБС стенокардия диагностируется в 43,5% случаев, другие формы ИБС — в 54,2%, а на долю ИМ приходится лишь 3% [10]. Согласно этим данным можно предполагать, что в нашей стране ИМ диагностируется и регистрируется значительно реже. Кроме того, если в США около 32,7% случаев смерти от ИБС обусловлено ИМ [11], то в Российской Федерации этот показатель достигает только 10,6% [12]. Согласно данным официальной статистики, у населения Российской Федерации преобладают хронические формы ИБС; высокая смертность от ИБС превышает таковую в США в 3 раза и эта ситуация ставит вопрос о причинах смерти больных ИБС [11—13]. Таким образом, данные официальной статистики по заболеваемости и смертности от ИБС и ИМ, по-видимому, не в полной мере соответствуют реальной ситуации.
Смертность от ИМ значительно преобладает у мужчин, особенно в трудоспособном возрасте. В последние годы отмечается увеличение числа случаев смерти от ИМ среди женщин в старших возрастных группах. Возможно, это связано с большей продолжительностью жизни женщин, более тяжелым течением ИМ и особенностями тактики лечения (женщинам проводится меньше процедур реваскуляризации).
С 2000 по 2011 г. наблюдается увеличение смертности от повторного ИМ на 33,7%, в то время как в других странах, например в Швеции, регистрируется снижение числа повторных ИМ [14]. Это может свидетельствовать о плохой вторичной профилактике ИМ и отсутствии преемственности в оказании медицинской помощи больным, перенесшим ИМ.
Кроме того, обращает внимание высокая больничная летальность от ИМ. По данным официальной статистики, больничная летальность от ИМ (15—16%) сопоставима с таковой в ряде российских исследований. Так, по результатам Регистра РЕКОРД, больничная летальность составила 13,2% [15], по данным исследования, проведенного в Люберецкой больнице Московской области, — 15,2% [16]. По данным Департамента здравоохранения Москвы, смертность от ИМ в московских стационарах в 2006 г. составила 15,4% (разброс данного показателя от 3,1 до 24,4%). Таким образом, показатель больничной летальности в Российской Федерации, по данным официальной статистики, по-видимому, отражает реальную ситуацию и согласуется с результатами других исследований. В экономически развитых странах мира летальность от ИМ существенно ниже. В регистре EHS летальность при остром коронарном синдроме (ОКС) с подъемом сегмента ST составила 7,5% [17], в регистре GRACE — 8% [18], а в регистре CRUSADE — 6% [19]. Особого внимания заслуживает проблема высокой больничной летальности в 1-е сутки после поступления в стационар (40,4%). Это обусловливает необходимость дополнительного анализа ее причин, среди которых можно выделить позднее поступление больных в медицинские организации, тяжесть состояния больных и, по-видимому, оказание специализированной медицинской помощи не на должном уровне (отсутствие выполнения тромболитической терапии, проведения реанимационных мероприятий и др.). Понимание причин высокой больничной летальности, особенно в 1-е сутки, позволит разработать меры по ее снижению. Созданная в СССР в 60—70-е годы прошлого века по инициативе и под руководством акад. Е.И. Чазова система оказания медицинской помощи больным с ИМ, признанная во всем мире, позволила существенно снизить больничную летальность от ИМ, которая составляла менее 10%, что сопоставимо с аналогичным показателем в зарубежных странах [20].
Для снижения заболеваемости и высокой смертности от ИМ в нашей стране представляется целесообразным реализация ряда мер, среди которых повышение эффективности первичной профилактики, включая специализированную, медико-санитарной помощи в поликлиниках и кардиологических диспансерах, повышение эффективности существующего до настоящего времени формального диспансерного наблюдения больных ИБС, в первую очередь перенесших ИМ. Так, в 2007 г. охват диспансерным наблюдением больных с ИМ составил 10% для первичного и 10,2% для повторного ИМ, а в 2011 г. — 14,5 и 11,7% соответственно. В настоящее время Министерством здравоохранения Российской Федерации готовится порядок диспансерного наблюдения, в том числе больных ССЗ, разрабатываемый специалистами Российского кардиологического научно-производственного комплекса.
С 2008 г. в рамках Национального проекта «Здоровье» под руководством Министерства здравоохранения и социального развития Российской Федерации в стране начала организовываться система медицинской помощи больным с острыми сосудистыми заболеваниями (ИМ, инсульт). Эта «сосудистая программа», включающая систему транспортировки, широкое использование тромболитической терапии, в том числе на догоспитальном этапе, применение высокотехнологичных методов лечения и современной медикаментозной терапии у больных с ОКС, в настоящее время активно развивается. Создаются и функционируют региональные сосудистые центры, в которых уже выполняются экстренные рентгеноэндоваскулярные вмешательства у больных ОКС. Так, по данным мониторинга региональных сосудистых центров, осуществляемого Минздравом России, число выполненных рентгеноэндоваскулярных вмешательств у больных с ОКС в 2009 г. составило 19 814, а в 2011 г. данный показатель увеличился в 2,8 раза и составил 55 227, при этом больничная летальность за 2009—2011 гг. составила 5,5%. Вместе с тем в сосудистых центрах существуют такие проблемы, как нехватка квалифицированных кадров, недостаточное финансовое обеспечение и др. Анализ показателей смертности от БСК свидетельствует о большем темпе снижения этого показателя в регионах, участвующих в «сосудистой программе». Так, за 2010—2011 гг. в регионах, участвующих в «сосудистой программе», смертность от БСК снизилась на 11,4%, в то время как в других регионах Российской Федерации — на 2,9%, что свидетельствует о вкладе реализации «сосудистой программы» в снижение смертности от БСК в нашей стране.
Для более полной и объективной оценки заболеваемости и смертности от ИМ и качества лечения больных с этим заболеванием в Российской Федерации представляются целесообразными проведение эпидемиологических исследований, а также сравнительного анализа результатов мониторинга региональных сосудистых центров, данных Федерального регистра ОКС [21] и результатов аудита сосудистых центров, проводимого специалистами Российского кардиологического научно-производственного комплекса. В настоящее время данный анализ выполняется.
По данным официальной статистики, в первом десятилетии XXI века в Российской Федерации наблюдается малая доля смертности от ИМ в структуре смертности от ИБС с относительно стабильным числом случаев ИМ и низкой вариабельностью заболеваемости ИМ.
Смертность от ИМ значительно преобладает у мужчин, особенно трудоспособного возраста. В последние годы отмечается увеличение числа случаев смерти от ИМ у женщин в старших возрастных группах.
За годы наблюдения регистрируется увеличение смертности от повторного ИМ (с 2000 по 2011 г. на 33,7%).
Сохраняется высокая больничная летальность от ИМ, которая за анализируемый период времени составляет 15—16%, с высоким уровнем летальности в 1-е сутки после поступления в стационар (40,4%).
Источник
