Сердечная недостаточность при раке прямой кишки
Рак прямой кишки – злокачественная опухоль, которая развивается в конечном отделе пищеварительного тракта, прямой кишке. Такие злокачественные новообразования объединяют с опухолями толстой и сигмовидной кишки под термином «колоректальный рак». В современном мире это один из самых распространенных типов рака.
Рак входит в число наиболее распространенных типов злокачественных опухолей. Он развивается при неоплазии (злокачественном перерождении) клеток слизистой оболочки прямой кишки – конечного отдела пищеварительного тракта. Риск заболеть в течение жизни для каждого человека составляет 4-5%. В случае своевременной диагностики и адекватно подобранной терапии данное онкологическое заболевание относительно легко поддается лечению и обладает хорошим прогнозом в отношении 5-летней выживаемости пациентов.
Группа особого риска: причины рака прямой кишки
В большинстве экономически развитых стран, за исключением Японии, рак прямой кишки — один из самых частых типов рака, встречающийся и у мужчин, и у женщин. Статистически достоверна взаимосвязь частоты развития рака прямой кишки и большого количества употребляемых в пищу мяса и животных жиров, дефицита в рационе питания грубой клетчатки и пищевых волокон, а также малоподвижного образа жизни. Рак прямой кишки занимает стабильное 3-е место в структуре заболеваемости злокачественными новообразованиями органов желудочно-кишечного тракта, составляет 45-55% среди новообразований кишечника.
Достоверно изучена только часть факторов, способствующих развитию злокачественных опухолей прямой кишки. Так, ряд веществ, образующихся в процессе переваривания животной пищи, в первую очередь мяса (индол, скатол) являются канцерогенами, и при длительном контакте со слизистой кишечника они способствуют метаплазии эпителия. Этот контакт увеличивается при обеднении пищи по пищевым волокнам, что нарушает естественный пассаж пищи и способствует хроническим запорам, вследствие длительного пребывания кала в ампулярном отделе прямой кишки.
К предраковым заболеваниям прямой кишки относят хронические воспалительные заболевания толстого кишечника: хронический проктит, хронический неспецифический язвенный проктосигмоидит, болезнь Крона.
Полипы кишечника
К заболеваниям с наиболее высокой онкогенностью относят полипоз кишечника из-за высокой частоты малигнизации (озлокачествления). Трансформация в рак происходит как при одиночных полипах в прямой кишке, так и при наличии множественных очагов. Особенно это касается случаев наследственного полипоза в семье.
В соответствии с классификацией Всемирной Организации Здравоохранения, аденомы кишки делятся на три разновидности: тубулярные, ворсинчато-тубулярные и ворсинчатые. Важную роль имеет первичная гистологическая диагностика биопсии полипов, полученной в ходе колоноскопии: например, ворсинчатые аденомы малигнизируются в 35-40% случаев, а в случае трубчатых аденом риск озлокачествления ниже – до 2-6%. Риск озлокачествления увеличивается в зависимости от размеров аденомы, особенно если ее диаметр более 1 см.

По данным биопсии, от 0,2 до 11% всех аденом кишечника, удаленных во время эндоскопии, содержат раковые клетки. Поначалу развивается «рак на месте», внутрислизистая карцинома, дисплазия высокой степени или инраэпителиальная неоплазия. Этими терминами обозначают злокачественные опухоли, которые находятся в самых поверхностных слоях слизистой оболочки. Их обозначают как Tis или рак на стадии 0. Такие злокачественные опухоли не метастазируют.
Когда опухоль прорастает в подслизистую основу, такой рак уже считается инвазивным, он может распространяться в лимфатические узлы и давать отдаленные метастазы.
Стадии рака прямой кишки
Опухоли прямой кишки классифицируются в соответствии с общепринятой системой TNM, в которой учитываются характеристики первичной опухоли (T), наличие очагов поражения в регионарных лимфатических узлах (N) и отдаленных метастазов (M).
Буква T может иметь индексы is, 1, 2, 3 и 4. Tis – опухоль, которая находится в пределах поверхностного слоя слизистой оболочки, не распространяется в лимфатические узлы и не метастазирует. T4 – рак, который пророс через всю толщу стенки прямой кишки и распространился в соседние органы.
Буква N может иметь индексы 0, 1 и 2. N0 – опухолевых очагов в регионарных лимфоузлах нет. N1 – очаги в 1–3 регионарных лимфоузлах или поражение брыжейки. N2 – очаги более чем в трех регионарных лимфатических узлах.
Буква M может иметь индексы 0 или 1. M0 – отдаленные метастазы отсутствуют. M1a – отдаленные метастазы в одном органе. M1b – отдаленные метастазы в двух и более органах, либо опухолевое поражение брюшины.
В зависимости от этих характеристик, выделяют пять стадий:
- 0 — Опухоль находится в слизистой оболочке (иногда внутри полипа) и не распространяется глубже (Tis). Такие новообразования называют “раком на месте” (in situ).
- I — Опухоль распространяется за пределы слизистой оболочки – в подслизистую основу (T1) или мышечный слой (T2). При этом раковые клетки отсутствуют в лимфатических узлах (N0), нет отдаленных метастазов (M0).
- II — Опухоль прорастает через стенку прямой кишки, может распространяться на соседние ткани. На стадии IIa рак распространяется глубоко в стенку кишки, но не прорастает ее насквозь (T3). На стадии IIb опухоль прорастает стенку кишки, но не вторгается в окружающие ткани (T4a). На всех этих подстадиях не поражены лимфоузлы (N0), отсутствуют метастазы (M0). На стадии IIc рак прорастает в соседние органы (T4b), либо не прорастает через стенку кишки (T1-2), но поражены 1-3 регионарных лимфоузла (N1), либо жировая ткань в области лимфоузлов (N1c).
- III — опухоль распространяется в соседние органы и в лимфоузлы, которые находятся рядом с прямой кишкой. При этом отсутствуют отдаленные метастазы (M0)
- IV — имеются отдаленные метастазы. На стадии IVA метастаз всего один (M1a), на стадии IVB – более одного (M1b), на стадии IVC раковые клетки распространяются на отдаленные участки брюшины (M1c).
Чем может проявляться рак прямой кишки?
Прямая кишка (лат. rectum) — это конечный участок толстого кишечника длиной около 14-18 см, в котором заканчиваются пищеварительные процессы и происходит формирование каловых масс. Прямая кишка состоит из нескольких анатомических участков, имеющих различное эмбриональное происхождение и гистологическое строение, что обуславливает существенные различия в характере течения рака прямой кишки в зависимости от уровня её поражения.
Прямая кишка делится на 3 части:
- анальную (промежностную), длиной 2,5 – 3,0 см, в которой расположены мышцы-сфинктеры, управляющие процессом дефекации,
- среднюю – ампулярную, длиной 8,0-9,0 см, в которой происходит всасывание жидкой части пищевого комка и формируются каловые массы,
- надампулярную, покрытую брюшиной, длиною около 4,0-5,0 см.
Злокачественные новообразования прямой кишки чаще всего локализуются в ампулярном отделе (до 80 % случаев), реже всего – в аноректальном отделе (5-8 %).
В ампулярном и надампулярном отделах прямой кишки, покрытом однослойным железистым эпителием, чаще наблюдается железистый рак – аденокарцинома, солидный рак, перстневидно-клеточный, смешанный, скирр. В целом аденокарцинома составляет 96% от всех случаев колоректального рака. Эта опухоль развивается из железистых клеток слизистой оболочки, которые продуцируют слизь. Чаще всего, употребляя термин “колоректальный рак”, врачи имеют в виду именно аденокарциному.
Аноректальный отдел прямой кишки, выстланный многослойным плоским неороговевающим эпителием, чаще поражает плоскоклеточный рак и меланома. Плоскоклеточный рак составляет около 90% злокачественных опухолей аноректального отдела.
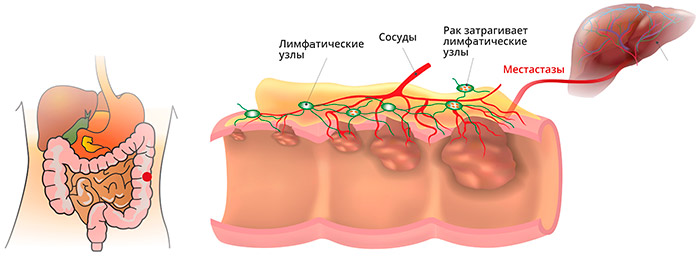
Метастазы при раке прямой кишки
Анатомические особенности прямой кишки, ее кровоснабжения и лимфооттока, определяют и характер преимущественного распространения метастазов:
- Рак прямой кишки метастазирует в регионарные лимфоузлы, расположенные в жировой клетчатке вокруг кишки (параректально) и в промежности, по ходу сосудов и нервов.
- Из-за особенностей венозного оттока из верхних отделов прямой кишки в систему воротной вены печени, очень часто метастазирование происходит непосредственно в печень.
- Кроме того, из-за обильного кровоснабжения нижних отделов прямой кишки, опухоль метастазирует по системе нижней полой вены в легкие, кости и другие органы.
Симптомы рака прямой кишки
- Первыми признаками рака прямой кишки при большинстве локализаций являются нарушения стула в виде хронических запоров и поносов, ощущения неполноценной дефекации, ложные позывы к ней (тенезмы), выделения из анального канала (слизь, кровь, гной).
- Кроме того, у большинства пациентов рано появляется болезненность при дефекации, обусловленная прорастанием опухолью стенок кишки и нарушением функции соответствующих нервов.
- При поражении мышц, формирующих анальные сфинктеры, развивается недержание кала и газов.
- Боли являются первым признаком рака прямой кишки только при раке аноректальной зоны c вовлечением в опухолевый процесс сфинктера прямой кишки. Характер боли при раке прямой кишки на ранних стадиях эпизодический, далее она может стать постоянной.
- При растущих в просвет кишки (экзофитных) и блюдцеобразных опухолях, опухолях-язвах первыми проявлениями онкологического заболевания может стать кровотечение или воспалительный процесс. Кровотечение отмечается у 75-90 % больных раком прямой кишки чаще всего в виде примеси крови в кале.
- Вместе с кровью на поздних стадиях рака могут выделяться слизь и гной.
- Ухудшение общего самочувствия (общая слабость, быстрая утомляемость, анемия, похудение, бледность кожных покровов), обусловленное длительной хронической кровопотерей и опухолевой интоксикацией, характерно для поздних стадий злокачественных образований прямой кишки.
Прямая кишка отделена тонкими фасциями и небольшим количеством рыхлой клетчатки от мочевого пузыря, семенных пузырьков и предстательной железы у мужчин, матки и задней стенки влагалища — у женщин. Поэтому при увеличении размеров опухолевого очага в дополнение к нарушениям функции прямой кишки относительно часто наблюдаются нарушения функции окружающих органов, вплоть до недержания мочи.
Диагностика рака прямой кишки
Основу диагностики рака прямой кишки составляют эндоскопические методики и биопсия. Опухоль можно выявить с помощью проктоскопа – специального инструмента с миниатюрной видеокамерой, который вводят в прямую кишку. При этом врач может увидеть новообразование, определить его размеры, положение, оценить, насколько близко оно расположено по отношению к сфинктеру.
Колоноскопия позволяет оценить состояние не только прямой, но и всей толстой кишки. При этом через задний проход вводят колоноскоп – инструмент в виде тонкой длинной гибкой трубки с видеокамерой. Его проводят через всю толстую кишку, осматривая ее слизистую оболочку. Колоноскопия – безболезненная процедура, во время нее пациент находится в состоянии медикаментозного сна.

Во время эндоскопии проводят биопсию: врач получает фрагмент патологически измененного участка слизистой оболочки и отправляет в лабораторию для цитологического, гистологического исследования.
Для оценки стадии рака прямой кишки и поиска метастазов применяют УЗИ брюшной полости, рентгенографию грудной клетки, МРТ, компьютерную томографию, ПЭТ-сканирование. Трансректальное УЗИ проводят с помощью специального ультразвукового датчика, который вводят в прямую кишку. Исследование помогает оценить, насколько опухоль распространилась в окружающие ткани за пределами кишки.
Лечится ли рак прямой кишки?
В соответствии с международными протоколами по результатам диагностического обследования определяется распространенность рака прямой кишки. При этом в дополнение к международной классификации TNM, часто применяют разделение рака на 1-4-ю стадии, а также классификацию Дюка, учитывается гистологическое строение опухоли, степень дифференцировки и особенности метастазирования в зависимости от расположения в прямой кишке, наличие осложнений.
Правильно поставленный диагноз стадии опухолевого процесса при раке прямой кишки позволяет выбрать наиболее рациональную схему лечения с учетом международных руководств, включив в нее хирургическую операцию, лучевую терапию, химиотерапию и терапию таргетными препаратами.
Варианты лечения рака прямой кишки на разных стадиях
На выбор тактики лечения при раке прямой кишки влияют разные факторы, но ведущее значение имеет стадия опухоли.
На 0 и I стадии обычно показано только хирургическое вмешательство. Иногда можно ограничиться удалением полипа – полипэктомией. В других случаях выполняют трансанальную резекцию прямой кишки, низкую переднюю резекцию, проктэктомию с коло-анальным анастомозом, абдоминально-промежностную резекцию. Если операция не может быть проведена из-за слабого здоровья пациента, применяют лучевую терапию,
На II стадии хирургическое лечение сочетают с химиотерапией и лучевой терапией. Наиболее распространенная схема выглядит следующим образом:
- На начальном этапе пациент получает курс химиотерапии (обычно 5-фторурацил или капецитабин) в сочетании с лучевой терапией. Это помогает уменьшить размеры опухоли и облегчить ее удаление.>
- Затем выполняется хирургическое вмешательство. Обычно это низкая передняя резекция, проктэктомия с коло-анальным анастомозом или абдоминально-промежностная резекция – в зависимости от локализации опухоли.
- После операции снова проводится курс химиотерапии, как правило, в течение 6 месяцев. Применяют разные комбинации препаратов: FOLFOX, CAPEOx, 5-фторурацил + лейковорин или только капецитабин.
На III стадии схема лечения будет выглядеть аналогичным образом, но объем хирургического вмешательства будет больше, так как в процесс вовлечены регионарные лимфатические узлы.
На IV стадии тактика зависит от количества метастазов. Иногда они единичные, и их можно удалить, как и первичную опухоль. Операцию дополняют химиотерапией и лучевой терапией. Для борьбы с очагами в печени может быть применена внутриартериальная химиотерапия, когда раствор лекарственного препарата вводят непосредственно в артерию, питающую опухоль.
Если метастазов много, удалить их хирургическим путем невозможно. В таких случаях бывают показаны лишь паллиативные операции, например, для восстановления проходимости кишки, если ее просвет заблокирован опухолью. Основным же методом лечения является применение химиопрепаратов и таргетных препаратов. Врачи в Европейской клиники подбирают лечение в соответствии с международными протоколами и особенностями злокачественной опухоли у конкретного больного.
Профилактика рака прямой кишки
Хотя защититься от рака прямой кишки, как и от других онкологических заболеваний, на 100% невозможно, некоторые меры помогают снизить риски:
- Ешьте больше овощей и фруктов, сократите в рационе количество жирного мяса.
- Откажитесь от алкоголя и курения.
- Регулярно занимайтесь спортом.
- Некоторые исследования показали, что защититься от колоректального рака помогает витамин D. Но прежде чем принимать его, нужно проконсультироваться с врачом.
- Если в вашей семье часто были случаи рака прямой кишки, вам стоит проконсультироваться с клиническим генетиком.
- Если у вас диагностировали наследственное заболевание, которое приводит к образованию полипов и злокачественных опухолей кишечника, вам нужно регулярно проходить колоноскопию.<
- После 50 лет пройти колоноскопию рекомендуется каждому человеку. Если во время исследования не обнаружено никаких патологий, его нужно повторить через пять лет.
Продолжительность жизни
Прогноз и продолжительность жизни напрямую зависят от стадии рака. Эффективность лечения определяется показателем пятилетней выживаемости. Согласно данным Американского Онкологического Общества (American Cancer Society), процент выживаемости при раке прямой кишки составляет:
- I стадия — 87%.
- II стадия — 49–80%.
- III стадия — 58–84%.
- IV стадия — 12%.
Цены на лечение рака прямой кишки
- Передняя резекция прямой кишки с регионарной лимфаденэктомией — 205000 руб.
- Брюшно-промежностная экстирпация прямой кишки с мезоректумэктомией и регионарной лимфаденэктомией – 240000 руб.
- Проведение системной химиотерапии у пациентов с диссеминированным колоректальным раком — 553000 руб.
- Проведение системной химиотерапии у пациентов с выявленной мутацией гена BRAF— 713000 руб.
Источник
Патология желудочно-кишечного тракта развивается у лиц с клинически манифестированной сердечной недостаточностью (СН) в клинически значимом проценте случаев, при этом качество жизни больных иногда значительно ухудшается вне связи с основным заболеванием. Нам представляется целесообразным отразить весь спектр «гастроэнтерологической» симптоматики, расположив ее по органному принципу.
Полость рта. Увеличение языка в объеме часто представляется единственным патогномоничным для сердечной недостаточности «стоматологическим» симптомом. Несмотря на то что это состояние коррелирует со степенью тяжести СН, в настоящее время оно встречается крайне редко. Другие симптомы — патологические элементы на слизистой оболочке, языке и губах — ассоциированы со снижением иммунитета, нутритивной недостаточностью или являются самостоятельными заболеваниями, причинно с СН не связанными [1].
Орофарингеальная дисфагия (ОД) — осложнение раннего послеоперационного периода в кардиохирургии [2]. Так, при изучении 1042 больных, подвергшихся операции на сердце по различному поводу, ОД выявлена более чем у 4% больных. При этом в 6,4% случаев идентифицирована оральная дисфагия, в 22,6% — фарингеальная, у остальных больных дисфагия имела смешанную природу [3]. Независимыми факторами риска возникновения ОД в послеоперационном периоде служат: пожилой возраст, сахарный диабет , почечная недостаточность, гиперлипидемия и наличие клинической симптоматики хронической сердечной недостаточности перед операцией. При этом отмечают, что стоимость лечения одного случая ОД является наибольшей именно при наличии ХСН [3].
Пищевод и желудок. Эпизоды гастроэзофагеального рефлюкса (ГЭР) можно разделить на 2 группы: дневные, или ГЭР в вертикальной позиции, и ночные, или ГЭР в горизонтальной позиции.
В 2001 г. в США проводили крупное исследование, целью которого служило выявление частоты эпизодов ночного ГЭР и его влияния на качество жизни пациентов с различными заболеваниями.
Показано, что у больных кардиологического профиля 74% эпизодов ГЭР наблюдаются в ночное время. При этом достоверно ухудшаются физическое (р < 0,001), психическое (р < 0,001) самочувствие и качество жизни в целом(р < 0,001). Отмечают также, что снижение качества жизни у пациентов данной группы вследствие ночных эпизодов ГЭР больше, чем при симптомах артериальной гипертензии, и сравнимо с изменением данного показателя, связанным с наличием стенокардии и хронической сердечной недостаточности [4].
Дисфагия у пациентов с сердечной недостаточностью имеет также эзофагеальную природу. Причинами этого служат: аневризма грудного отдела аорты, атеросклеротическая деформация аорты, изменения конфигурации подключичных артерий, дилатация левого предсердия [5].
При эндоскопическом исследовании при дисфагии пищеводной этиологии обычно выявляются пульсации его стенки, совпадающие с периферическим пульсом, и компрессия просвета пищеварительной трубки в средних отделах пищевода. Изменений со стороны слизистой обычно не наблюдается, и эндоскоп свободно проходит через суженный участок. Наличие подобных стенотических изменений в дистальных и проксимальных отделах косвенно свидетельствует о дилатации всех камер сердца [6].
При исследовании с барием при дилатации левого предсердия определяется отклонение пищевода кзади одновременно с нарушением пассажа взвеси по просвету трубки.
Пищеводная манометрия выявляет зону высокого давления, возникающую с циклической частотой в зависимости от сердечных сокращений. Периодические осцилляции характерны для пациентов с синусовым ритмом, нерегулярные — для лиц с мерцанием предсердий [7].
До зоны высокого давления и после нее перистальтические волны обычно не изменены, что, по мнению ряда авторов, свидетельствует о причинной связи между компрессией и дисфагией [8]. Тем не менее ишемия сплетений Мейсснера и/или Ауэрбаха, а также компрессия ствола блуждающего нерва способны значительным образом изменить перистальтику пищевода [9].
Печень. Клетки печени очень чувствительны к недостатку кислорода, и при наличии низкого артериального давления и сниженного сердечного выброса наблюдаются изменения морфологии и функциональной способности ткани печени. Вследствие анатомических особенностей наиболее чувствительна к гипоксии левая доля печени [10].
Гипоксия вызывает дегенерацию гепатоцитов в зоне 3, расширение синусоидов и замедление секреции желчи. Это происходит, несмотря на высокий коэффициент поглощения кислорода, вследствие особенностей кровообращения. Компенсаторно увеличивается поглощение кислорода из крови синусоидов. Небольшое нарушение диффузии кислорода может возникать в результате склероза пространства Диссе [11].
Снижение артериального давления при низком сердечном выбросе приводит к некрозу гепатоцитов. Рост давления в печеночных венах и связанный с этим застой определяются уровнем центрального венозного давления [7, 11, 12]. При этом даже незначительные неблагоприятные изменения гемодинамики (гипотензия, эмболические осложнения, физическая нагрузка) ведут к усилению поражения гепатоцитов [7].
Больные обычно слегка желтушны. Выраженная желтуха наблюдается редко и обнаруживается у больных с хронической сердечной недостаточностью на фоне ИБС или митрального стеноза. У госпитализированных больных наиболее распространенной причиной повышения концентрации билирубина в сыворотке служат заболевания сердца и легких. Длительно существующая или рецидивирующая сердечная недостаточность ведeт к усилению желтухи. На отечных участках желтизны не отмечается, так как билирубин связан с белками и не поступает в отечную жидкость с низким содержанием белка [11].
Пациент может жаловаться на боли в правых отделах живота, вызванные, вероятнее всего, растяжением капсулы увеличенной печени. Край печени плотный, гладкий, болезненный, может определяться на уровне пупка.
Повышение давления в правом предсердии передается на печеночные вены, особенно при недостаточности трикуспидального клапана. При использовании инвазивных методов кривые изменения давления в печеночных венах у таких больных напоминают кривые давления в правом предсердии. Пальпаторно определяемое расширение печени во время систолы также может объясняться передачей давления. У больных с трикуспидальным стенозом обнаруживают пресистолическую пульсацию печени. Набухание печени выявляют путем бимануальной пальпации. При этом одну руку располагают в проекции печени спереди, а вторую — на области задних отрезков правых нижних ребер. Увеличение размеров позволит отличить пульсацию печени от пульсации в эпигастральной области, передающейся от аорты или гипертрофированного правого желудочка. Важно установление пульсации с фазой сердечного цикла [7, 11].
У больных с сердечной недостаточностью давление на область печени приводит к увеличению венозного возврата. Нарушенные функциональные возможности правого желудочка не позволяют справиться с возросшей преднагрузкой, что вызывает повышение давления в яремных венах. У больных с окклюзией или блоком печеночных, яремных или магистральных вен средостения рефлюкс отсутствует.
Давление в правом предсердии передается на сосуды вплоть до портальной системы. С помощью импульсного дуплексного допплеровского исследования можно определить усиление пульсации воротной вены; при этом амплитуда пульсации определяется выраженностью сердечной недостаточности [13]. Однако фазные колебания кровотока обнаруживаются не у всех больных с высоким давлением в правом предсердии [14].
Установлена связь асцита со значительно повышенным венозным давлением, низким сердечным выбросом и выраженным некрозом гепатоцитов в зоне наихудшего кровообращения. Это сочетание обнаруживают у больных с митральным стенозом, недостаточностью трикуспидального клапана или констриктивным перикардитом. При этом выраженность асцита может не соответствовать тяжести отеков и клиническим проявлениям застойной сердечной недостаточности.
Признаки портальной гипертензии (за исключением спленомегалии) обычно отсутствуют, за исключением больных с тяжелым сердечным циррозом в сочетании с констриктивным перикардитом.
Печеночная недостаточность встречается редко, однако этот синдром может быть единственным клиническим проявлением нераспознанной кардиальной патологии [15].
Биохимические сдвиги обычно умеренно выражены и определяются степенью тяжести сердечной недостаточности. Активность щелочной фосфатазы может быть незначительно повышенной или нормальной. Возможно небольшое снижение концентрации альбумина в сыворотке, чему способствуют потери белка через кишечник [11].
Тонкий кишечник. При изучении 187 пациентов с миокардитом в 9 (4,4%) случаях выявлены антиэндомизиальные антитела, являющиеся специфическим маркером глютеновой энтеропатии (кишечного спру). Во всех случаях получены эндоскопические и гистологические доказательства поражения кишечника. В данной группе больных 55% имели клинические признаки хронической сердечной недостаточности [16]. Терапия иммуносупрессорами и назначение специфической диеты позволили добиться одновременного улучшения функциональной способности сердца и иммунологической активности процесса.
Наличие правожелудочковой недостаточности сопряжено с повышением центрального венозного давления — фактора, являющегося причиной значительной потери белка из пищеварительной трубки. Это происходит из-за неблагоприятных изменений в лимфатических сосудах (застой) стенки кишечника. Учитывая тот факт, что в большинстве случаев даже при тяжелой сердечной недостаточности не наблюдается клинически значимой потери белка, ряд авторов приходят к выводу, что для развития протеин-теряющей энтеропатии необходим особый преморбидный фон — в частности, наличие не связанных с функцией сердца изменений лимфатических сосудов кишечника (например, врожденной кишечной лимфангиэктазии) [7].
Потеря белка через кишечник развивается наиболее часто при констриктивном перикардите, среди других причин — врожденный стеноз легочной артерии, недостаточность трикуспидального клапана, карциноидный синдром и дефект межпредсердной перегородки [7, 17]. Диарея развивается приблизительно в 50% случаев, стеаторея — крайне редко. Не следует забывать, что гипоальбуминемия может быть связана с общим увеличением жидкости в организме (феномен «разведения»).
Диагноз основан на клинико-лабораторных показателях (гипопротеинемия и гипоальбуминемия) и подтверждается одним из 3 нижеперечисленных методов: изучение экскреции альбумина, меченного 51Cr; биопсия слизистой тонкого кишечника; определение фекального α1-антитрипсина (молекулярная масса и общее количество, проводится параллельно с исследованием альбумина).
Толстый кишечник. Хотя известны сообщения об одновременном наличии хронической сердечной недостаточности и ряда заболеваний толстого кишечника, особенно его ректосигмоидального отдела, исследований данного вопроса, удовлетворяющих требованиям доказательной медицины, не проводилось. На настоящий момент нельзя с уверенностью говорить о наличии специфических или ассоциированных изменений конечного отдела пищеварительной трубки при хронической сердечной недостаточности.
По вопросам литературы обращайтесь в редакцию.
С. Н. Терещенко, доктор медицинских наук, профессор
И. В. Жиров, кандидат медицинских наук
МГМСУ, Москва
Источник
