Реперфузионная терапия при инсульте
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
При наличии показаний (клинический диагноз ишемического инсульта, возраст от 18 до 80 лет, время не более 3 часов от начала заболевания –«терапевтическое окно») в экстренном порядке показана реперфузионная терапия ишемического инсульта.
Экстренно необходимы:
1. Клинический осмотр с оценкой неврологического статуса по шкале NIHSS.
2. Мониторирование АД не реже, чем каждые 15 минут, в случаях когда АД систолическое более 185 мм.рт.ст., АД диастолическое более 105 мм.рт.ст. необходима коррекция АД.
3. Проведение лабораторных исследований крови (общий анализ крови с обязательным определением числа тромбоцитов, определение уровня гликемии, АЧТВ и МНО).
4. Установка периферического венозного катетера.
5. Мониторирование неврологического статуса.
Внутривенная тромболитическая терапия (ТЛТ) при ишемическом инсульте должна проводиться в условиях палаты блока интенсивной терапии многопрофильного стационара при обязательном наличии круглосуточных служб нейровизуализации и лабораторной диагностики. Показания и противопоказания к тромболизису оцениваются еще на этапе приемного покоя, см. протокол «Клинический протокол. Острый инсульт. Приемный покой». Риск и потенциальная польза тромболизиса должны обсуждаться с пациентом и его семьей. После чего пациентом или его уполномоченным законным представителем подписывается информированное согласие.
Пациент, получающий тромболитическую терапию, также наблюдается в соответствии с основными принципами лечения острого инсульта, см. протокол «Клинический протокол. Ишемический инсульт. Блок нейрореанимации».
1. Базисная терапия (вне зависимости от характера инсульта)
– контроль и обеспечение функционирования жизненно важных функций (дыхание, центральная гемодинамика)
– мониторирование и коррекция уровня оксигенации
– контроль температуры тела
– контроль основных параметров гомеостаза
– контроль за глотанием
– контроль за состоянием мочевого пузыря, кишечника, кожных покровов.
2. Лечение сопутствующих неврологических нарушений (отек головного мозга, судорожный синдром, острая окклюзионная гидроцефалия, кровоизлияние в зону инфаркта, дислокация)
3. Ранние реабилитационные мероприятия
4. Профилактика и терапия висцеральных осложнений (пневмония, ТЭЛА, тромбоэмболии глубоких вен нижних конечностей, пептические язвы, пролежни и др.)
Реперфузионная терапия ишемического инсульта
Основные методы реперфузии:
1. Восстановление и поддержание системной гемодинамики (удержание АД на перфузионно достаточном уровне)
2. Тромболизис
3. Гемангиокоррекция (антикоагулянтная и антиагрегантная терапия).
Реперфузия должна быть активной и кратковременной с реперфузионным периодом не более 3-6 часов.
Тромболитическая терапия
Тромболитическая терапия (ТЛТ) – единственный метод с высокой степенью доказательности, приводящий к реканализации.
Виды тромболитической терапии:
Медикаментозная ТЛТ
– системный (внутривенный тромболизис)
– внутриартериальный (селективный тромболизис)
– комбинированный (внутривенный+ внутриартериальный, внутриартериальный+механический)
Механическая ТЛТ
– УЗ деструкция тромба
– аспирация тромба ( с использованием устройств Catch, Merci Retrieval System)
Показания для внутривенной ТЛТ
1. Клинический диагноз ишемического инсульта
2. Возраст от 18 до 80 лет
3. Время не более 3 часов от начала заболевания
Противопоказания для внутривенной ТЛТ
1. Время появления первых симптомов больше 3 часов от начала заболевания или не известно (например «ночной» инсульт).
2. АД систолическое более 185 мм.рт.ст., АД диастолическое более 105 мм.рт.ст.
3. КТ- иили МРТ- признаки внутричерепного кровоизлияния, опухоли мозга, артериовенозной мальформации, абсцесса мозга, аневризмы церебральных сосудовили МРТ признаки.
4. КТ- иили МРТ-признаки обширного инфаркта мозга: очаг ишемии распространяется на территорию более бассейна средней мозговой артерии.
5. Бактериальный эндокардит.
6. Гипокоагуляция.
– прием непрямых антикоагулянтов и МНО менее 1,5
– в предшествующие 48 часов вводился гепарин и АЧТВ выше нормы
7. Предшествующие инсульт или тяжелая черепно-мозговая травма в течении 3 месяцев.
8. Неврологические симптомы за время наблюдения существенно регрессировали, легкий инсульт (NIHSS менее 4 баллов).
9. Тяжелый инсульт (NIHSS более 24 баллов).
10. Легкие и изолированные неврологические симптомы (дизартрия, атаксия)
11. Проводится дифференциальная диагностика с субарахноидальным кровоизлиянием.
12. Геморрагические инсульты в анамнезе.
13. Инсульты любого генеза в анамнезе у больного сахарным диабетом.
14. Инфаркт миокарда в течении последних 3 месяцев.
15. Желудочно-кишечные кровотечения или кровотечения из мочеполовой системы за последние 3 недели.
16. Большие операции или тяжелые травмы за последние 14 суток, малые операции или инвазивные вмешательства в последние 10 дней.
17. Пункции трудно прижимаемых артерий за последние 7 суток.
18. Беременность, а также 10 дней после родов.
19. Количество тромбоцитов менее 100*109л.
20. Глюкоза крови менее 2,7 ммольл или более 22 ммольл.
21. Геморрагические диатезы, включая почечную и печеночную недостаточность
22. Данные о кровотечении или острой травме (переломе) на момент осмотра.
23. Низкая степень самообслуживания до инсульта (по модифицированной шкале Рэнкина менее 4 баллов), (приложение 2).
24. Судорожные приступы в дебюте заболевания, если нет уверенности, что приступ является клинической манифестацией ишемического инсульта с постиктальным резидуальным дефицитом в анамнезе.
Дозы и методика введения препарата
В качестве тромболитика на сегодняшний день (опираясь на доказательность) возможно применение единственного препарата- рекомбинантный тканевой активатор фибриногена (rt-PA) (Альтеплаза, Актилизе, «Берингер Ингельхайм) в дозе 0,9 мгкг массы тела пациента, 10% препарата вводят внутривенно болюсно, остальную дозу внутривенно капельно в течении 60 минут как можно раньше в пределах 3 часов после начала ишемического инсульта.
Протокол ведения пациентов при ТЛТ
– Оценивать витальные функции (частоту пульса и дыхания, сатурацию крови кислородом, температуру тела) и неврологический статус с оценкой по шкале NIHSS каждые 15 минут в процессе введения альтеплазы, каждые 30 минут в последующие 6 часов и каждый час до истечения 24 часов после введения препарата.
– Контролировать АД каждые 15 минут в первые 2 часа, каждые 30 минут последующие 6 часов и каждый час до истечения 24 часов после введения препарата.
– Измерять АД каждые 3-5 минут при систолическом АД выше 180 мм.рт.ст. или диастолическом выше 105 мм.рт.ст. и назначить антигипертензивные препараты для поддержания его ниже этих пределов.
– Контролировать и корректировать уровень глюкозы на рекомендуемом уровне.
– Воздержаться от использования назогастральных зондов, мочевых, внутрисосудистых катетеров в первые сутки после ТЛТ (при необходимости установка их до ТЛТ).
– При наружных кровотечениях применять давящие повязки.
– Следить за признаками появления крови в моче, кале, рвотных массах.
Если у пациента повысилось АД , появилась сильная головная боль, тошнота или рвота, прекратить введение альтеплазы и срочно провести повторную КТ мозга.
Пациент должен соблюдать постельный режим и воздержаться от еды в течении 24 часов.
Повторные нейровизуализационные исследования (КТ или МРТ головного мозга) необходимо провести через 24 часа или ранее при ухудшении состояния пациента. Транскраниальное доплерографическое мониторирование оказывает дополнительное воздействие ультразвуком, улучшая эффект фибринолиза (при постоянном зондировании в диагностическом режиме 2 МГц), осуществляет верификацию реканализации или реокклюзии.
Из-за высокого риска геморрагических осложнений следует избегать назначения антиагрегантов и антикоагулянтов первые 24 часа! после проведения ТЛТ. Перед назначением антикоагулянтов и антиагрегантов у пациентов после ТЛТ необходимо проведение КТМРТ головного мозга для исключения геморрагических осложнений.
Осложнения ТЛТ и неблагоприятные реакции
Наиболее частыми неблагоприятными реакциями при введении альтеплазы являются геморрагические осложнения. Выделяют следующие типы кровотечений, связанных с ТЛТ:
– Поверхностные кровоизлияния (подкожные, внутримышечные- в местах инъекций, ушибов; кровотечения со слизистой ротовой полости)
– Внутренние кровоизлияния (в желудочно-кишечном или урогенитальном тракте, в забрюшинном пространстве, центральной нервной системе или кровотечения из паренхиматозных органов).
При лечении острого ишемического инсульта наиболее грозными являются симптомные внутримозговые кровоизлияния, в первую очередь:
1. Геморрагические трансформации ишемического очага.
Выделяют следующие формы:
1. Геморрагический инфаркт:
– геморрагический инфаркт 1 типа (небольшие петехии)
– геморрагический инфаркт 2 типа (сливающиеся петехии)
2. Паренхиматозное кровоизлияние:
– паренхиматозное кровоизлияние 1 типа (менее 30% объема инфаркта)
– паренхиматозное кровоизлияние 2 типа (более 30% объема инфаркта)-симптомное внутримозговое кровоизлияние. Геморрагические трансформации ишемического очага определяются как симптомные, если развитие трансформации приводит к усугублению неврологической симптоматики на 4 балла по шкале NIHSS или смерти пациента.
2. Кровоизлияние вне очага
Кроме этого, различают ранние, возникающие в интервале до 24-36 ч. От проведения ТЛТ и поздние геморрагические трансформации.
В случае развития потенциально опасного кровотечения ведение альтеплазы должно быть прекращено. В большинстве случаев необходимости в замещении факторов свертывания не возникает вследствие короткого периода полувыведения альтеплазы. У большинства пациентов с геморрагическим осложнением достаточно прекращения введения альтеплазы и осуществления мануальной компрессии кровоточащего сосуда. В случаях, когда консервативные меры недостаточны, показано использование препаратов крови (криопреципитата, свежезамороженной плазмы).
Значительно реже на фоне введения альтеплазы возникают аллергические реакции м ангионевротический отек язвка и губ. У некоторых пациентов введение альтеплазы сопровождается тошнотой и рвотой.
Внутриартериальный тромболизис при ишемическом инсульте
Внутриартериальный тромболизис показан пациентам с окклюзией проксимальных сегментов интрацеребральных артерий. Применение внутриартериального тромболизиса предполагает пребывание пациента в инсультном центре высокого уровня с круглосуточным доступом к церебральной ангиографии. Внутриартериальный тромболизис является методом выбора у пациентов с тяжелым ишемическим инсультом давностью до 6 часов, при инсульте в вертебро-базилярном бассейне до 12 часов. Во время эндоваскулярного вмешательства возможны внутриартериальное введение тромболитика (Альтеплаза) и применение механических методов реканализации. Важным является то, что возможность проведения эндоваскулярного вмешательства в большинстве случаев не должно быть основанием для отказа от внутривенной ТЛТ согласно показаниям.
Показания для внутриартериального тромболизиса
1. Клинический диагноз ишемического инсульта с оценкой по шкале NIHSS не менее 10 баллов и не более 24 баллов.
2. Возраст от 18 до 75 лет.
3. Время не более 6 часов от начала заболевания.
Противопоказания для внутриартериального тромболизиса
Отбор пациентов для эндоваскулярных (внутриартериальных) вмешательств при остром ишемическом инсульте осуществляется на основании критериев исключения аналогичных противопоказаниям для внутривенной ТЛТ. Эндоваскулярные вмешательства проводятся под многокомпонентным медикаментозным наркозом в отделении рентгенохирургических методов диагностики и лечения.
Источник
В статье рассматриваются возможности применения в остром периоде ишемического инсульта технологий реперфузионной терапии: системной тромболитической терапии, селективного внутриартериального тромболизиса и тромбоэмболэктомии. Отмечается, что указанные технологии при применении в первые часы ишемического инсульта достоверно улучшают исходы заболевания, обусловливая снижение смертности, и достоверно увеличивают количество пациентов с хорошим восстановлением нарушенных неврологических функций.
Рисунок. Количество процедур системной тромболитической терапии, выполненных в сосудистых центрах Российской Федерации
Таблица 1. Характеристики пациентов с ишемическим инсультом, которым проводилась системная тромболитическая терапия
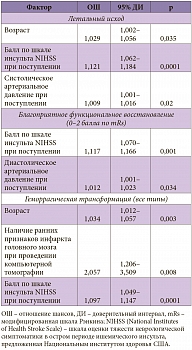
Таблица 2. Факторы, ассоциированные с летальным исходом, благоприятным функциональным восстановлением и развитием любого типа геморрагической трансформации зоны ишемического инсульта после тромболитической терапии
Таблица 3. Сравнение результатов внедрения тромболитической терапии в Российской Федерации с результатами исследований NINDS, ECASS III, SITS-MOST
Широкая распространенность, высокий процент инвалидизации и смертности обусловливают медицинскую и социальную значимость инсульта. Новые подходы к лечению ишемического инсульта заключаются в применении современных высокоэффективных методов реперфузии вещества головного мозга в первые часы заболевания. Методы направлены на восстановление кровотока в пораженном сосуде и предотвращение необратимых повреждений вещества головного мозга либо уменьшение их объема, что позволяет минимизировать выраженность остаточного неврологического дефицита.
Системная тромболитическая терапия
В соответствии с рекомендациями Европейской организации по борьбе с инсультом (European Stroke Organisation – ESO) (класс доказательности 1, уровень А) и Американской ассоциации по борьбе с инсультом (American Stroke Association – ASA) (класс доказательности 1, уровень В) системная тромболитическая терапия с использованием рекомбинантного тканевого активатора плазминогена (recombinant tissue plasminogen activator – rt-PA) является наиболее эффективным и безопасным методом реперфузионной терапии при ишемическом инсульте в первые четыре с половиной часа с момента развития симптоматики [1, 2]. Безопасность и эффективность системного тромболизиса с применением rt-PA при ишемическом инсульте изучались в ряде крупных рандомизированных плацебоконтролируемых клинических исследований.
Исследование NINDS (National Institute of Neurological Disorders and Stroke) было первым рандомизированным плацебоконтролируемым исследованием, в ходе которого была доказана безопасность и эффективность системной тромболитической терапии с использованием rt-PA в первые три часа от момента развития заболевания. Вероятность отсутствия инвалидизации или наличия лишь минимальных неврологических расстройств спустя три месяца после инсульта была выше по крайней мере на 30% у пациентов, получавших rt-PA (основная группа), чем у больных, получавших плацебо (контрольная группа). Несмотря на увеличение частоты симптомного внутримозгового кровоизлияния среди пациентов основной группы по сравнению с пациентами контрольной группы (6,4 против 0,6%, p = 0,001), достоверных различий по уровню смертности выявлено не было (17% при использовании rt-PA и 21% – плацебо, р = 0,3) [3].
В рандомизированных плацебоконтролируемых исследованиях ECASS (European Cooperative Acute Stroke Study) I и II [4, 5] оценивалась безопасность и эффективность применения rt-PA в разных дозах (ECASS I – 1,1 мг/кг, а ECASS II – 0,9 мг/кг) в течение шести часов от начала развития ишемического инсульта. Результаты ECASS I и ECASS II, касающиеся безопасности использования rt-PA, были сопоставимы с результатами, полученными в исследовании NINDS, однако не было выявлено достоверных различий по эффективности между группами rt-PA и плацебо.
В исследованиях ATLANTIS (Alteplase ThromboLysis for Acute Noninterventional Therapy in Ischemic Stroke) A и B оценивалась безопасность и эффективность применения rt-PA в дозе 0,9 мг/кг в течение пяти часов от начала развития инсульта. При начале терапии в период от трех до пяти часов с момента появления симптоматики существенного положительного эффекта от применения rt-PA по сравнению с плацебо не было [6]. В то же время у пациентов, которые получали rt-PA в течение трех часов от начала инсульта, увеличивались шансы благоприятного исхода спустя 90 дней (р = 0,01).
Метаанализ исследований NINDS, ECASS I и II, ATLANTIS A и B [7] подтвердил, что применение rt-PA у пациентов с ишемическим инсультом в течение трех часов снижает риск летального исхода или зависимости от окружающих через 90 дней. Шанс сохранить самостоятельность в повседневной жизни после применения rt-PA в указанное время (≤ трех часов от начала заболевания) повышался на 50% (в сравнении с плацебо). Было также показано, что при применении rt-PA в указанное трехчасовое терапевтическое окно смертность не увеличивается, несмотря на увеличение частоты развития внутричерепных кровоизлияний (по сравнению с плацебо). Вероятность благоприятного исхода в случае применения rt-PA была тем выше, чем раньше начиналась тромболитическая терапия. Через 3–4,5 часа от начала заболевания сохранялась вероятность благоприятного исхода (отношение шансов (ОШ) 1,34, 95% доверительный интервал (ДИ) 1,04–1,72); начиная с 4,5 до шести часов тромболизис был неэффективен (ОШ 1,04, 95% ДИ 0,84–1,29). Данное обоснование эффективности системной тромболитической терапии в первые 4,5 часа явилось предпосылкой проведения исследования ECASS III, завершенного в 2008 г. [7].
Как показали результаты исследования ECASS III, применение rt-PA в период до 4,5 часов от начала заболевания увеличивает количество благоприятных функциональных исходов по сравнению с плацебо (52,4 против 45,2%, ОШ 1,34, 95% ДИ 1,0–1,65, р
По результатам ECASS III были пересмотрены Европейские и Американские рекомендации по лечению ишемического инсульта, в том числе увеличена продолжительность терапевтического окна при проведении системного тромболизиса до 4,5 часов [1, 2]. В Российской Федерации соответствующие изменения в инструкцию к препарату алтеплаза были внесены 25 мая 2011 г. Теперь выполнение системной тромболитической терапии стало возможным в первые 4,5 часа после развития заболевания.
Многоцентровые исследования острого инсульта MAST-I, MAST-E (Multicentre Acute Stroke Trial) и ASK (Australian Streptokinase Trial), в которых для проведения тромболизиса при инсульте использовалась стрептокиназа, были остановлены досрочно из-за увеличения риска смерти в группе стрептокиназы вследствие более высокой частоты геморрагической трансформации зоны ишемического инсульта [9–11].
Изучение другого фибринолитика, полученного из слюны летучих мышей, – десмотеплазы, более фибринспецифичного и менее нейротоксичного по сравнению с rt-PA, проводилось в исследованиях DEDAS (Dose Escalation of Desmoteplase for Acute Ischemic Stroke) [12] и DIAS (Desmoteplase in Acute Ischemic Stroke) I и II [13, 14]. Десмотеплаза вводилась в течение трех – девяти часов от начала заболевания при выявлении области перфузионно-диффузионного несоответствия (DWI-PWI mismatch) при магнитно-резонансной томографии (МРТ) головного мозга.
В первой части исследования DIAS пациенты получали 25, 37,5 или 50 мг препарата либо плацебо. Исследование было досрочно прекращено из-за высокой частоты симптомных внутричерепных кровоизлияний в группе десмотеплазы (26,7%).
Во второй части исследования DIAS использовались меньшие дозы препарата (62,5, 90 и 125 мкг/кг), что значительно снизило количество случаев симптомной геморрагической трансформации зоны ишемического инсульта (2,2%). Реканализация в группе, получавшей десмотеплазу (125 мкг/кг), наблюдалась в 71,4% случаев, в то время как в группе плацебо – только в 19,2% случаев (p = 0,0012). В группе плацебо благоприятные исходы заболевания к 90-му дню были выявлены у 22,2% пациентов, а в группе десмотеплазы – у 13,3% больных при введении дозы 62,5 мкг/кг (p = 0,757), у 60% больных при введении дозы 125 мкг/кг (p = 0,0090). Было показано, что применение десмотеплазы в интервале трех – девяти часов от начала развития ишемического инсульта у пациентов с верифицированным перфузионно-диффузионным несоответствием, установленным при МРТ, ассоциируется с большей частотой реканализации и хорошими клиническими исходами заболевания по сравнению с плацебо.
В исследование DEDAS [12] было включено 37 пациентов. Обязательным критерием участия было наличие перфузионно-диффузионного несоответствия при МРТ головного мозга. Больные получали десмотеплазу в дозе 90 или 125 мкг/кг либо плацебо. Реканализация наблюдалась у 37,5% пациентов, получивших плацебо, у 18,2% пациентов, получивших десмотеплазу в дозе 90 мкг/кг, и у 53,3% пациентов, получивших препарат в дозе 125 мкг/кг.
Однако при дальнейшем исследовании десмотеплазы в рамках рандомизированного плацебоконтролируемого исследования DIAS II [14] безопасность и эффективность десмотеплазы не получили подтверждения. В исследовании участвовали 186 пациентов, у которых с начала развития симптомов ишемического инсульта еще не прошло девяти часов. Пациенты были распределены на три группы и получали десмотеплазу в дозе 95 мкг/кг (n = 57), десмотеплазу в дозе 125 мкг/кг (n = 66) или плацебо (n = 63). Благоприятные клинические исходы заболевания к 90-му дню в группах пациентов, получивших десмотеплазу в дозах 95 и 125 мкг/кг, наблюдались в 47 и 36% случаев (27 и 24 пациентов соответственно). В группе плацебо благоприятные клинические исходы к указанному сроку отмечены в 46% (n = 29) случаев. Частота симптомных внутричерепных кровоизлияний при использовании десмотеплазы в дозах 95 и 125 мкг/кг составила 3,5 и 4,5% соответственно. В группе плацебо данное осложнение не отмечалось.
Таким образом, в настоящее время rt-PA является единственным препаратом с доказанными безопасностью и эффективностью при ишемическом инсульте.
Селективный внутриартериальный тромболизис
Наиболее радикальными подходами к лечению острого ишемического инсульта являются селективный внутриартериальный тромболизис и тромбоэмболэктомия. Данные методы базируются на возможностях церебральной ангиографии, с помощью которой осуществляются не только диагностические исследования, но и различные рентгенохирургические операции на сосудах мозга.
Селективный внутриартериальный тромболизис является методом выбора, если фибринолитическая терапия может быть начата спустя 4,5–6 часов от начала ишемического инсульта в системе сонной артерии, 9–12 часов при окклюзии основной артерии, а также в ситуациях, когда системный тромболизис оказывается неэффективным (не наблюдается клинического улучшения к концу его проведения).
Внутриартериальное введение
rt-PA и других фибринолитиков изучалось в исследованиях PROACT (Pro-urokinase for Acute Ischemic Stroke) [15], EMS (Emergency Management of Stroke) [16], IMS (Interventional Management of Stroke) [17], IMS II [18].
Впервые эффективность и безопасность внутриартериальной тромболитической терапии при ишемическом инсульте были доказаны в двойном слепом рандомизированном плацебоконтролируемом исследовании PROACT [15]. Активатор плазминогена (рекомбинантная проурокиназа – r-pro-UK) вводился пациентам в первые шесть часов развития заболевания. Симптомные внутричерепные кровоизлияния в группе r-pro-UK (основная) зарегистрированы в 15,4% случаев, а в группе плацебо (контрольная) – в 7,1% случаев. Частичная или полная реканализация в течение 120 минут от начала терапии была достигнута в 15 (57,7%) случаях в основной группе и только в двух (14,3%) случаях в группе плацебо. По данным ангиографии, у пяти пациентов основной группы была достигнута полная реканализация сосуда, в то время как в контрольной группе ее добиться не удалось. Статистически значимых различий в группах по частоте геморрагических трансформаций, явившихся причиной неврологического ухудшения, выявлено не было. На основании этого был сделан вывод о том, что внутриартериальное введение r-pro-UK при ишемическом инсульте в течение шести часов от начала симптоматики является эффективным и безопасным методом лечения.
Целью исследования EMS [16] явилось сравнение эффективности комбинированной тромболитической терапии и внутриартериальной терапии. Была доказана безопасность комбинированной тромболитической терапии при лечении ишемического инсульта.
В нерандомизированном исследовании IMS [17] (n = 80) оценивались безопасность и эффективность комбинированной тромболитической терапии. В течение 90 дней после ее проведения смертность составила 16%. Это значительно ниже, чем в группе плацебо (24%), и сопоставимо с соответствующим показателем в основной группе (17%) исследования NINDS. Симптомные внутричерепные кровоизлияния наблюдались в 6,3% случаев, что также оказалось сопоставимым с данными исследования NINDS, где подобное осложнение регистрировалось в 6,6% случаев. Среди участников исследования IMS отмечалось большее количество благоприятных исходов по сравнению с контрольной группой в исследовании NINDS. Смертность и частота развития симптомных внутричерепных кровоизлияний в исследовании IMS (16 и 6,3% соответственно) были сопоставимы с таковыми в основной группе в исследовании NINDS (17 и 6,4% соответственно).
Для дальнейшего изучения безопасности комбинированного тромболизиса при ишемическом инсульте было проведено открытое сравнительное нерандомизированное исследование IMS II [18], в которое был включен 81 больной. За три месяца летальные исходы отмечены в 16% случаев. Частота симптомных внутричерепных кровоизлияний (9,9%) оказалась сопоставимой с таковой в исследовании NINDS (6,6%). Однако было показано: проведение комбинированного тромболизиса способствует лучшему восстановлению неврологических функций после инсульта (в сравнении с основной группой исследования NINDS).
По результатам многоцентрового рандомизированного сравнительного исследования IMS III [19], в первые три часа от начала инсульта эндоваскулярные вмешательства и системный тромболизис имеют сходные показатели безопасности (летальность 19,1 и 21,6% соответственно) и эффективности. Так, оценку 0–2 балла по модифицированной шкале Рэнкина (modified Renkin scale – mRs) имели 40,8% пациентов в группе эндоваскулярной терапии и 38,7% в группе, в которой проводилась системная тромболитическая терапия.
Метаанализ 27 исследований, опубликованных в 2001 г., подтвердил, что при внутриартериальной тромболитической терапии чаще по сравнению с плацебо отмечались положительные функциональные исходы (41,5 против 23% соответственно) [20]. Несмотря на то что частота симптомных внутримозговых кровотечений в группе тромболизиса была выше (9,5 против 3%), частота смертельных случаев в ней оказалась ниже (27,2 против 40%).
В метаанализе [21] было убедительно показано, что проведение внутриартериального фибринолиза не только достоверно чаще приводит к высокой степени функционального восстановления (0–2 балла по mRs), но и увеличивает количество больных с восстановлением нарушенных неврологических функций (0–1 балл по mRs). Несмотря на более высокую частоту развития внутричерепных геморрагий в основной группе, включая симптомные геморрагические инсульты, это увеличение не сопровождалось достоверным увеличением показателей смертности.
Тромбоэмболэктомия
В настоящее время более эффективной по сравнению с внутриартериальным тромболизисом является механическая реканализация пораженного участка артерии с использованием специального инструментария – тромбоэмболэктомия. Данное оперативное вмешательство выполняется в условиях рентгеноперационной. Преимуществами тромбоэмболэктомии являются минимизация риска системных геморрагических осложнений и возможность воздействия на тромб или эмбол после безуспешного внутривенного тромболизиса. К настоящему времени опубликованы результаты исследований с такими устройствами, как Merci, Penumbra и Catch [22–24].
Системный и селективный внутриартериальный тромболизис в России
Впервые в Российской Федерации методы системного и селективного внутриартериального тромболизиса были внедрены в НИИ цереброваскулярной патологии и инсульта Российского государственного медицинского университета на базе Городской клинической больницы № 31 в 2005–2006 гг. [25, 26]. Метод тромболитической терапии был одобрен Федеральной службой по надзору в сфере здравоохранения и социального развития в качестве новой медицинской технологии (разрешение от 01.08.2008 № 2008/169). С 2008 г. тромболизис является неотъемлемой частью оказания медицинской помощи больным с инсультом в первичных сосудистых отделениях и региональных сосудистых центрах, созданных в рамках реализации комплекса мероприятий по снижению смертности от сосудистых заболеваний [27].
С 2009 по 2012 г. включительно в первичных и региональных центрах было проведено 6286 процедур системной тромболитической терапии (рисунок). Характеристика пациентов представлена в таблице 1. Тромболитическая терапия проводилась в основном пациентам с инсультом средней степени тяжести: медиана балла по шкале оценки тяжести неврологической симптоматики в остром периоде ишемического инсульта, предложенной Национальным институтом здоровья США (National Institutes of Health Stroke Scale – NIHSS), составляла 13 баллов. Среди больных преобладали мужчины (59%), медиана возраста составила 62 года. Уровень 30-дневной летальности – 13,2%. Симптомная геморрагическая трансформация была диагностирована в 6,7% случаев.
Согласно результатам регрессионного анализа, с летальным исходом ассоциированы такие факторы, как возраст, уровень систолического артериального давления при поступлении, выраженность неврологического дефицита по шкале NIHSS. На функциональное восстановление оказывали влияние уровень диастолического артериального давления при поступлении, тяжесть инсульта по шкале NIHSS. Вероятность возникновения геморрагической трансформации очага поражения головного мозга (как симптомной, так и бессимптомной) зависела от возраста, наличия ранних признаков инфаркта головного мозга по данным компьютерной томографии, а также выраженности неврологического дефицита по шкале инсульта NIHSS (табл. 2). Таким образом, на тяжесть инсульта влияли все анализируемые исходы, что еще раз подчеркивает необходимость тщательного обследования и отбора пациентов для тромболитической терапии.
В целом результаты безопасности и эффективности внедрения метода тромболитической терапии в Российской Федерации были сопоставимы с результатами наиболее крупных исследований и регистра SITS-MOST (Safe implementation of treatments in stroke Monitoring Study) (табл. 3). Более высокие показатели симптомной геморрагической трансформации и смертности по сравнению с показателями исследований ECASS III и регистра SITS-MOST, вероятно, связаны с исходно более тяжелым неврологическим дефицитом по шкале инсульта NIHSS при поступлении (13 баллов против 10,7 и 12 соответственно).
Таким образом, новые технологии реперфузионной терапии в первые часы ишемического инсульта активно внедряются в нашей стране, качественно изменяя подходы к ведению больных и достоверно улучшая исходы заболевания, обусловливая снижение смертности и высокодостоверное увеличение количества пациентов с хорошим восстановлением нарушенных неврологических функций.
Источник
