Ремоделирование сердца при хронической сердечной недостаточности

Патологические изменения у больных с сердечной недостаточностью могут усиливаться при нарушении функции сосудистого эндотелия. Если концентрация эндотелина возрастает и его количество превышает уровень вазорелаксирующих факторов, это приводит к выраженной вазоконстрикции и способствует задержке в организме натрия и воды. При сердечной недостаточности уровень секреции сосудистым эндотелием эндотелина увеличивается, а его концентрация в плазме крови повышена. Обычно уровень эндотелина в крови больных прямо коррелирует с уровнем ангиотензина II. Последний, в свою очередь, еще больше может стимулировать секрецию эндотелина.
Вследствие прогрессирующей гипертрофии миокарда возникает диастолическая ригидность левого желудочка, резко усиливается дилатация сердца, которую раньше обозначали как миогенная дилатация, к диастолической дисфункции присоединяется систолическая.
Тахикардия, которая первоначально носит компенсаторный характер, резко повышает энергетические затраты сердца и существенно ограничивает толерантность к физическим нагрузкам. Все эти, уже патологические, механизмы стимулируются гиперактивацией нейрогормональных систем. Прогрессирующее снижение сердечного выброса способствует задержке в организме жидкости. В миокардиоцитах происходит трансформация ангиотензина I в ангиотензин П. Длительное повышение его уровня в плазме крови, особенно в сочетании с гиперальдостеронизмом, сопровождается некрозом кардиомиоцитов. Ангиотензин П имеет особое значение в развитии гипертрофии миокарда, которая первоначально, как упоминалось выше, также носит компенсаторный характер.
Параллельно гибели части миокардиоцитов и гипертрофии оставшихся стимулируется рост фибробластов, увеличивается содержание коллагена в мышце сердца, прогрессирует фиброз. Это приводит к снижению эластичности миокарда и усилению его ригидности. Развивается так называемая диастолическая жесткость желудочков сердца. Диастолическая дисфункция является ведущей причиной развития сердечной недостаточности у многих больных с застойной сердечной недостаточностью уже на ранних этапах заболевания.
Чрезмерная гипертрофия сопровождается увеличением потребности миокарда в кислороде. Кроме того, по мере нарастания гипертрофии ухудшается кровообращение миокарда, поскольку развитие коллатералей при этом существенно отстает от увеличения массы миокарда и в конце концов приводит к ослаблению сократительной деятельности сердечной мышцы.
При многих заболеваниях сердечно-сосудистой системы в мышце сердца происходят структурные изменения, затрагивающие как поврежденные, так и неповрежденные участки миокарда. Они развиваются у больных хронической ИБС в результате повторяющихся эпизодов ишемии, у больных инфарктом миокарда вследствие некроза участков функционирующего миокарда, появляются при воспалительных процессах, хронической перегрузке сердца объемом или давлением и при других поражениях миокарда. С одной стороны, они часто предшествуют клиническому проявлению сердечной недостаточности, с другой – сами усугубляют систолическую и диастолическую дисфункции желудочков, способствуют прогрессированию сердечной недостаточности, отрицательно влияют на качество и продолжительность жизни больных.
В последние годы внимание исследователей привлекают структурные изменения сердца, происходящие при сердечной недостаточности и обозначаемые как «ремоделирование». Ремоделирование миокарда можно обозначить как комплекс структурных изменений в мышце сердца, возникающих вследствие сложных нейрогуморальных изменений. Термин «ремоделирование» стал использоваться начиная с 1980-х годов для обозначения структурно-геометрических изменений левого желудочка, развивающихся после инфаркта миокарда. В настоящее время этот термин применяется в более широком смысле.
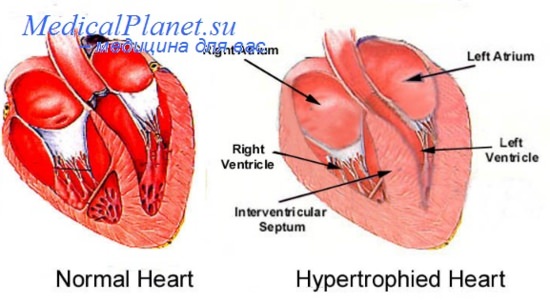
В широком понимании ремоделирование сердца означает комплекс морфологических и функциональных изменений, происходящих в сердце в ответ на повреждение миокарда. Ремоделирование сердца в первую очередь включает прогрессирующее увеличение массы миокарда, дилатацию полостей, а также изменение геометрии сердца.
Схематично развитие ремоделирования миокарда можно представить следующим образом. После повреждения мышцы сердца (инфаркт миокарда, миокардит, дилатационная кардиомиопатия и т.п.) часть кардиомиоцитов гибнет. В миокарде сразу начинаются процессы, направленные на то, чтобы сохранить основную функцию сердца – сократительную. Происходит компенсаторная активация нейрогормональной системы, прежде всего симпатико-адреналовой и ренин-ангиотензин-альдостероновой, стимулирующих оставшиеся неповрежденные кардиомиоциты взять на себя функцию погибших.
Начинается ремоделирование. Оно характеризуется тем, что оставшиеся в живых кардиомиоциты, переполняясь кальцием, резко повышают свою контрактильность, повышают пейсмекерную активность, начинают гипертрофироваться. Эти процессы позволяют временно поддержать на адекватном уровне сердечный выброс. Однако вскоре компенсаторное (адаптивное) ремоделирование переходит в свою противоположность.
Гипертрофия миокарда, тахикардия, гиперконтрактильность – это энергоемкие процессы, которые сопровождаются повышением потребности миокарда в кислороде. Адекватность доставки кислорода к миокардицитам уменьшается, в результате чего развивается хроническая гипоксия. Гипоксия миокарда наряду с переполнением кардиомиоцитов кальцием приводит к нарушению диастолического расслабления, повреждению клеточных мембран клеток, вызывает электрическую нестабильность миокарда.
При этом включается защитно-приспособительный механизм, получивший название «гибернация миокарда» («спячка»). Часть клеток потребляет минимум энергии, хуже сокращается, но благодаря этому сохраняет свою жизнеспособность.
Среди оставшейся части живых и способных к сокращению клеток миокарда срабатывает генетически детерминированный механизм – гибель клеток путем апоптоза. Апоптоз характерен для всех клеток, но при ХСН он активизируется, в результате чего дополнительно погибает еще часть кардиомиоцитов.
При длительном применении инотропных средств у больных с ХСН все меньшее число кардиомиоцитов способно функционировать адекватно. Это приводит к прогрессирующей дилатации сердца и снижению сердечного выброса. Этим, в частности, объясняется негативное влияние на течение и прогноз у больных с ХСН сердечных гликозидов и других препаратов, обладающих положительным инотропным действием.
На важность взаимоотношения между геометрией и функцией сердца указывал еще Гарвей в XVII в. При нормальной сократительной функции миокарда происходит последовательное динамическое изменение геометрии левого желудочка от более эллипсоидной в фазу систолы к более сферичной в момент диастолы. Относительное удлинение левого желудочка во время систолы является важным механизмом, позволяющим ему выбрасывать больший объем крови. Нарушение геометрии желудочка с его дисфункцией выявляется у всех больных с сердечной недостаточностью и часто предшествует уменьшению фракции выброса, нарушениям системной гемодинамики и клиническим проявлениям заболевания.
У больных ИБС после перенесенного крупноочагового инфаркта миокарда этот процесс может завершиться развитием сердечной недостаточности в течение нескольких месяцев или лет даже в случае прекращения прогрессирования ИБС. Если же ИБС прогрессирует, возникают повторные инфаркты миокарда, вероятность развития сердечной недостаточности резко возрастает.
– Читать далее “Адаптация организма к хронической сердечной недостаточности. Изменения органов при ХСН”
Оглавление темы “Сердечная недостаточность”:
- Ремоделирование миокарда при сердечной недостаточности – механизмы
- Адаптация организма к хронической сердечной недостаточности. Изменения органов при ХСН
- Варианты гипертрофии левого желудочка. Патогенез
- Водный обмен человека – регуляция, нарушения
- Регуляция обмена натрия и его нарушения
- Гипомагниемия, гипермагниемия – клиника, диагностика
- Гипокальциемия, гиперкальциемия – клиника, диагностика
- Классификация сердечной недостаточности
- Немедикаментозное лечение хронической сердечной недостаточности (ХСН) – принципы
- Диуретики для лечения хронической сердечной недостаточности (ХСН)
Источник
Ремоделирование сердца

Раповец Валерий Александрович
Врач-кардиолог инфарктного отделения, г.Минск
Термин «ремоделирование сердца» был предложен N. Sharp в конце 70-х годов прошлого века для обозначения структурных и геометрических изменений после острого инфаркта миокарда. Затем он получил более широкое толкование.
Ишемическое ремоделирование – динамический, обратимый процесс изменения толщины миокарда, размера и формы камер сердца, функции левого желудочка (появление дисфункции).
Гипертрофия левого желудочка – начальный этап ремоделирования при артериальной гипертензии, зависит не столько от уровня артериального давления (гемодинамическая перегрузка), сколько от активности ренинангиотензинальдостероновой системы.
Риск развития хронической сердечной недостаточности увеличивается в 15 раз. Гипертрофия левого желудочка развивается по концентрическому типу (добавление саркомеров внутри кардиомиоцита). А11 стимулирует рост мышечных волокон, альдостерон изменяет внутриклеточный матрикс с формированием диастолической дисфункции.
Диастолическая дисфункция – ранний этап ремоделирования левого желудочка, маркер фиброза миокарда.
Расслабление – наиболее энергозависимый процесс, при гипертрофии левого желудочка страдает в первую очередь. Наибольшую гемодинамическую перегрузку при диастолической дисфункции испытывает левое предсердие. Дилатация левого предсердия вызывает митральную регургитацию.
Важный этап – переход концентрической гипертрофии левого желудочка в эксцентрическую. К систолической перегрузке давлением добавляется диастолическая перегрузка объемом. Дилатация левого желудочка сопровождается систолической дисфункцией, а это увеличивает летальность на 50%. Хроническая сердечная недостаточность движется к финишной стадии.
Ингибиторы ангиотензинпревращающего фермента вызывают регресс концентрической гипертрофии, уменьшая толщину стенок левого желудочка; нормализуют диастолу. Уменьшается объем мышечных волокон и миокардиальный фиброз.
На стадии эксцентрической гипертрофии ингибиторы ангиотензинпревращающего фермента препятствуют истончению миокарда, уменьшают миокардиальный стресс. Ингибиторы ангиотензинпревращающего фермента увеличивают фракцию выброса, уменьшают объем левого желудочка, улучшают локальную сократимость – уменьшают индекс асинергии.
Острый инфаркт миокарда
В первые 72 часа острого инфаркта миокарда наступает раннее ремоделирование – растяжение и истончение миокарда, дилатация и сферификация левого желудочка. При обширном трансмуральном инфаркте миокарда происходит серьезная архитектурная перестройка, определяющая прогноз заболевания.
После повреждения и гибели части кардиомиоцитов и в нормальной, и поврежденной зоне идет процесс склерозирования. Миоциты гипертрофируются, меняется их взаимное расположение; нарушается соотношение: «основание/верхушка».
Активизируются процессы поддержания сердечного выброса и нормализации напряжения стенки левого желудочка. Изменяется радиус кривизны стенок левого желудочка, от которого зависит разная жесткость его стенок и распределение внутрижелудочкового объема.
Механизм поддержания сердечного выброса и нормализации напряжения стенки левого желудочка реализуется через ренинангиотензинальдостероновую систему и гипертрофию неповрежденных сегментов миокарда.
Экспансия инфаркта
В 1978 г. G. Hutchius и B. Bulkley описали процесс острого увеличения и истончения зоны инфаркта без дополнительного некроза миокарда. В первые часы после гибели миоцитов отек и воспаление локализуют зону инфаркта. Дальше наблюдается пролиферация фибробластов и замещение этого участка коллагеном. Зона инфаркта может истончаться и расширяться.
Длина саркомеров не изменяется. Таким образом, увеличение объема левого желудочка происходит вследствие перегруппировки миофибрилл без их растяжения. Стенка истончается из-за скольжения мышечных волокон друг относительно друга в результате ослабления связей между миоцитами в инфарктной зоне.
При ЭхоКГ определяется увеличение зоны акинезии без ферментативного сдвига.
Экспансия вероятнее всего при трансмуральном инфаркте миокарда и заканчивается хронической сердечной недостаточностью, аневризмой и разрывом миокарда. Передне-верхушечная область более уязвимая, так как она наиболее изогнута. Возможна дилатация непораженной зоны с тотальным расширением левого желудочка.
Постинфарктное ремоделирование левого желудочка
Резкое растяжение жизнеспособного миокарда по закону Франка – Старлинга, увеличение хроно-инотропных эффектов при стимуляции адренорецепторов поддерживает насосную функцию в условиях уменьшения сокращающейся части миокарда. При поражении более 20% массы левого желудочка компенсация будет неадекватной.
Увеличение полости левого желудочка помогает восстановить ударный объем на фоне снижения фракции выброса. Дилатация увеличивает миокардиальный стресс, порочный круг замыкается. В качестве компенсации наступает гипертрофия миоцитов: до 78% от исходного объема.
Гипертрофия может быть концентрической без увеличения полости и эксцентрической с дилатацией Гипертрофия может восстановить напряжение стенки левого желудочка. При обширном инфаркте миокарда дилатация не пропорциональна приросту массы миокарда
Роль цитокинов. Цитокины – маркеры хронической сердечной недостаточности
Развитие хронической сердечной недостаточности сопровождается увеличением провоспалительных цитокинов (интерлейкинов-1,6) в плазме крови и в миокарде.
Увеличение провоспалительных цитокинов происходит без увеличения антивоспалительных цитокинов, что приводит к усилению воспаления.
Экспрессия цитокинов и их рецепторов на мембранах кардиомиоцитов подтверждает центральную роль цитокинов в патогенезе хронической сердечной недостаточности.
Уровень фактора некроза опухоли прямо зависит от функционального класса хронической сердечной недостаточности. Иммуномодуляторы повышают уровень противовоспалительных медиаторов. Внутривенное введение пентоксифиллина, иммуноглобулина увеличивает фракцию выброса и снижает снижает уровень фактора некроза опухолей– альфа.
Натрий – уретический пептид в норме вырабатывается кардиомиоцитами предсердий и регулирует водно-солевое равновесие и снижает артериальное давление. При уменьшении сердечного выброса у больных с асимптоматической дисфункцией левого желудочка и с хронической сердечной недостаточности 1 функционального класса растет синтез натрий-уретического пептида в желудочках сердца.
Это блокирует активность циркулирующего звена ренинангиотензинальдостероновой системы и компенсирует состояние больных. Прогрессирование хронической сердечной недостаточности активизирует ренинангиотензинальдостероновую систему. Снижается натрий-уретический ответ на рост активности натрий-уретического пептида.
Это приводит к задержке натрия и воды, системной и почечной вазоконстрикции.
Постинфарктная аневризма левого желудочка
Классическим вариантом постинфарктного ремоделирования левого желудочка является постинфарктная аневризма левого желудочка, развивается в 8-34% случаев трансмурального инфаркта миокарда; характеризуется акинезией или дискинезией стенки левого желудочка. Изменяется геометрия, объем и масса левого желудочка. Клинически проявляется в виде хронической сердечной недостаточности у 50% больных и более, желудочковых нарушений ритма, тромбоэмбоэмболического синдрома.
Хирургическим методом лечения является реваскуляризация миокарда и пластика левого желудочка. Прогностически неблагоприятны ранние аневризмы при переднем инфаркте миокарда.
Факторы риска:
- более 2-х инфарктов миокарда в анамнезе;
- приступы сердечной астмы — III, IV функциональные классы по NYHA;
- фракция выброса 24 мм. рт. ст.;
- стеноз ствола левой коронарной артерии;
- поражение трех основных бассейнов коронарных артерий.
- Прогноз ремоделирования левого желудочка
Рентгенологически видимое увеличение левого желудочка неблагоприятно и увеличивает летальность в 3 раза, прогнозирует развитие хронической сердечной недостаточности.
Подъем сегмента SТ со снижением или отсутствием зубца R на ЭКГ помогает не только диагностировать инфаркт миокарда, определить его размеры, но и предполагать ремоделирование левого желудочка.
Компенсаторные процессы зависят от состояния коронарного кровотока уцелевшего миокарда, при неадекватном кровоснабжении дилатация больше, выше летальность. Стеноз артерий ограничивает компенсаторную гипертрофию миокарда и повышенную нагрузку. Дилатация полостей прямо коррелирует с риском фатальных аритмий.
Первичная профилактика не вызывает сомнений: это наиболее раннее и адекватное восстановление перфузии у больных острым коронарным синдромом. Профилактика хронической сердечной недостаточности начинается в первые часы острого инфаркта миокарда. Надо ограничить зону некроза: тромболитики, нитраты, бета-адреноблокаторы, антиагреганты. Хирургическая реваскуляризация миокарда
Доказан эффект ингибиторов ангиотензинпревращающего фермента: предпочтительны пролонгированные препараты и препараты, действующие на тканевой ангиотензинпревращающий фермент.
Летальность от хронической сердечной недостаточности достоверно снижается, фракция выброса – увеличивается. Ингибиторы ангиотензинпревращающего фермента более эффективны при переднем инфаркте миокарда.
Терапия ингибиторами ангиотензинпревращающего фермента назначается в первые сутки инфаркта миокарда.
Бета-адреноблокаторы оказывают не только антиаритмическое действие, но и тормозят ремоделирование левого желудочка. K. Shiono не отметил эффект от атенолола. Метопролол вызывает редукцию объема и регрессию массы левого желудочка; улучшает геометрию левого желудочка.
Эффективны антагонисты кальция: амлодипин, дилтиазем и изоптин, но лечение должно быть длительным.
Нитраты ограничивают раннее постинфарктное ремоделирование левого желудочка.
Дигоксин в результате инотропной стимуляции при переднем инфаркте миокарда может увеличивать инфарктное выпячивание левого желудочка без снижения содержания коллагена.
L- карнитин в остром и отдаленном периоде инфаркта миокарда уменьшал дилатацию левого желудочка (S. Iliceto).
Литература:
Кардиология, 2003, 8, стр. 83-94.
Кардиология, 2003, 8, стр. 68-72.
Бузиашвили ЮИ и др Кардиология, 2002, 10, стр. 88-94.
Источник: //www.eurolab.ua/encyclopedia/565/44319/
Ремоделирование миокарда при сердечной недостаточности – механизмы

Патологические изменения у больных с сердечной недостаточностью могут усиливаться при нарушении функции сосудистого эндотелия.
Если концентрация эндотелина возрастает и его количество превышает уровень вазорелаксирующих факторов, это приводит к выраженной вазоконстрикции и способствует задержке в организме натрия и воды.
При сердечной недостаточности уровень секреции сосудистым эндотелием эндотелина увеличивается, а его концентрация в плазме крови повышена. Обычно уровень эндотелина в крови больных прямо коррелирует с уровнем ангиотензина II. Последний, в свою очередь, еще больше может стимулировать секрецию эндотелина.
Вследствие прогрессирующей гипертрофии миокарда возникает диастолическая ригидность левого желудочка, резко усиливается дилатация сердца, которую раньше обозначали как миогенная дилатация, к диастолической дисфункции присоединяется систолическая.
Тахикардия, которая первоначально носит компенсаторный характер, резко повышает энергетические затраты сердца и существенно ограничивает толерантность к физическим нагрузкам. Все эти, уже патологические, механизмы стимулируются гиперактивацией нейрогормональных систем.
Прогрессирующее снижение сердечного выброса способствует задержке в организме жидкости. В миокардиоцитах происходит трансформация ангиотензина I в ангиотензин П. Длительное повышение его уровня в плазме крови, особенно в сочетании с гиперальдостеронизмом, сопровождается некрозом кардиомиоцитов.
Ангиотензин П имеет особое значение в развитии гипертрофии миокарда, которая первоначально, как упоминалось выше, также носит компенсаторный характер.
Параллельно гибели части миокардиоцитов и гипертрофии оставшихся стимулируется рост фибробластов, увеличивается содержание коллагена в мышце сердца, прогрессирует фиброз. Это приводит к снижению эластичности миокарда и усилению его ригидности.
Развивается так называемая диастолическая жесткость желудочков сердца. Диастолическая дисфункция является ведущей причиной развития сердечной недостаточности у многих больных с застойной сердечной недостаточностью уже на ранних этапах заболевания.
Чрезмерная гипертрофия сопровождается увеличением потребности миокарда в кислороде. Кроме того, по мере нарастания гипертрофии ухудшается кровообращение миокарда, поскольку развитие коллатералей при этом существенно отстает от увеличения массы миокарда и в конце концов приводит к ослаблению сократительной деятельности сердечной мышцы.
При многих заболеваниях сердечно-сосудистой системы в мышце сердца происходят структурные изменения, затрагивающие как поврежденные, так и неповрежденные участки миокарда.
Они развиваются у больных хронической ИБС в результате повторяющихся эпизодов ишемии, у больных инфарктом миокарда вследствие некроза участков функционирующего миокарда, появляются при воспалительных процессах, хронической перегрузке сердца объемом или давлением и при других поражениях миокарда.
С одной стороны, они часто предшествуют клиническому проявлению сердечной недостаточности, с другой – сами усугубляют систолическую и диастолическую дисфункции желудочков, способствуют прогрессированию сердечной недостаточности, отрицательно влияют на качество и продолжительность жизни больных.
В последние годы внимание исследователей привлекают структурные изменения сердца, происходящие при сердечной недостаточности и обозначаемые как «ремоделирование».
Ремоделирование миокарда можно обозначить как комплекс структурных изменений в мышце сердца, возникающих вследствие сложных нейрогуморальных изменений.
Термин «ремоделирование» стал использоваться начиная с 1980-х годов для обозначения структурно-геометрических изменений левого желудочка, развивающихся после инфаркта миокарда. В настоящее время этот термин применяется в более широком смысле.
В широком понимании ремоделирование сердца означает комплекс морфологических и функциональных изменений, происходящих в сердце в ответ на повреждение миокарда. Ремоделирование сердца в первую очередь включает прогрессирующее увеличение массы миокарда, дилатацию полостей, а также изменение геометрии сердца.
Схематично развитие ремоделирования миокарда можно представить следующим образом. После повреждения мышцы сердца (инфаркт миокарда, миокардит, дилатационная кардиомиопатия и т.п.) часть кардиомиоцитов гибнет.
В миокарде сразу начинаются процессы, направленные на то, чтобы сохранить основную функцию сердца – сократительную.
Происходит компенсаторная активация нейрогормональной системы, прежде всего симпатико-адреналовой и ренин-ангиотензин-альдостероновой, стимулирующих оставшиеся неповрежденные кардиомиоциты взять на себя функцию погибших.
Начинается ремоделирование.
Оно характеризуется тем, что оставшиеся в живых кардиомиоциты, переполняясь кальцием, резко повышают свою контрактильность, повышают пейсмекерную активность, начинают гипертрофироваться.
Эти процессы позволяют временно поддержать на адекватном уровне сердечный выброс. Однако вскоре компенсаторное (адаптивное) ремоделирование переходит в свою противоположность.
Гипертрофия миокарда, тахикардия, гиперконтрактильность – это энергоемкие процессы, которые сопровождаются повышением потребности миокарда в кислороде.
Адекватность доставки кислорода к миокардицитам уменьшается, в результате чего развивается хроническая гипоксия.
Гипоксия миокарда наряду с переполнением кардиомиоцитов кальцием приводит к нарушению диастолического расслабления, повреждению клеточных мембран клеток, вызывает электрическую нестабильность миокарда.
При этом включается защитно-приспособительный механизм, получивший название «гибернация миокарда» («спячка»). Часть клеток потребляет минимум энергии, хуже сокращается, но благодаря этому сохраняет свою жизнеспособность.
Среди оставшейся части живых и способных к сокращению клеток миокарда срабатывает генетически детерминированный механизм – гибель клеток путем апоптоза. Апоптоз характерен для всех клеток, но при ХСН он активизируется, в результате чего дополнительно погибает еще часть кардиомиоцитов.
При длительном применении инотропных средств у больных с ХСН все меньшее число кардиомиоцитов способно функционировать адекватно. Это приводит к прогрессирующей дилатации сердца и снижению сердечного выброса. Этим, в частности, объясняется негативное влияние на течение и прогноз у больных с ХСН сердечных гликозидов и других препаратов, обладающих положительным инотропным действием.
На важность взаимоотношения между геометрией и функцией сердца указывал еще Гарвей в XVII в. При нормальной сократительной функции миокарда происходит последовательное динамическое изменение геометрии левого желудочка от более эллипсоидной в фазу систолы к более сферичной в момент диастолы.
Относительное удлинение левого желудочка во время систолы является важным механизмом, позволяющим ему выбрасывать больший объем крови.
Нарушение геометрии желудочка с его дисфункцией выявляется у всех больных с сердечной недостаточностью и часто предшествует уменьшению фракции выброса, нарушениям системной гемодинамики и клиническим проявлениям заболевания.
У больных ИБС после перенесенного крупноочагового инфаркта миокарда этот процесс может завершиться развитием сердечной недостаточности в течение нескольких месяцев или лет даже в случае прекращения прогрессирования ИБС. Если же ИБС прогрессирует, возникают повторные инфаркты миокарда, вероятность развития сердечной недостаточности резко возрастает.
– Читать далее “Адаптация организма к хронической сердечной недостаточности. Изменения органов при ХСН”
Оглавление темы “Сердечная недостаточность”:
Источник: //medicalplanet.su/cardiology/remodelirovanie_miokarda_pri_serdechnoi_nedostatochnosti.html
Источник
