Ремоделирование миокарда при сердечной недостаточности

Патологические изменения у больных с сердечной недостаточностью могут усиливаться при нарушении функции сосудистого эндотелия. Если концентрация эндотелина возрастает и его количество превышает уровень вазорелаксирующих факторов, это приводит к выраженной вазоконстрикции и способствует задержке в организме натрия и воды. При сердечной недостаточности уровень секреции сосудистым эндотелием эндотелина увеличивается, а его концентрация в плазме крови повышена. Обычно уровень эндотелина в крови больных прямо коррелирует с уровнем ангиотензина II. Последний, в свою очередь, еще больше может стимулировать секрецию эндотелина.
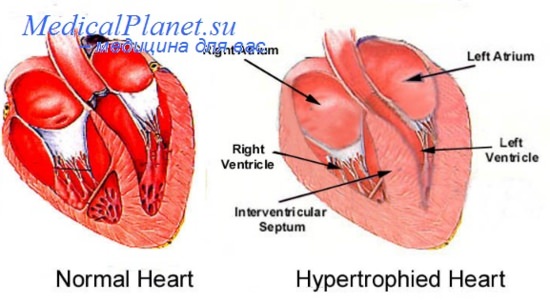
Вследствие прогрессирующей гипертрофии миокарда возникает диастолическая ригидность левого желудочка, резко усиливается дилатация сердца, которую раньше обозначали как миогенная дилатация, к диастолической дисфункции присоединяется систолическая.
Тахикардия, которая первоначально носит компенсаторный характер, резко повышает энергетические затраты сердца и существенно ограничивает толерантность к физическим нагрузкам. Все эти, уже патологические, механизмы стимулируются гиперактивацией нейрогормональных систем. Прогрессирующее снижение сердечного выброса способствует задержке в организме жидкости. В миокардиоцитах происходит трансформация ангиотензина I в ангиотензин П. Длительное повышение его уровня в плазме крови, особенно в сочетании с гиперальдостеронизмом, сопровождается некрозом кардиомиоцитов. Ангиотензин П имеет особое значение в развитии гипертрофии миокарда, которая первоначально, как упоминалось выше, также носит компенсаторный характер.
Параллельно гибели части миокардиоцитов и гипертрофии оставшихся стимулируется рост фибробластов, увеличивается содержание коллагена в мышце сердца, прогрессирует фиброз. Это приводит к снижению эластичности миокарда и усилению его ригидности. Развивается так называемая диастолическая жесткость желудочков сердца. Диастолическая дисфункция является ведущей причиной развития сердечной недостаточности у многих больных с застойной сердечной недостаточностью уже на ранних этапах заболевания.
Чрезмерная гипертрофия сопровождается увеличением потребности миокарда в кислороде. Кроме того, по мере нарастания гипертрофии ухудшается кровообращение миокарда, поскольку развитие коллатералей при этом существенно отстает от увеличения массы миокарда и в конце концов приводит к ослаблению сократительной деятельности сердечной мышцы.
При многих заболеваниях сердечно-сосудистой системы в мышце сердца происходят структурные изменения, затрагивающие как поврежденные, так и неповрежденные участки миокарда. Они развиваются у больных хронической ИБС в результате повторяющихся эпизодов ишемии, у больных инфарктом миокарда вследствие некроза участков функционирующего миокарда, появляются при воспалительных процессах, хронической перегрузке сердца объемом или давлением и при других поражениях миокарда. С одной стороны, они часто предшествуют клиническому проявлению сердечной недостаточности, с другой – сами усугубляют систолическую и диастолическую дисфункции желудочков, способствуют прогрессированию сердечной недостаточности, отрицательно влияют на качество и продолжительность жизни больных.
В последние годы внимание исследователей привлекают структурные изменения сердца, происходящие при сердечной недостаточности и обозначаемые как «ремоделирование». Ремоделирование миокарда можно обозначить как комплекс структурных изменений в мышце сердца, возникающих вследствие сложных нейрогуморальных изменений. Термин «ремоделирование» стал использоваться начиная с 1980-х годов для обозначения структурно-геометрических изменений левого желудочка, развивающихся после инфаркта миокарда. В настоящее время этот термин применяется в более широком смысле.
В широком понимании ремоделирование сердца означает комплекс морфологических и функциональных изменений, происходящих в сердце в ответ на повреждение миокарда. Ремоделирование сердца в первую очередь включает прогрессирующее увеличение массы миокарда, дилатацию полостей, а также изменение геометрии сердца.
Схематично развитие ремоделирования миокарда можно представить следующим образом. После повреждения мышцы сердца (инфаркт миокарда, миокардит, дилатационная кардиомиопатия и т.п.) часть кардиомиоцитов гибнет. В миокарде сразу начинаются процессы, направленные на то, чтобы сохранить основную функцию сердца – сократительную. Происходит компенсаторная активация нейрогормональной системы, прежде всего симпатико-адреналовой и ренин-ангиотензин-альдостероновой, стимулирующих оставшиеся неповрежденные кардиомиоциты взять на себя функцию погибших.
Начинается ремоделирование. Оно характеризуется тем, что оставшиеся в живых кардиомиоциты, переполняясь кальцием, резко повышают свою контрактильность, повышают пейсмекерную активность, начинают гипертрофироваться. Эти процессы позволяют временно поддержать на адекватном уровне сердечный выброс. Однако вскоре компенсаторное (адаптивное) ремоделирование переходит в свою противоположность.
Гипертрофия миокарда, тахикардия, гиперконтрактильность – это энергоемкие процессы, которые сопровождаются повышением потребности миокарда в кислороде. Адекватность доставки кислорода к миокардицитам уменьшается, в результате чего развивается хроническая гипоксия. Гипоксия миокарда наряду с переполнением кардиомиоцитов кальцием приводит к нарушению диастолического расслабления, повреждению клеточных мембран клеток, вызывает электрическую нестабильность миокарда.
При этом включается защитно-приспособительный механизм, получивший название «гибернация миокарда» («спячка»). Часть клеток потребляет минимум энергии, хуже сокращается, но благодаря этому сохраняет свою жизнеспособность.
Среди оставшейся части живых и способных к сокращению клеток миокарда срабатывает генетически детерминированный механизм – гибель клеток путем апоптоза. Апоптоз характерен для всех клеток, но при ХСН он активизируется, в результате чего дополнительно погибает еще часть кардиомиоцитов.
При длительном применении инотропных средств у больных с ХСН все меньшее число кардиомиоцитов способно функционировать адекватно. Это приводит к прогрессирующей дилатации сердца и снижению сердечного выброса. Этим, в частности, объясняется негативное влияние на течение и прогноз у больных с ХСН сердечных гликозидов и других препаратов, обладающих положительным инотропным действием.
На важность взаимоотношения между геометрией и функцией сердца указывал еще Гарвей в XVII в. При нормальной сократительной функции миокарда происходит последовательное динамическое изменение геометрии левого желудочка от более эллипсоидной в фазу систолы к более сферичной в момент диастолы. Относительное удлинение левого желудочка во время систолы является важным механизмом, позволяющим ему выбрасывать больший объем крови. Нарушение геометрии желудочка с его дисфункцией выявляется у всех больных с сердечной недостаточностью и часто предшествует уменьшению фракции выброса, нарушениям системной гемодинамики и клиническим проявлениям заболевания.
У больных ИБС после перенесенного крупноочагового инфаркта миокарда этот процесс может завершиться развитием сердечной недостаточности в течение нескольких месяцев или лет даже в случае прекращения прогрессирования ИБС. Если же ИБС прогрессирует, возникают повторные инфаркты миокарда, вероятность развития сердечной недостаточности резко возрастает.
– Читать далее “Адаптация организма к хронической сердечной недостаточности. Изменения органов при ХСН”
Оглавление темы “Сердечная недостаточность”:
- Ремоделирование миокарда при сердечной недостаточности – механизмы
- Адаптация организма к хронической сердечной недостаточности. Изменения органов при ХСН
- Варианты гипертрофии левого желудочка. Патогенез
- Водный обмен человека – регуляция, нарушения
- Регуляция обмена натрия и его нарушения
- Гипомагниемия, гипермагниемия – клиника, диагностика
- Гипокальциемия, гиперкальциемия – клиника, диагностика
- Классификация сердечной недостаточности
- Немедикаментозное лечение хронической сердечной недостаточности (ХСН) – принципы
- Диуретики для лечения хронической сердечной недостаточности (ХСН)
Источник
Начало: бета-адреноблокаторы в лечении хронической сердечной недостаточности.
По определению Ю. Н. Беленкова (2002) процесс непрерывного развития сердечно-сосудистых заболеваний – от факторов риска до гибели пациента есть единый сердечно-сосудистый континуум (рис. 1.). Как видно из представленного рис., этот процесс от появления главных факторов риска (ФР) — артериальной гипертензии (АГ), сахарного диабета (СД) и дислипидемии, способных привести к ишемической болезни сердца (ИБС), которая может осложниться развитием острого инфаркта миокарда (ОИМ), до ремоделирования левого желудочка (ЛЖ) вследствие гибели кардиомиоцитов (КМЦ) и потери сократительной способности миокарда может протекать достаточно продолжительно. Интенсивность развития ХСН, приводящей к смерти пациента, во многом определяется как количеством погибших кардиомиоцитов, так и качеством лечения пациента. В то же время гибель больного, особенно у лиц с начальными проявлениями ХСН, может быть вследствие появления жизненно опасных аритмий. Развитие ХСН может идти и иным путем: артериальная гипертензия → гипертрофия левого желудочка → дисфункция левого желудочка → ХСН или ИБС → гибернация миокарда → дисфункция левого желудочка → ХСН.

Необходимой стадией развития сердечно-сосудистого континуума является ремоделирование сердечной мышцы. По определению М. Pfeffer (1985) “ремоделирование — это структурно-геометрические изменения левого желудочка, включающие в себя процессы гипертрофии миокарда и дилатации сердца, приводящие к изменению его геометрии и нарушению систолической и диастолической функции”. Как видно из вышеприведенного рис., одним из важнейших путей прерывания порочного круга ремоделирования сердечной мыщцы является воздействие на его главное звено патогенеза — гиперактивацию нейрогормональных систем, роль которых в сердечно-сосудистом континууме может быть схематично представлена следующим образом (рис.2).

В результате перегрузки сердца давлением, как, например, при артериальной гипертензии, развивается концентрический тип гипертрофии стенок левого желудочка (рис.3). За счет утолщения стенок левого желудочка (увеличения его полости при этом нет) повышается жесткость миокарда, т.е. развивается так называемая диастолическая дисфункция левого желудочка (ДДЛЖ). При таком изменении структуры левого желудочка меняется и его функция, в данном случае наблюдается недостаточное диастолическое расслабление левого желудочка. Второй тип ремоделирования развивается по иному механизму, когда результатом структурной перестройки сердечной мышцы является эксцентрическая гипертрофия левого желудочка.

Суть процесса перестройки геометрии левого желудочка заключается в следующем. При объемной перегрузке, возникающей, например, при гемодинамически значимой недостаточности митрального клапана, ситуации нередкой у пациентов ранее перенесших острый инфаркт миокарда (ОИМ), вследствие митральной регургитации развивается эксцентрическая гипертрофия левого желудочка и расширение его полости. Подобная ситуация, усугубляющаяся ишемией миокарда, ведущей к гибели кардиомиоцитов, сопровождается существенным снижением силы сердечного сокращения, т.е. наблюдается типичная картина систолической дисфункции левого желудочка (СДЛЖ), прогностически более неблагоприятной, чем диастолическая дисфункция левого желудочка.
Резюмируя представленные данные, не останавливаясь на других важнейших механизмах формирования недостаточности миокарда, выделим главное. На длинном пути от дисбаланса нейрогормонов, определяющих степень и интенсивность клеточного повреждения до появления структурного изменения самой мышцы сердца, вплоть до эксцентрического ремоделирования, у большинства пациентов проходят годы. Этапность сердечно-сосудистого континуума позволяет полезно воздействовать на ключевые звенья патофизиологического процесса развития и прогрессирования ХСН. Эффективность применения нейромодуляторов, к числу которых относятся, в первую очередь, ингибиторы ангиотензинпревращающего фермента (иАПФ) и бета-адреноблокаторы, доказана огромным числом масштабных многоцентровых кооперативных исследований.
Тем не менее, даже несмотря на достаточно четкие представления о патофизиологии основных причин, приводящих к ХСН (артериальной гипертензии, сахарного диабета (СД) и дислипидемии), а так же стандартов по их медикаментозной коррекции, прогноз течения ХСН остается пессимистическим.
В качестве одной из причин развития ХСН можно отметить ситуацию у больных с артериальной гипертензией — основной категории пациентов, у которых формируется дисфункция миокарда. В России по данным И. Е. Глазовой (2002), базирующихся на исследованиях сотрудников центра профилактической медицины РФ, артериальной гипертензией страдают 41,1% женщин старше 18 лет и 39,2% мужчин. Тем не менее, несмотря на такую высокую распространенность артериальной гипертензии (по данным обследования 80000 человек в возрасте 40-45 лет в 23-х городах России в среднем артериальная гипертензия в популяции составила 23%), о наличии заболевания знали лишь 57% больных, а эффективным лечение было признано только в 8% случаев. Эффективно лечатся только 27% пациентов с артериальной гипертензией в США, Италии – 9%, Египте – 8%, Англии – 6%, Китае – 3%, Польше – 2 %.
Исходя из этого немаловажного и только одного примера, перед врачом-практиком возникает вопрос: что же делать, чтобы лиц с дисфункцией миокарда было как можно меньше и какими способами это можно осуществить? Что делать, если применение таких испытанных временем и опытом клиницистов популярных антигипертензивных средств, как резерпин, адельфан и др., например, еще более популярного клонидина (клофелина), является свидетельством некомпетентности терапевта в области современной кардиологии и в конечном итоге ведет к увеличению случаев смертей от инсульта у больных с артериальной гипертензией, особенно в сочетании ее с ХСН?
Далее: гипертрофия миокарда левого желудочка.
Источник
Повторяющиеся эпизоды ишемии и реперфузии при хронической ишемической болезни сердца, хроническая сердечная недостаточность, различные варианты кардиомиопатии сопровождаются сложными изменениями в сердце, которые означают его ремоделирование.
Термином «ремоделирование»обозначают структурно-геометрические изменения в сердце, характеризующиеся гипертрофией, гиперплазией и нарушением взаимного расположения кардиомиоцитов, дистрофией и фиброзом миокарда, заменой в нем коллагена типа I на тип III, снижением относительной плотности капилляров и увеличением капилляро-мышечного пространства. Это приводит к дилатации и изменению геометрии полостей сердца, его контуров, к прогрессирующему снижению его сократительной функции.
Выделяют несколько ключевых клеточных и молекулярно-генетических механизмов ремоделирования сердца. К ним относят:
– изменения в гено- и фенотипе (заключаются в активации экспрессии гена тяжелых цепей миозина, торможении процесса образования миофибрилл кардиомиоцитов, снижении АТФ-азной активности миозина, снижении инотропизма миокарда и др.);
– эксцентрическую гипертрофию миокарда (характеризующуюся гипертрофией, перерастяжением и увеличением продольного размера кардиомиоцитов);
– гибель кардиомиоцитов (как по механизмам некроза, так и апоптоза);
– тотальный кардиофиброз (интерстициальный, периваскулярный);
– повышенное образование и лизис коллагена;
– активацию металлопротеиназ с разрывами сшивок кардиомиоцитов и, в связи с этим, их продольное проскальзывание.
Одновременно происходит и метаболическое ремоделирование, включающее расстройства энергообеспечения миокарда; дисбаланс ионов и жидкости, спектра ферментов и их активности; нарушение синтеза компонентов мембран; существенные нарушения метаболизма в строме сердца и др.
Ишемия и реперфузия миокарда сочетаются с развитием ряда патологических состояний, характеризующихся специфическими изменениями в сердце и организме в целом. К таким состояниям относят: отсутствие (невосстановление) кровотока в миокарде при его постокклюзионной реперфузии или феномен «no-reflow», «оглушенный» миокард, «спящий» миокард. Указанные состояния представляют собой закономерные следствия ишемии – реперфузии миокарда.
Феномен «no-reflow»характеризуется отсутствием или значительно сниженным и недостаточным кровотоком в ранее ишемизированной зоне сердца при ликвидации окклюзии магистральной ветви коронарной артерии. Такая ситуация может наблюдаться при эпизодах нестабильной стенокардии или при возобновлении кровотока в остром периоде инфаркта миокарда (в результате выполнения тромболизиса, тромбэктомии, аортокоронарного шунтирования, стентирования и других методов реваскуляризации).
Ключевыми звеньями патогенеза феномена «no-reflow» являются:
– обтурация сосудов микроциркуляторного русла микротромбами форменных элементов крови и фибрина, а также атероматозными массами (появляющимися в процессе разрушения атеросклеротических бляшек при ангиопластике и стентировании);
– сужение просвета микрососудов отечными клетками эндотелия;
– сдавление сосудов отекшими кардиомиоцитами;
– спазм артериол сердца под влиянием избытка катехоламинов.
«Оглушенный» миокардхарактеризуется более или менее длительным преходящим снижением сократительной функции ранее ишемизированного жизнеспособного миокарда при его реперфузии. В англоязычной литературе этот феномен обозначается как станнированный миокард (англ. stun – оглушать, ошеломлять). В клинике он нередко выявляется у пациентов со стенокардией стабильного и нестабильного течения, острым инфарктом миокарда, сердечной недостаточностью на фоне хронической ишемической болезни сердца.
Основными механизмами развития этого состояния считают:
– повреждение реперфузируемых клеток миокарда кальцием, который в избытке накапливается в них при возобновлении коронарного кровотока (ионы кальция вызывают разобщение окисления и фосфорилирования в митохондриях, интенсифицируют процесс липопероксидации, активируют внутриклеточные гидролитические ферменты, в том числе кальпаины, осуществляющие внутриклеточный протеолиз);
– чрезмерную интенсификацию липопероксидных процессов и потенцирование повреждения мембран и ферментов реперфузируемых кардиоцитов.
Спящий или гибернированный(англ. hibernate – быть в бездействии, находиться в зимней спячке) миокард проявляется стойким (но при эффективной реперфузии – обратимым) снижением контрактильной функции жизнеспособного миокарда. Причиной гибернации миокарда является его длительная гипоперфузия (в том числе при постишемическом восстановлении кровотока, но неадекватном для восстановления метаболизма и сократительной функции). Своевременное возобновление адекватного коронарного кровотока обеспечивает восстановление обмена веществ и сокращения миокарда.
К числу основных механизмов гибернации гипоперфузируемого миокарда относят:
– нарушение кальцийтранспортной функции саркоплазматической сети кардиомиоцитов;
– расстройство в них кальциевой регуляции взаимодействия актина и миозина;
– снижение содержания в клетках миокарда сократительных белков;
– массированный апоптоз кардиомиоцитов;
– их дедифференцировку и утрату специфических функций.
Лечебные мероприятия при ремоделировании и сердечной недостаточности проводятся комплексно. Они направлены на прекращение (снижение степени) патогенного действия причинного фактора (этиотропная терапия), разрыв звеньев механизма ее развития (патогенетическая терапия), потенцирование адаптивных процессов в сердце. При своевременном начале терапии и ее рациональном проведении возможна нормализация сердечной деятельности и системной гемодинамики.
Источник
