Рекомендации по инфаркту миокарда 2013
В сентябре 2013 г. были представлены новые рекомендации по диагностике и лечению стабильной ишемической болезни сердца (ИБС) [1]. Среди многих изменений в рекомендациях повышенное внимание привлекает стенокардия при неизмененных коронарных артериях (КА), или микроваскулярная стенокардия. Спектр клинико-патологических корреляций между симптомами и характером изменений КА при стенокардии достаточно широк и варьирует от типичных проявлений стенокардии, обусловленных стенозирующим поражением КА и транзиторной ишемией миокарда, до нетипичного для стенокардии болевого синдрома при неизмененных КА. Это диапазон от атипичного для стенокардии болевого синдрома на фоне значимых стенозов в КА, в конечном итоге приобретающего форму диагноза «стенокардия», до типичной клиники заболевания на фоне неизмененных КА, которое предлагается идентифицировать как «микроваскулярная стенокардия» (МВС) в Рекомендациях от 2013 г. по стабильной стенокардии, или ранее – кардиальный синдром Х (КСХ).
Определение «КСХ» впервые было применено в 1973 г. доктором H.G. Кеmр, обратившим внимание на исследования канадских ученых R. Arbogast и M.G. Bou-rassa. Болевой синдром в этой группе пациентов может отличаться следующими характеристиками:
1) боль может охватывать небольшую часть левой половины грудной клетки, продолжаться от нескольких часов до нескольких дней и не купироваться приемом нитроглицерина;
2) боль может иметь типичные характеристики ангинозного приступа по локализации, продолжительности, но при этом возникать в покое (атипичная стенокардия, обусловленная вазоспазмом);
3) возможно проявление болевого синдрома с типичными характеристиками ангинозного приступа, но более продолжительным по времени без четкой связи с физической нагрузкой и отрицательным результатом стресс-тестов, что соответствует клинической картине МВС.
Диагностика и определение тактики лечения у больных МВС представляют собой сложную задачу. У значительной части пациентов (приблизительно 50% женщин и 20% мужчин) при наличии стенокардии коронароангиография (КАГ) не выявляет атеросклероза эпикардиальных артерий, что указывает на нарушение функции (коронарного резерва) микрососудов [2, 3]. Данные исследования Women’s Ischemia Syndrome Evaluation (WISE), организованного Национальным институтом сердца, легких и крови, продемонстрировали 2,5% ежегодный риск развития неблагоприятных сердечно-сосудистых событий в этой группе больных, включая смерть, инфаркт миокарда, инсульт и сердечную недостаточность [4]. Результаты 20-летнего наблюдения за 17 435 больными в Дании с неизмененными КА и необструктивным диффузным поражением КА со стенокардией показали 52 и 85% повышение риска крупных сердечно-сосудистых событий (сердечно-сосудистая смертность, госпитализация по поводу ИМ, сердечной недостаточности, инсульта) и 29 и 52% повышение риска общей смертности соответственно в этих группах без существенных различий по половому признаку.
Несмотря на отсутствие универсального определения МВС, основным проявлениям заболевания соответствует наличие триады признаков:
1) типичная стенокардия, обусловленная нагрузкой (в комбинации или при отсутствии стенокардии покоя и одышки);
2) наличие признаков ишемии миокарда по данным ЭКГ, холтеровского мониторирования ЭКГ, стресс-тестов в отсутствие других заболеваний сердечно-сосудистой системы;
3) неизмененные или малоизмененные КА (стенозы <50%) [1]. Наиболее чувствительным методом диагностики ишемии миокарда у этих больных является применение фармакологических тестов или ВЭМ-теста в сочетании с однофотонной эмиссионной компьютерной томографией миокарда при введении 99mTc-МИБИ (аналог таллия-201), позволяющего визуализировать дефекты перфузии миокарда как результат нарушенного коронарного резерва в ответ на повышенные метаболические потребности миокарда. Приступы стенокардии могут возникать достаточно часто – несколько раз в неделю, но при этом иметь стабильный характер. Таким образом, МВС является формой хронической стенокардии и по МКБ-10 относится к коду 120.8 «Другие формы стенокардии». Диагноз формулируется в зависимости от функционального класса стенокардии, например «ИБС при неизмененных коронарных артериях. Стенокардия ФК II. (Микроваскулярная стенокардия)».
Основной причиной МВС является дисфункция коронарных микрососудов, определяемая как аномальный ответ коронарной микроциркуляции на вазоконстрикторные и вазодилатирующие стимулы. На рисунке 1 представлены основные механизмы и сигнальные пути регуляции коронарного кровотока. В качестве основных причин микрососудистой дисфункции обсуждаются дисфункция эндотелия, гиперреактивность гладкомышечных клеток и повышенная активность симпатической нервной системы [6–8]. Дефицит эстрогенов может способствовать развитию КСХ за счет дисфункции эндотелия (ДЭ) у женщин в постменопаузальном периоде. Известные традиционные факторы риска атеросклероза, такие как дислипидемия, курение, ожирение, нарушение углеводного обмена, также могут влиять на становление дисфункции эндотелия КА с последующим развитием МВС.
Коронарный резерв, определяемый как соотношение миокардиального кровотока в фазу гиперемии с базальным кровотоком, уменьшается при условии увеличенного базального кровотока либо сокращенного в фазу гиперемии. Базальный кровоток коррелирует с показателями гемодинамики (артериальное давление, нейрогуморальные параметры, метаболизм миокарда, частота сердечных сокращений – ЧСС). Недавно получены данные о наличии замедленного обратного захвата норадреналина в синапсах у женщин, что может объяснять специфичность МВС для женщин и нарушение автономной регуляции тонуса микрососудов со снижением коронарного резерва [9]. Напротив, гиперемический ответ регулируется эндотелийзависимой и эндотелийнезависимой реакцией. Механизмы, вызывающие повреждение гиперемического миокардиального кровотока у больных МВС, в настоящее время не уточнены: часть пациентов демонстрирует дисфункцию эндотелия, другие – аномалию эндотелийнезависимых вазодилатирующих реакций, в частности дефект метаболизма аденозина [10]. Нами впервые продемонстрировано снижение резерва миокардиальной перфузии при проведении АТФ-ОЭКТ миокарда (рис. 2) [11]. Возможно применение дипиридамола для оценки коронарного резерва с помощью трансторакальной ультразвуковой допплерографии (рис. 3), также убедительные доказательства в пользу снижения коронарного резерва были получены в исследованиях с применением позитронно-эмиссионной томографии сердца [12].
Ишемические изменения на ЭКГ и дефекты захвата миокардом таллия во время стресс-тестов идентичны у больных с МВС и обструктивным атеросклерозом эпикардиальных КА, но отличаются отсутствием зон гипокинеза при МВС, что обусловлено небольшими объемами очагов ишемии, частой локализацией их в субэндокардиальной зоне, быстрым вымыванием анаэробных метаболитов и появлением зон с компенсаторной гиперсократимостью сопредельных миоцитов, что существенно ограничивает возможность визуализации таких зон с нарушенной сократимостью [8, 13]. Все же компенсаторное высвобождение аденозина может оказаться достаточным для стимуляции афферентных волокон, вызывающих ощущение боли, что особенно ярко проявляется в условиях повышенной болевой чувствительности, характеризующей пациентов с МВС.
МВС, как было отмечено выше, устанавливается при наличии приступов стенокардии, документированной ишемии миокарда при отсутствии гемодинамически значимых стенозов в КА (стенозы ≤50% или интактные КА) и отсутствии признаков вазоспазма (как это имеет место при вариантной стенокардии Принцметала). Документируется ишемия миокарда обычно нагрузочными тестами, в качестве которых используются велоэргометрия (ВЭМ), тредмил-тест, или 24-часовым холтеровским мониторированием ЭКГ (ХМ-ЭКГ) путем выявления горизонтальной депрессии сегмента ST более чем на 1 мм от точки J на ЭКГ. Следует считать недопустимым практикуемый врачами метод исключения диагноза «ИБС» только выявлением неизмененных КА по данным КАГ у больных с болевым синдромом в грудной клетке, отказ от проведения дополнительных методов исследования, наиболее точно верифицирующих ишемию миокарда, т.к. это приводит к недооценке симптомов стенокардии и неназначению необходимой медикаментозной терапии, что ухудшает течение болезни, требует повторных госпитализаций. Таким образом, достоверная верификация ишемии миокарда у больных КСХ представляется детерминантой, определяющей стратегию и тактику лечения, а значит, и прогноз жизни в этой группе больных.
Для больных с МВС характерны низкая воспроизводимость ишемических изменений на ЭКГ при проведении нагрузочных тестов и практически отсутствие возможности выявить зоны гипокинеза по данным стресс-ЭхоКГ [14], что обусловлено развитием субэндокардиальной ишемии вследствие спазма интрамиокардиальных сосудов в отличие от больных с обструктивным атеросклерозом эпикардиальных артерий, соответствующей транмуральной ишемией и систолической дисфункцией миокарда [15, 16].
Верификация ишемии миокарда в этой группе больных возможна:
1) при визуализации дефектов перфузии миокарда в нагрузочных или фармакологических тестах;
2) подтверждением биохимическими методами нарушения метаболизма в миокарде.
В связи с трудоемкостью последней методики основополагающими методами верификации ишемии миокарда у больных МВС являются:
1. Однофотонная эмиссионная компьютерная томография сердца, совмещенная с ВЭМ-тестом или фармтестом. В первом случае при достижении субмаксимальной частоты сердечных сокращений (ЧСС) или ЭКГ-признаков ишемии миокарда во время выполнения ВЭМ-теста пациентам вводят внутривенно 99mTc-МИБИ (99mTc-метоксиизобутилизонитрила) активностью 185–370 мБк с последующим проведением через 1 ч ОЭКТ миокарда и оценкой дефектов перфузии. В случаях с недостаточной информативностью пробы с физической нагрузкой или при ее отрицательных результатах альтернативным методом при проведении радионуклидных исследований перфузии миокарда является метод с использованием фармакологического теста. В этом случае ВЭМ-тест заменяется введением внутривенно фармпрепарата (добутамина, дипиридамола, аденозина). Ранее проводились исследования в ФГБУ РКНПК Минздрава России с введением ацетилхолина интракоронарно и 99mTc-МИБИ внутривенно с целью провокации ишемии миокарда, обусловленной дисфункцией эндотелия [8]. Эти данные в последующем были подтверждены в исследовании ACOVA [17]. Указанный метод продемонстрировал высокую информативность, но не нашел широкого применения из-за инвазивного характера. Применение добутамина представляется нецелесообразным у больных МВС, т.к. ожидаемые эффекты снижения сократимости миокарда вследствие его ишемии будут крайне редки, как и в случае стресс-ЭхоКГ. В настоящее время исследования, проведенные в ФГБУ РКНПК Минздрава России, позволяют рекомендовать в широкой клинической практике способ верификации ишемии миокарда у больных МВС – ОЭКТ миокарда, совмещенную с введением доступного на фармрынке РФ аденозинтрифосфата (АТФ) [11, 18].
2. Интракоронарное введение аденозина с оценкой скорости кровотока методом внутрисосудистого ультразвукового исследования доказывает наличие аномальной скорости кровотока у больных МВС [19].
3. Аномальное соотношение фосфокреатина/АТФ в миокарде у больных МВС по данным МР-спектроскопии [2].
4. Субэндокардиальные дефекты перфузии по данным МРТ сердца [16].
При лечении у всех больных МВС должен быть достигнут оптимальный уровень факторов риска. Подбор симптоматической терапии носит эмпирический характер в силу неуточненной причины заболевания. Результаты клинических исследований не поддаются обобщению в связи с отсутствием единых критериев селекции и немногочисленностью выборок больных, несовершенным дизайном исследования и недостижением эффективности лечения МВС [1].
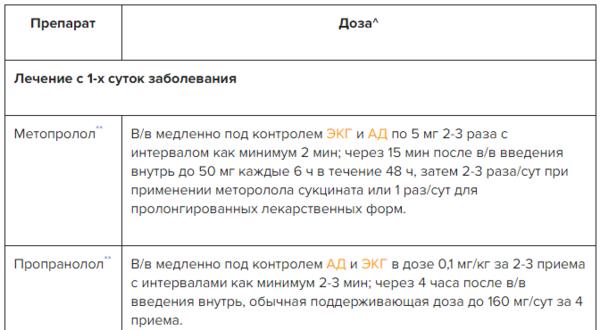
Традиционные антиангинальные препараты назначают на первых этапах лечения. Короткодействующие нитраты рекомендуют для купирования ангинозных приступов, но они часто не оказывают эффекта. В связи с доминирующей симптоматикой стенокардии напряжения рациональной представляется терапия β-блокаторами, положительное влияние которых на устранение симптомов стенокардии доказано в нескольких исследованиях; это препараты первого выбора, особенно у больных с очевидными признаками повышенной адренергической активности (высокая частота пульса в покое или при физической нагрузке).
Антагонисты кальция и пролонгированные нитраты продемонстрировали неоднозначные результаты в клинических исследованиях, их эффективность очевидна при дополнительном назначении к β-блокаторам в случае сохранения стенокардии. Антагонисты кальция могут быть рекомендованы как препараты первой линии в случае вариабельности порога стенокардии напряжения. У пациентов с сохраняющейся стенокардией, несмотря на проводимую оптимальную антиангинальную терапию, могут быть предложены следующие назначения. Ингибиторы АПФ (или блокаторы ангиотензина II) способны улучшить функцию микрососудов, нейтрализуя вазоконстрикторный эффект ангиотензина II, особенно у больных с артериальной гипертонией и сахарным диабетом. Возможно назначение некоторым пациентам с целью подавления повышенной симпатической активности α-адреноблокаторов, влияние которых на симптомы стенокардии остается неочевидным. Улучшение толерантности к физическим нагрузкам у больных МВС продемонстрировано в ходе терапии никорандилом.
Улучшение клинических симптомов достигалось за счет коррекции функции эндотелия при терапии статинами и эстрогензаместительной терапии. Больным с сохраняющейся стенокардией на фоне терапии препаратами, указанными выше, может быть предложено лечение производными ксантинов (аминофиллин, бамифиллин) в дополнение к антиангинальным препаратам с целью блокады аденозиновых рецепторов. Новые антиангинальные препараты – ранолазин и ивабрадин – также продемонстрировали эффективность у больных с МВС (табл. 1). Наконец, в случае рефрактерной стенокардии должны быть обсуждены дополнительные вмешательства (например, чрескожная нейростимуляция).
Литература
1. 2013 ESC guidelines on the management of stable coronary artery disease. The Task Force on the management of stable coronary artery disease of the European Society of Cardiology. https://eurheartj.oxfordjournals.org/ content/early/2013/ 08/28/eurheartj.eht296
2. Zipes D.P., Libby P., Bonow R.O. et al. Braunwald’s heartcdisease: a textbook of cardiovascular medicine, 8 edn. Saunders-Elsevier, Philadelphia 66. Zorc-Pleskovic R., Vraspir-Porenta O., Zorc M. et al .2008.
3. Sharaf B.L., Pepine C.J., Kerensky R.A. et al. Detailed angiographic analysis of women with suspected ischemic chest pain (pilot phase data from the NHLBI-sponsored Women’s Ischemia Syndrome Evaluation [WISE] Study Angiographic Core Laboratory // Am. J. Cardiol. 2001. Vol. 87. P. 937–941.
4. Johnson B.D., Shaw L.J., Buchthal S.D. et al. Prognosis in women with myocardial ischemia in the absence of obstructive coronary disease. Results from the National Institutes of Health–National Heart, Lung, and Blood Institute-sponsored Women’s Ischemia Syndrome Evaluation (WISE) // Circulation. 2004. Vol. 109. P. 2993–2999.
5. Jespersen L., Hvelplund A., Abildstrøm S.Z. et al. Stable angina pectoris with no obstructive coronary artery disease is associated with increased risks of major adverse cardiovascular events // Eur. Heart J. 2012. Vol. 33. P. 734–744.
6. Cannon R.O. 3rd, Watson R.M., Rosing D.R., Epstein S.E. Angina caused by reducedvasodilator reserve of the small coronary arteries // J. Am. Coll. Cardiol. 1983. Vol. 1. P. 1359–1373.
7. Camici P.G., Crea F. Coronary microvascular dysfunction // N. Engl. J. Med. 2007. Vol. 356. P. 830–840.
8. Сергиенко В.Б., Самойленко Л.Е., Саютина Е.В. и др. Роль дисфункции эндотелия в развитии ишемии миокарда у больных ИБС с неизмененными и малоизмененными коронарными артериями // Кардиология. 1999. № 1. С. 25–30.
9. Lanza G.A., Giordano A., Pristipino C. et al. Abnormal cardiac adrenergic nerve function in patients with syndrome X detected by [I 123] Metaiodobenzylguanidine myocardial scintigraphy // Circulation. 1997. Vol. 96. P. 821–826.
10. Meeder J.G., Blanksma P.K., van der Wall E.E. et al. Coronary vasomotion in patients with syndrome X: evaluation with positron emission tomography and parametric myocardial perfusion imaging // Eur. J. Nucl. Med. 1997. Vol. 24 (5). P. 530–537.
11. Патент на изобретение: Способ диагностики ишемии миокарда у больных Кардиальным синдромом Х по данным однофотонной эмиссионной компьютерной томографии с 99mТс-МИБИ в сочетании с фармакологической пробой с аденозинтрифосфатом натрия. Заявка N 2012122649, решение о выдаче патента от 22.07.2013г. Г.Н. Соболева, Л.Е. Самойленко, И.Е. Карпова, В.Б. Сергиенко, Ю.А. Карпов.
12. Graf S., Khorsand A., Gwechenberger M. et al. Myocardial perfusion in patients with typical chest pain and normal angiogram // Eur. J. Clin. Investig. 2006. Vol. 36. P. 326–332.
13. Zeiher A.M., Krause T., Schachinger V. et al. Impaired endothelial-dependent vasodilatation of coronary resistance vessels is associated with exercise induced myocardial ischemia // Circulation. 1995. Vol. 91. P. 2345–2352.
14. Рустамова Я.К., Алехин М.Н., Сальников Д.В. и др. Значение стресс-эхокардиографии у пациентов с ангиографически неизмененными коронарными артериями // Кардиология. 2008. № 12. С. 4–9.
15. Camici P.G. Is the chest pain in cardiac syndrome X due to subendocardial ischaemia? // Eur. Heart J. 2007. Vol. 28. P. 1539–1540.
16. Vermeltfoort I.A., Bondarenko O., Raijmakers P.G. et al. Is subendocardial ischaemia present in patients with chest pain and normal coronary angiograms? A cardiovascular MR study // Eur. Heart J. 2007. Vol. 28. P. 1554–1558.
17. Ong P., Athanasiadis A., Borgulya G. et al. High prevalence of a pathological response to acetylcholine testing in patients with stable angina pectoris and unobstructed coronary arteries. The ACOVA Study (Abnormal COronary VAsomotion in patients with stable angina and unobstructed coronary arteries) // J. Am. Coll. Cardiol. 2012. Vol. 59(7). P. 655–662.
18. Gemignani A.S., Abbott B.G. The emerging role of the selective A2A agonist in pharmacologic stress testing // J. Nucl. Cardiol. 2010. Vol. 17. P. 494–497.
19. Rigo F., Gherardi S., Cortigiani L. et al. Long-term survival of patients with chest pain syndrome and angiographically normal or near-normal coronary arteries // Eur. Heart J. 2007. (abstract).
Источник
Инфаркт миокарда – одно из тяжелейших осложнений ишемии сердца, смертность от которого еще несколько десятилетий назад была очень высока.
 Сегодня развитие медицины и фармакологии позволило снизить смертность при инфаркте, однако заболевание продолжает стремительно «молодеть». Диагноз «инфаркт миокарда» устанавливают тогда, когда доказан некроз сердечной мышцы вследствие острого нарушения кровообращения в ней.
Сегодня развитие медицины и фармакологии позволило снизить смертность при инфаркте, однако заболевание продолжает стремительно «молодеть». Диагноз «инфаркт миокарда» устанавливают тогда, когда доказан некроз сердечной мышцы вследствие острого нарушения кровообращения в ней.
В половине случаев ИМ является первым клиническим проявлением не выявленной ранее ишемической болезни сердца.
↯
Больше статей в журнале
«Заместитель главного врача»
Активировать доступ
 Коды ИМ по МКБ-10
Коды ИМ по МКБ-10
I21 Острый инфаркт миокарда
I22 Повторный инфаркт миокарда
I24.0 Коронарный тромбоз, не приводящий к инфаркту миокарда
I24.8 Другие формы острой ишемической болезни сердца
Рассмотрим клинические рекомендации по диагностике и лечению инфаркта миокарда.
Клинрекомендации по инфаркту миокарда
Клинические рекомендации по острому инфаркту миокарда составлены Обществом специалистов по неотложной кардиологии.
Они касаются пациентов взрослого возраста и подлежат пересмотру 1 раз в 3 года.
Случай из практики. Женщина поступила в больницу с инфарктом. Родственникам сказали, что уход стоит 3 тыс. руб. в сутки. Отказываетесь — сидите сами.
Какие действия персонала пресечь, чтобы избежать внеплановых проверок по платным медуслугам, читайте в журнале «Заместитель главного врача».
Осложнения
Выделяют следующие основные осложнения ИМ:
- застой в малом круге кровообращения;
- нарушение ритма и проводимости сердечной мышцы;
- кардиогенный шок;
- отек легких.
При наиболее тяжелых механических осложнениях инфаркта рассматривается возможность и целесообразности применения различных методов поддержки кровообращения пациента.
✔ Инфаркт миокарда с повышением сегмента ST: как прогнозировать оценку, информация в Системе Консилиум
 Скачать документ
Скачать документ
Острый ИМ
Острый коронарный синдром – состояние, означающее период обострения ИБС, когда любая группа симптомов дает основания заподозрить острый инфаркт или нестабильную стенокардию.
Термин «острый коронарный синдром» включает в себя следующие понятия:
- Острый инфаркт миокарда.
- Инфаркт миокарда с подъемом сегмента ST ЭКГ (ИМпST).
- Инфаркт миокарда без подъема сегмента ST ЭКГ (ИМбпST).
- Инфаркт миокарда, диагностированный по изменениям ферментов, по другим биомаркерам или по поздним ЭКГ-признакам.
- Нестабильная стенокардия.
Понятие острого коронарного синдрома было введено во врачебную практику, когда обнаружилось, что решение об использовании некоторых методов лечения должно приниматься как можно быстрее, часто еще до того, как установлен диагноз «острый инфаркт».
Доказано, что характер и срочность терапевтических мероприятий, направленных на восстановление коронарного кровотока, зависит от положения сегмента ST к изоэлектрической линии на ЭКГ – при его смещении вверх больному показана коронарная ангиопластика, но при невозможности ее проведения в соответствующие сроки эффективна тромболитическая терапия.
Восстановление коронарного кровотока при ОКСп ST проводится немедленно.
Больной подал в суд заявление о возмещении утраченного заработка и компенсации морального вреда. Посттравматическая дистальная плексопатия:
клинический случай и пример разбора ситуации
– в журнале «Заместитель главного врача».
Подъем сегмента STчаще всего происходит из-за трансмуральной ишемии сердечной мышцы при полной непроходимости одной из коронарных артерий. В этих случаях, как правило, возникает инфаркт миокарда, обозначающийся как ИМпST. ОКСпST ЭКГ, как правило, является следствием окклюзирующего тромбоза коронарной артерии.
Тромб образуется на месте разрыва нестабильной атеросклеротической бляшки, имеющей большой липидное ядро, истонченную оболочку и богатой различными воспалительными элементами.
Также возможно возникновение окклюзирующего тромба на дефекте (эрозии) эндотелия коронарной артерии над антриовентрикулярной блокадой.
Чаще всего непроходимость возникает в месте гемодинамически незначимого стеноза коронарной артерии. Однако при обширном инфаркте миокарда не всегда в ранние сроки заболевания отмечается стойкий подъем сегмента ST на ЭКГ.
В статье вы найдете только несколько готовых образцов и шаблонов.
В Системе «Консилиум» их более 5000.
Успеете скачать всё, что нужно, по демодоступу за 3 дня?
Активировать
Диагностика заболевания
При диагностике острого коронарного синдрома с понижением ST необходимо основываться на анамнестических данных, наличии факторов риска ишемии сердца, особенностях острых симптомов заболевания, характере изменений на электрокардиограмме, а также (не всегда) на сведениях о локальной сократительной функции желудочков.
Согласно клиническим рекомендациям по инфаркту миокарда 2019 года, при недостаточной информативности ЭКГ применяются дополнительные методы обследования. Как правило, это необходимо для того, чтобы исключить болезни сердца с похожей клинической картиной, а также для выявления инфаркта миокарда и оценки рисков неблагоприятного прогноза заболевания.
Характерные симптомы ИМ:
- чувство давления и сжатия за грудиной;
- боль, похожая по субъективным ощущениям на боль при приступе стенокардии, однако более выраженная по силе и длительности;
- характер боли – давящий, жгучий, сжимающий, иногда описывается больным как чувство дискомфорта;
- боль не купируется до конца приемом нитроглицерина, а в ряде случаев – и инъекциями наркотических обезболивающих препаратов;
- боль может быть разной по силе – от незначительной до мучительной и невыносимой;
- болевые ощущения накатывают «волнами» и длятся от 20 минут до нескольких часов;
- боль чаще всего иррадирует в левую руку, под левую лопатку, в челюсть, плечо, зону эпигастрия и др.
Критерии острого ИМ скачайте в Системе Консилиум
Атипичные формы ИМ с понижением ST:
- абдоминальная;
- астматическая;
- аритмическая;
- цереброваскулярная;
- малосимптомная (безболевая).
Лечение по клинрекам
Если боль не исчезает и не ослабевает после устранения провоцирующего фактора (чаще всего им выступает физическая нагрузка) или возникла в состоянии покоя, больному нужно принять нитроглицерин в виде таблеток под язык или спрея. Если через 5 минут после этого приступ не прекратился, но переносимость нитроглицерина хорошая, рекомендовано принять повторную дозу. Если и после этого через 5 минут боль и дискомфорт не исчезли, необходимо срочно вызвать бригаду скорой помощи и еще раз принять дозу нитроглицерина.
Однако нужно иметь ввиду, что в редких случаях больному для купирования приступа необходим прием нескольких доз нитроглицерина, но при условии,что интенсивность и характер боли остаются неизменными.
Для снятия болевых ощущения при ИМ предпочтительнее использовать препараты на основе морфина. Они способствуют снятию страха и нервного возбуждения, снижают симпатическую активность, повышают тонус блуждающего нерва, расширяют периферические вены и артерии, уменьшают работу дыхания.
Доза наркотического анальгетика рассчитывается индивидуально и зависит от особенностей организма пациента, его возраста и веса.
Принимать препараты для профилактики осложнений наркотических анальгетиков нецелесообразно. При сильном беспокойстве и нервном перевозбуждении оправдано дополнительное использование транквилизаторов.
✔ Медикаментозное лечение инфаркта миокарда с повышением сегмента ST, таблица в Системе Консилиум
 Скачать документ
Скачать документ
Клинические рекомендации по лечению инфаркта миокарда гласят, что в терапии данного заболевания очень важна своевременная антитромботическая терапия, а именно – неопределенно долгое использование ацетилсалициловой кислоты (если нет противопоказаний).
Для получения быстрого эффекта оправдано использование однократной нагрузочной дозы ацетилсалициловой кислоты 250 мг (150 мг внутривенно), а также сочетание ацетилсалициловой кислоты с ингибитором Р2Y12-рецепторов тромбоцитов (если не планируется срочная операция коронарного шунтирования и при отсутствии противопоказаний (чрезмерный риск серьезных кровотечений).
Также при отсутствии противопоказаний и при планировании первичного чрескожного коронарного вмешательства к ацетилсалициловой кислоте добавляется Тикагрелор.
Перейти на прием этого препарата можно и пациента, ранее получавшим Клопидогрел. Применение Тикагрелоране исключает возможность использования блокаторов гликопротеиновых IIb/IIIa рецепторов при выполнении чрескожного коронарного вмешательства.
При одновременном приеме ацетилсалициловой кислоты и Тикагрелора перед коронарным шунтированием и другими крупными вмешательствами последний отменяется за 5-7 дней, кроме тех случаев, когда опасность отказа от срочной операции превосходит риск кровотечения.
Клопидогрел в комплексе с ацетилсалициловой кислотой назначается больным, которые не могут принимать Тикагрелор или нуждаются в приеме пероральных антикоагулянтов.
Данный препарат может использоваться вместо ацетилсалициловой кислоты, когда ее использование не представляется возможным из-за аллергии или выраженного расстройства функции ЖКТ в ответ на прием препарата.

Клинические рекомендации по инфаркту миокарта требуют продолжать двойную антитромбоцитарную терапию в течение года независимо от тактики лечения и типа установленного стента (при отсутствии противопоказаний).
В частности, эта мера показана конкретным больным, имеющим высокий риск тромботических осложнений и низкий риск кровотечений.
Минимальная длительность двойной антитромботической терапии:
- после установки голометаллического стента – 1 месяц;
- после установки стента, выделяющего лекарственный препарат – 3-6 месяцев.
Больным, находящимся на двойной антитромботической терапии и имеющим высокий риск развития кровотечения их ЖКТ, показаны ингибиторы протонного насоса.
При чрескожном коронарном вмешательстве и широком применении ДАТТ в случае возникновения тромботических осложнений или высокого риска их развития назначаются ингибиторы ГП IIb/IIIa-рецепторов тромбоцитов.
В случаях, когда чрескожное коронарное вмешательство может быть проведено в течение 2 часов с момента обращения за медицинской помощью, оно предпочтительнее тромболитической терапии. При этом должно использоваться сочетание ацетилсалициловой кислоты, блокатора P2Y12 рецепторов тромбоцитов (Тикагрелор или Клопидогрел) и внутривенного введения антикоагулянта. В ряде случаев показано введение блокатора ГП IIb/IIIa тромбоцитов.
Больным с тяжелой острой сердечной недостаточностью и кардиогенным шоком ЧКВ предпочтительнее тромболитической терапии.
При первичном чрескожном вмешательстве достаточно провести операцию на инфаркт-связанном сосуде. Это не касается больных с кардиогенным шоком и сохранением ишемии после вмешательства на стенозе, который спровоцировал инфаркт.
Некоторым гемодинамически стабильным больным с многососудистым поражением либо во время первичного ЧКВ, либо в качестве планового поэтапного вмешательства показано ЧКВ в не инфаркт-связанной артерии.
Клинические рекомендации по инфаркту миокарда утверждают, что рутинная аспирация тромба нежелательна.
Тромболизис при отсутствии противопоказаний должен начинаться в течение получаса с момента контакта больного с медицинским работником. Противопоказания для этой процедуры:
- ранее перенесенное ОНМК неясного происхождения или геморрагический инсульт;
- ишемический инсульт в течение полугода;
- травмы и опухоли центральной нервной системы;
- ЧМТ или операция в течение 21 дня до госпитализации;
- кровотечения из ЖКТ в течение последнего месяца;
- геморрагический диатез;
- расслаивающая аневризма аорты;
- пункция некомпрессируемых сосудов (биопсия печени, спинного мозга и др.) в течение предыдущих суток.
Относительные противопоказания к тромболизису:
- ТИА в предыдущие полгода;
- артериальная гипертензия, плохо поддающаяся контролю;
- тяжелые патологии печени;
- инфекционный эндокардит;
- перенесенная длительная СЛР;
- беременность и первая неделя послеродового периода;
- введение стрептокиназы более 5 дней назад или аллергия на нее;
- язвенная болезнь в остром периоде;
- прием антикоагулянтов непрямого действия.
Клинические рекомендации по осложнениям инфаркта миокарда гласят, что при тромболитической терапии фибринолитик должен использоваться в сочетании с ацетилсалициловой кислотой, Клопидогрелом и внутривенным антикоагулянтом.
✔ Немедикаментозные методы профилактики, лечения и медицинской реабилитации инфаркта в Системе Консилиум
 Скачать документ
Скачать документ
Реабилитация
Больные с ИМ включаются в программы вторичной профилактики и реабилитации. Адекватно составленная программа повышает приверженность больного к медикаментозному лечению и пересмотру образа жизни, включающему правильное питание, отказ от пагубных привычек и регулярную физическую активность.
Программа реабилитации по возможности должна включать в себя кардионагрузки 3 раза в неделю по полчаса. Пациентов, ведущих малоподвижный образ жизни, нужно активно стимулировать к выполнению реабилитационных программ с нагрузками малой интенсивности.
Профилактика ИМ включает в себя:
- коррекцию факторов риска;
- изменение поведения в сторону ЗОЖ;
- отказ от табакокурения и спиртного;
- постоянный (чаще всего пожизненный) прием нескольких групп медикаментов.
Смотреть список литературы
Материал проверен экспертами Актион Медицина
Источник
