Реабилитация после инсульта протокол
Драматическая статистика инсульта – пугающая распространенность (более полумиллиона человек ежегодно в России испытывают острое нарушение мозгового кровообращения), его высокая летальность (123 на 100 000 населения), значительная инвалидизация (56–81%) и социальная дезадаптация1 пациентов определили особое положение в современном здравоохранении и повышенное внимание со стороны медицинской общественности к его проблемам. И прежде всего к реабилитации пациентов, перенесших его, – справедливо считаемой чрезвычайно важной, сложной и дискуссионной.
Постинсультная реабилитация – совокупность мер и методов, нацеленных на продолжение лечения, начатого в остром периоде, и способствующих устранению или компенсированию повреждений после инсульта.
В последние годы появилось достаточно данных, подтвержденных серьезными исследованиями, ставших причиной отхода специалистов от разработанной ранее GRADE-концепции (модели преемственной помощи) и других рекомендуемых принципов2 в пользу новых, делающих ставку на грамотную организацию инсультного отделения, которая позволяет снижать смертность и инвалидизацию именно за счет того, что в таком отделении проводятся не только диагностика и терапия, но и всесторонние реабилитационные мероприятия.
Акцентируют внимание врачей на острую необходимость постинсультной реабилитации и последние международные рекомендательные документы – Rehabilitation 2030 (ВОЗ), Report on Stroke in Europe (Европейского альянса по инсульту). Еще один документ ВОЗ (Global Stroke Bill of Rights) представляет реабилитацию и социальную реинтеграцию как основное право пациента после инсульта.3
Новые отношения к ведению пациентов, перенесших острое нарушение мозгового кровообращения, отражают последние (2018 г.) Рекомендации Американской ассоциации сердца/Американской ассоциации инсульта (American Heart Association/American Stroke Association) по раннему уходу за пациентами с острым ишемическим инсультом.4
Интересным и значимым событием стал и выход в 2018 году Австрийского руководства (Клинические рекомендации по реабилитации после инсульта).5 Согласно этому документу, цель реабилитации – «начать общие и специфические методы лечения как можно раньше, сразу после терапии в реанимации, чтобы помочь пациенту быстрее вернуться к прежней жизни или заново адаптироваться к окружающему пространству, социальной среде».
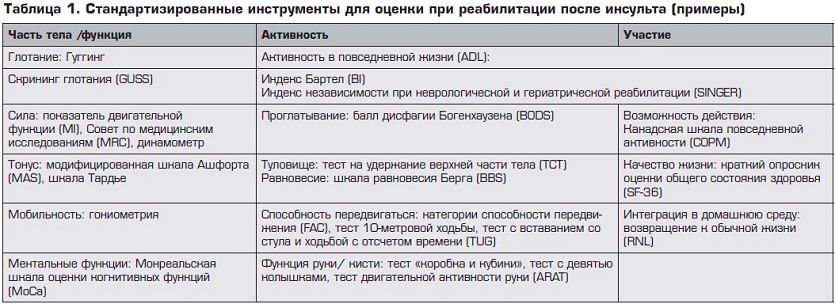
Сегодня становится все более очевидным, что реабилитация должна начинаться в первые 24–48 часов от развития инсульта, проводиться в отделении неотложной терапии и основываться на индивидуальном подходе, комплексной оценке, обоснованности выбора диагностических, лечебных методов. Основная регламентация реабилитационных мероприятий сегодня связана с Международной классификацией функционирования, жизнедеятельности и здоровья (МФК). Реабилитационные активности различаются по уровню (структурный, функциональный), по целям, видам и степени активности пациента. Мероприятия должны быть релевантными состоянию больного (уровень доказательности A), легко измеряться и подстраиваться под пациента, иметь достаточный мотивационный компонент.

И конечно же она требует наличия мультидисциплинарной команды, в которую, помимо невролога и физиотерапевта, должны войти логопед, психолог, эрготерапевт, социальный работник, другие специалисты.
Важный аспект реабилитации – физическая активность. В постинсультном периоде она снижает инвалидизацию, повышает кардиореспираторную толерантность к ходьбе, улучшает когнитивные функции и настроение, повышает работоспособность, а также влияет на другие аспекты, связанные с инсультом (уровень В). Комплексы физических упражнений должны разрабатываться для всех перенесших инсульт пациентов (кто способен их выполнять) вместе с программами по кардиореабилитации. Пациентам также должны предлагаться способы логопедической коррекции и когнитивные тренинги.
Хорошие результаты дают различные виды реабилитации в поликлинике, дневном стационаре или на дому в течение первого года после выписки больного из клиники. Далеко не последнее место занимает здесь и активное вовлечение в реабилитационный процесс родственников, близких для больного людей.
Эти основополагающие принципы позволяют снижать степень инвалидизации, повышать качество жизни пациентов и помогают более быстрой адаптации – и личной, и бытовой, и социальной, и профессиональной.6
Важную роль в этом подходе играет также медикаментозная нейрореабилитация, выстроенная на принципах доказательной медицины. Последние годы дали достаточно доказательств того, что защита нейрососудистой структуры от ишемического повреждения имеет первостепенное значение. Появилась и возможность применения современных репаративных лекарственных средств (терапия стволовыми клетками, моноклональными антителами). К этой группе относятся и экстракты из биологических тканей животных, другие ускорители восстановления.7 Новые возможности сегодня позволяют изучать патофизиологические процессы на молекулярном уровне, а это означает, что необходимо переоценить те исследования эффективности существующих нейропротекторов, которые были проведены с менее высокой степенью точности.7
Серьезного внимания требует и поздняя реабилитация после инсульта (после года). Стойкое нарушение жизнедеятельности организма ведет к дальнейшему ухудшению и сопутствующим дисфункциям. Спастичность, болевой синдром, парестезии, изменения температурной чувствительности часто развиваются только на этапе хронизации. Целевые физические тренировки для верхних конечностей пациентов, для развития равновесия и ходьбы оказывали положительный эффект даже спустя год (и более) после инсульта.8 Важно отметить и значение профессиональной реабилитации, которая для работающих пациентов – необходимый фактор для возвращения к полноценной жизни.
Перед началом реабилитации в течение первых 48 часов должна проводиться терапевтическая оценка. Оцениваются конкретные функциональные ограничения каждого пациента по отдельным системам организма и их функциональному состоянию, по уровню активности больного, его взаимодействию с социальной средой.9 После этого определяется набор соответствующих инструментов для достижения поставленных целей реабилитации (уровень B).
Медикаментозная терапия и нейровосстановление
С точки зрения экспертов, готовящих Австрийское руководство по реабилитации после инсульта,5 как и многих их зарубежных коллег, сегодня необходимо серьезное внимание обращать на такие понятия, как нейрорепарация, нейропластичность и нейровосстановление. Сам механизм развития заболевания ставит перед врачами важнейшую задачу – максимально раннее предотвращение смерти нейронов (нейропротекция) и затем реорганизацию нейрональных сетей, таким образом, обеспечивая преемственность между нейропротекцией и нейровосстановлением.
Медикаментозная терапия объективно способна ускорять нейровосстановление (нейропротективную терапию, цитопротекцию, метаболическую защиту мозга). Этот процесс сложен и разнообразен, отражает многогранность механизмов ишемического повреждения ткани мозга.10 Основные ее направления – антиоксидантная терапия, торможение местной воспалительной реакции (антагонисты провоспалительных цитокинов и молекул клеточной адгезии), улучшение трофического обеспечения мозга (нейротрофины), нейроиммуномодуляция (нейропептиды), регуляция рецепторных структур (ганглиозиды).11 Сегодня есть данные о положительном влиянии леводопы,12 специфических пептидных комплексов (Церебролизина).13–15
Действие последнего препарата стоит рассмотреть подробнее. В прошлом году он был включен в стандарты реабилитационных мероприятий после инсульта в Австрии.5
Институт инсульта Австрии признал возможности нейротрофической поддержки в реабилитации пациентов после инсульта. Клинические рекомендации по реабилитации содержат единственный нейротрофический препарат – Церебролизин (ЭВЕР Фарма Йена ГмбХ) (с уровнем доказательности II,B)5.
Особенность препарата, по мнению специалистов, заключается в том, что механизм его действия не ограничивается только нейропротекцией, его основное действие – модуляция эндогенного восстановления головного мозга после повреждения.
Как известно, естественная защитная реакция мозга в первые минуты ишемии – синтез нейротрофических факторов (и рецепторов к ним). Именно их высокий уровень обеспечивает регресс неврологического дефицита даже при сохранении вызвавшего его морфологического дефекта. Нейротрофическими и ростовыми свойствами обладают эндогенные низкомолекулярные нейрополипептиды, избирательно действующие на центральные холинергические нейроны, демонстрирующие нейропротективные, репаративные и пролиферативные эффекты. Они свободно преодолевают ГЭБ, их физиологическая активность во много раз выше, чем непептидных соединений. При этом они (в зависимости от места высвобождения) могут осуществлять разнообразные функции: медиаторную, модулятора реактивности определенных групп нейронов, регулятора тканевого метаболизма и многие другие.16
Нейротрофической активностью в полной мере обладает комплекс специфических пептидов – Церебролизин®. В его составе уникальное сочетание 24 нейропептидов и 17 L-аминокислот. Исследователи установили специфические трофическую и модуляторную функции каждого из этих компонентов,17 объясняющие способность препарата повышать выживаемость клеток мозга в условиях прекращения их нейротрофической поддержки со стороны клеток-мишеней, недостаточности кислорода и глюкозы (на уровне клеток – предотвращение повреждения дендритов).16,18
За более чем 60-летнюю историю (зарегистрирован в 1954 г. в Австрии) препарат участвовал в огромном числе клинических исследований, став единственным ноотропным пептидергическим препаратом с доказанной нейротрофической активностью, аналогичной таковой у естественных факторов роста нервов, но проявляющейся в условиях периферического введения.20 Большие и ограниченные, международные и отечественные исследования многократно доказывали его безопасность и эффективность при ишемическом инсульте как в острую стадию, так и в период реабилитации (а также при хронической нейродегенеративной и церебральной патологии).13-15, 17-26
И исследования продолжаются, в прошлом году профессором Натаном Борнштейном и его коллегами26 были опубликованы результаты большого метаанализа. Под их пристальное внимание попало 9 клинических исследований (по дизайну все: проспективные, рандомизированные, двойные слепые, плацебоконтролируемые) с оценкой эффективности этого ноотропного препарата в отношении улучшения общего неврологического состояния пациентов на ранних этапах после перенесенного инсульта (препарат в дозе 30–50 мл/1 раз в сутки в течение 10–21 дня).
В резюме проведенного метаанализа отмечены:
- Величина эффекта (непараметрический критерий MW) при проведении оценки с помощью шкалы тяжести инсульта NIHSS на 30 день (или 21) при обобщении результатов 9 РКИ указывала на большую эффективность данного препарата по сравнению с плацебо (MW 0,60; P
- Наиболее выраженные эффекты были отмечены в исследованиях с исходной высокой степенью тяжести инсульта – по шкале NIHSS: MW = 0,64; P = 0,0001.
- Совокупное NNT для клинически значимых изменений при проведении ранней оценки по шкале NIHSS составляло 7,7 (95% ДИ: 5,2–15,0).
- В предварительно запланированном развернутом ранговом анализе оценки по шкале mRS на 90-й день у пациентов с заболеванием умеренной и тяжелой степени был получен MW 0,61, свидетельствующий о статистически значимой большей эффективности препарата (95% ДИ 0,52-0,69; P = 0,0118; N = 314; процедура обобщения Вэй-Лачин [MERT]).
- Во всех анализах чувствительности подтверждены результаты анализа первой линии.
- В плане безопасности данный препарат был сопоставим с плацебо при наличии тенденции к уменьшению смертности (ОР 0,83). В целом препарат демонстрирует благоприятное соотношение «польза-риск».
Таким образом, предлагаемые в настоящее время основополагающие принципы и ранней, и отсроченной во времени реабилитации позволяют заметно снижать степень инвалидизации, повышать качество последующей жизни пациентов, способствовать более быстрому возвращению пациента к личной, бытовой, социальной и профессиональной активности. Важную роль в развитии этого подхода играет и современная медикаментозная нейрореабилитация, выстроенная на принципах доказательной медицины. При этом, как подчеркивают эксперты, успешность всех реабилитационных методик обеспечивается комплексным подходом, с учетом индивидуальных физических, эмоциональных, двигательных и когнитивных возможностей постинсультного пациента.
Ключевые слова: инсульт, реабилитация после инсульта, австрийские рекомендации по реабилитации больных после инсульта, нейропептиды, нейропротекция.
Литература
1 Пирадов М.А., Максимова М.Ю., Танашян М.М. Инсульт. Пошаговая инструкция. М. Гэлтар-Медиа, 2019, 272 с.
2 Wein T., Lindsay M.P., Cote R. et al. Canadian stroke best practice recommendations: Secondary prevention of stroke, sixth edition practice guidelines, update 2017. Int J Stroke. 2018, 13 (4), p. 420–443.
3 World Stroke Campaign. https://www.worldstrokecampaign.org/images/global_stroke_bill_of_rights/English_GlobalBO-Rights_web.pdf (zuletzt abgerufen 16.3.2018) 2018.
4 Powers W.J. et al. 2018 Guidelines for the Early Management of Patients With Acute Ischemic Stroke: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2018, Mar., 49 (3), e46-e110. doi: 10.1161/STR.0000000000000158.
5 https://neurologic.ru/nejroreabilitacija-posle-insulta/
6 United Nations Organisation. https://www.un.org/development/desa/disabilities/convention-on-the-rights-of-persons-with-disabilities/article-26-habilitation-and- rehabilitation.html. 2018.
7 Neuhaus A.A., Couch Y., Hadley G., Buchan A.M. Neuroprotection in stroke: the importance of collaboration and reproducibility. Brain 2017, 140 (8), p. 2079–2092.
8 Pollock A., Baer G., Campbell P. et al. Physical rehabilitation approaches for the recovery of function and mobility following stroke. Cochrane Database Syst Rev. 2014, (4):CD001920.
9 World Health Organisation. https://www.who.int/classifications/icf/en/ (zuletzt abgerufen 16.3.2018) 2018.
10 Одинак М.М., Вознюк И.А., Янишевский С.Н. Ишемия мозга. Нейропротективная терапия. Дифференцированный подход. СПб. ВМедА, 2002, 77 с.
11 Завалишин И.А., Захарова М.Н. Оксидантный стресс – общий механизм повреждения при заболеваниях нервной системы. Журнал неврологии и психиатрии. Т. 96, № 2, 1996, с. 111–114.
12 Scheidtmann K., Fries W., Muller F., Koenig E. Effect of levodopa in combination with physiotherapy on functional motor recovery after stroke: a prospective, randomised, double-blind study. Lancet. 2001, 358 (9284), p. 787–90.
13 Bornstein N.M., Guekht A., Vester J. et al. Safety and efficacy of Cerebrolysin in early post-stroke recovery: a meta-analysis of nine randomized clinical trials. Neurol Sci. 2018, 39(4), p. 629–640.
14 Muresanu D.F., Heiss W.D., Hoemberg V. et al. Cerebrolysin and recovery after stroke (CARS): a randomized, placebo-controlled, double-blind, multicenter trial. Stroke. 2016, 47, p. 151–159.
15 Guekht A., Vester J., Heiss W.D. et al. Safety and efficacy of Cerebrolysin in motor function recovery after stroke: a meta-analysis of the CARS trials. Neurol Sci. 2017, 38, p. 1761–1769.
16 Windisch M., Gschanes A., Hutter–Paier B. Neurotrophic activities and therapeutic experience with brain derived peptide preparation. J. Neural. Transm. 1998, vol. 53, p. 289–298.
17 Windisch M., Albrecht E., Eggenreich U., Paier B. Neurotrophic effects of the nootropic drug cerebrolysin – a summary. 3rd Int. Conf. on Alzheimer’s disease and related disorders. Padova. 1992, p. 4–5.
18 Watanabe Y., Gould E., McEwen B.S. Stress-induced atrophy of apical dendrites of hippocampal CA3 pyramidal neurons. Brain Res. 1992, vol. 588, p. 341–345.
19 Востриков В.В., Шишляников Г.З., Зеленцов К.Е., Востриков М.В., Шабанов П.Д. Церебролизин в практической медицине. Обзоры по клинической фармакологии и лекарственной терапии. Т. 7, № 4, 2009, с. 21–75.
20 Читаева Г.Е., Никифорова А.Н., Сапон Н.А. Общепринятые и новые аспекты применения препарата церебролизин. Український нейрохірургічний журнал. 2005, №3, с. 123–131.
21 Ladurner G., Kalvach P., Gmeinbauer R. et al. The MCA stroke trial: A multicentre, randomized, double-blind, placebo-controlled trial of cerebrolysin in patients with ischaemic stroke. Neuroprotection in ischaemic stroke. 26-th Intern. stroke conf. of Amer. Heart As soc. 2001.
22 Коппи С., Баролин Г. Применение церебролизина в терапии ишемического инсульта. Журнал неврологии и психиатрии. Т. 98, № 10, 1998, с. 30–33.
23 Скворцова В.И. Ишемический инсульт: патогенез ишемии, терапевтические подходы. Неврологический журнал. Т. 6, № 3, 2001, с. 4–9.
24 Скворцова В.И. Нейропротективная терапия ишемического инсульта. Врач. № 6, 2004, с. 26–32.
25 Гусев Е.И., Гехт А.Б., Гаптов В.Б., Тихопой Е.В. Реабилитация в неврологии. М. 2000, 52 с.
26 Bornstein Natan M., Guekht Alla, Vester Johannes, Heiss Wolf-Dieter, Gusev Eugene et al. Safety and efficacy of Cerebrolysin in early post-stroke recovery: a meta-analysis of nine randomized clinical trials. Neurological Sciences. April 2018, vol. 39, iss.4, p. 629–640.
Источник
КЛИНИЧЕСКИЙ ПРОТОКОЛ ИШЕМИЧЕСКИЙ ИНСУЛЬТ МЗ РК №23 от «12» декабря 2013 года.
Название протокола: Ишемический инсульт.
Определение: Ишемический инсульт (ИИ) – это инфаркт мозга, который происходит вследствие прекращения поступления крови в мозг. ИИ развивается при закрытии просвета сосуда питающего мозг, что приводит к прекращению подачи крови в мозг, а с ней и кислорода и питательных веществ, необходимых для нормальной жизнедеятельности мозга.
Клиническая классификация
Подтипы ишемических нарушений мозгового кровообращения, НИИ РАМН, 2000: (Патогенетические варианты TOAST)
Атеротромботический инсульт;
Кардиоэмболичесrий инсульт;
Гемодинамический инсульт;
Лакунарный инсульт;
Инсульт по типу гемореологической микрооклюзии;
Неизвестной этиологии.
По локализации инфаркта мозга
В соответствии с топической характеристикой очаговой неврологической симптоматики, по пораженному артериальному бассейну:
внутренняя сонная артерия;
позвоночные артерии и их ветви,
основная артерия и ветви;
средняя мозговая артерия;
передняя мозговая артерия;
задняя мозговая артерия.
По тяжести состояния больных
лѐгкой степени тяжести — неврологическая симптоматика выражена незначительно, регрессирует в течение 3-х недель заболевания. Вариант малого инсульта;
средней степени тяжести — преобладание очаговой неврологической симптоматики над общемозговой, отсутствуют расстройства сознания;
тяжѐлый инсульт — протекает с выраженными общемозговыми нарушениями, угнетением сознания, грубым очаговым неврологическим дефицитом, часто дислокационными симптомами.
Показания для госпитализации
При подозрении на инсульт показана экстренная госпитализация пациента в кратчайшие сроки в стационар, имеющий специализированное отделение для лечения инсульта (инсультный центр), блок нейрореанимации и нейрохирургическое отделение, клиническую лабораторию, диагностическое оборудование, включающее круглосуточное, доступное каждому, без исключений, пациенту КТ/МРТ – 24 часа в сутки, с учетом выходных и праздничных дней, а также ультразвуковые приборы для оценки состояния экстра и интракраниальных артерий. Время госпитализации должно быть минимальным от начала развития очаговой неврологической симптоматики, желательно в первые 3 часа после начала заболевания (терапевтическое окно). Своевременная госпитализация пациентов с инсультом является одним из ключевых факторов, обусловливающих эффективность лечения. Ограничений к ней по медицинским показаниям не существует. В качестве относительных медико-социальных ограничений к госпитализации больных традиционно рассматривают глубокую кому, терминальные стадии онкологических и других хронических заболеваний. Абсолютным противопоказанием для госпитализации больного с ОНМК является только агональное состояние.
Диагностические критерии:
Клиническая картина ишемического инсульта у больных людей складывается из общемозговой и очаговой неврологической симптоматики.
Для ишемического инсульта характерны:
предшествующие ТИА или транзиторная монокулярная слепота. -выявленные ранее стенокардия или симптомы ишемии нижних конечностей -патология сердца (нарушения ритма сердца, чаще в виде мерцательной аритмии, наличие искусственных клапанов, ревматизм, инфекционный эндокардит, острый инфаркт миокарда, пролапс митрального клапана и др.);
развитие во время сна, после приема горячей ванны, физического утомления, а также во время или после приступа мерцательной аритмии, на фоне ОИМ, коллапса, кровопотери;
постепенное развитие неврологической симптоматики, в ряде случаев ее мерцание;
возраст старше 50 лет;
превалирование очаговой неврологической симптоматики над общемозговой.
Прогрессирующее течение инсульта (постепенное или ступенеобразное нарастание неврологических нарушений в течение нескольких часов или дней) наблюдается у 20 % больных людей с ишемическим инсультом в каротидном бассейне и у 40 % больных с ишемическим инсультом в вертебробазилярном бассейне. Оно чаще вызвано увеличением размера внутриартериального тромба, повторными эмболиями, нарастанием отѐка мозга, геморрагической трансформацией инфаркта или увеличением его размеров вследствие снижения системного артериального давления. Повышение артериального давления наблюдается у 70—80 % больных людей в первые дни инсульта. В дальнейшем у большинства из них отмечается спонтанное снижение давления. Транзиторное повышение артериального давления может быть вызвано отѐком головного мозга и повышением внутричерепного давления, а также стрессом, обусловленным развитием заболевания. Общемозговые симптомы Общемозговые симптомы характерны для инсультов средней и тяжѐлой степени. Характерны нарушения сознания — оглушѐнность, сонливость или возбуждение, возможна кратковременная потеря сознания. Типична головная боль, которая может сопровождаться тошнотой или рвотой, головокружение, боль в глазных яблоках, усиливающаяся при движении глаз. Реже наблюдаются судорожные явления. Возможны вегетативные расстройства: чувство жара, повышенная потливость, ощущение сердцебиения, сухость во рту. Очаговая неврологическая симптоматика На фоне общемозговых симптомов инсульта появляются очаговые симптомы поражения головного мозга. Клиническая картина у каждого конкретного больного человека определяется тем, какой участок мозга пострадал из-за повреждения кровоснабжающего его сосуда.
Инструментальные методы диагностики ишемического инсульта:
Ультразвуковые методы;
КТ (+ КТ-ангиография + КТ-перфузия);
МРТ (ДВИ, Т2 , FLAIR, МРТ-перфузия, МРА).
При остром периоде ишемического инсульта объем обследования определяется неврологом/нейрохирургом, а также смежными специалистами, к которым направлен пациент на дообследование.
Показания для консультации специалистов
При обширном инфаркте мозжечка, возникновении острой окклюзионной гидроцефалии, при наличии признаков нарастающего отека головного мозга и дислокации срединных структур консультация нейрохирурга;
Консультация кардиолога с целью подбора или коррекции базисной гипотензивной терапии, коррекции нарушений сердечного ритма, при подозрении на острый коронарный синдром и ТЭЛА, а также для разработки программы вторичной индивидуальной профилактики;
Консультация сосудистого хирурга при выявленных стенозирующих поражениях магистральных сосудов шеи с целью определения показаний для реконструктивных операций;
Консультация эндокринолога с целью коррекции гипергликемии и для разработки программы вторичной индивидуальной профилактики у больных сахарным диабетом;
Консультация гематолога при наличии коагулопатий;
Консультация терапевта, пульмонолога при развитии осложнений- внутрибольничной пневмонии;
Консультация уролога при развитии осложнений- задержка, недержание мочи, инфекции мочевыводящих путей;
Консультация хирурга при развитии пролежней, подлежащих хирургическому лечению; Консультация гастроэнтеролога при развитии осложнений: острых стресс- язв желудка и двенадцатиперстной кишки.
Длительность реабилитации определяется сроками восстановления нарушенных функций: максимальное улучшение двигательных функций отмечается в первые 6 месяцев, бытовых навыков и трудоспособности – в течение 1 года, речевых функций – на протяжении 2-3 лет с момента развития ОНМК. Систематичность предполагает ежедневные занятия не менее 1 часа в день, частотой не реже 5 раз в неделю. Все принципы реабилитации могут быть осуществлены только с помощью хорошо организованной этапной системы реабилитации. Наиболее идеальна следующая модель этапной реабилитации после инсульта: 1 этап (4-72 часа)- реабилитация начинается в условиях БИТ в инсультном центре (или обычном неврологическом) отделении клинической больницы, куда доставляется больной бригадой скорой помощи; 2 этап (16-18 дней)–отделение ранней нейрореабилитации инсультного центра; 3 этап (18-20 дней)-отделения любой медицинской организации данной области или города, районного центра, санатория, профилактория для продолженной реабилитации; 4 этап – амбулаторная реабилитация, реабилитация в специальных реабилитационных санаториях, реабилитация на дому.
Первичная профилактика ишемического инсульта
Профилактика инсульта направлена на устранение факторов риска.
Факторы риска-различные клинические, биохимические, поведенческие и другие характеристики, свойственные отдельному человеку (отдельным популяциям), а также внешние воздействия, наличие которых указывает на повышенную вероятность развития определенного заболевания.
Факторы риска:
Корригируемые:
артериальная гипертония;
курение, патология сердца;
патология магистральных артерий головы;
нарушения липидного обмена;
сахарный диабет;
гемостатические нарушения;
злоупотребление алкоголем и наркотиками;
прием оральных контрацептивов;
мигрень.
К группе высокого риска развития инсульта относятся больные любого возраста, перенесшие инсульт или ТИА, больные страдающие ревматическим поражением сердечно-сосудистой системы, ИБС, застойной сердечной недостаточностью, больные со сниженной сократительной функцией левого желудочка по данным УЗИ сердца, а также больные в возрасте 75 лет и старше, страдающие артериальной гипертензией или сахарным диабетом. К группе с умеренным риском развития инсульта относятся больные старше 65 лет, не относящиеся к группе высокого риска развития инсульта, а также больные моложе 65 лет с клинически значимыми факторами риска, включая сахарный диабет, артериальную гипертонию, заболевания периферических артерий, ИБС .
Вторичная профилактика инсульта
Мероприятия по вторичной профилактике инсульта начинают сразу же после стабилизации состояния больного в условиях отделения ранней нейрореабилитации по результатам проведенных обследований и консультаций.
Источник
