Протеомный анализ при инсульте
Инсульт – острое нарушение кровоснабжения головного мозга, которое возникает в результате разрыва или закупорки сосуда головного мозга. При этом поступление крови к определенной части мозга значительно снижается либо прекращается.
Кровь приносит к нервным клеткам головного мозга кислород и питательные вещества, которые необходимы для нормальной жизнедеятельности. При инсульте поступление в клетки мозга кислорода и питательных веществ прекращается, что в течение нескольких минут приводит к их гибели.
Инсульт характеризуется потерей сознания, нарушениями движений, речи, потерей чувствительности в определенной части тела. Раннее начало лечения позволяет снизить повреждение головного мозга и улучшить прогноз заболевания. Большое значение в профилактике инсульта имеет контроль артериального давления, уровня холестерина, отказ от курения и злоупотребления алкоголем.
Синонимы русские
Острое нарушение мозгового кровообращения, апоплексический удар.
Синонимы английские
Сerebrovascular accident, stroke.
Симптомы
- Интенсивная головная боль, которая может сопровождаться тошнотой, рвотой.
- Потеря сознания.
- Внезапное чувство онемения кожи на лице, туловище, в руке или ноге на одной стороне.
- Внезапная слабость в мышцах руки, ноги, туловища преимущественно на одной стороне.
- Нарушение речи. Могут возникать трудности при произношении слов или звуков, в понимании речи.
- Нарушения зрения: двоение в глазах, снижение остроты зрения.
- Судороги – в редких случаях.
Общая информация о заболевании
Существует два основных вида инсульта: ишемический и геморрагический. Наиболее часто встречается ишемический – около 80 % случаев. Он возникает в результате закупорки артерии (например, тромбом) и прекращения или резкого снижения кровотока по этой артерии. При отсутствии кровоснабжения в той области мозга, которая получает кровь из данной артерии, гибнут нервные клетки.
Второй вид инсульта – геморрагический. Он развивается при разрыве сосуда головного мозга, в результате чего происходит кровоизлияние в головной мозг.
В зависимости от причины возникновения ишемический инсульт классифицируют на следующие типы.
- Тромботический инсульт – когда закупорка артерии происходит из-за формирования тромба (кровяного сгустка) в одной из артерий, снабжающих кровью головной мозг. Тромб образуется на стенках артерий, на которых есть атеросклеротические бляшки (отложения холестерина и других жиров). Бляшка сужает просвет сосуда, и вокруг нее формируется тромб. Сужение просвета сосуда приводит к уменьшению или прекращению кровоснабжения участка головного мозга, что и вызывает инсульт.
- Эмболический инсульт – развивается при формировании эмболов (кровяных сгустков, частиц жира, воздуха) на отдалении от головного мозга, которые с током крови попадают в более узкие сосуды головного мозга, вызывая их полную или частичную закупорку. Эмболы часто образуются при нарушениях сердечного ритма, пороках сердца и других заболеваниях.
Геморрагический инсульт возникает по многим причинам, в основном из-за высокого артериального давления и слабых мест в сосудах головного мозга (аневризм и мальформации).
- Разрыв аневризмы. Аневризма сосуда головного мозга – расширение сосуда с истончением его стенок. При повышении артериального давления сосуд в этом месте повреждается и происходит кровоизлияние в головной мозг.
- Разрыв артериовенозной мальформации. Артериовенозная мальформация – клубок истонченных сосудов, которые в норме отсутствуют. Эта патология повышает риск кровоизлияния в головной мозг.
В зависимости от местонахождения сосуда, кровоизлияние может произойти в вещество головного мозга или между головным мозгом и его оболочками. Если разорвавшийся сосуд расположен в веществе головного мозга, происходит внутримозговое кровоизлияние, если ближе к поверхности мозга – субарахноидальное кровоизлияние (между головным мозгом и его оболочками). В обоих случаях возникает сильно выраженное повреждение и нарушение деятельности головного мозга, что обуславливает тяжелое состояние пациентов.
Иногда появляются симптомы инсульта. Отличие состоит в том, что они достаточно быстро проходят (иногда в течение нескольких минут). Это может происходить в результате временного снижения кровотока в сосуде головного мозга, и называется данное состояние транзиторной ишемической атакой. Механизм развития такой же, как при ишемическом инсульте, но при транзиторной ишемической атаке не происходит значительного повреждения головного мозга, так как нарушения кровообращения временные. Несмотря на полное исчезновение симптомов, транзиторная ишемическая атака требует обследования и лечения, так как она может быть предвестником инсульта.
Пациенты, перенесшие инсульт, могут иметь серьезные нарушения, которые требуют длительной реабилитации. К ним относятся:
- снижение силы или полное отсутствие движений (паралич) в мышцах на одной стороне тела;
- нарушение памяти;
- нарушения речи;
- нарушение жевания, глотания пищи;
- изменение поведения.
Данные расстройства возникают при поражении определенных областей мозга при инсульте, которые отвечают за эти функции. Выраженность данных нарушений и возможность восстановления утраченных функций зависят от степени повреждения головного мозга.
Кто в группе риска?
- Лица старше 55 лет.
- Те, чьи родственники перенесли инсульт.
- Люди с повышенным артериальным давлением.
- Люди с высоким уровнем холестерина.
- Больные диабетом.
- Злоупотребляющие алкоголем, курящие.
- Страдающие ожирением.
- Ведущие малоподвижный образ жизни.
- Принимающие противозачаточные или гормональные препараты, содержащие эстрогены.
Диагностика
Диагностика инсульта заключается в исследованиях головного мозга (компьютерной томографии, ультразвуковой доплерографии и др.), направленных на установление вида инсульта, объема, области поражения головного мозга. Тяжелое состояние больных при инсульте требует тщательного контроля за многими лабораторными показателями крови, мочи.
Чтобы оценить риск возникновения инсульта, применяют следующие анализы.
- Общий анализ крови. Позволяет определить количество эритроцитов, тромбоцитов, лейкоцитов, содержание гемоглобина в эритроцитах. Оценка данных показателей важна для выявления возможных причин инсульта. Уменьшение количества эритроцитов, гемоглобина (анемия) препятствует доставке кислорода к способствует кровоизлиянию.
- Скорость оседания эритроцитов (СОЭ). Повышение СОЭ может указывать на воспалительные процессы в организме, в том числе на воспалительные изменения стенки сосудов (артериит), которые способны играть роль в возникновении инсульта.
- Общий анализ мочи с микроскопией осадка. Позволяет охарактеризовать различные свойства мочи (цвет, плотность, содержание белка, глюкозы, билирубина), выявить воспалительные изменения в органах мочевыделительной системы. Глюкоза может появляться в моче при сахарном диабете, а одной из причин повышения в ней уровня белка бывает гипертоническая болезнь. Данные заболевания – факторы риска возникновения инсульта.
- Глюкоза крови. Глюкоза – основной вид углеводов, который используется в качестве источника энергии в организме. Ее концентрация часто увеличена при сахарном диабете.
- Холестерол – липопротеины низкой плотности. Они доставляют холестерин в органы и ткани организма. Увеличение их количества способствует развитию атеросклероза (отложению атеросклеротических бляшек на стенках сосудов).
- Коагулограмма – анализ свертывающей системы крови. Среди параметров свертывания – показатели МНО (международное нормализованное отношение), АЧТВ (активированное частичное тромбопластиновое время) и др. Повышение МНО и АЧТВ свидетельствует о гипокоагуляции, то есть снижении способности крови к свертыванию (склонности к кровотечению), снижение данных показателей указывает на повышенный риск тромбообразования. Учёт коагулограммы важен для профилактики инсульта и для оценки эффективности приема антикоагулянтов (препаратов, предотвращающих образование тромбов).
Исследования головного мозга
- Компьютерная томография играет ведущую роль в диагностике инсульта головного мозга. Метод основан на изменении интенсивности рентгеновского излучения при прохождении через различные по плотности среды. Специальные датчики фиксируют данные изменения, и после компьютерной обработки формируются послойные изображения структур организма. При внутривенном введении специального контрастного вещества можно исследовать сосуды головного мозга. Данное исследование позволяет выявить вид инсульта, объем и область поражения головного мозга, а также изменения в сосудах.
- Магнитно-резонансная томография основана на действии сильного магнитного поля на ткани человека. В результате после компьютерной обработки получаются послойные изображения внутренних органов, так что можно определить объем поврежденной ткани мозга при ишемическом инсульте.
- Ангиография позволяет увидеть сосуды головного мозга. Через небольшой разрез в бедренную артерию вводится специальный катетер, который затем проводится через крупные сосуды в сонную или позвоночную артерию и далее из этих артерий в сосуды головного мозга. В ходе манипуляции по катетеру пропускается контрастное вещество, видимое в рентгеновском излучении. После введения в сосуды контрастного вещества получается их изображение на серии снимков.
- Ультразвуковая доплерография основана на применении ультразвука. С ее помощью выявляют сужения просвета сосудов, атеросклеротические бляшки, определяют скорость кровотока в сосудах и другие важные показатели.
Дополнительные исследования
- Эхокардиография – ультразвуковой метод исследования сердца. Позволяет получить изображение сердца и выявить эмболы, которые могут с током крови попасть в головной мозг и вызвать инсульт.
Лечение
Подход к лечению зависит от вида инсульта. При ишемическом инсульте главная задача – восстановить кровоснабжение пострадавшего участка головного мозга. Для этого используются препараты, разжижающие кровь, способствующие растворению кровяных сгустков. В целях предупреждения ишемического инсульта в последующем могут быть проведены следующие операции:
- каротидная эндартерэктомия – операция, направленная на извлечение атеросклеротических бляшек, которые сужают сонные артерии, снабжающие головной мозг кровью;
- стентирование и ангиопластика – операции, направленные на расширение просвета суженных артерий. В просвет суженной артерии вводят баллон, который раздувается и увеличивает объем артерии. Затем в артерию помещаются специальные сетчатые трубочки – стенты, которые препятствуют уменьшению просвета сосуда в дальнейшем.
При геморрагическом инсульте лечение направлено на контроль кровотечения из разорвавшегося сосуда, обеспечение нормального кровоснабжения головного мозга. Хирургическое лечение применяется для удаления внутричерепных кровоизлияний и для предотвращения повторных кровотечений.
- Клипирование аневризм головного мозга – операция, направленная на изоляцию из кровотока расширенной части артериального сосуда (аневризмы). Тем самым устраняется источник кровотечения. На основание аневризмы накладывается клипс (специальный зажим), и кровь перестает поступать в аневризму.
- Эмболизация аневризм – введение спиралей в просвет аневризмы специальным катетером. Кровоток в аневризме значительно снижается, и аневризма тромбируется (закупоривается кровяными сгустками) – этим предупреждается ее разрыв.
- Удаление артериовенозных мальформаций – извлечение клубка расширенных и истонченных сосудов, которые могут являться источником кровотечения.
Профилактика
- Контроль за уровнем артериального давления.
- Контроль за уровнем холестерина.
- Контроль за уровнем сахара крови.
- Поддержание нормального веса.
- Употребление большого количества овощей и фруктов.
- Регулярные физические нагрузки.
- Отказ от курения, злоупотребления алкоголем.
Рекомендуемые анализы
- Общий анализ крови
- Скорость оседания эритроцитов (СОЭ)
- Общий анализ мочи с микроскопией осадка
- Глюкоза в плазме
- Холестерол – липопротеины низкой плотности (ЛПНП)
- Коагулограмма № 3 (протромбин (по Квику, МНО, фибриноген, АТIII, АЧТВ, D-димер)
Источник
Статья посвящена диагностическому значению протеомного анализа жидкости передней камеры глаза при катаракте, первичной открытоугольной глаукоме и псевдоэксфолиативном синдроме
Протеомный анализ является одним из новых направлений исследований состава биологических жидкостей. Протеомика – наука, основным предметом изучения которой являются белки, их функции и взаимодействия в живых организмах, в т. ч. в человеческом. Основная ее задача – количественный анализ экспрессии белков в клетках в зависимости от их типа, состояния или влияния внешних условий [1]. Протеомика осуществляет сравнительный анализ больших групп белков – от всех белков, вовлеченных в тот или иной биологический процесс, до полного протеома (совокупности всех белков организма) [2]. Традиционно изучение белков являлось одним из разделов биохимии, но после определения структуры всей геномной ДНК человека и ряда других организмов у исследователей белков появились новые методы, с которыми и связывают появление в 1997 г. нового термина «протеомика» [3]. В частности, появились исчерпывающие базы данных, содержащие последовательности всех белков человека, а также их протеолитических ферментов, полученных в стандартных условиях. Это позволяет идентифицировать белки по молекулярной массе их фрагментов методом масс-спектрометрии. Поскольку протеомика оперирует большим объемом данных, для обработки которых требуются специализированные алгоритмы и большие вычислительные мощности, она тесно связана с биоинформатикой.
В последние годы протеомный анализ стал неотъемлемой частью биомедицинских исследований [4]. Главной целью клинической протеомики является обнаружение нового белкового или пептидного биомаркера, который связан с определенным заболеванием. Биомаркер – молекула, наличие или отсутствие которой позволяет сделать вывод о протекании определенного клеточного процесса или определить тип клетки. Сравнение протеомов здорового человека и больного позволяет выявить конкретные белки, потенциально вовлеченные в развитие болезни, которые в дальнейшем могут стать мишенями для новых лекарственных препаратов. Кроме того, если такие белки уже известны, анализ протеома может использоваться как метод ранней диагностики.
Одним из основных методов протеомики является масс-спектрометрия белков, которая позволяет установить количественный и качественный состав в исследуемом образце, будь то очищенный и выделенный белок или клеточный лизат. В клинической практике установление новых биомаркеров может помочь в разработке скрининговых методов для ранней диагностики заболевания.
В настоящее время в медицине применение методов протеомного анализа позволяет выявить маркеры онкологических заболеваний на их ранней стадии [5–7]. Есть работы по диагностике хронических дерматозов и аутоиммунных заболеваний кожи методом протеомного анализа [8]. Определен протеомный профиль мочи пациентов с хроническим гломерулонефритом, выявлены белки-маркеры, ответственные за разные фазы течения патологического процесса [9].
В последнее время метод протеомного анализа приобретает большую актуальность и в офтальмологии. С помощью масс-спектрометрии были исследованы слеза и жидкость ПКГ, забор которых осуществлялся при различных заболеваниях [10–13], в частности, при глаукоме.
Жидкость ПКГ (син.: водянистая влага (ВВ)) вырабатывается пигментным и непигментным эпителием цилиарного тела [14]. Секреция происходит со скоростью 2–3 мкл/мин. Человеческий глаз производит от 3 до 9 мл ВВ в сутки. Функции ВВ – обеспечение питанием бессосудистых тканей глаза (хрусталика, стекловидного тела, роговицы) и удаление шлаковых метаболитов. Основная трудность протеомного исследования ПКГ заключается в небольшом количестве ее объема, который можно получить из одного глаза. Так как общий объем ВВ в передней камере не превышает 150–200 мкл [15] и с возрастом уменьшается [16], трудно собрать больше 100–150 мкл.
В состав жидкости ПКГ входит около 99% воды и менее 1% белков, среди которых преобладают фракции альбуминов, глобулины и трансферрин. По сравнению с сывороткой крови ВВ содержит гораздо меньше белка (от 2,4 до 3,7 мг/мл) [17]. Также в жидкости ПКГ были обнаружены различные аминокислоты (лизин, гистидин, триптофан), ферменты (протеаза), гиалуроновая кислота (ГК).
Среди белков жидкости ПКГ у пациентов с глаукомой идентифицированы матриксные металлопротеиназы [18], которые осуществляют лизис базальных мембран и гидролиз всех существующих компонентов межклеточного матрикса и активируют связанные с ним ангиогенные факторы роста [19, 20]. Также в жидкости ПКГ выделены ангиогенный фактор VEGF А [21] и фибронектин [22].
Фибронектин – гликопротеин внеклеточного матрикса, выполняет регуляторную и стабилизирующую функции в межклеточных взаимодействиях и является общей адгезивной молекулой для соединительной ткани (тканевая форма), плазмы крови и других биологических жидкостей (плазменная форма). По литературным данным, фибронектин определяется в составе псевдоэксфолиативного материала и во всех структурах дренажной системы глаза [23].
В нескольких исследованиях обнаружена более высокая концентрация фибронектина в жидкости ПКГ у пациентов с глаукомой [24], причем при псевдоэксфолиативной глаукоме уровень этого гликопротеина значительно выше, чем при ПОУГ. Авторы связывают это с повреждением и нарушенной проницаемостью гематоофтальмического барьера [22]. В другом исследовании у пациентов без подтвержденного диагноза глаукомы с ПЭС был определен более высокий уровень фибронектина в жидкости ПКГ, чем у пациентов без ПЭС [25].
Также в жидкости ПКГ пациентов с псевдоэксфолиативной глаукомой были обнаружены более высокие уровни металлопротеиназ 2 и 3 типа и эндогенного ингибитора металлопротеиназы-2. Это свидетельствует о нарушении баланса между металлопротеиназами и их эндогенными ингибиторами и может быть одним из звеньев патогенеза ПЭС.
При ПОУГ в жидкости ПКГ были обнаружены более высокие уровни растворимого CD44 – интегрального клеточного гликопротеина, играющего важную роль в межклеточных взаимодействиях, клеточной адгезии и миграции. Это рецептор для ГК, некоторых других лигандов, а также, возможно, матриксных металлопротеиназ [26]. Авторы выдвинули рабочую гипотезу о том, что ПОУГ биохимически характеризуется снижением концентрации ГК в жидкости ПКГ и повышением экспрессии рецептора CD44 для ГК, что, в свою очередь, может влиять на трабекулярный аппарат и выживаемость ганглионарных клеток сетчатки.
В нескольких исследованиях определяли уровень антител сыворотки крови пациентов с глаукомой. Были обнаружены антитела к Нsp [27], γ-енолазе [28], белку, стимулирующему активацию аденилатциклазы [29] и гликозаминогликанам [30]. Также были определены повышенные уровни антител к антигенам сетчатки и другим структурам глаза в сыворотке крови больных глаукомой [31–33]. В жидкости ПКГ пациентов с глаукомой нормального давления тоже обнаружили повышенные уровни антител к антигенам сетчатки по сравнению с таковыми у пациентов из группы контроля [34].
Цель исследования: определить протеомный состав жидкости ПКГ и его различия при катаракте, ПОУГ и ПЭС.
Материал и методы
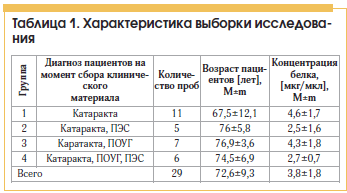
Под наблюдением находились 29 пациентов в возрасте от 45 до 82 лет. 1-ю группу (контрольную) составили пациенты с катарактой (11 человек), не имеющие другой офтальмопатологии. Во 2-ю группу вошли пациенты с катарактой и ПЭС без подтвержденного диагноза глаукомы (5 человек). 3-ю группу составили пациенты с катарактой и открытоугольной глаукомой (7 человек). В 4-ю группу вошли пациенты с катарактой, ПОУГ и ПЭС (6 человек) (табл. 1).

В исследование включались пациенты, не имеющие тяжелых соматических заболеваний, хронических системных заболеваний, не переносившие за последний год лазерные операции на исследуемом глазу и не имеющие в анамнезе хирургических вмешательств на глазном яблоке.
Пациентам всех групп проводились комплексное офтальмологическое обследование и забор жидкости ПКГ для проведения протеомного исследования.
Офтальмологическое обследование включало визометрию, периметрию, тонометрию, гониоскопию, биомикроскопию, прямую и обратную офтальмоскопию, оптическую когерентную томографию, ультразвуковое В-сканирование, пахиметрию, определение критической частоты слияния мельканий.
Забор жидкости ПКГ проводился во время первого этапа операции экстракции катаракты в филиале № 1 ГКБ им. С.П. Боткина «Офтальмологический стационар». Жидкость ПКГ исследовалась при помощи высокоэффективной жидкостной хроматографии (ВЭЖХ) в сочетании с высокоточной тандемной масс-спектрометрией. ВЭЖХ проводили с помощью прибора Agilent 1100 Series (Agilent Technologies, США). Тандемный масс-спектрометрический анализ проводили с помощью прибора Orbitrap Q Exactive (Thermo Scientific, США). Лабораторные исследования проводились на базе ФГБНУ «НИИ биомедицинской химии им. В.Н. Ореховича» (ИБМХ).
В исследование были включены 29 образцов жидкости ПКГ. Каждый образец исследовался с помощью ВЭЖХ в сочетании с высокоточной тандемной масс-спектрометрией в 3 технических повторах. Биоинформатический анализ полученных спектров проводился с использованием программы MaxQuant версии 1.5.2.8. Полученный список белков имел уровень ложноположительных результатов (FDR)=1% как для белковых, так и для пептидных идентификаций, что было получено путем сопоставления результатов с инвертированной базой данных.
Анализ аннотации белков жидкости ПКГ проводился с помощью Gene Ontology (GO). GO – это важный биоинформационный проект, посвященный созданию унифицированной терминологии для аннотации генов и генных продуктов всех биологических видов. Целями проекта являются поддержание и пополнение определенного списка генов и их продуктов, составление аннотаций генов и продуктов, а также разработка инструментов доступа к базе данных проекта. GO является частью более крупного проекта Open Biomedical Ontologies [35–37].
Для определения уровня значимости обогащения использовали расчет значений p-value по формуле гипергеометрического распределения или мультивариантного гипергеометрического распределения, которое в теории вероятностей моделирует количество удачных выборок без возвращения из конечной совокупности. Наиболее значимыми считали биологические процессы с наименьшим значением p-value. Например, уровень значимости обогащения p=8,77×10-44 свидетельствует о высокой достоверности полученного результата.
Результаты
В работе найдены 263 белковые группы, характеризующие протеом жидкости ПКГ. Основная часть выделенных нами белковых групп отвечает за функцию связывания биологических молекул и тем самым осуществляет регуляцию клеточного ответа на различные сигналы, что важно для координации всех биохимических процессов, происходящих в жидкости ПКГ.
Большая часть белков (148 из 263) была обнаружена во всех группах. В соответствии с классификацией GO, большинство выделенных белковых групп участвуют в регуляции протеолиза. К примеру, ингибитор эндопептидазы и регулятор пептидазы, выделенные в жидкости ПКГ, предотвращают развитие патологического протеолиза. По литературным данным, большинство белков, обнаруженных в жидкости ПКГ, также выделены в плазме крови и спинномозговой жидкости [4].
Из выделенных нами белков жидкости ПКГ особого внимания заслуживает Pigment Epithelium Derived Factor (PEDF, фактор пигментного эпителия, genename SERPIN F1), который относится к семейству серпинов – белков, ингибирующих пептидазы. Данный белок выявлен во всех исследуемых группах. По литературным данным, PEDF синтезируется в клетках пигментного эпителия сетчатки [38], защищает нейрональные клетки от апоптоза и является природным ингибитором ангиогенеза [39].
Особый интерес представляют 26 белков, выделенных только в группе пациентов с катарактой. Среди них α-кристаллин (идентификатор Gene Name CRYAA), витамин K-зависимый белок (PROS1), корнеодесмосин (CDSN), плакофилин-1 (PKP1), α-цепь тубулина (TUBA1B). По литературным данным, эти белки являются структурными составляющими вещества хрусталика и появляются в жидкости ПКГ при развитии катаракты [40, 41]. Авторы связывают их появление (особенно белков-кристаллинов) с биохимическими изменениями, происходящими при развитии катаракты. Также авторы отмечают, что гены alpha-crystallin A (CRYAA), beta-crystallin A3 (CRYBA1) и beta-crystallin A4 (CRYBA4) относятся к генам, отвечающим за изменения в хрусталике, соответственно, мутации в них вызывают катаракту.
Из 16 белков, характеризующих катаракту с ПЭС, впервые выявленными являются 6 белков: флавин-редуктаза (BLVRB), белок S100-A1 (S100A1), глутатион-S-трансфераза-3 (GSTM3), α-1-цепь коллагена (COL18A1), рибонуклеаза-4 (RNASE4), десмин (DES). Для группы пациентов с глаукомой найдено 12 уникальных белков, 4 из них являются впервые выявленными: аполипопротеин С-III (APOC3), α-2-цепь коллагена (COL1A2), α-3-цепь коллагена (COL9A3), пролин-богатый белок-4 (PRR4).
Из 4 белков, характеризующих глаукому с ПЭС, 2 являются впервые выявленными: F-бокс белок (NCCRP1) и НАД(Ф)Н-дегидрогеназа (NQO1).
Семь белковых групп, найденных на пересечении множеств «катаракта + ПЭС» и «глаукома + ПЭС», позволяют выявить тенденции к возникновению различий белкового состава при ПЭС. Основные функции этих белков – участие в связывании различных биологических молекул и регуляция метаболических процессов в жидкости ПКГ.
Среди белков жидкости ПКГ по сравнению со всем протеомом человека чаще встречаются аннотированные как обладающие активностью в отношении ингибирования эндопептидаз (GO:0004866) (уровень значимости обогащения p=9,74×10-41), что свидетельствует о важности защиты жидкости ПКГ от протеолиза. Основной молекулярный процесс в протеоме жидкости ПКГ – каскад активации белков (GO:0072376) (уровень значимости обогащения p=8,77×10-44), т. к. клеточный сигналинг очень важен для координации биохимических процессов в клетках. Как и ожидалось, клеточная локализация белков жидкости ПКГ аннотирована как принадлежность к внеклеточному пространству (GO:0044421) (уровень значимости обогащения p=1,78×10-196). Это обусловлено тем, что белки внеклеточного матрикса играют важную роль в формировании структур глаза, а внутренняя поверхность эндотелиальных клеток граничит с ВВ, заполняющей ПКГ.
Анализ аннотации белков, «конститутивно» представленных в жидкости ПКГ, по результатам нашей работы и ранее опубликованным данным показал, что чаще встречаются белки, аннотированные как обладающие активностью в отношении ингибирования эндопептидаз (GO:0004866) (уровень значимости обогащения p=1,73×10-34). Преобладающим молекулярным процессом в протеоме жидкости ПКГ является негативная регуляция пептидазной активности (GO:0010466) (уровень значимости обогащения p=4,29×10-32), важная для защиты жидкости ПКГ от протеолиза. Так, например, протеолиз субъединиц коннексинов, образующих щелевые контакты между волокнами хрусталика, или волокон, в которые упакованы кристаллины, вызывает помутнение хрусталика [42]. Клеточная локализация аннотирована как принадлежность к внеклеточному пространству (GO:0005615) (уровень значимости обогащения p=8,99×10-84).
Заключение
Впервые в России были исследованы образцы жидкости ПКГ 29 пациентов с катарактой, глаукомой и ПЭС методом хромато-масс-спектрометрии на приборе высокого разрешения.
Полученные данные позволяют оценить различия в белковом составе внутриглазной жидкости у больных представленных групп. В исследовании были идентифицированы группы белков, ранее не описанные в составе жидкости ПКГ. Также выявлены 4 уникальные группы белков, характерные для катаракты, ПЭС и глаукомы. Найдена тенденция к возникновению различий состава протеома жидкости ПКГ у больных с ПЭС и без него.
Анализ объединенного протеома ВВ на предмет преобладания определенных структурно-функциональных групп белков с использованием категорий GО выявил, что основной функцией белков жидкости ПКГ является ингибирование эндопептидаз.
Обнаруженные различия в белковом составе жидкости ПКГ свидетельствуют об изменении обмена веществ, что может являться одним из ключевых звеньев патогенеза ПЭС и глаукомы.
Проведение протеомных исследований глазных жидкостей является перспективным, т. к. дает возможность разработки методов диагностики и лечения заболеваний глаза.
Источник
