Предпочтительной методикой кинезотерапии при инфаркте мозга является
Церебральный инсульт является серьезной проблемой здравоохранения во всем мире, имеющей не только медицинские, но и социально-экономические последствия [1]. У большинства перенесших инсульт наблюдаются нарушения двигательных и познавательных (когнитивных) функций, а также трудности в самообслуживании [2].
Большинство исследователей подчеркивают важность ранней реабилитации для пациентов, перенесших церебральный инсульт. Раннее начало реабилитационных мероприятий существенно влияет на течение болезни и способствует улучшению качества жизни пациента [3]. Комплексная реабилитация возвращает или восполняет биосоциальные функции, способствует большей функциональной независимости пациента и возможности возвращения к полноценной жизни [4]. Многие авторы указывают, что кинезотерапия является главным средством реабилитации для пациентов с инсультом, содействующим реорганизации головного мозга и восстановлению двигательных функций [5,6].
Эффективность реабилитации и исход болезни у лиц, перенесших инсульт, могут быть различными [7]. Проведены исследования влияния отдельных факторов на функциональное восстановление перенесших инсульт пациентов, но их результаты неоднозначны, а порой и противоречивы. Особенно много противоречивых данных в вопросах влияния на исход реабилитации пола [8-10] и возраста [11, 12] пациентов, а влияние таких факторов, как масса тела больного и участие близких пациента в процессе реабилитации, изучаются очень редко. Почти отсутствуют исследования о факторах, влияющих на эффективность кинезотерапии во время первого этапа реабилитации у лиц, перенесших церебральный инсульт. При этом раннее выявление факторов, способствующих функциональному улучшению, очень важно при составлении эффективной программы реабилитации [13].
Цель исследования – оценка факторов, влияющих на эффективность кинезотерапии во время острого периода болезни (первого этапа реабилитации) у лиц, перенесших инфаркт головного мозга (ИГМ).
Исследование проводилось в отделе неврологии университетской больницы Каунаса. Обследованы 40 пациентов, 26 (65%) женщин и 14 (35%) мужчин, в возрасте от 45 до 74 лет (средний – 61,8±9,7 года), с верифицированным диагнозом инфаркта головного мозга (ИГМ).
В исследование включались пациенты в остром периоде впервые развившегося инсульта с показателем функционального восстановления по индексу Бартел до 20 баллов.
Всем больным 5 раз в неделю проводилась индивидуальная кинезотерапия продолжительностью 30-45 мин, в среднем 10,2±4,1 процедуры. Процедуры кинезотерапии включали лечение положением, пассивные и активные упражнения для конечностей и туловища, дыхательные и идеомоторные упражнения, обучение функциональным навыкам (переворачиваться, садиться, вставать, ходить). Кроме того, проводились функциональная электростимуляция мышц и массаж конечностей. Эффективность кинезотерапии (динамика двигательных функций) оценивалась по тесту FIM (Functional Independence Measure – тест функциональной независимости, только моторная шкала) [14] и по шкале моторных функций MAS (Motor Assessment Scale) [15].
Моторная часть теста FIM (сумма баллов от 13 до 91) используется для оценки возможности приема пищи, осуществления личной гигиены, купания, одевания верхней и нижней частей тела, пользования туалетом, контроля мочеиспускания и испражнения, пересаживания в кровать, кресло, коляску, передвижения в туалете, ванной, душе, передвижения на коляске, ходьбе, подъема по лестнице. Каждая из этих способностей оценивается в диапазоне от 1 до 7 баллов.
Шкала моторных функций MAS используется для оценки способностей переворачиваться на неповрежденную сторону, садиться, поддерживать равновесие сидя, вставать, ходить, а также контролируются движения плечевого пояса, кисти, сложные движения руки. Каждое задание оценивается по качеству от 0 (не способен) до 6 (полностью способен). Сумма набранных баллов по этой шкале варьирует от 0 до 48, чем больше баллов, тем лучше независимость пациента.
Двигательные функции пациентов во время первого этапа реабилитации оценивали дважды – перед началом и после курса кинезотерапии при выписке из стационара. В протоколе исследования отмечали следующую информацию: пол, возраст, масса тела и индекс массы тела (ИМТ) больного, локализацию повреждения головного мозга, степень повреждения (гемиплегия или гемипарез), афазию, перенесенные болезни до ИГМ (сопутствующие заболевания) и их количество, продолжительность периода от развития инсульта до начала кинезотерапии, мотивацию больного, участие близких пациента в реабилитационном процессе.
Статистический анализ полученных данных проведен с помощью программ SPSS 13.0 и MS Excel. Данные представлены в виде среднего арифметического и среднего квадратического отклонения (M±SD). В случаях достаточной выборки и нормального распределения средние величины двух независимых групп сравнивались по критерию Стьюдента. В случаях малой выборки (n<20) или ненормального распределения средние величины двух независимых групп сравнивались по непараметрическому критерию Манна-Уитни. Для зависимых групп различия между двумя группами оценивались соответственно по парному критерию Стьюдента и непараметрическому критерию Уилкоксона. Различия между группами оценивались как статистически значимые при p<0,05.
По результатам тестов FIM и MAS двигательная функция у пациентов с ИГМ в конце исследования по окончании процедур кинезотерапии статистически значимо улучшилась (p<0,05). Анализ результатов реабилитации в зависимости от пола, возраста, ИМТ (табл. 1), количества сопутствующих заболеваний, продолжительности периода от развития инсульта до начала кинезотерапии и участия близких больного в реабилитационном процессе (табл. 2) показал, что эффективность кинезотерапии от этих факторов не зависела.
 При сравнении восстановления пациентов в зависимости от их мотивации установлено, что существуют статистически значимые различия между низкой, средней и высокой мотивацией – меньше всего двигательные функции (по FIM и MAS) улучшались у пациентов с низкой мотивацией (p<0,05, см. табл. 2).
При сравнении восстановления пациентов в зависимости от их мотивации установлено, что существуют статистически значимые различия между низкой, средней и высокой мотивацией – меньше всего двигательные функции (по FIM и MAS) улучшались у пациентов с низкой мотивацией (p<0,05, см. табл. 2).
Среднее улучшение по FIM и MAS статистически значимо (p<0,05) отличалось в случаях повреждений полушарий головного мозга, особенно левого, и мозжечка. У пациентов, перенесших повреждение в мозжечке, моторика по FIM после кинезотерапии улучшилась в среднем на 23,0±4,1 балла, а по MAS – на 13,8±2,9 балла, в то время как улучшение после курса кинезотерапии при повреждении левого полушария составляло лишь 15,0±7,4 и 8,4±5,2 балла соответственно (табл. 3). Анализ эффективности кинезотерапии в зависимости от локализации инсульта также выявил статистически значимые (p<0,05) различия между ИГМ в бассейне средней мозговой артерии и в вертебрально-базилярном бассейне: у пациентов, перенесших инсульт в бассейне позвоночной и основной артерий, двигательная функция была оценена более высокими баллами, улучшившись по FIM в среднем на 23,0±5,9 балла, а по MAS – на 13,8±2,9 балла, в то время как улучшение в случаях ИГМ в бассейне средней мозговой артерии составило 16,2±8,3 и 8,7±5,4 балла соответственно (см. табл. 3).
Анализ эффективности кинезотерапии в зависимости от локализации инсульта также выявил статистически значимые (p<0,05) различия между ИГМ в бассейне средней мозговой артерии и в вертебрально-базилярном бассейне: у пациентов, перенесших инсульт в бассейне позвоночной и основной артерий, двигательная функция была оценена более высокими баллами, улучшившись по FIM в среднем на 23,0±5,9 балла, а по MAS – на 13,8±2,9 балла, в то время как улучшение в случаях ИГМ в бассейне средней мозговой артерии составило 16,2±8,3 и 8,7±5,4 балла соответственно (см. табл. 3).
У пациентов с гемипарезом двигательные функции в начале первого этапа реабилитации были значительно лучше (p<0,05), чем у пациентов с гемиплегией. После кинезотерапии, в конце первого этапа реабилитации по результатам обоих тестов эти функции также восстанавливались достоверно (p<0,05) лучше у пациентов с гемипарезом (см. табл. 3). Двигательные функции у пациентов с гемипарезом улучшились в среднем на 21,2±8,4 балла по FIM и на 15,2±5,1 балла по MAS, в то время как у пациентов с гемиплегией улучшение составило 13,3±6,2 и 5,9±2,9 балла соответственно.
При наличии у пациентов сенсомоторной афазии их двигательные функции до кинезотерапии были оценены значительно хуже, чем у пациентов без этого нарушения. Это различие сохранялось и в конце исследования – двигательные функции по FIM у пациентов с сенсомоторной афазией восстанавливались значительно хуже, чем у пациентов без речевых нарушений (см. табл. 3). Во время первого этапа реабилитации улучшение двигательных функций у пациентов без афазии составило в среднем 17,4±8,5 балла по FIM, у пациентов с моторной афазией – 21,7±10,1 балла, а у пациентов с сенсомоторной афазией – 14,3±5,9 балла.
Результаты проведенного исследования показали, что двигательные функции у пациентов с ИГМ на фоне применения кинезотерапии во время первого этапа реабилитации статистически значимо улучшились (при оценке по тестам FIM и MAS). По нашим данным, эффект кинезотерапии не зависел от пола и возраста пациента. При этом данные литературы о влиянии пола на восстановление функций у пациентов, перенесших ИГМ, неоднозначны. Одни исследователи [8, 16] указывают, что женщины восстанавливаются лучше чем мужчины, поскольку реорганизация полушарий головного мозга после инсульта у женщин проявляется шире, чем у мужчин. В то же время другие исследователи [9, 17] утверждают, что пол не имеет влияния на эффективность кинезотерапии. Более того, некоторые авторы [10, 18, 19] предполагают, что результаты реабилитации лучше у мужчин, так как функциональное состояние после инсульта у женщин обычно бывает хуже, чем у мужчин.
О том, влияет ли на восстановление после инсульта возраст, исследователи тоже не пришли к единому мнению: результаты одних исследований [11, 20] указывают на отсутствие такого влияния, в то время как другие [12, 21] подтверждают, что с возрастом возможности восстановления после ИГМ уменьшаются – более молодые пациенты восстанавливаются быстрее и лучше. Несмотря на разногласия, исследователи согласны с тем, что стационарная реабилитация эффективна и для пожилых пациентов, даже тех, которые старше 85 лет.
Настоящее исследование также показало, что восстановление двигательных функций на фоне кинезотерапии во время первого этапа реабилитации у больных с ИГМ не зависит от массы тела пациента. В литературе подобных результатов не найдено.
Восстановление двигательных функций по тестам FIM и MAS в зависимости от локализации повреждения головного мозга было больше всего выражено в случаях повреждения мозжечка, а меньше всего – левого полушария головного мозга. Объяснение этому предлагают Э. Милинавичене и соавт. [22], которые в 2008 г получили похожие результаты: в случае повреждения левого полушария головного мозга у больных проявляются расстройства речи, восприятия, чтения, письма – то есть те, которые существенно влияют на способности, связанные с познавательной функцией. Полученные в настоящем исследовании результаты совпадают с данными зарубежных авторов [23]. Однако некоторые авторы [24, 25] не обнаруживают существенной разницы между повреждением левого и правого полушария или не свидетельствуют о том, что пациенты с левосторонней гемиплегией при реабилитации достигают лучших функциональных результатов [9].
Анализ эффективности кинезотерапии при ИГМ в зависимости от пораженного бассейна показал, что у пациентов с инсультом в бассейне позвоночной и основной артерий двигательные функции были оценены лучше уже в начале кинезотерапии, и их восстановление во время первого этапа реабилитации также было лучше, чем в случаях инсульта в бассейне средней мозговой артерии. Сходных выводов в других доступных источниках найти не удалось.
Т. Юрайтис [26] в своей работе упоминает, что лучшие возможности восстановления (особенно функции рук) отмечаются у больных, перенесших инсульт в бассейне позвоночной и основной артерий.
Результаты сравнения больных по степени пареза показали, что двигательные функции у пациентов с гемипарезом более сохранны по сравнению с больными с гемиплегией как до, так и после кинезотерапии. В литературе сообщается [10, 27], что паралич руки отрицательно влияет на моторные, познавательные и психосоциальные функции и действия из-за отсутствия движений или сильно ограниченной амплитуды движений, боли в плечевом суставе или сублюксации.
Сравнение эффективности кинезотерапии в зависимости от наличия и типа афазии (моторная или сенсомоторная) показало, что самое худшее состояние моторики как в начале, так и в конце первого этапа реабилитации, было у пациентов с сенсомоторной афазией. Y. Fang и соавт. [28] установили, что сенсомоторная афазия как существенное расстройство познавательных функций отрицательно влияет на восстановление у пациентов, перенесших ИГМ. Вероятно, это связано с тем, что пациенты с афазией или расстройствами познавательных функций не в состоянии понять указаний кинезотерапевта и, следовательно, выполняют упражнения с поврежденной конечностью только спонтанно [28]. Любопытно, что в нашем исследовании у пациентов с моторной афазией восстановление двигательных функций во время первого этапа реабилитации было более выражено, чем у пациентов без повреждения речи, хотя различие не было значительным. Это можно объяснить тем, что пациенты с афазией дольше были в стационаре и благодаря этому получили больше реабилитационных процедур [29].
При сравнении восстановления моторики пациентов в зависимости от других сопутствующих заболеваний (одно или больше) статистически значимых различий в эффективности кинезотерапии не обнаружено. Однако многие исследователи [30] утверждают, что у пациентов с тремя и больше сопутствующими заболеваниями эффективность реабилитации ниже, и что большее их количество отрицательно сказывается на эффективности реабилитации. Некоторые авторы [31] утверждают, что сопутствующие заболевания связаны с независимостью пациента в начале реабилитации, но на момент выписки восстановление функционального состояния от них не зависит.
При оценке эффективности кинезотерапии в зависимости от продолжительности срока от развития инсульта до начала процедур установлено, что сроки в 1-3 дня и 4-10 дней статистически значимо не отличаются. Хотя двигательные функции в конце первого этапа реабилитации у пациентов, которым кинезотерапия была назначена в первые 1-3 дня после инсульта, были несколько лучше, различия не достигали статистической значимости. В литературе утверждается [28, 32, 33], что раннее начало реабилитации обеспечивает лучший исход функционального восстановления; очень важно начать реабилитационные мероприятия в течение первых 20 дней после инсульта.
В нашем исследовании эффективность восстановления моторики на раннем этапе реабилитации не зависела от того, участвуют ли близкие больного в процессе реабилитации. Похожих данных в доступной литературе не найдено, но в одной статье [34] утверждается, что дополнительные упражнения, выполняемые с близкими пациента, существенно улучшают восстановление моторики у перенесших ИГМ больных.
Большинство авторов утверждают [35, 36], что мотивация пациента является главным фактором, определяющим возможности восстановления его функционального состояния. В нашем исследовании этот факт подтвердился – двигательные функции у пациентов с низкой мотивацией улучшились значительно меньше, чем у пациентов со средней или высокой мотивацией. Любопытно заметить, что несколько большее (хотя статистически незначимое) улучшение наблюдалось у пациентов со средней мотивацией, а не с высокой. Это можно объяснить тем, что пациентам с высокой мотивацией может быть свойственна переоценка своих возможностей. Множество перенесших инсульт пациентов испытывают депрессию, расстройства эмоций, поведения или познавательных функций – все это может оказывать влияние не только на мотивацию пациента, но и на весь процесс реабилитации [37, 38].
Резюмируя сказанное, можно сделать вывод, что двигательные функции у лиц, перенесших ИГМ, на фоне применения кинезотерапии в течение первого этапа реабилитации достоверно улучшаются. Меньшая эффективность кинезотерапии во время острого периода болезни наблюдается при инфаркте в левом полушарии головного мозга и в бассейне средней мозговой артерии, а также в случаях гемиплегии, сенсомоторной афазии и низкой мотивации пациента.
Источник
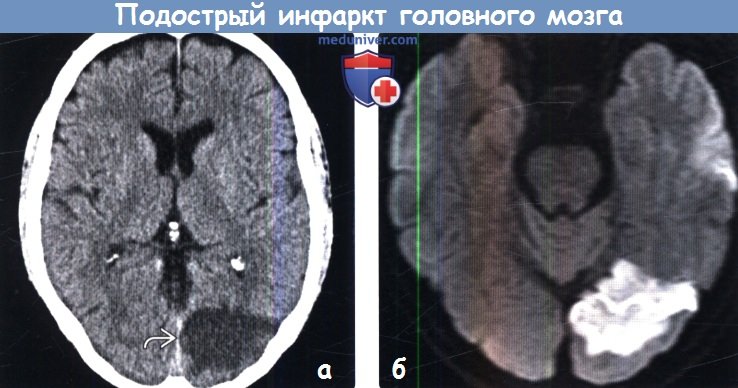
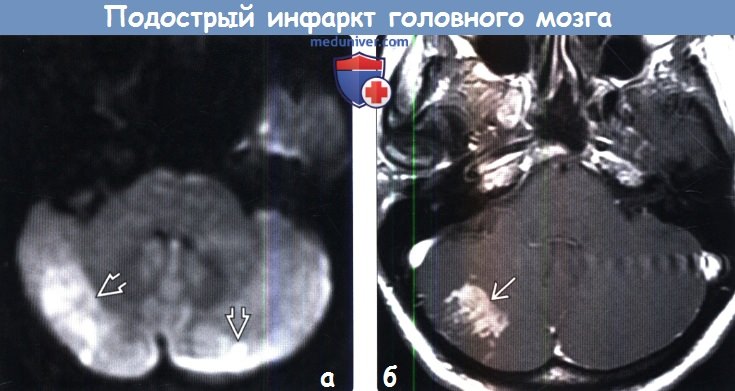
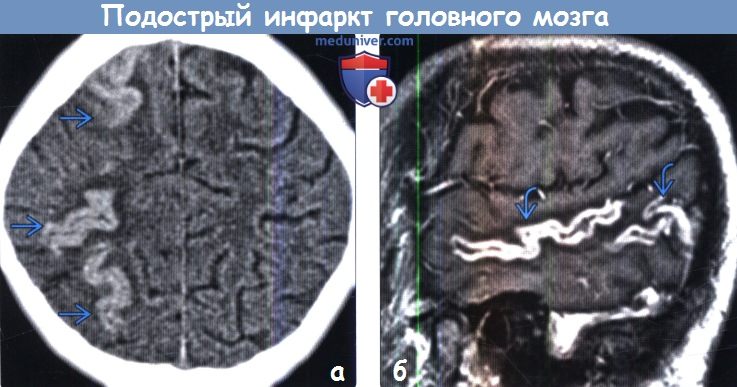
Диагностика подострого инфаркта головного мозга по КТ, МРТа) Терминология: б) Визуализация: 1. Общие характеристики подострого инфаркта головного мозга:
2. КТ при подостром инфаркте головного мозга: 3. МРТ при подостром инфаркте головного мозга:
4. Ангиография: 5. Радионуклидная диагностика: 6. Рекомендации по визуализации:
в) Дифференциальная диагностика подострого инфаркта головного мозга: 1. Новообразование: 2. Венозный инфаркт: 3. Энцефалит/церебрит: г) Патология: 1. Общие характеристики подострого инфаркта головного мозга: 2. Макроскопические и хирургические особенности: 3. Микроскопия: д) Клиническая картина: 1. Проявления подострого инфаркта головного мозга: 2. Демография: 3. Течение и прогноз: 4. Лечение: е) Диагностическая памятка: ж) Список литературы:
– Также рекомендуем “Хронический инфаркт головного мозга на КТ” Редактор: Искандер Милевски. Дата публикации: 21.3.2019 |
Источник