Повышение кфк при инсульте
Острые нарушения мозгового кровообращения (ОНМК) представляют собой одно из самых распространенных заболеваний в современной неврологии и клинической медицине вообще. ОНМК в мире входят в четверку заболеваний, являющихся причиной смертности. В остром периоде данное заболевание приводит у третьей части пациентов к летальному исходу, а в последующий год летальность увеличивается еще на 10–15 %. Также следует учитывать высокую степень инвалидизации приблизительно у 80 % пациентов, у которых основной причиной инвалидности является ОНМК [1].
Несмотря на имеющиеся фундаментальные работы в области изучения патогенетических процессов, протекающих в остром периоде ишемического инсульта, важным и актуальным остается изучение некоторых процессов, в частности окислительно-восстановительных. Известно, что в остром периоде церебрального ишемического инсульта происходит критическое снижение мозгового кровообращения, в результате чего становится недостаточным поступление кислорода в мозговую ткань. Вследствие кислородного дефицита возникают явления дисциркуляторной и тканевой гипоксии. На данном этапе недостаток кислорода, подавляющий метаболизм в митохондриях, вызывает нарушение биоэнергетического обмена. Впоследствии происходит стимуляция малоэффективного анаэробного пути расщепления глюкозы, которая приводит к образованию лактата, снижению рН, развитию внеклеточного и внутриклеточного ацидоза. Резкое увеличение уровня лактата в крови является постоянным показателем мозговой ишемии и может объективно указывать на степень гипоксии, особенно в остром периоде церебрального ишемического инсульта [2–4].
На современном этапе научных исследований установлено, что биоэнергетические механизмы включают процессы продукции, транспорта и утилизации энергии. Из литературных источников известно, что существует система транспорта энергии, основными компонентами которой являются креатин, креатинфосфат, креатинфосфокиназа (КФК). Образование АТФ из креатинфосфата обеспечивает транспорт дыхательной АТФ и ее дифференцированное использование [2–5].
Исходя из того, что биохимические реакции происходят с участием ферментов, актуальным является изучение состояния активности некоторых ферментов, принимающих участие в окислительно-восстановительных процессах и метаболизме основных энергетических и пластических материалов организма человека в течение острого периода церебрального ишемического инсульта.
Для достижения данной цели нами была изучена активность аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), щелочной фосфатазы (ЩФ), КФК, лактатдегидрогеназы (ЛДГ), гамма-глутамилтранспептидазы (ГГТП) у 124 больных с острым нарушением мозгового кровообращения по ишемическому типу, в возрасте 45–74 лет, на 1-е — 3-и и 7–9-е сутки заболевания. Активность ферментов АСТ, АЛТ, ЩФ, КФК, ЛДГ, ГГТП изучалась с помощью энзиматического кинетического метода на биохимическом анализаторе Screen master lab производства Hospitex Diagnostics по общепринятым инструкциям. Контрольную группу составили 30 практически здоровых людей соответствующего возраста.
Находящиеся на лечении больные были разделены на четыре клинические группы в зависимости от степени тяжести заболевания: 1-я группа — больные в относительно удовлетворительном состоянии — 21,0 %; 2-я группа — больные в состоянии средней степени тяжести — 41,9 %; 3-я группа — больные в тяжелом состоянии — 25,8 %; 4-я группа — больные в состоянии крайней степени тяжести — 11,3 %.
В ходе проведенного исследования во все сроки наблюдения отмечалось повышение активности исследуемых показателей. На 1-е — 3-и сутки заболевания по всем клиническим группам уровень ЩФ превышал значения контрольной группы на 24,9 %, КФК — на 76,2 %, ЛДГ — на 31,3 %, ГГТП — на 71,6 %, АСТ — на 19,4 %, АЛТ — на 43,7 %. При повторном исследовании на 7–9-е сутки заболевания у всех обследуемых больных значения ЩФ превышали соответствующие контрольные показатели на 18,5 %, КФК — на 47,8 %, ЛДГ — на 30,6 %, ГГТП — на 52,7 %, АСТ — на 15,4 %, АЛТ — на 31,7 %.
После анализа данных активности исследуемых ферментов по клиническим группам нами было отмечено, что уровень ЛДГ на 1-е —3-и сутки заболевания у больных 1-я группы выше контрольных значений на 42,2 %, у больных 2-й группы — на 44,6 %, 3-й группы — на 50,5 %, 4-й группы — на 19,6 %. Уровень ЛДГ на 7–9-е сутки заболевания был выше относительно показателей контрольной группы соответственно на 31,4, 27,8, 26,4, 21,3 %.
В ходе исследования отмечено достоверное увеличение (р < 0,001) уровня КФК: на 1-е — 3-и сутки заболевания его уровень у больных 1-й группы превышал контрольные значения на 84,2 %, у больных 2-й группы — 97,3 %, 3-й группы — 110,0 %, 4-й группы — на 161,1 %. К 7–9-м суткам заболевания показатель КФК был соответственно выше показателей контрольной группы на 78,5 % у больных 1-й группы, на 86,7 % — 2-й группы, на 103,1 % — 3-й группы и на 119,8 % — 4-й группы.
Исследования показали увеличение уровня ЩФ на 1-е —3-и сутки заболевания у больных 1-й группы на 19,6 %, 2-й группы — 28,7 %, 3-й группы — 23,2 %, 4-й группы — 26,6 % в сравнении с данными контрольной группы. На 7–9-е сутки заболевания уровень ЩФ был выше контрольных значений по клиническим группам соответственно на 14,6, 22,1, 23,4 и 25,9 %.
Уровень ГГТП на 1-е —3-и сутки заболевания был выше контрольных значений у больных 1-й группы на 24,0 %, больных 2-й группы — на 32,0 %, 3-й группы — на 36,0 %, 4-й группы — на 32,0 %. К 7–9-м суткам этот показатель был выше контрольных по клиническим группам соответственно на 18,5, 28,0, 24,0, 34,0 %.
Достоверных изменений уровня АЛТ в ходе проведенного исследования больных в остром периоде церебрального ишемического инсульта не отмечалось. Уровень АЛТ на 1-е — 3-и сутки увеличивался относительного контрольных значений только у больных 2-й группы на 13,5 %, 3-й группы — 19,3 %, 4-й группы — 24,8 %. На 7–9-е сутки уровень данного фермента был выше контрольных значений у больных 3-й группы — на 17,5 %, 4-й группы — на 22,2 %.
Во время исследования активности некоторых ферментов в крови больных с ишемическим инсультом в остром периоде нами было проанализировано изменение определяемых показателей в зависимости от бассейнов ишемического поражения головного мозга.
Среди 124 обследованных больных у 48 человек ишемический инсульт возник в левом каротидном бассейне, у 40 человек — в правом каротидном бассейне, у 36 человек — в вертебробазилярном бассейне.
Следует отметить, что наиболее значимые изменения уровня ГГТП произошли на 1-е — 3-и сутки заболевания у больных с ишемическим инсультом в вертебробазилярном бассейне, его значение превышало контрольное на 51,6 %, на 7–9-е сутки заболевания уровень ГГТП был наивысшим у больных с расположением ишемического очага в левом каротидном бассейне — на 75,5 %.
Уровень ЛДГ не имел существенных изменений у больных с ишемическим инсультом в вертебробазилярном бассейне, его значение при полушарном инсульте был выше контрольных показателей на 42,7 % на 1-е — 3-и сутки заболевания, с незначительным преобладанием показателя у больных с расположением очага в левом каротидном бассейне. На 7–9-е сутки уровень ЛДГ снижался у больных с ишемическим инсультом в левом каротидном бассейне и был повышен у больных с очагом ишемии в правом каротидном бассейне.
Содержание КФК максимально повышалось относительно контрольных значений у больных с ишемическим инсультом в правом каротидном бассейне на 1-е — 3-и сутки заболевания, а на 7–9-е сутки — у больных с очагом ишемии в левом каротидном бассейне. Уровень ЩФ во все сроки наблюдения был выше у больных с ишемическим инсультом в левом каротидном бассейне. Оценивая данные АСТ и АЛТ, следует отметить преобладание уровня АСТ у больных с ишемическим инсультом в левом каротидном бассейне.
Таким образом, в ходе проведенного исследования отмечено стойкое изменение содержания в крови исследуемых ферментов, которое проявлялось в виде гиперферментемии во все сроки исследования по всем клиническим группам в зависимости от степени тяжести состояния больных и от расположения очага ишемического поражения головного мозга.
Учитывая литературные данные, указывающие на то, что активность КФК свидетельствует о степени энергетического обмена, активность ЛДГ — о степени ацидоза, ЩФ — степени повреждающего эффекта клетки и ГГТП — степени повреждения мозговой паренхимы [5], можно сделать соответствующие выводы. Полученные результаты позволяют расширить имеющиеся представления о патогенетических процессах ишемического поражения головного мозга в остром периоде с последующей возможностью формирования комплекса традиционных лечебно-реанимационных и реабилитационных мероприятий соответствующими препаратами в адекватных дозах.
Источник
Ферменты организма — это специфические вещества-катализаторы. Их основная задача — ускорять прочие биохимические процессы.
КФК в крови — это фермент креатинкиназа, один из важнейших катализаторов, ускоряющий синтез АТФ (аденозинтрифосфата), той самой структуры, которая участвует во всех без исключения энергетических процессах. Без нее жизнедеятельность организма невозможна в принципе.
Само по себе это соединение группы ферментов неоднородно, несмотря на общее название. Существует несколько модификаций (изоферментов). Они отличаются концевой химической структурой молекулы.
Но в целом, устроены по той же схеме:
- КФК ММ. Эта разновидность креатинкиназы расположена в скелетной мускулатуре. В свободной форме в сыворотке крови на ее долю приходится более 95% от общей массы вещества. Среди всех изоферментов.
- КФК МВ. Гибридная разновидность. Вещество локализуется в клетках миокарда. В меньшей степени в сыворотке крови. Показатель изменяется при заболеваниях сердца, особенно сильно после инфаркта и при хронических ишемических процессах. То есть тех явлениях, связанных с недостаточным энергетическим обменом.
- КФК ВВ. Специфический тип. Локализуется в мозговых тканях. В крови не обнаружатся, поскольку соединение не способно пройти через гематоэнцефалический барьер.
Все изоферменты похожи друг на друга и выполняют близкие функции, но в разных тканях организма.
В ходе анализа исследуются все фракции, кроме той, что копится в мозгу. По уже названной причине.
Роль фермента в организме
Функции соединения примерно одни и те же. Если говорить подробнее:
- Синтез АТФ. Креатинфосфокиназа работает как ускоритель выработки этого вещества.
- То же самое касается и синтеза высокоэнергетического соединения, креатинфосфата. КФК выполняют главную роль в обоих случаях.
Как и все прочие ферменты, креатинфосфокиназа действует узконаправленно, соответственно, функции ее минимальны, хотя и очень важны.
Есть и не столь очевидный момент. По концентрации изоферментов КФК врачи могут судить о патологиях различных органов и систем. Потому стоит говорить о креатинфосфокиназе еще и как об индикаторе заболеваний головного мозга, сердца, костно-мышечной системы. Это информативный показатель.
Когда назначают анализ
Оснований для исследования довольно много:
Боли в мышцах
Дискомфорт в мускулах — явный и частый признак миозита. Местного воспалительного процесса.
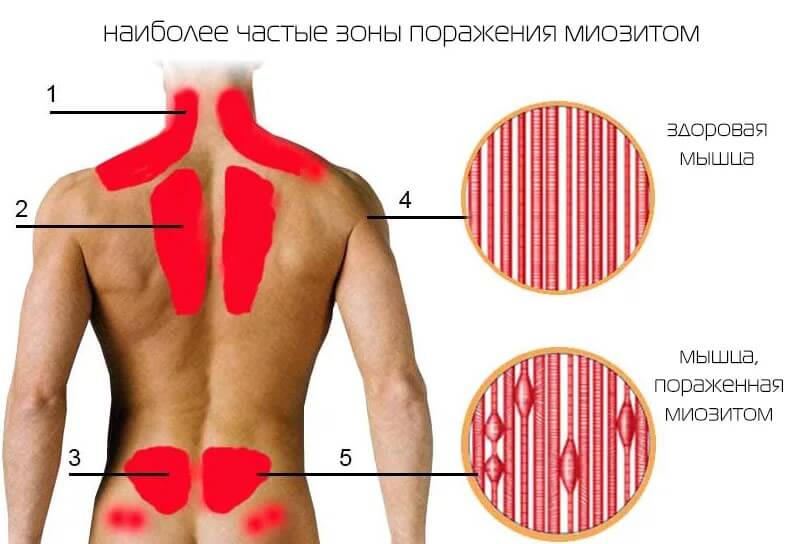
На фоне этого явления концентрация КФК возрастает. Чем интенсивней поражение мышц, тем больше показатели фермента.
Удобно исследовать фракции, если нужно оценить динамику состояния. Например, до и после лечения.
Отравления алкоголем
В этом случае диагностика назначается, чтобы исследовать сохранность энергетического обмена. Этанол, спирт, выступает своего рода ингибитором, замедляет синтез АТФ. Парадоксально, но КФК при этом растет.
Как результат — падает мускульная сила, снижается скорость обмена веществ в головном мозге. Если это явление достигает критических масштабов (например, после обильного потребления алкоголя, на уровне смертельной дозы), вероятны необратимые изменения.
Исследование количества креатинфосфокиназы призвано оценить степень нарушения. А затем и отследить, как проходит процесс восстановления.
Тахикардия, любые отклонения со стороны сердца
Аденозинтрифосфат (АТФ), а значит косвенным образом и креатинфофокиназа играет ключевую роль в работе мышечного органа.
Поскольку без достаточного количества этих веществ сократительная способность была бы в принципе невозможной. Любые отклонения сразу дают знать о себе.
На ранних этапах орган пытается компенсировать нарушение за счет накопленного запаса сил. Собственных ресурсов. Число сокращений в минуту растет. Как только внутренний потенциал исчерпан, сердце перестает биться с достаточной силой.
Внимание:
Если концентрация КФК так и продолжает расти, а функция миокарда так же мала, вероятна остановка работы органа.
Врачи имеют возможность поймать патологию на подступах. Хотя тахикардия развивается и по другим причинам.
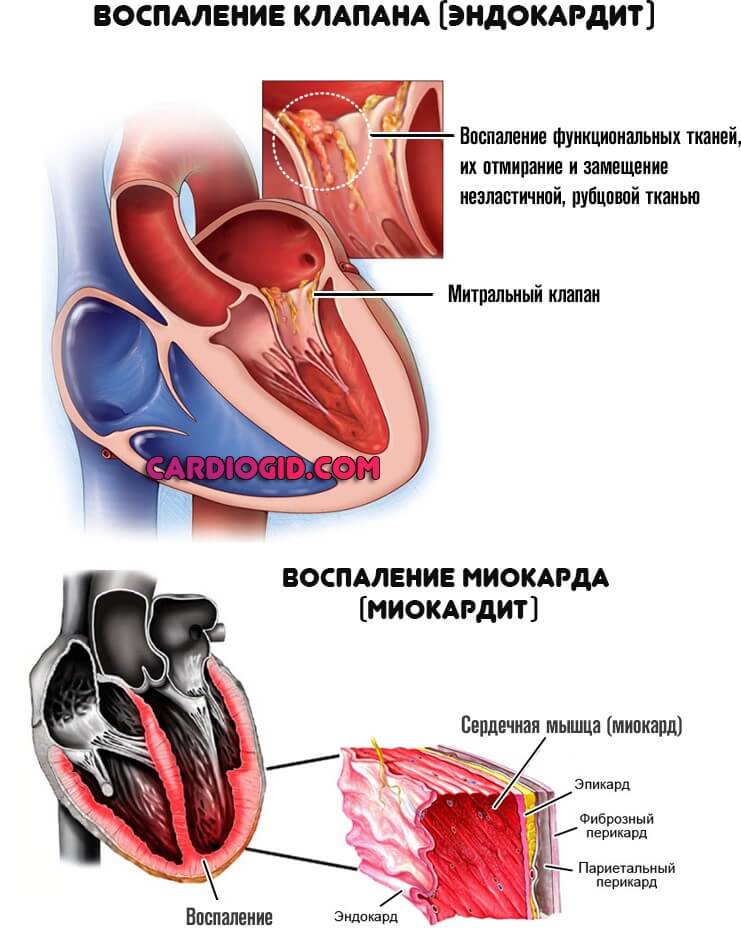
Ревмокардит
Речь идет о воспалении аутоиммунного происхождения. По своей природе, подобное расстройство несет опасность для биохимических процессов вообще. В результате ложного ответа защитных сил организма, концентрация КФК увеличивается.
Поскольку мышечный слой разрушается, изоферменты начинают выходить в кровь и больше не обеспечивают внутренний ресурс и запас прочности миокарда. Чем это заканчивается — уже понятно. Возможна остановка сердца и смерть пациента.
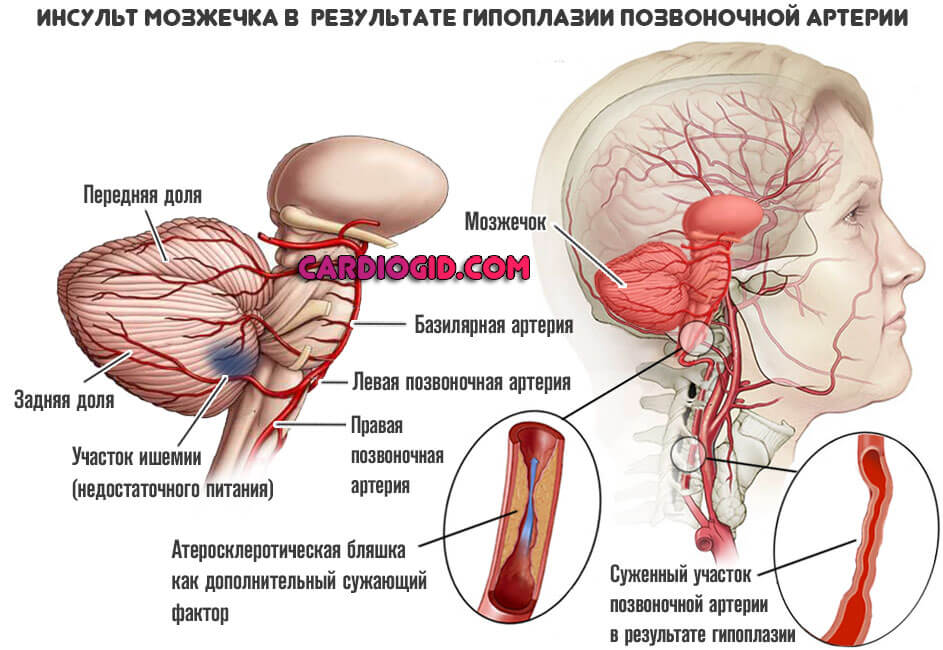
Подозрения на инсульт и недавно перенесенные острые дефициты мозгового кровотока
Нарушения целостности церебральных тканей. В первом случае исследование косвенно подтверждает поражение нервных структур. Во втором — позволяет определить тяжесть расстройства.
Признаки предынсультного состояния подробно описаны здесь, а инсульта — тут.

Воспалительные процессы
Любой этиологии. В основном — инфекционные. Токсины, которые вырабатывают бактерии, а также те, что остаются от разрушения собственных клеток организма, ингибируют, замедляют выработку КФК. По результатам анализа можно судить о степени тяжести воспаления.
Высокая нагрузка на миокард
Вариантов таковой может быть много. Например, спортивные тренировки или физическая, изнурительная работа. Категории пациентов, которые сталкиваются с подобными нагрузками — в группе повышенного риска.
В этой ситуации анализ крови на КФК назначают в качестве меры профилактики. Проводить исследование нужно регулярно. Как минимум, 2 раза в год. Можно чаще по потребности.
Все отклонения — это явное основание для тревоги. Энергетический обмен нужно поддерживать. Здесь на помощь приходят кардиопротекторы и прочие препараты. Это уже другой вопрос.
Перечень показаний далеко не полный. Анализ крови на креатинфосфокиназу назначают при опухолевых процессах, для подтверждения этиологии психических расстройств. Нужно ли в конкретном случае сдавать анализ решает профильный специалист.
Таблицы норм
Концентрация креаниткиназы зависит от пола пациента и его возраста. В меньшей мере расы, происхождения.
У женщин
| Возраст (лет) | Уровень КФК (ед/л) |
|---|---|
| 15-20 | 123 |
| 21-50 | до 150 |
| Старше 50 | Не более 160 |
Выкладки примерные. На деле — нужно учитывать в том числе индивидуальные особенности организма, конституцию тела, рост, вес, общее состояние здоровья и прочие.
Справиться может только специалист. Когда уточнит все необходимые моменты. Это возможно на очном приеме.
У мужчин
У мужчин, норма КФК в анализе крови изначально в два раз выше женской и находится в диапазоне от 270 до 300 Ед/литр.
Почему так? Причина в том, что общий объем мышц больше, а сила сокращений мускулатуры выше. Это обусловлено гормональными особенностями и конституцией тела. Потому энергетический обмен идет быстрее.
| Возраст (лет) | Норма КФК в единицах на литр крови |
|---|---|
| 15-20 | 270 |
| 21-50 | Не выше 300 |
| После 50 | Менее 280 |
Точнее нельзя сказать по тем же самым причинам.
У детей
Нормы КФК в крови у детей различны, но в отношении пола пока еще серьезного разброса нет. При рождении показатели самые высокие, и со временем падают в 2-3 раза.
Подробные данные представлены в таблице:
| Годы | Концентрация фермента (максимальная) |
|---|---|
| Первая неделя | 650 |
| До 6 месяцев | 295 |
| До 1 года | 200 |
| 1-3 года | 230 |
| 4-6 лет | 150 |
| 6-12 лет (в подростковый, ранний пубертатный период отличия в части пола становятся более заметны, приведены усредненные значения) | 160 (ж), 250 (м) |
| 13-15 лет | 125 (ж), 270 (м) |
Уровни приблизительные. Расшифровку лучше оставить специалисту. Вопрос сложный. Универсальных показателей не существует.
Причины повышения
Рост концентрации КФК встречается чаще, чем снижение. В основном подобное отклонение начинается при дегенеративных процессах.
- Миокардит. Воспалительное поражение сердечной мышцы. Имеет инфекционную, реже несептическую природу. Креатинкиназа в крови повышена по причине разрушения тканей. Фермент переходит из связанной в свободную форму и находится в крови в больших объемах.
В норме уровень КФК МВ составляет около 2% от общего количества креатинфосфокиназы. По концентрации вещества и степени отклонения от нормы судят о тяжести заболевания.
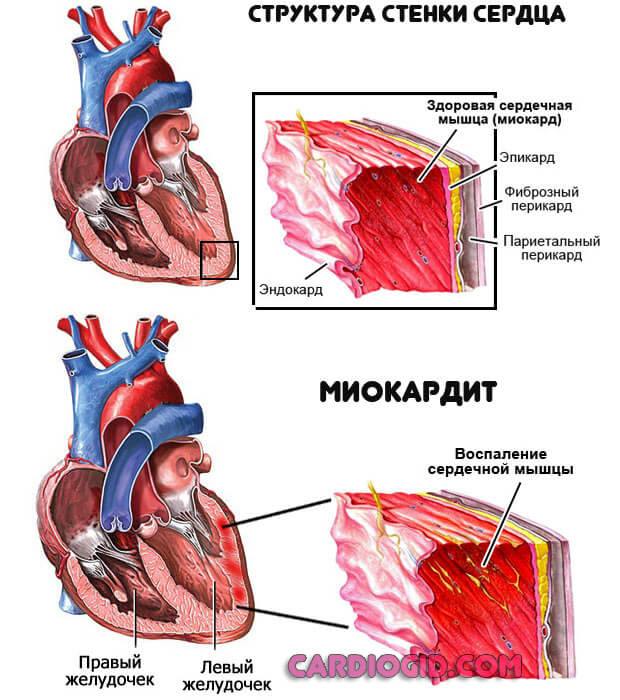
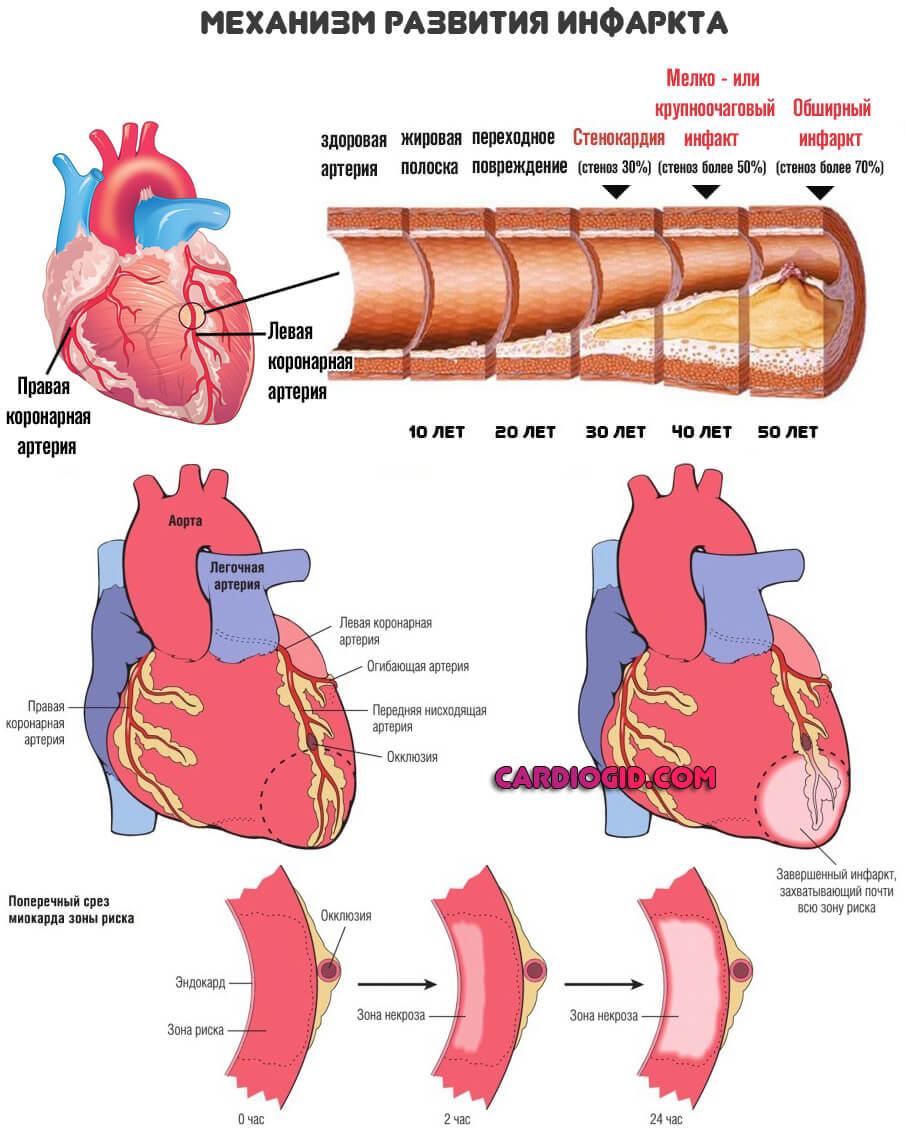
- То же самое касается инфаркта. Это неотложное состояние, при котором мышечный слой стремительно разрушается от недостатка питания и клеточного дыхания. Наблюдается резкий рост КФК, сразу после того как патологический процесс развился.
Далее уровень постепенно снижается. На это требуется не один день, а порой вообще несколько недель. Помочь скорректировать энергетический обмен способны врачи. Если систематически использовать протекторы и прочие препараты, восстановление пойдет быстрее.
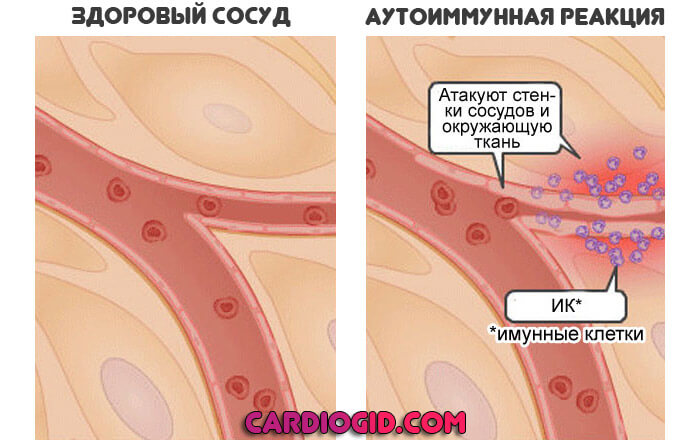
- Аутоиммунное поражение мускулатуры. Довольно редкое явление. При этом состоянии мышцы организма разрушает собственная защитная система. Степень расстройства различна. В самых легких случаях это локализованный процесс. В более сложных — генерализованный. Когда задействовано множество мышц.
В кровеносное русло выходит КФК ММ, концентрация повышается, это сразу становится заметно. Тем более что эта модификация составляет подавляющее большинство от общей массы соединения в русле.
- Причиной, почему креатинкиназа в крови повышена, может быть и инсульт, острое нарушение церебрального кровообращения. Суть явления примерно та же, что и при инфаркте. Отличается только локализация. Участки головного мозга отмирают.
КФК ВВ, специфический изофермент который содержится в нервных волокнах, не повышается. Мешает гематоэнцефалический барьер.
Однако, из-за нарушений центральной регуляции процессов энергообмена, количество прочих модификаций КФК меняется. Это скорее косвенное последствие, но оно хорошо заметно. Все возвращается в норму спустя несколько недель.
- Потребление большого количества спиртного. Повышение креатинфосфокиназы означает, что произошла интоксикация, и чем сильнее отравление, тем серьезнее страдает энергетический обмен.
Исследование проводят дважды. Первый раз — до того, как начато лечение (детоксикационные мероприятия). Второй — уже после. Чтобы исследовать, насколько восстановился синтез АТФ.
Можно оценить уровень и потом, в динамике. Это важно если, например, пациент получил критически опасное отравление, и его едва удалось вернуть в норму. Вопрос остается на усмотрение профильных врачей.
- Использование некоторых препаратов. КФК может повыситься и при приеме определенных лекарственных средств — это побочный эффект. Обычно серьезной опасности он не несет, но возможны исключения из правила. Тот же эффект встречается у препаратов психотропного ряда. Антидепрессантов, нейролептиков. В меньшей мере у транквилизаторов.
- Еще одна причина повышения креатинкиназы в крови — это недавно проведенная операция. Чем тяжелее вмешательство, чем сложнее восстановление, тем серьезнее нарушения энергетического обмена. Главный признак этого — рост креатинфосфокиназы.
КФК может быть выше нормы по причине деструкции мышц, нервных тканей, структур миокарда. В каждом случае растет определенная фракция фермента. Не считая разве что головного мозга, поскольку вещество не может выйти за пределы гематоэнцефалического барьера.
Чтобы определиться, в чем дело, нужно провести полную диагностику. Заниматься этим должна группа специалистов: невролог, кардиолог и прочие.
Внимание:
Рост КФК отнюдь не помогает организму, и здоровья не добавляет. Хотя так и может показаться на первый взгляд.
Дело в том, что от увеличения концентрации энергетический обмен сам по себе не усиливается. Чаще всего фракции фермента высвобождаются при разрушении тканей. Нервных, мышечных.
Они выступают своего рода депо, хранилищами. При деструкции происходит активный выброс. Но вещества так и остаются инактивными. Им нечего ускорять. Субстрата больше не становится.
К тому же основное заболевание само по себе может быть фактором недостаточного энергообмена. Возникает парадоксальная ситуация: КФК в крови повышен, а процесс предельно медленный.
Причины снижения
Это нарушение встречается реже. Тем не менее, ничего хорошего пациентам оно также не сулит.
- Заболевания печени. Цирроз. Деструкция тканей органа. Представляет собой некроз, стремительное отмирание клеток. При хронической форме КФК уменьшается постепенно, следуя за прогрессированием основного заболевания. Что же касается острого гепатонекроза, происходит стремительный скачок. Поэтому, показатели креатинфосфокиназы используют как индикатор благополучия крупнейшей железы.
- Токсические поражения печени. Встречаются, например, при активном потреблении алкоголя. Реже диагностируют лекарственные формы. Те, которые развиваются после долгого лечения некоторыми препаратами: стероидами, противовоспалительными и при передозировке ацетилсалициловой кислоты.
- Беременность. Во время гестации организм усиливать энергетический обмен. Вырабатывается больше креатинфосфокиназы. Она призвана стимулировать энергообмен в теле самой матери, а заодно обеспечивать плод.
Правда, не всегда это так. На поздних стадиях (ко второму-третьему триместру), потребности ребенка и самой матери столь велики, что количество КФК падает. Это нормальное явление. Оно указывает на интенсивное развитие плода. Вещество быстро утилизируется, замещается новым.
- Недостаточное питание. Алиментарный фактор в этом случае играет одну из главных ролей. Наравне с беременностью это самая частая причина снижения КФК. При неправильном питании, если организм недополучает белка, незаменимых аминокислот, синтез креатинфосфокиназы серьезно замедляется.
В самых опасных случаях, тело начинает утилизировать собственные мышцы, чтобы получить КФК и прочие необходимые для энергетического обмена вещества. Ничем хорошим это не заканчивается.
Длительное голодание может привести к смерти. Энергообмен восстанавливается медленно, даже если процесс еще не перешел в критическую фазу. На восстановление может понадобиться до нескольких месяцев.
Дополнительные мероприятия
Одного только анализа на КФК редко хватает, чтобы поставить диагноз. Исследование используют, чтобы констатировать факт: что-то не так. Что именно — выясняют другими способами.
- Опрос и сбор анамнеза. Нужно понять, какие жалобы имеются. Чтобы выдвинуть гипотезы и рассмотреть варианты болезней. Это первый шаг.
- УЗИ органов пищеварительного тракта. В основном исследуют печень. Она — один из главных виновников проблемы.
- ЭКГ и эхокардиография. Чтобы оценить состояние сердца. Отклонения вроде ИБС, тем более перенесенные инфаркты обязательно скажутся на показателях КФК.
- Электроэнцефалография мозга.
- Изучение сосудов церебральных структур, позвоночных артерий.
- Биохимический анализ крови. В особенности показатели АЛТ и АСТ. Также их называют печеночными пробами.
- Электромиография. По необходимости. Чтобы оценить сократимость мышц. При недостаточной концентрации КФК и АТФ, она обычно снижается.
- МРТ или КТ по необходимости. В основном, если врачу не до конца понятно структурное состояние той или иной системы или определенного органа.
В основном — этого достаточно. По усмотрению специалистов, перечень может быть расширен.
КФК или креатинфосфокиназа — это катализатор, фермент, который ускоряет выработку АТФ. Вещества, что позволяет организму вообще существовать и заниматься деятельностью.
Все отклонения однозначно нужно тщательно проверять. Искать причину нарушения и по необходимости — лечить.
Источник
