Периферическая кровь при инфаркте
При приступе инфаркта миокарда в крови больного происходят биохимические изменения. Потому для подтверждения диагноза и выявления срока давности недуга проводят анализ крови. При инфаркте миокарда он позволяет уточнить диагноз и дополняет другие методы исследования. Ниже представляется перечень информации об изменениях в крови.
Биохимические изменения
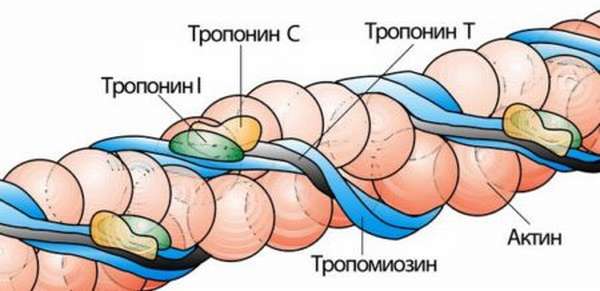
Внимание! При инфаркте миокарда в кровь выбрасывается определенное количество специфических белков (тропонин, миоглобин), которые позволяю диагностировать приступ.
При приступе некроза кардиомиоциты выделяют огромное количество белка тропонина. Чтобы поставить диагноз, необходимо выявить уровень данного белка к моменту восстановления перфузии. Поскольку определяется уровень белка прикроватно, это позволяет облегчить диагностику, которая может быть осложнена при сомнительном результате ЭКГ.
После того как с момента приступа прошло около 4-6 часов, возрастает уровень некоторых специфичных ферментов. К ним относится КФК (креатинфосфокиназа). Пик активности КФК достигается после суток с момента приступа. Нормализуется содержание данного фермента после 2-3 суток. Пика КФК может достичь и через 12 часов на фоне тромболизиса.
Однако повышение КФК не может служить единственным и точным показателем инфаркта миокарда, так как оно наблюдается и при повреждении скелетных мышц или при гипотиреозе.
Более специфичным показателем служит активность МВ-фракций КФК. Например, если активность КФК при повреждении скелетных мышц наблюдается, то МВ-фракция не так активна. Это связано с тем, что она имеется в большей степени именно в сердечных тканях.
Если сравнивать динамику всей КФК и отдельной МВ-фракции, то вторая быстрее достигает своей максимальной точки. Нормализация, следовательно, тоже достигается раньше (через 1,5 суток).
Повышенная активность МВ-фракций наблюдается и при миокардите, после хирургических вмешательств на сердечной мышце или гипотиреозе, но в данных случаях динамика не такая, как при инфаркте. В этом случае уровень МВ-фракции выше КФК на 2,5 процента. Выявление активности МВ-фракций и общего КФК проводится через 12 и 24 часа после приступа.
Вышеописанная МВ-фракция присутствует в МВ1 и МВ2 изоформе. Для диагностирования инфаркта миокарда применяют анализ отношения МВ2 к МВ1. К примеру, более чем у 90% пациентов уже через 4-6 часов с момента приступа данное соотношение превышает коэффициент 1,5.

Высокоспецифичный признак инфаркта миокарда – уровень сердечных тропонинов T и I. Распознать произошедший инфаркт по ним можно уже после 3 часов с момента приступа, так как уровень этих белков начинает повышаться и сохраняется на несколько суток. Это позволяет выявить некроз сердечной мышцы даже при поступлении больных через 48 часов после появления ангинозных неприятных ощущений в груди.
Более того, данный метод диагностирования весьма информативен потому, что позволяет прогнозировать течение недуга. Согласно проведенным исследованиям, чем выше уровень тропонина I и чем раньше анализ на тропонин T дает положительный результат, тем хуже прогноз.
После некроза коронарной артерии уже через 2 часа в кровь поступает белок миоглобин. Но из-за того что почки очень быстро выводит его из организма, специфичной важности данный показатель не представляет.
Спустя через 1-2 сутки с момента приступа активизируется фермент ЛДГ (лактатдигидрогеназа). Пик ее приходится на 3-5 сутки и нормализуется ЛДГ к 8-10 суткам.
Внимание! Раньше использовали метод выявления уровня ЛДГ у больных, поступивших через 2-3 суток, когда КФК уже приходит в норму. В последнее время для постановки диагноза определяют уровень тропонина.
Показатели крови при инфаркте миокарда
Делая краткий вывод, можно отметить биохимические изменения в крови после приступа инфаркта.
Ферменты
Для диагностирования используют показатели следующих ферментов:
- АСТ. Повышение уровня данного фермента проходит в 1-2 сутки и нормализуется к 3-4 суткам.
- КФК. Повышение данного фермента начинается уже после 4-8 часов с момента некроза сердечной мышцы и достигает пика через сутки. Нормализация КФК проходит в последующие 2-3 суток.
- ЛДГ. Активизируется ЛДГ через 2-3 суток и достигает максимального уровня через 4-6 суток. Вызвать повышение могут и иные патологии, которые не связаны с инфарктом миокарда, повышение ЛДГ не считается 100% показателем некроза сердечной мышцы.
Как видно, каждый из ферментов имеет свои особенности, которые позволяют установить диагноз инфаркт миокарда в различное время после появления первых ощущений.
Лейкоцитоз
При инфаркте миокарда данный показатель может возрасти до 12-15 тыс. кубическом миллиметре. В некоторых случаях пик может быть больше, а нормализация данного показателя происходит через несколько недель после приступа инфаркта миокарда. Количество лейкоцитов увеличивается большей частью за счет молодых нейтрофилов, поэтому происходит нейтрофильный сдвиг лейкоцитарной формулы влево, что становится диагностически значимым признаком.
Скорость оседания эритроцитов
Повышение СОЭ происходит спустя несколько суток после некроза сердечной мышцы, высокий уровень сохраняется несколько недель.
Сердечно-сосудистые заболевания часто сопровождаются повышенным содержанием тяжелых металлов в крови. Повышенное содержание кадмия или алюминия оказывает токсичное воздействие. А уровень некоторых важных для жизнедеятельности микроэлементов снижается – хром, медь, марганец.
Ниже рассмотрены несколько тяжелых металлов и их негативное воздействие на организм при избыточном содержании:
- Свинец. Вызывает разрушение эндокринной системы. Помимо сердца и сосудов, поражается печень. Следствием повышенного уровня свинца становится артериальная гипертензия и атеросклероз. У пациентов появляются следующие осложнения:
- аритмия,
- тахикардия,
- синусовая брадикардия,
- васкулит.
- Кадмий. При избытке данного тяжелого металла может возникнуть отравление печени, развиться кардиопатия и нарушиться регуляция гипофиза. Повышенное содержание кадмия вызывает развитие повторных атеросклеротических бляшек, артериальной гипертензии.
- Мышьяк. Из-за большого количества мышьяка в организме сосуды теряют способность пропускать кровь. Утолщение сосудов ведет к развитию кардиогенного шока.
Изменения в содержании тяжелых металлов происходит из-за приступа инфаркта миокарда, а они, в свою очередь, могут развить осложнения.
Полная диагностика

Сложность диагностирования инфаркта миокарда заключается в том, что многие его симптомы способны маскироваться под другие заблевания. Например, нестабильная стенокардия протекает с теми же ангинозными болями в загрудинной области. Иногда боль при приступе стенокардии тоже отдается в руки или спину.
Но стенокардию можно отличить от инфаркта. Если после успокоения человека болевые ощущения не проходят, то это не стенокардия, а инфаркт миокарда. Даже 3-4 дозы нитроглицерина не погасят дискомфорт и жжение при инфаркте, как при стенокардии.
Чтобы правильно диагностировать патологию, пациенту придется принять непосредственное участие в этом процессе. У больного врач собирает анамнез, в котором требуется ответить на следующие вопросы:
- Время начала приступа и продолжительность.
- Был ли эффект от принятия обычных медикаментов.
- Сколько раз приступ повторялся, и с какой периодичностью.
- Изменялись ли ощущения при успокоении или при изменении положения тела.
Внимание! Анамнез становится важной частью диагностики. Опытный врач отталкивается от него при слабовыраженных симптомах.
При сахарном диабете нередко приступ инфаркта миокарда имеет смазанные симптомы, что связано с поражением нервных окончаний. При появлении подозрений на инфаркт миокарда следует срочно обратиться за медицинской помощью, даже если ощущения не ярко выраженные.
Для постановки диагноза используют не только биохимический анализ крови. Вот перечень обследований, которые проходит пациент:
- Электрокардиография. Данное обследование позволяет врачу получить полную картину о функционировании сердечной мышцы. Квалифицированный врач сможет точно определить факт некроза клеток сердечной мышцы по нескольким показателям. Оценивается высота остроконечного зубца T, появление зубца Q, изменение сегмента ST. Для лучшей оценки состояния ЭКГ проводят периодично с получасовым перерывом. При каждом снятии данных проводится оценка динамики некроза.
- Биохимия. После полученных результатов ЭКГ подтверждением диагноза становится анализ крови. Как уже отмечено, при поступлении больного сразу после приступа инфаркта миокарда у него наблюдается увеличенное СОЭ. В крови обнаруживаются маркеры, подтверждающие некроз сердечной мышцы. Другой специфичный показатель – белок тропонин, который появляется при приступе инфаркта миокарда, а в нормальном состоянии не наблюдается.
- Эхокардиография. В качестве дополнительного обследования проводят эхокардиографию, если полученные результаты ЭКГ не позволяют выстроить ясную картину. К тому же это обследование позволяет определить наличие иных недугов, например, ишемической болезни. С другой стороны, эхокардиография может отменить диагноз инфаркта.
- Рентгенография. В некоторых случаях пациенту с жалобами на ангинозные ощущения в груди могут назначить рентгенографическое исследование, на котором специалист сможет определить, имеется ли застой в легких – признак инфаркта миокарда.
Как и у анализа крови, у других методов диагностирования есть свои особенности, которые позволяют определить приблизительное время начала некроза. Если после обследования поставлен диагноз инфаркт миокарда, больного определяют на стационарное лечение. Только стационарно можно предотвратить дальнейшее развитие некроза и спасти жизнь пациенту.
Читайте также: Тропониновый тест при инфаркте миокарда – правила проведения, расшифровка результатов
Загрузка…
Источник
Атипичные формы инфаркта миокарда
Инфаркт миокарда не имеет единой патологической симптоматики, его клинические и инструментально-лабораторные данные вариабельны. Поэтому диагностика заболевания должна основываться на сумме клинических, электрокардиографических и ферментативных признаков.
Наиболее частым симптомом инфаркта миокарда является длительный болевой приступ в области сердца и за грудиной. Боль при инфаркте миокарда отличается от болевого приступа стенокардии не только интенсивностью, но и длительностью, поскольку не купируется обычными дозами нитратов. Боль возникает внезапно, имеет особенно интенсивный характер, сжимающая, в ряде случаев острая, распирающая, иррадиирующая в левую руку, кисть, нижнюю челюсть, ухо, зубы, эпигастральную область, под левую лопатку. Наличие болевого синдрома характеризует начало развития острейшего периода заболевания. Чем больше зона некроза, тем интенсивнее боль.
Боль носит волнообразный характер (то усиливается, то ослабевает), может продолжаться несколько часов и даже суток, не снимается нитроглицерином. Сопровождается чувством страха, возбуждением. Наблюдается бледность кожи, слизистых оболочек, акроцианоз, холодеют пальцы рук и ступней, появляется гиперемия с синюшным цветом на коже шеи, что служит показателем боли и одновременно характеристикой ее интенсивности.
Вместе с тем могут встречаться и атипичные формы инфаркта миокарда: периферическая; безболевая.
Периферическая форма инфаркта миокарда, в свою очередь, делится на:
- леворучную;
- леволопаточную;
- гортанно-глоточную;
- верхнепозвоночную;
- нижнечелюстную.
Безболевые атипические формы инфаркта миокарда:
- абдоминальная;
- астматическая;
- коллаптоидная;
- отечная;
- аритмическая;
- церебральная;
- малосимптомная;
- комбинированная.
Атипичные формы чаще всего встречаются у пожилых людей с выраженными явлениями кардиосклероза, недостаточности кровообращения и др.
Через два дня после начала заболевания повышается температура тела до субфебрильнои и несколько выше и удерживается 3-5 сут, а у лиц старшего возраста она может быть и нормальной.
При исследовании крови в остром периоде, который отражает развитие явлений некроза, асептического воспаления, наблюдается увеличение ферментов, миоглобин, нейтрофильный лейкоцитоз со сдвигом влево, а начиная с 3-го дня увеличивается скорость оседания эритроцитов, повышается уровень грубодисперсных фракций белка (глобулины, фибриноген), ферментов сыворотки крови.
На ЭКГ появляются характерные изменения комплекса QRST.
При мелкоочаговом инфаркте миокарда на ЭКГ наблюдаются только изменения зубца Т.
После острой стадии болезни, когда с помощью лечения снижаются боль и артериальное давление, больной может почувствовать себя удовлетворительно.
У некоторых больных приступы стенокардии возобновляются.
Фeдюкoвич Н.И.
Кардиология, подробнее…
Общие закономерности формирования и заживления инфаркта
Развитию инфаркта предшествует ишемия. Первые сдвиги, обусловленные нарушением кровоснабжения, определяются угнетением тканевого дыхания, компенсаторной активацией анаэробного гликолиза, быстрым накоплением метаболитов в клетках в токсических концентрациях.
Недостаточное воспроизводство энергии и гистотоксический эффект ишемии нарушают электролитный гомеостаз клеток и подавляют пластические процессы, что приводит к прогрессирующей диссоциации цитомембран, закислению внутриклеточной среды, денатурации белков, гибели и разрушению клеток.
Электронно-микроскопически при ишемизации выявляют внутриклеточный отек или, напротив, дегидратацию цитоплазматического матрикса. Органеллы клеток набухают, их мембраны подвергаются гомогенизации и фрагментации, гранулы лабильного гликогена исчезают, отмечают накопление липидов в виде капель вследствие их высвобождения из диссоциирующих фосфолипидов цитомембран и нарушения липидного обмена.
В лизосомах накапливаются продукты внутриклеточного распада.
Происходят перераспределение, конденсация либо вымывание ядерного хроматина и разрушение ядрышек, расплавление цитоплазматических рибосом и органелл немембранной структуры. Гистохимически и биохимически в ишемизированной ткани определяется снижение уровня макроэргических фосфатов, активности окислительно-восстановительных ферментов, накопление недоокисленных метаболитов, нарушение обмена электролитов, уменьшение содержания гликогена, РНК и ДНК, а со временем — накопление продуктов распада стромальных структур.
На некротической стадии инфаркта при микроскопическом исследовании ядра клеток не окрашиваются, все структурные элементы ткани сливаются в однородную массу.
Стадия репаративных изменений наступает вслед за формированием некроза.
По периферии инфаркта всегда существует зона дистрофических изменений и реактивного воспаления — так называемый демаркационный вал. Микроскопически воспалительная реакция отмечается уже через несколько часов, а максимум ее развития приходится на 3-и–5-е сутки.
Воспаление в зоне демаркационного вала сопровождается выходом форменных элементов крови из капилляров. Некротические массы постепенно частично расплавляются под действием протеолитических ферментов, выходящих из нейтрофильных лейкоцитов, частично подвергаются фагоцитозу или резорбируются лимфатической сетью и выводятся по ее сосудам.
Организация зоны некроза — замещение некротических масс соединительной тканью, которая врастает со стороны демаркационного вала и к 7–10-м суткам трансформируется в грануляционную (юную) соединительную ткань, а со временем созревает в рубцовую.
Особенности развития инфаркта в различных органах
В клинической практике наиболее часто отмечают инфаркт сердца (миокарда), головного мозга, кишечника, легких, почек и селезенки.
Время, необходимое для развития инфаркта в различных органах, неодинаково и зависит от функциональных энергозатрат и филогенетически сложившегося метаболизма, что определяет потребность ткани в обеспечении кислородом.
Для развития ИМ достаточно полного прекращения его кровоснабжения на 20–25 мин, однако ишемия длительностью 5 мин уже ведет к гибели отдельных мышечных клеток.
В реальной жизни формирование инфаркта сердечной мышцы требует несколько большего промежутка времени, так как в зоне ишемии всегда частично сохраняется кровоток по сосудистым анастомозам и коллатералям. Он недостаточен для того, чтобы полностью предотвратить некроз, но несколько увеличивает срок его развития и ограничивает размеры.
Инфаркт обычно локализуется в ЛЖ, чаще всего в передней стенке.
По типу это белый инфаркт с геморрагическим венчиком, имеющий неправильную форму.
В зависимости от объема и локализации пораженной ткани миокарда различают мелко- и крупноочаговый, субэпикардиальный, интрамуральный, субэндокардиальный и трансмуральный ИМ, охватывающий все слои сердечной стенки.
В зоне перехода инфаркта на эпикард или эндокард развивается реактивное вос паление, в первом случае приводящее к фиброзному перикардиту (выпот в полость перикарда плазмы крови, обогащенной фибрином, и образование фиб ринозных наслоений на эпикарде), во втором — к тромбоэндокардиту (пристеночный тромбоз соответственно зоне инфаркта).
Формирование ИМ начинается с ишемической стадии.
Наряду с прогрессирующим нарушением метаболизма и дезинтеграцией клеточных мембран отмечают фрагментацию, растяжение и дезинтеграцию миофибрилл кардиомиоцитов. В результате снижается активность внутриклеточных энзимов, изменяется характер окрашивания клеток при использовании основных или кислотных гистологических красителей, нарушается способность клеток к лучепреломлению в поляризованном свете и люминесцентно-микроскопические свойства.
Эти явления используются для ранней диагностики метаболических и ишемических повреждений сердца. Гистологические признаки гибели клеток — сморщивание, набухание и разрушение клеточного ядра, исчезновение продольной и поперечной исчерченности, гомогенизирование саркоплазмы выявляют через 12 ч (рис. 2.1).
Рис. 2.1. Острый ИМ
Параллельно с деструктивными изменениями рабочих клеток миокарда происходит сосудистотканевая реакция, характеризующаяся спазмированием и паретической дилатацией интрамуральных артерий и артериол, плазматическим пропитыванием и повышением проницаемости их стенок, а также нарушением микроциркуляции с внутрисосудистой агрегацией эритроцитов, отеком интерстиция.
При развитии некроза кровоток в некротической зоне прекращается, а в периинфарктной увеличивается.
Наряду с диапедезными кровоизлияниями в ней происходит экстравазация лейкоцитов и формируется лейкоцитарный вал.
В толще некротической зоны вокруг сохранившихся сосудов иногда выявляют островки жизнеспособной ткани, по периферии которых отмечают такие же явления, как и в окружающей инфаркт зоне.
В течение первых 18–24 ч от начала патологического процесса миокард в бассейне пораженной артерии отличается бледностью на фоне подчеркнуто неравномерного кровенаполнения остальной ткани.
В конце 1-х суток участок некроза становится различимым макроскопически.
В связи с непрерывной деятельностью сердца, высокой активностью ферментов, выделяющихся из лейкоцитов, на 3-и–5-е сутки начинается размягчение (миомаляция) погибшей ткани. Постепенное рассасывание (резорбция) некротизированной массы осуществляется при активном участии микрофагальных клеток, которые появляются на 4-й день кнаружи от лейкоцитарного вала.
Фибропластическая реакция интерстиция также возникает на 4–5-е сутки, а первые волокнистые элементы новообразованной соединительной ткани в зоне инфаркта появляются еще через 3 сут.
В течение последующей недели зона некроза представлена распадающимися мышечными волокнами, пропитана отечной жидкостью и инфильтрирована распадающимися лейкоцитами. По ее периферии и вокруг периваскулярных островков сохранившегося миокарда происходит новообразование соединительной ткани.
Процесс организации продолжается 2–2,5 мес. В дальнейшем соединительная ткань, образовавшаяся на месте некротических масс, уплотняется, ее сосуды запустевают и облитерируются, на месте некроза образуется рубец (рис. 2.2).
Рис. 2.2. Постинфарктный кардиосклероз
Проводящая система сердца более устойчива к гипоксии по сравнению с рабочим миокардом и способна дольше сохраняться в зонах ишемии, что важно для восстановления ритмичной работы сердца после экстренной инвазивной антиишемической терапии.
В почках обычно развивается белый инфаркт с геморрагическим венчиком.
Вследствие хорошего развития сосудистых анастомозов и коллатералей инфаркт возникает только при нарушениях проходимости сосудов больше го калибра, чем дольковая артерия. Характерное расположение инфаркта — передняя латеральная поверхность органа, так как в этой зоне почечные артерии ветвятся не по магистральному, а по рассеянному типу, при котором межсосудистые коллатерали выражены значительно слабее.
https://www.youtube.com/watch?v=LjxdK1et49c
Источник
