Пенумбра при ишемическом инсульте
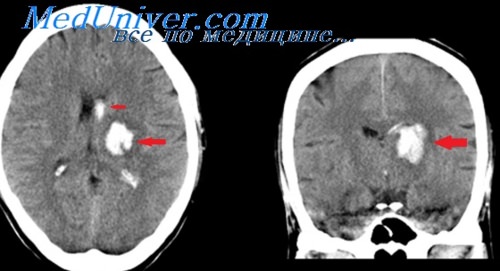
Пороги ишемии и пенумбра. Ишемический отек мозга
Пороги ишемии. Локальная или тотальная ишемия приводит к недостатку кислорода и глюкозы. Когда мозговая перфузия опускается ниже функционального порога (18—22 мл/1 00 г мозговой ткани в минуту), перестают регистрироваться вызванные потенциалы, а ЭЭГ становится плоской. Если перфузия вновь восстанавливается, функция мозга нормализуется (как по электрофизиологическим, так и по клиническим данным).
Если же перфузия опускается еще ниже и становится менее 8—1 0 мл/1 00 г мозговой ткани в минуту, наступает необратимое повреждение мозга; этот уровень называют порогом инфаркта.
Выраженность морфологических нарушений зависит не только от пороговых показателей кровотока, но и от продолжительности воздействия ишемии. Если перфузия поддерживается на уровне ниже функционал ьного порога достаточно длительное время, происходит гибель отдельных нейронов. Особенно чувствительны к ишемии, например, нейроны гиппокампа.
Ишемическая пенумбра. Зона головною мозга, показатели перфузии в которой находятся в промежутке между функциональным порогом и порогом инфаркта, называется «пенумбра». Как правило, инфаркт головного мозга с необратимо поврежденной мозговой тканью окружен такой зоной. Судьба вещества мозга в этой зоне зависит от времени и степени восстановления кровотока.

Состояние пенумбры можно исследовать с помошью методов функциональной нейровизуализации, например ПЭТ (позитронной эмиссионной томографии). Перфузнойная МРТ оценивает объем ткани мозга с пониженным кровотоком, а Диффузионная МРТ -ткани с необратимыми изменениями. Разница между этими двумя объемами (ткань мозга с нарушенной перфузией минус ткань мозга с патологической диффузией) позволяет приблизительно оценить размеры пенумбры и, соответственно, теоретически определить размеры участка мозга, который можно «спасти» с помощью терапии.
После наступления ишемии в качестве одного из основных ее осложнений развивается отек мозга. В соответствии с осмотическими закономерностями макромолекулы и электролиты, перемещаясь из внеклеточного пространства внугрь клетки, влекут за собой воду, которая из-за нарушения функции натрий-калиевого насоса не может быть транспортирована обратно.
Поэтому развивается клеточный (цитотоксичеекий) отек мозга, который можно выявить на диффузионно-взвешенных МРТ-изображениях. Если ишемия сохраняется длительное время и нарушается гематоэнцефапичсский барьер, составные части плазмы и с ними осмотически активные вещества начинают проникать во внеклеточное пространство, в связи с этим во внеклеточном пространстве также увеличивается содержание воды (вазогенный отек мозга). Позднее, при присоединении вазогенного компонента отека, свободная вода распространяется в белом веществе вдоль пучков нервных волокон.
В результате зона отека приобретает «пальце видные контуры», как в случае пазогенною отека мозга при опухолях. Выраженный are к может оказывать масс-эффект, приводя к локальному или диффузному повышению внутричерепного давления. Это может приводить к ухудшению перфузии пенумбры, расширению зоны инфаркта, и в конечном итоге к транстенториальному вклинению сверху вниз или снизу вверх (соответственно при супра- и инфратенториальных инфарктах).
– Также рекомендуем “Основы анатомии мозговых сосудов. Вертебрально-базилярная система”
Оглавление темы “Сосудистая патология головного мозга”:
1. Компьютерная томография при цереброваскулярных заболеваниях. Внутривенное контрастирование при КТ
2. Магнитно-резонансная томография. Методика МРТ головного мозга
3. Влияние кровотока на МРТ головного мозга. Перфузионная и диффузионная МРТ
4. Функциональная МРТ головного мозга. Показания к КТ и МРТ головного мозга
5. Ультразвуковое исследование мозговых сосудов. Допплеросонография
6. Цветная дуплексная ультрасонография. Техника дуплексной ультрасонографии
7. Эхокардиография. Ишемический инсульт
8. Пороги ишемии и пенумбра. Ишемический отек мозга
9. Основы анатомии мозговых сосудов. Вертебрально-базилярная система
10. Интра- и экстракраниальное коллатеральное кровообращение. Типы инсультов головного мозга
Источник
Мультимодальная визуализация головного мозга и сосудов в острейшем периоде ишемического инсульта, пожалуй, является “матерью всех споров” в современную эпоху борьбы с инсультом. Противоположные взгляды на этот вопрос достаточно устойчивы, и сторонники этих концепций зачастую ловко их защищают, как в случае с доктором P.D. Lyden и доктором M.W. Parsons. Давайте выделим следующие факты: (1) для ткани мозга критическим показателем является время — каждая минута на счету, (2) значение ишемической пенумбры как потенциально жизнеспособной ткани в случае своевременной и успешной реперфузии не подлежит сомнению. Теперь обратимся к следующим вопросам относительно потенциальной пользы (или ее отсутствия) получения дополнительных данных по результатам диффузионно-взвешенной МРТ, перфузионной МРТ или КТ, или КТ-ангиографии, МР-ангиографии или транскраниальной допплерографии.
Существуют ли дополнительные преимущества определения анатомии сосудов у пациента с инсультом, поступившего в течение установленного периода времени от момента появления симптомов, пригодного для введения тканевого активатора плазминогена (ТАП)? Безусловно, знание характера и локализации поражения сосудов до начала лечения полезно. Однако вряд ли оно окажет влияние на тактику ведения пациента в течение первых 3–4,5 часов от начала инсульта, независимо от локализации окклюзии артерии, поскольку не существует доказательств, свидетельствующих об эффективности эндоваскулярных вмешательств в качестве терапии первой линии в течение этого временнoго окна, особенно если учесть время, необходимое для получения результатов ангиографии даже в самых передовых центрах лечения больных инсультом [1]. Однако что делать, если при визуализации сосудов не выявляют окклюзии артерий? Необходимо ли начинать системный тромболизис? Доктор M.W. Parsons и другие эксперты утверждают, что эмболию дистальных отделов артерий трудно обнаружить при проведении визуализации сосудов и в этой ситуации более чувствительным методом является визуализация перфузии. Исходы заболевания у пациентов с “отрицательными” результатами визуализации сосудов, которым проводили системный тромболизис, были изучены недостаточно и в течение длительного времени зреет необходимость вдумчивого изучения этого вопроса. Итак, мы согласны с доктором P.D. Lyden, утверждающим, что пациентам с инсультом, поступившим в течение указанного временнoго окна и соответствующим всем критериям для проведения тромболизиса, необходимо без промедления внутривенно вводить ТАП, и что визуализацию сосудов необходимо выполнять только после начала проведения системного тромболизиса с целью определения характера и локализации окклюзии артерии, поскольку это может служить основанием для зачисления в текущие исследования вспомогательного системного тромболизиса и эндоваскулярных вмешательств.
А что насчет визуализации пенумбры и “несоответствия”? Перфузионная визуализация позволяет оценить ткань пенумбры на основе концепции “несоответствия”, хотя необходимо решить много вопросов, касающихся точности различных методов визуализации и пороговых значений, и провести стандартизацию оценочных показателей. Выявление “несоответствия” может быть потенциально полезным в 3 случаях: (1) удлинение временнoго интервала для лечения пациентов, которым в соответствии с современными стандартами проведение тромболитической терапии не показано; (2) рекомендация отказаться от проведения тромболизиса некоторым пациентам, поступающим в течение 3–4,5 часов в связи с его бесполезностью; (3) выявление кандидатов, не подходящих для проведения системного тромболизиса, которым показано проведение вспомогательных эндоваскулярных вмешательств. На сегодняшний день основное внимание было сфокусировано на использовании результатов перфузионной визуализации с целью продления срока начала реперфузионной терапии за пределы 3–4,5-часового временнoго окна, а доказательств, подтверждающих влияние проведения визуализации пенумбры на улучшение исходов после инсульта попросту нет. Использование “несоответствия” в качестве визуализационного критерия с целью улучшения отбора пациентов для проведения системного тромболизиса и других реперфузионных методов лечения, безусловно, рационально. Тем не менее ответ на лечение и клинические исходы являются сложными процессами, на которые оказывают влияние множество факторов, таких как размер и локализация инфаркта и пенумбры, состав тромба, исходная тяжесть инсульта, возраст, уровень содержания глюкозы в крови и т.д. Поэтому приравнивание простого наличия “несоответствия” к показанию либо ответу на проведение реперфузионной терапии не всегда целесообразно. Мы с нетерпением ждем результатов нескольких продолжающихся клинических испытаний, таких как Extending the Time for Thrombolysis in Emergency Neurological Deficits (EXTEND), MR and Recanalization of Stroke Clots Using Embolectomy (MRRESCUE), Desmoteplase in Acute Ischemic Stroke Trial-4 (DIAS-4) и Diffusion and Perfusion Imaging Evaluation for Understanding Stroke Evolution-2 (DEFUSE-2), чтобы определить, поможет ли визуализация пенумбры расширить временнoе окно за пределы 3–4,5 часов для проведения системного тромболизиса или другой реперфузионной терапии у пациентов с инсультом и привести к улучшению исходов заболевания. Опубликовано мало данных относительно использования концепции “несоответствия” в течение 3–4,5-часового окна. Перфузионная визуализация в течение этого времени может иметь потенциально важное клиническое значение. Данные испытаний DEFUSE и Echoplanar Imaging Thrombolytic Evaluation Trial (EPITHET), в которых изучали пациентов, поступивших в течение 3–6 часов от момента появления симптомов инсульта, показывают, что частота развития благоприятного исхода не зависит от статуса реперфузии у пациентов без “несоответствия”, подразумевая, что таким пациентам проводить реперфузионную терапию не следует. Тем не менее современные стандарты по лечению и страх перед судебно-медицинскими исками существенно ограничивают использование результатов перфузионной визуализации для индивидуализированного отбора пациентов на проведение тромболизиса в течение 3–4,5-часового временнoго окна. В настоящее время и до тех пор, пока рандомизированное клиническое испытание поддерживает использование перфузионной визуализации для эффективного отбора “хорошо” реагирующих на реперфузионную терапию пациентов, мы можем рекомендовать использование результатов перфузионной визуализации только в отдельных случаях у пациентов, которым в противном случае на основании существующих стандартов, проведение реперфузионной терапии не показано. Это относится к пациентам, поступившим спустя 3–4,5 часа от момента появления симптомов инсульта или с неизвестным временем начала инсульта. В течение 3–4,5-часового окна перфузионная визуализация может быть полезна в тех случаях, когда неизвестно, обусловлено ли развитие неврологического дефицита инсультом, судорожным припадком (паралич Тодда) [2] или метаболическими расстройствами, например гипогликемией, а также у пациентов, у которых после тщательного клинического обследования диагноз “инсульт” вызывает сомнения [3]. Кто-то может утверждать, что проведение системного тромболизиса “безопасно” при масках инсульта, мы согласны, но…разве это то, что нужно для практической медицины?
Мы пришли к выводу, что уравнительный подход к визуализации у пациентов с подозрением на инсульт в острейшем периоде неуместен. Некоторым пациентам вполне достаточно проведения бесконтрастной КТ для принятия соответствующего решения о ведении, с последующим использованием более современных методов визуализации головного мозга и сосудов с целью определения механизма развития инсульта, его патофизиологии и локализации. В других случаях для принятия обоснованного клинического решения может потребоваться проведение современных нейровизуализирующих исследований даже в течение первых 3–4,5 часа. Идейным лидерам необходимо отразить эти факты в будущих стандартах по лечению для улучшения качества оказания помощи при инсульте.
1. Alexandrov A.V., Schellinger P.D., Saqqur M., Barreto A., Demchuk A.M., Ribo M., et al. CLOTBUST and TUCSON Investigators. Reperfusion and outcomes in penumbra vs systemic tissue plasminogen activator clinical trials. Int J Stroke. 2011; 6:118–122.
2. Selim M., Kumar S., Fink J., Schlaug G., Caplan L.R., Linfante I. Seizure at stroke onset: should it be an absolute contraindication to thrombolysis? Cerebrovasc Dis. 2002;14:54–57.
3. Mehdiratta M., Selim M. Value of perfusion computed tomography in stroke mimics. Arch Neurol. 2007;64:1348–1349.
Источник
Ишемическая полутень (penumbra)

Ишемическая полутень, или пенумбра (лат. Penumbra — полутень вокруг солнечного пятна — umbra) — это зона вокруг инфаркта, в которой объ-емный мозговой кровоток снижен до уровня, достаточного лишь для поддержания жизнеспособности нейронов, но не их функционирования.
В области пенумбры у больного объемный мозговой кровотокснижен до 23—10 мл (при норме 58 мл) на 100 г вещества мозга в минуту. Установлено, что пенумбра не является стабильной, гомогенной и четко очерченной зоной. Ее состояние определяется уровнем церебральной перфузии, глутамата, активности Са-каналов и др.
В зоне ишемической полутени различают два типа эксайтотоксического повреждения нейронов: быстрое, опосредованное NMDA-рецепторами (рецепторы селективно активируются синтетическим аналогом глутамата N-метил-D-аспартатом), и медленное, опосредованное рецепторами АМРА (-амино-3-гидрокси-5-метил-4-изо-ксазолпропионовая кислота) и каината.
В зоне пенумбры нейроны могут погибать путем апоптоза, обусловленного разобщением транснейрональных связей.
Микроскопически в этой зоне обнаруживаются неизмененные нейроны, нейроны с явлениями хроматолиза и гиперхроматоза цитоплазмы, нейроны с признаками ишемических изменений, а также выпадения единичных или многих нейронов.
Киста мозга
Стенка кистообразной полости, которая наиболее часто форми-руется на месте инфаркта, образована аргирофильными, коллагеновыми и глиальными волокнами. В ней определяются новообразованные сосуды, макрофаги.
Вблизи от полости наблюдается изоморфный или гетероморфный глиоз, видны аксональные шары с петрификацией, склерозированные микрососуды. Если инфаркт был красным, то стенки кисты окрашиваются в бурый цвет в связи с накоплением макрофагов, нагруженных гемосидерином.
Сморщивание ткани мозга по границам инфаркта сопровождается расширением бокового желудочка на стороне поражения.
Геморрагические нарушения мозгового кровообращения
Оболочечные кровоизлияния могут быть эпидуральными, интрадуральными, субдуральными и субарахноидальными. Эпидуральные,интрадуральные, субдуральные кровоизлияния чаще всего возникают при черепно-мозговых травмах, субарахноидальные и субарахноидально-паренхиматозные кровоизлияния, как правило — при разрыве аневризм сосудов мозга или сосудистого порока развития.
Внутримозговые кровоизлияния занимают третье место по частоте развития среди всех форм нарушений мозгового кровообращения, после тромбоза и эмболии артерий мозга.
Среди заболеваний, приводящих к возникновению внутримозговых кровоизлияний, первое место занимают гипертоническая болезнь и вторичная артериальная гипертензия.
Внутримозговые кровоизлияния, обусловленные артериальной гипертензией, составляют 8% всех видов инсульта в Европе и 25% — в Японии.
Кроме того, внутримозговые кровизлияния встречаются при амилоидной ангиопатии, разрыве мешотчатых аневризм, сосудистой мальформации, реже при опухолях мозга, васкулитах, гемобластозах, сепсисе, энцефалитах, интоксикациях, антикоагулянтной и тромболитической терапии и др. Различают два типа внутримозговых кровоизлияний — кровоизлияния типа гематомы и типа геморрагического пропитывания.
Гематома мозга
Макроскопически гематома представляет собой полость, заполненную кровью. Кровь, изливаясь из артерии, отодвигает ткань мозга и замещает освободившееся про-странство. Ткань мозга разрушается, но в небольшом объеме по сравнению с объемом самой гематомы. Поэтому киста, формирующаяся при относительно благоприятном исходе поражения, имеет щелевидную форму.
Механизмы повреждения мозга при внутримозговых кровоизлияниях:
– Прямая первичная механическая травма ткани мозга вышедшими за пределы сосуда элементами крови;
– Увеличение внутричерепного давления;
– Вторичное грыжевое выпячивание мозга как осложнение объемного расширяющегося внутричерепного образования.
Морфологическое исследование гематомы и окружающей ткани мозга :
1—12 ч от начала кровоизлияния — период, в течение которого отмечается увеличение объема излившейся крови;
1-е сутки — в ткани мозга, окружающей гематому, обнаружи- ваются выраженный отек, полнокровие, стаз и микротромбы в капиллярах, некроз стенок микрососудов, периваскулярные кровоизлияния, лейкостаз и лейкопедез, ишемические изменения нейронов;
3-и сутки — вокруг гематомы выявляется большое число глиальных макрофагов и зернистых шаров, сидерофагов, валлеровская дегенерация нервных волокон, набухание и деструкция миелина;
2—4-е сутки — начало формирования глиомезодермального рубца — ”капсулы” гематомы;
4 нед — минимальный период, необходимый для организации гематомы и формирования апоплексической кисты.
| Просмотров 2451 | Эта страница нарушает авторские права |
Источник: https://allrefrs.ru/5-1134.html
Загадка пенумбры и визуализация при остром инсульте

Мультимодальная визуализация головного мозга и сосудов в острейшем периоде ишемического инсульта, пожалуй, является “матерью всех споров” в современную эпоху борьбы с инсультом.
Противоположные взгляды на этот вопрос достаточно устойчивы, и сторонники этих концепций зачастую ловко их защищают, как в случае с доктором P.D. Lyden и доктором M.W. Parsons.
Давайте выделим следующие факты: (1) для ткани мозга критическим показателем является время — каждая минута на счету, (2) значение ишемической пенумбры как потенциально жизнеспособной ткани в случае своевременной и успешной реперфузии не подлежит сомнению.
Теперь обратимся к следующим вопросам относительно потенциальной пользы (или ее отсутствия) получения дополнительных данных по результатам диффузионно-взвешенной МРТ, перфузионной МРТ или КТ, или КТ-ангиографии, МР-ангиографии или транскраниальной допплерографии.
Существуют ли дополнительные преимущества определения анатомии сосудов у пациента с инсультом, поступившего в течение установленного периода времени от момента появления симптомов, пригодного для введения тканевого активатора плазминогена (ТАП)? Безусловно, знание характера и локализации поражения сосудов до начала лечения полезно.
Однако вряд ли оно окажет влияние на тактику ведения пациента в течение первых 3–4,5 часов от начала инсульта, независимо от локализации окклюзии артерии, поскольку не существует доказательств, свидетельствующих об эффективности эндоваскулярных вмешательств в качестве терапии первой линии в течение этого временнoго окна, особенно если учесть время, необходимое для получения результатов ангиографии даже в самых передовых центрах лечения больных инсультом [1]. Однако что делать, если при визуализации сосудов не выявляют окклюзии артерий? Необходимо ли начинать системный тромболизис? Доктор M.W. Parsons и другие эксперты утверждают, что эмболию дистальных отделов артерий трудно обнаружить при проведении визуализации сосудов и в этой ситуации более чувствительным методом является визуализация перфузии. Исходы заболевания у пациентов с “отрицательными” результатами визуализации сосудов, которым проводили системный тромболизис, были изучены недостаточно и в течение длительного времени зреет необходимость вдумчивого изучения этого вопроса. Итак, мы согласны с доктором P.D. Lyden, утверждающим, что пациентам с инсультом, поступившим в течение указанного временнoго окна и соответствующим всем критериям для проведения тромболизиса, необходимо без промедления внутривенно вводить ТАП, и что визуализацию сосудов необходимо выполнять только после начала проведения системного тромболизиса с целью определения характера и локализации окклюзии артерии, поскольку это может служить основанием для зачисления в текущие исследования вспомогательного системного тромболизиса и эндоваскулярных вмешательств.
А что насчет визуализации пенумбры и “несоответствия”? Перфузионная визуализация позволяет оценить ткань пенумбры на основе концепции “несоответствия”, хотя необходимо решить много вопросов, касающихся точности различных методов визуализации и пороговых значений, и провести стандартизацию оценочных показателей.
Выявление “несоответствия” может быть потенциально полезным в 3 случаях: (1) удлинение временнoго интервала для лечения пациентов, которым в соответствии с современными стандартами проведение тромболитической терапии не показано; (2) рекомендация отказаться от проведения тромболизиса некоторым пациентам, поступающим в течение 3–4,5 часов в связи с его бесполезностью; (3) выявление кандидатов, не подходящих для проведения системного тромболизиса, которым показано проведение вспомогательных эндоваскулярных вмешательств. На сегодняшний день основное внимание было сфокусировано на использовании результатов перфузионной визуализации с целью продления срока начала реперфузионной терапии за пределы 3–4,5-часового временнoго окна, а доказательств, подтверждающих влияние проведения визуализации пенумбры на улучшение исходов после инсульта попросту нет. Использование “несоответствия” в качестве визуализационного критерия с целью улучшения отбора пациентов для проведения системного тромболизиса и других реперфузионных методов лечения, безусловно, рационально. Тем не менее ответ на лечение и клинические исходы являются сложными процессами, на которые оказывают влияние множество факторов, таких как размер и локализация инфаркта и пенумбры, состав тромба, исходная тяжесть инсульта, возраст, уровень содержания глюкозы в крови и т.д. Поэтому приравнивание простого наличия “несоответствия” к показанию либо ответу на проведение реперфузионной терапии не всегда целесообразно. Мы с нетерпением ждем результатов нескольких продолжающихся клинических испытаний, таких как Extending the Time for Thrombolysis in Emergency Neurological Deficits (EXTEND), MR and Recanalization of Stroke Clots Using Embolectomy (MRRESCUE), Desmoteplase in Acute Ischemic Stroke Trial-4 (DIAS-4) и Diffusion and Perfusion Imaging Evaluation for Understanding Stroke Evolution-2 (DEFUSE-2), чтобы определить, поможет ли визуализация пенумбры расширить временнoе окно за пределы 3–4,5 часов для проведения системного тромболизиса или другой реперфузионной терапии у пациентов с инсультом и привести к улучшению исходов заболевания. мало данных относительно использования концепции “несоответствия” в течение 3–4,5-часового окна. Перфузионная визуализация в течение этого времени может иметь потенциально важное клиническое значение. Данные испытаний DEFUSE и Echoplanar Imaging Thrombolytic Evaluation Trial (EPITHET), в которых изучали пациентов, поступивших в течение 3–6 часов от момента появления симптомов инсульта, показывают, что частота развития благоприятного исхода не зависит от статуса реперфузии у пациентов без “несоответствия”, подразумевая, что таким пациентам проводить реперфузионную терапию не следует. Тем не менее современные стандарты по лечению и страх перед судебно-медицинскими исками существенно ограничивают использование результатов перфузионной визуализации для индивидуализированного отбора пациентов на проведение тромболизиса в течение 3–4,5-часового временнoго окна. В настоящее время и до тех пор, пока рандомизированное клиническое испытание поддерживает использование перфузионной визуализации для эффективного отбора “хорошо” реагирующих на реперфузионную терапию пациентов, мы можем рекомендовать использование результатов перфузионной визуализации только в отдельных случаях у пациентов, которым в противном случае на основании существующих стандартов, проведение реперфузионной терапии не показано. Это относится к пациентам, поступившим спустя 3–4,5 часа от момента появления симптомов инсульта или с неизвестным временем начала инсульта. В течение 3–4,5-часового окна перфузионная визуализация может быть полезна в тех случаях, когда неизвестно, обусловлено ли развитие неврологического дефицита инсультом, судорожным припадком (паралич Тодда) [2] или метаболическими расстройствами, например гипогликемией, а также у пациентов, у которых после тщательного клинического обследования диагноз “инсульт” вызывает сомнения [3]. Кто-то может утверждать, что проведение системного тромболизиса “безопасно” при масках инсульта, мы согласны, но…разве это то, что нужно для практической медицины?
Мы пришли к выводу, что уравнительный подход к визуализации у пациентов с подозрением на инсульт в острейшем периоде неуместен.
Некоторым пациентам вполне достаточно проведения бесконтрастной КТ для принятия соответствующего решения о ведении, с последующим использованием более современных методов визуализации головного мозга и сосудов с целью определения механизма развития инсульта, его патофизиологии и локализации.
В других случаях для принятия обоснованного клинического решения может потребоваться проведение современных нейровизуализирующих исследований даже в течение первых 3–4,5 часа. Идейным лидерам необходимо отразить эти факты в будущих стандартах по лечению для улучшения качества оказания помощи при инсульте.
1. Alexandrov A.V., Schellinger P.D., Saqqur M., Barreto A., Demchuk A.M., Ribo M., et al. CLOTBUST and TUCSON Investigators. Reperfusion and outcomes in penumbra vs systemic tissue plasminogen activator clinical trials. Int J Stroke. 2011; 6:118–122.2. Selim M., Kumar S., Fink J., Schlaug G., Caplan L.R., Linfante I. Seizure at stroke onset: should it be an absolute contraindication to thrombolysis? Cerebrovasc Dis. 2002;14:54–57.
3. Mehdiratta M., Selim M. Value of perfusion computed tomography in stroke mimics. Arch Neurol. 2007;64:1348–1349.
Источник: https://lib.medvestnik.ru/articles/Zagadka-penumbry-i-vizualizaciya-pri-ostrom-insulte.html
Источник
