Патогенез инфаркта миокарда при стрессе

Социальные факторы инфаркта миокарда. Стресс и депрессия как причина инфаркта миокардаВместо психологического типа поведения А (энергичные, амбициозные, “сгорающие” на работе люди) теперь всё больше говорят о депрессии. Разумеется, психиатрам, психологам и кардиологам предстоит ещё немало потрудиться, чтобы определить значение различных вариантов эмоциональных расстройств в развитии ИБС, инфаркта миокарда, осложнений постинфарктного периода. Коснёмся роли психосоциального стресса как фактора риска сердечно-сосудистой патологии. Теоретическая основа для этого была заложена около тысячи лет назад великим Ибн Синой. Свои взгляды о решающей роли покоя и душевного равновесия в сохранении здоровья и выздоровлении он подкрепил классическим экспериментом с двумя баранами, которых держал на одинаковой диете. Второй баран, у которого не было подобного соседства, продолжал здравствовать ещё долгое время…
Заметим, что данное исследование проводилось в благополучной Западной Германии ещё до объединения страны. Вот так сжато и метко описали патогенез инфаркта миокарда В. П. Образцов и Н. Д. Стражеско. Со временем это фундаментальное открытие обросло подробностями, но не изменилось по сути: в основе развития инфаркта миокарда лежит тромбоз венечной артерии. Факторы риска ИБС и патогенетические основы развития инфаркта миокарда были достаточно подробно рассмотрены в пособии “Диагностика и лечение дислипидемий” (В. А. Крыжановский, 1995). Вкратце напомним основные положения. Как отмечают Е. Falk, P. К. Shah, V. Fuster (1995), конкретные пусковые механизмы развития инфаркта миокарда требуют дальнейшего изучения. – Также рекомендуем “Патогенез инфаркта миокарда. Механизмы развития инфаркта миокарда” Оглавление темы “Причины и диагностика инфаркта миокарда”: |
Источник
Патогенез инфаркта миокарда. Механизм развития инфаркта миокарда.Как правило, без атеросклероза коронарных артерий нет и инфаркта миокарда. Адекватность коронарного кровообращения метаболическим запросам миокарда определяется тремя основными факторами: величиной коронарного кровотока, составом артериальной крови и потребностью миокарда в кислороде. Для образования тромба в коронарной артерии обычно необходимы тоже три фактора: патологические изменения в ее интиме вследствие атеросклероза, активация в системе тромбообразования (рост коагуляции, агрегации тромбоцитов и эритроцитов, наличие сладж-феномена в МЦК, снижение фибринолиза) и пусковой фактор, способствующий взаимодействию двух первых (например, спазм артерии). Атеросклероз коронарных артерий прогрессирует с годами и суживает их просвет, порождая атеросклеротические бляшки. Затем вследствие действия факторов, способствующих разрыву (рост напряжения по всей окружности бляшки, ухудшение реологических свойств крови, большое количество воспалительных клеток, инфекция), нарушается целостность бляшки: обнажается ее липидное ядро, эрозируется эндотелий и обнажаются коллагеновые волокна. К дефекту прилипают активированные тромбоциты и эритроциты, чем запускается каскад свертывания и формирование тромбоцитарных пробок с последующим наслоением фибрина Возникает резкое сужение просвета коронарной артерии, вплоть до ее полной окклюзии Обычно от формирования тромбоцитарного тромба до тромботической окклюзии коронарной артерии проходит 2—6 дней, что клинически соответствует периоду нестабильной стенокардии. Хроническая тотальная закупорка коронарной артерии не всегда связана с последующим развитием ИМ От коллатерального кровотока, как и от других факторов (например, от уровня метаболизма миокарда, размеров и локализации зоны его поражения, снабжавшейся закупоренной артерией, скорости развития коронарной обструкции), зависит жизнеспособность клеток миокарда Коллатеральное кровообращение обычно хорошо развито у больных с тяжелой Ст (сужением просвета более чем на 75% в одной или нескольких коронарных артериях), выраженной гипоксией (тяжелые анемия, ХОБЛ и врожденные «синие» пороки) и ГЛЖ Наличие тяжелого стеноза коронарной артерии (более 90%) с регулярно повторяющимися периодами ее полной окклюзии позволяет существенно ускорить развитие коллатералей. Частота развития коронарных коллатералей через 1—2 недели после инфаркта миокарда варьирует, достигая 75-100% у больных с персистирующей окклюзией коронарных артерий и только 20—40% у пациентов с субтотальной окклюзией В случаях 1, 2, отмеченных на рисунке, инфаркт миокарда обычно не развивается вследствие доставки крови из соседней коронарной или другой артерии, а формируется в случае 3 (когда спазмирована дополнительно питающая миокард артерия) или 4 (ее просто нет) На фоне существенного сужения коронарной артерии разрыв атеросклеротической бляшки, приводящий к ИМ, происходит под действием триггеров, например ФН или стресса. Стресс (эмоциональный или физический) стимулирует выброс катехоламинов (они оказывают гистотоксический эффект) и повышает потребление кислорода миокардом. Сердце — это важная рефлексогенная зона. Негативный психоэмоциональный стресс (смерть близких, их тяжелая болезнь, выяснение отношений с начальством и др ) часто является «спичкой, дающей факел» – ИМ Инфаркт миокарда может спровоцировать и чрезмерная ФН (например, марафон, статический подъем больших тяжестей) даже у молодых лиц. Развитие инфаркта миокарда после острой окклюзии коронарной артерии. – Также рекомендуем “Банкетный инфаркт миокарда. Морфология инфаркта миокарда.” Оглавление темы “Инфаркт миокарда.”: |
Источник
Патогенез инфаркта миокарда. Механизмы развития инфаркта миокардаРассмотрим последовательно три составные части патогенеза инфаркта миокарда, а также связь между патогенезом и клиникой. Наиболее характерное проявление атеросклероза — это фиброзная атеросклеротическая бляшка, т. е. фиброатерома. Её “внешние черты” определяются двумя факторами (М. J. Davies, N. Woolf, 1991): а) соотношением липидного и соединительнотканного компонентов; Не существует какого-то типового “чертежа” атеросклеротической бляшки. От строения бляшки зависит клиническое течение заболевания (развитие осложнений). Именно разрыв таких поражений часто приводит у сорокалетних мужчин к тромбозу коронарной артерии с дальнейшим развитием обширного инфаркта (аневризмы сердца) или к внезапной смерти. Как отмечают М. J. Davies (1990); R. Т. Lee, P. Libby (1997), два варианта нарушения целостности бляшки могут приводить к тромбозу венечной артерии:
Разрыв атеросклеротической бляшки с полным или частичным тромбозом коронарной артерии — наиболее частая причина развития коронарных катастроф: нестабильной стенокардии, инфаркта миокарда, внезапной смерти (V. Fuster et al., 1992). Образование необтурирующих или кратковременно закупоривающих коронарную артерию тромбов обусловливает такие клинические проявления ИБС, как нестабильная стенокардия (с болями в состоянии покоя) и мелкоочаговый инфаркт миокарда. Обтурирующий (на протяжении длительного времени) тромбоз — патогенетическая основа крупноочагового (трансмурального) инфаркта миокарда (R. L. Ridolfi, G. M. Hutchins, 1977). Формирование вследствие разрыва бляшки как обтурирующего, так и не обтурирующего тромба может приводить к внезапной смерти. Кроме того, выброс в кровоток атероматозного содержимого расположенной в аорте бляшки может вызвать эмболию артерий мозга и других органов. Это объясняется хорошим развитием коллатеральных сосудов при длительно существующих стенозирующих бляшках (в ответ на часто возникающую ишемию миокарда — приступы стенокардии). Чем же отличаются на микроскопическом уровне “уязвимые” бляшки, которые, разорвавшись, могут вызвать острую коронарную недостаточность, от стабильных? “Уязвимые” бляшки: – “эксцентричны”, т. е. занимают лишь часть окружности артерии; – богаты липидами (липидное ядро занимает > 50 % их общего объёма); Уточним, что клетки воспаления (макрофаги, Т-лимфоциты), концентрация которых повышена в нестабильной бляшке, продуцируют различные цитокины, в частности интерлейкин 6 (interleukin 6, сокращённо IL6), которые могут активировать гладкомышечные клетки (S. Kinlay, P. Ganz, 1997). Программированная гибель (апоптоз) гладкомышечных клеток в оболочке бляшки, причины развития которой сейчас только изучаются, также может повышать вероятность разрыва бляшки (R. Т. Lee, P. Libby, 1997). – Также рекомендуем “Нестабильная атеросклеротическая бляшка. Диагностика нестабильной бляшки” Оглавление темы “Причины и диагностика инфаркта миокарда”: |
Источник
Определение
Сердце человека – орган, который работает непрерывно от первого вздоха до последнего, без выходных и отпусков. Мышца сердца, миокард, обеспечивает насосную функцию, сокращается каждую секунду и нуждается в активном кровообращении. Венечные (или коронарные) артерии обеспечивают питанием и кислородом самую трудолюбивую мышцу нашего тела.
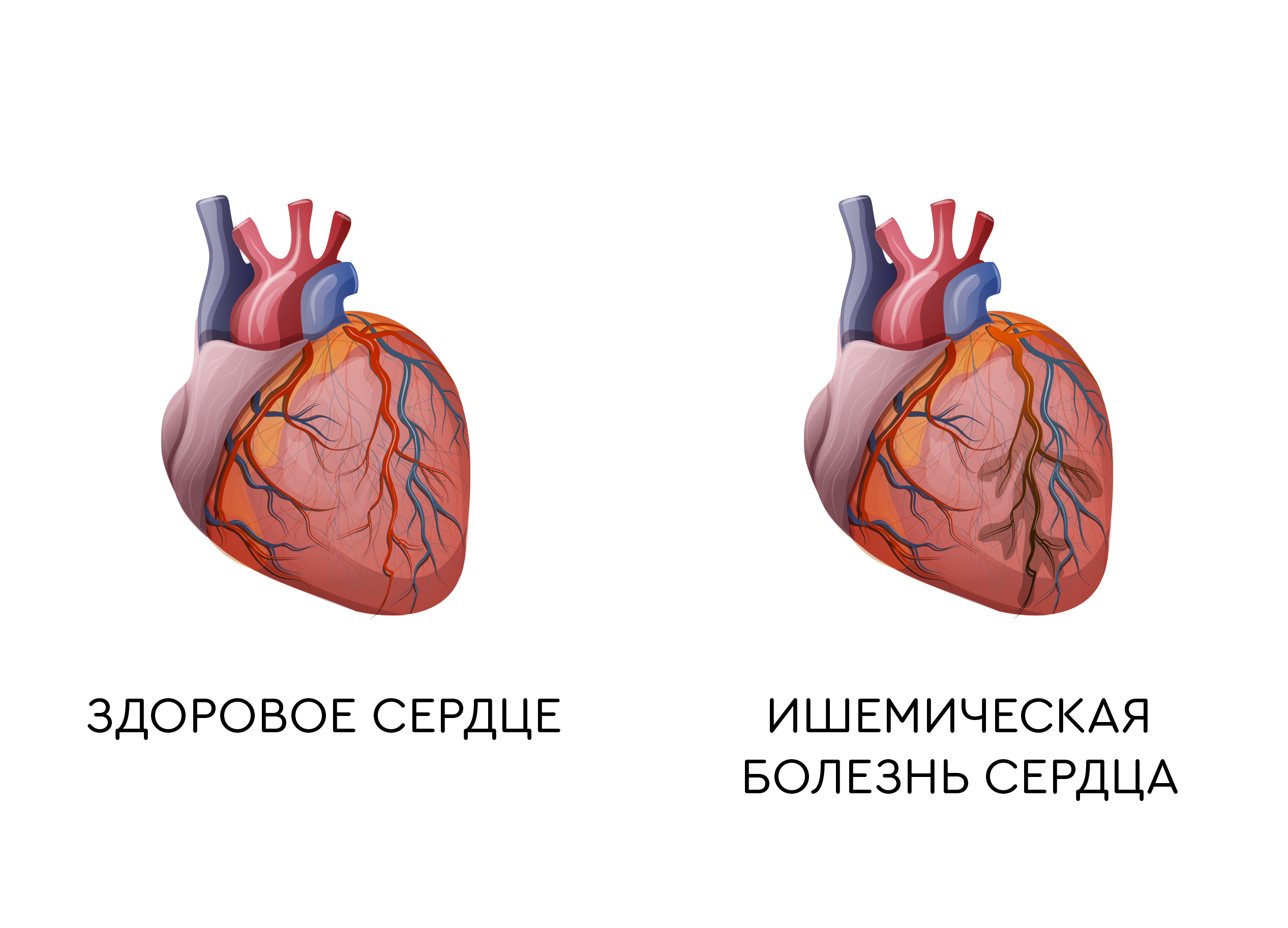
Если в одной или нескольких коронарных артериях возникает затруднение тока крови из-за атеросклеротических наложений, сужения сосуда – снижается кровоснабжение миокарда, возникает боль. Такая боль называется ишемической и болезнь – ишемической болезнью сердца.
Ишемия, в переводе с греческого – местное малокровие, обескровливание, что объясняет основную природу заболевания.
Инфаркт миокарда (ИМ) – сердечно-сосудистая катастрофа, сердечный приступ: это гибель участка миокарда из-за затянувшегося эпизода ишемии.
Причины инфаркта
В подавляющем числе случаев причиной инфаркта является атеросклероз – образование атеросклеротической бляшки на стенке сосуда, сужающей ее просвет.
Этот процесс хронический и бляшка «растет» постепенно. Как правило, такая постепенность дает организму возможность подготовиться – развиваются коллатеральные, обходные, пути кровотока и даже тотальное перекрытие магистральной артерии не ведет к полному обескровливанию и развитию инфаркта.
Но, если по какой-то причине, бляшка стала нестабильной, нарушилась целостность ее «покрышки» – запускается неудержимый каскад тромбоза. И тогда даже небольшая по размеру бляшка может стать причиной инфаркта миокарда. Клетки крови макрофаги, тромбоциты стремятся закрыть дефект, активируется свертывающая система крови, образуется фибриновый сгусток и тромб, полностью перекрывающий просвет артерии. Сердечная мышца очень чувствительна к гипоксии. Через 30 минут начинается гибель клеток, а через 90-100 минут участок миокарда, лишенный кровотока, необратимо погибает полностью.
Иногда кровоток восстанавливается самостоятельно – собственная противосвертывающая система справляется с тромбом и инфаркт не случается. От 4-х до 27% сердечных приступов заканчиваются подобным образом.
Тромбоз является причиной инфаркта в 9 из 10 случаев. Другие причины – эмболия (перекрытие просвета коронарной артерии не тромбом, а фрагментом той же кальцинированной бляшки или измененного сердечного клапана), спазм, кровоизлияние в бляшку, отслойка внутренней стенки артерии. Они встречаются гораздо реже.
Факторы риска
Факторами риска атеросклероза и инфаркта миокарда являются:
Дислипидемия: повышение уровня общего холестерина и липопротеидов низкой плотности крови – основа формирования атеросклеротической бляшки
Табакокурение: повреждение эндотелия сосудов, хроническая гипоксия из-за воздействия угарного газа, прямое сосудосуживающее действие никотина – не полный перечень влияния курения на сосуды и сердце
Сахарный диабет: нарушена микроциркуляция, поддерживается состояние хронического воспаления
Артериальная гипертония: повышает нагрузку на сердечную мышцу.
Абдоминальное ожирение: способствует нарушениям обмена липидов и глюкозы, повышению АД, увеличению потребности в кровоснабжении.
Низкая физическая активность: снижение тренированности, уменьшение массы мускулатуры, возможностей адаптации организма к изменениям.
Нездоровое питание, злоупотребление алкоголем
Психоэмоциональные причины: стресс, депрессия.
Симптомы, клиника
Типичным симптомом ишемического поражения миокарда является боль в груди. Чаще она сжимающего, давящего характера, локализуется за грудиной. Характерна иррадиация (распространение) в левую руку, плечо, под лопатку. Боль длительная, может быть волнообразной.
Характерны также холодный «липкий» пот, бледность кожи, одышка.
Тревожность, чувство страха, беспокойство, резкая усталость – часто сопровождают инфаркт.
Такая классическая картина сопровождает инфаркт далеко не всегда.
Описаны нетипичные варианты клиники ИМ. Часто они встречаются среди женщин, пожилых людей, при повторных инфарктах, сахарном диабете.
Астматический – ведущий симптом одышка, вплоть до удушья. Обычно при обширном поражении сердца и развитии недостаточности левого желудочка у пожилых пациентов и при повторном инфаркте;
Аритмический – болевой синдром выражен незначительно, беспокоят сердцебиение, «провалы» в биении сердца, слабость;
Абдоминальный – боль в животе, тошнота и рвота, часто при нижней локализации инфаркта миокарда;
Церебральный – с преобладанием признаков поражения мозга, головокружения. Снижение сократительной способности, замедление ритма могут привести к снижению мозгового кровообращения, особенно у пациентов с исходными нарушениями церебрального кровотока;
Бессимптомный или малосимптомный – нет типичных признаков, боль не интенсивная или совсем отсутствует. Заболевание диагностируется postfaсtum по изменениям ЭКГ. Такой вариант течения заболевания характерен для пациентов сахарным диабетом, пожилых и женщин;
С нетипичной локализацией боли – в правой руке, нижних конечностях, спине.
Диагностика
Диагноз ИМ устанавливается на основании совокупности клинической картины (симптомы) и данных ЭКГ (запись электрической активности сердечной мышцы). Для принятия решения о неотложности лечения часто этого достаточно.
В дальнейшем, для подтверждения диагноза, определения прогноза необходимы лабораторные тесты и более сложные инструментальные исследования.
Изменения ЭКГ при инфаркте миокарда зависят от локализации очага поражения, его объема и глубины. Эти изменения динамичны, проходят определенные стадии.
В типичном случае в острейшем периоде ИМ регистрируется подъем сегмента ST (как минимум, в 2-х смежных отведениях), затем формируется зубец Q(или QS) и характерная динамика з. Т в подострой стадии.
Трудно оценить инфарктную динамику ЭКГ при наличии кардиостимулятора, нарушений проводимости по типу полной блокады ножек пучка Гиса, синдрома Вольфа-Перкинсона-Уайта и здесь необходимы лабораторные тесты повреждения миокарда.
К ним относятся определение сердечных тропонинов (T и I, высокочувствительный), креатинфосфокиназы. Первые маркеры (тропонины) появляются уже через 2-3 часа от начала гибели кардиомиоцитов и позволяют поставить точный диагноз и начать лечение, спасающее жизнь. Экспресс-анализ на тропонин возможно выполнить уже бригадой скорой помощи.
Как и ЭКГ, уровень лабораторных показателей меняется в динамике, достигая максимальных значений к концу вторых суток и приходя к норме через 10-14 дней. Кроме тропонинов и КФК в общем анализе крови может быть умеренный лейкоцитоз (максимально до 15х109/л) в течение первой недели заболевания, а затем ускорение СОЭ, сохраняющееся до нескольких недель. Эти изменения часто сопровождают умеренную лихорадку (до 380С) из-за системного воспаления в ответ на попадание в кровоток продуктов некроза миокарда.
Классификация, стадии инфаркта миокарда
Временные фазы-периоды:
1. Острейший – первые 2 часа после начала болевого синдрома;
2. Острый – до 10 дней от начала заболевания;
3. Подострый – от 2-х недель до 1,5 месяцев;
4. Стадия рубцевания – от 1,5 до 6 месяцев;
5. Стадия исходов, постинфарктный кардиосклероз – через 6 месяцев от момента инфаркта;
В зависимости от размера очага некроза: крупноочаговый, мелкоочаговый.
В зависимости от глубины распространения некроза: субэпикардиальный, субэндокардиальный,интрамуральный, трансмуральный
Наличие осложнений: осложненный, неосложненный.
В зависимости от локализации очага: передней, боковой, задней, нижней стенки левого желудочка, межжелудочковой перегородки, верхушки сердца, правого желудочка, предсердий или комбинированные варианты.
По наличию в прошлом ИМ: первый, повторный (после 28 суток от предыдущего инфаркта), рецидив (в течение 28 суток от инфаркта).
Первая помощь, лечение
Ухудшение самочувствия при инфаркте миокарда, как правило, внезапное и выраженное, сопровождается тревогой, страхом, беспокойством.
Первое, что нужно сделать – прекратить выполняемую нагрузку, по возможности сесть или прилечь. Обеспечить доступ свежего воздуха – открыть окно, расстегнуть верхние пуговицы рубашки, ослабить ремень, галстук.
Если у человека ранее были проблемы с сердцем, он может иметь при себе соответствующее лекарство – нитроглицерин. При появлении боли нужно принять до 3-х таблеток нитроглицерина с интервалом 5 минут (если в ответ на первую таблетку избыточно не снизилось АД, не появилось сильное головокружение).
Также рекомендовано принять ½ таблетки аспирина (250мг). Неэффективность нитроглицерина и прекращения нагрузки характерна для ИМ, в отличие от стенокардии напряжения. Поэтому очень важно как можно скорее вызвать скорую медицинскую помощь и четко объяснить диспетчеру 03, что ситуация неотложная и вероятен инфаркт миокарда.
От своевременности оказания помощи напрямую зависит не только объем поражения сердца, риск развития осложнений, но и возможность пережить инфаркт миокарда. Если в течение 60 минут пациент будет доставлен в стационар для проведения лечения, его шансы выжить и не стать инвалидом значительно возрастают.
Смертность от инфаркта миокарда достигает 20% и 80-90%смертей происходит из-за позднего начала лечения.
Врачи бригады скорой помощи регистрируют ЭКГ, которая в большинстве случаев определяет диагноз и дальнейшую тактику. Если есть данные за инфаркт миокарда – лечение начинается незамедлительно.
При сохраняющемся болевом синдроме проводится обезболивание, чаще используется морфин.
По показаниям вводятся антиаритмические, седативные средства.
Следующий важный вопрос – восстановление кровотока в коронарной артерии, реперфузионная терапия. Она позволяет либо предотвратить гибель кардиомиоцитов, либо уменьшить объем поражения, возобновив кровообращение.
Такой восстановление проводится либо внутривенным введением медикаментов тромболитического действия (непосредственное «растворение» тромба внутри артерии) или механическим расширением сосуда – чрезкожное вмешательство (ЧКВ) или ангиопластика с возможным последующим стентированием (установкой стента-пружины для сохранения проходимости пораженной артерии).
Преимущества ангиопластики перед тромболизисом доказаны, если она проведена в течение не более 2-х часов от начала болевого приступа. Это вмешательство несет значительно меньший риск кровотечений, в том числе геморрагического инсульта.
Поэтому так важна оперативность доставки пациента с инфарктом в больницу.
Но, введение препаратов тромболитического действия может быть начато уже в машине скорой помощи, если шансов доставить пациента в специализированное отделение в течение 60 минут от начала приступа нет. Проведение тромболизиса в течение часа от начала заболевания позволяет «остановить» развитие каждого третьего инфаркта. Чем больше времени проходит от начала заболевания, тем меньше эффективность такой терапии и через 12 часов она практически равна нулю.
После проведенной тромболитической терапии в течение суток проводится плановое ЧКВ: рентгенконтрастное исследование коронарных артерий – коронарография. Это важно для контроля состояния коронарного русла и, при необходимости, проведения ангиопластики и стентирования.
Надо понимать, что есть очень четкий алгоритм действия врачей по оказанию помощи при остром коронарном синдроме (состояние, когда еще непонятно во что выльется сердечный приступ – стенокардию или инфаркт). Он разработан на основе многих исследований, наблюдений и помогает спасать пациентов.
Осложнения инфаркта миокарда
Они разделяются на ранние и поздние.
К ранним осложнениям относятся:
1. Острая левожелудочковая недостаточность – резкое снижение сократительной способности миокарда, проявляется одышкой, кашлем, учащением пульса. Может сопровождать острую аневризму сердца – выбухание участка желудочка по месту обширной инфарктной зоны;
2. Нарушения ритма и проводимости сердца – различные нарушения регистрируются у 90% пациентов. Некоторые из таких нарушений – смертельно опасны (как фибрилляция предсердий, полная атриовентрикулярная блокада), лечение их возможно только в условиях отделения интенсивной терапии – дефибрилляция или установка кардиостимулятора;
3. Кардиогенный шок – невозможность адекватного кровоснабжения, резкое снижение АД при поражении большого участка миокарда;
4. Ранняя постинфарктная стенокардия – возникает в первые 24 часа острого инфаркта, может быть проявлением незавершившегося некроза сердечной мышцы;
5. Перикардит – воспаление сердечной сумки в первые 1-3 суток, осложняет течение заболевания, увеличивает риск неблагоприятного исхода;
6. «Несердечные» осложнения: желудочно-кишечные кровотечения, острый психоз или депрессия, тромбоэмболические осложнений в другие сосуды.
Поздние осложнения:
1. Синдром Дресслера – через 2-6 недель появляются полисерозиты – воспаление плевры, перикарда, суставов. Имеют аутоиммунный характер;
2. Тромбоэндокардит – возникновение и воспаление пристеночного тромба в полости сердца, на клапанах, опасен эмболическими осложнениями;
3. Формирование хронической аневризмы сердца – в области обширного рубца, способствует прогрессированию сердечной недостаточности, образованию внутрисердечного тромба;
4. Хроническая сердечная недостаточность – недостаточная насосная функция сердца ведет к снижению физической работоспособности, появлению одышки, отеков;
Как жить после инфаркта
Целями восстановления являются физическая, психологическая адаптация, восстановление работоспособности, предупреждение развития осложнений и повторного инфаркта.
Физическая реабилитация начинается с палаты интенсивной терапии. До 28 дней – в кардиологическом отделении или реабилитационном центре, санатории. Постепенное увеличение физической активности позволяет снизить риск осложнений, вернуться к обычной жизни.
Часто необходимо участие психолога, чтобы помочь пациенту продолжить жить с новой болезнью.
Медикаментозная терапия – также является частью реабилитационного плана. Она включает в себя различные группы препаратов, которые назначаются индивидуально. Чаще всего назначаются препараты для урежения частоты пульса, снижение уровня холестерина, нормализации артериального давления и предотвращения повышенной свертываемости крови.
Важно выполнять рекомендации врача по приему препаратов и соблюдению режима физической активности.
Огромную роль играют изменения в образе жизни, касающиеся не только физических упражнений. Коррекция массы тела при ее избытке (или недостатке!), изменения в составе рациона питания (по типу антиатерогенного), отказ от курения (если человек еще этого не сделал) – без этой работы пациент имеет мало шансов «жить долго и счастливо».
Источник