Патогенез инфаркта миокарда порочные круги

Болевой синдром. Как для инфаркта миокарда, так и для стенокардии характерен болевой синдром, отличающийся рядом особенностей. Боль не имеет точной локализации (болит в груди, как говорят больные), обладает способностью иррадиировать (чаще всего в левую руку, левое плечо, левую лопатку, левую половину шеи и нижней челюсти) и носит чрезвычайно тягостный характер, вызывая у больных чувство страха смерти (argor precardialis).
Причиной боли является накопление в зоне ишемии недоокисленных продуктов, биологически активных веществ, в частности брадикинина. Способность висцеральной боли к иррадиации связана с тем, что замыкание рефлекторных дуг от сердца и соответствующих участков тела происходит в одних и тех же (или соседних) сегментах спинного мозга, в результате чего болевые ощущения, исходящие из сердечной мышцы, распространяются на другие области тела.
Висцеральная боль имеет большое значение в развитии инфаркта миокарда. Эмоционально-болевой стресс и сопровождающее его напряжение могут усугубить процесс некротизации сердечной мышцы, что приведет к расширению зоны инфаркта, а это, в свою очередь, усилит боль и т. д. Замыкается “порочный крут”. Поэтому одним из первых мероприятий врача при инфаркте миокарда является ликвидация болевого синдрома.
Ослабление сократительной способности миокарда ( синдром малого выброса).Ишемизированный (или некротизированный) участок миокарда теряет сократительную способность, что ведет к ослаблению контрактильной активности сердечной мышцы, к уменьшению коронарного кровотока. Это может закончиться увеличением зоны инфаркта, что еще больше ослабит сердечный выброс и т. д. Замыкается второй “порочный круг”.
Возникновение аритмий.В связи с тем, что в зоне ишемии резко нарушаются биоэлектрические свойства миокардиальных клеток, очаг поражения, особенно в первые часы его возникновения, может стать источником эктопической активности. Разность потенциалов между волокнами, находящимися в зоне ишемии и вне ее, ведет к возникновению гетеротопных очагов автоматизма. Этот фактор в сочетании с резким повышением гетерогенности сердечной мышцы при инфаркте может стать основой возникновения фибрилляции желудочковсердца — наиболее частой причины смертности при инфаркте миокарда.
Но даже несмертельные аритмии (экстрасистолия, пароксизмальная тахикардия), давая дополнительную нагрузку на поврежденный миокард, могут привести к расширению зоны некроза, что, в свою очередь, усилит нарушения сердечного ритма. Замыкается третий “порочный круг”.
Наряду с патогенетическими при инфаркте миокарда формируется и включается в процесс рядсаногенетических механизмов,важнейшими из которых являются:
1. Усиление коллатерального кровообращения. На первый взгляд это положение выглядит несколько парадоксальным, поскольку известно, что коронарные артерии характеризуются абсолютной недостаточностью коллатералей, т. е. являются функционально концевыми. Однако, несмотря на это, кровоснабжение области инфаркта может быть улучшено за счет:
1) расширения других ветвей той самой коронарной артерии, в одной из ветвей которой нарушена проходимость;
2) расширения других коронарных артерий (в случае, когда коронарные артерии распределяются в сердце по рассыпному типу, т. е. одна и та же область сердца васкуляризуется несколькими артериальными ветвями);
3) ослабления сократительной способности миокарда и наступающего при этом увеличения остаточного систолического объема крови в полости желудочков и повышения внутриполостного диастолического давления. В этих условиях кровь по системе сосудов Вьесенна-Тебезия может начать идти ретроградно — из полостей сердца в венечные сосуды, что усиливает васкуляризацию ишемизированного участка. В центре обширного очага ишемии сохраняется оксигенация ткани сердца на уровне не ниже 15—25 % от нормальных значений.
2. Усиление парасимпатических влияний на миокард. При инфаркте сердечной мышцы обычно отмечается усиление парасимпатических влияний на сердечную мышцу, что проявляется клинически выраженной брадикардией. Хотя парасимпатические влияния обладают коронаросуживающим эффектом, их усиление при инфаркте миокарда играет положительную роль, так как они понижают потребность миокарда в кислороде, причем это понижение “перекрывает” коронаросуживающий эффект парасимпатических медиаторов.
3. Активация эндогенных стресс-лимитирующих систем организма. Острое повреждение сердца формирует состояние “напряжения” — стресс-реакцию, выраженность которой в большей степени определяется активностью эндогенных стресс-лимитирующих системорганизма. К ним относят центральные ГАМК-реактивные и серотонин-реактивные структуры, а также области продукции и рецепции регуляторных нейропептидов. В обширной группе нейропептидов наиболее отчетливо выражена стресс-протективная функция опиоидных пептидов (энкефалины, эндорфины). Взаимодействуя с пресинаптическими опиатными рецепторами, данные короткие фрагменты белковых молекул обладают способностью ограничивать выделение большинства медиаторов из аксонов. Кроме того, постсинаптическиеих эффекты обусловливают уменьшение реакции эффекторных клеток при действии катехоламинов.
Некроз миокарда может возникнуть при относительной недостаточности коронарных сосудов, когда венечные артерии доставляют нормальное (или даже увеличенное) количество крови, но которое не обеспечивает потребности миокарда, работающего в условиях повышенной нагрузки. Относительная недостаточность венечных сосудов ведет, как правило, к возникновению большого количества мелких некрозов
В эксперименте такие некрозы можно смоделировать при сужении аорты или легочной артерии, когда миокард соответствующего желудочка вынужден работать с перенапряжением, а максимальная “пропускная способность” венечных сосудов не в состоянии обеспечить необходимым количеством кислорода.
В клинике некрозы такого типа могут возникать в правом желудочке сердца при двусторонней пневмонии, выраженной эмфиземе легких; одним словом, в тех случаях, когда резко возрастает периферическое сопротивление в малом круге кровообращения и правому желудочку приходится работать с перенапряжением, а коронарные сосуды, даже максимально расширяясь, не могут обеспечить достаточного количества кислорода.
Аналогичная ситуация может возникать и у плохо тренированных спортсменов, когда резкое повышение работы сердца при поднятии тяжестей, беге или другой интенсивной нагрузке не обеспечивается достаточным поступлением крови..
Очаг некроза оказывает неблагоприятное действие на деятельность сердца и организм: снижается насосная функция (МОК) сердца, т.к. сокращения сегментов желудочков становятся асинхронными, боль включается в патогенез развития СН и шока, прогрессирует гиперкоагуляция.
Осложнения ИМ: аритмии, застойная СН, кардиогенный шок, разрыв миокарда, аневризма сердца, перикардит, сердечная астма и отек легких, постинфарктный синдром Дресслера (аутоиммунный постинфарктный полисерозит, синдром 3 «п»: перикардит, плеврит, перитонит).
Кардиогенный шок(см. также Патофизиология экстремальных состояний). При кардиогенном шоке, возникающем как осложнение ИМ левый желудочек не может обеспечить адекватный сердечный выброс в результате асинхронного рассогласованного сокращения миокарда. Падает АД как результат синдрома малого выброса. Компенсаторный спазм артериол как результат активации симпатической нервной системы, действие катехоламинов, вазопрессина, ангиотензина II увеличивает ОПСС, поддерживает АД, обеспечивает централизацию кровообращения. Но это обманчивая стабилизация, т.к. на уровне периферических органов и тканей происходит накопление вазоактивных БАВ (результат гипоксии). Через 4-5 часов эти БАВ вызывают децентрализацию кровообращения и стойкое снижение АД. Усугубляется нарушение коронарное кровообращение, нарушается мозговое кровообращение, развивается ОПН, ДВС. Клетки организма страдают от гипоксического повреждения.
В борьбе с кардиогенным шоком очень важно осуществить ряд профилактических мероприятий. На фоне поддержания работы сердца и уровня артериального давления провести раннюю децентрализацию кровообращения (спазмолитики), предупредить образование БАВ с вазодилятаторным механизмом действия (ингибиторы протеолиза), предупредить тромбообразование (антикоагулянты).
Реперфузионный синдром –следствие возобновления кровотока в ишемизированном участке через 20 минут и позднее после начала ишемии. Кровоток возобновляется вследствие: прекращения спазма, лизиса тромба, хирургического вмешательства (аорто- или маммокоронарного шунтирования, ангиопластики и др.), фибринолитической терапии. Однако попытка реперфузии сопровождается риском реперфузионных повреждений. Кровь приносит в ранее ишемизированный участок кислород, что сопровождается усиленной продукцией свободных радикалов (кислородный парадокс). Во время ишемии вследствие дефицита АТФ нарушалась работа ионных каналов и поэтому в клетках много Nа+ и восстановленный кровоток ведет к накоплению в клетках жидкости – внутриклеточной гипергидратации, что ведет к набуханию внутриклеточных структур (осмотический отек органелл), особенно митохондрий, что нарушает синтез АТФ и еще усугубляет ионный дисбаланс. Также в результате сложных механизмов происходит закачка в клетку Са++, который обладает гидрофильными свойствами, а также разобщает окисление и окислительное фосфорилирование. Кроме этого, он активирует фосфолипазы, повреждающие мембрану, а также другие гидролазы (кальциевый парадокс).
Таким образом, постокклюзионная реперфузия коронарных артерий оказывает, наряду с основным – репаративным, восстановительным эффектом, также и патогенное действие на миокард.
Источник


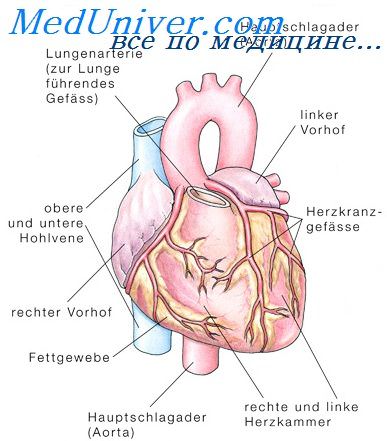
С точки зрения анатомии сердце человека является органом, состоящим из тканей различных типов, среди которых ведущая роль принадлежит мышечной ткани.
В то же время существует, по меньшей мере, две особенности, кардинально отличающих сердечную мышечную ткань, состоящую из кардиомиоцитов, от других мышц:
- сердечная мышца регулярно сокращается и расслабляется «в автоматическом режиме» на протяжении всей жизни организма, причем число таких циклов сокращений и расслаблений миокарда составляет несколько десятков в течение каждой минуты;
- сердечная мышца обеспечивает снабжение кровью, насыщенной кислородом, не только всех органов и тканей организма, но и самой себя, благодаря 2 коронарным артериям – правой и левой.
Миокард, выполняющий очень большой объем работы, нуждается в значительном количестве кислорода из артериальной крови даже в том случае, когда человек находится в состоянии покоя (до 4% от общего сердечного выброса такой крови). А при физической нагрузке потребность миокарда в артериальной крови резко возрастает – до 20% от общего сердечного выброса.
При дефиците кислорода в том или ином участке сердечной мышцы быстро развивается одновременное кислородное голодание кардиомиоцитов, ведущее к их гибели, в чем и заключается суть инфаркта.
Ключевая причина
В подавляющем большинстве случаев инфаркта миокарда (свыше 90%) его причиной становится значительное уменьшение просвета одной из двух коронарных артерий (или артерий меньшего размера, отходящих от левой коронарной артерии), вызванное тромбом, сгустком крови. Кардиологи называют такое уменьшение просвета артерии, вызванное тромбом, «тромботическая окклюзия коронарной артерии» или «окклюзия коронарного сосуда».
Окклюзия коронарных артерий в свою очередь чаще всего является следствием такого хронического заболевания как атеросклероз. При атеросклерозе наблюдается нарушение обмена веществ в тканях стенок артерий (в первую очередь метаболизма жиров и белков), в результате чего на внутренних стенках этих кровеносных сосудов образуются бляшки, состоящие из «плохого» холестерина (липопротеинов низкой плотности – ЛПНП) и сложных белков липопротеинов. Кроме того, атеросклероз сопровождается и кальцинозом стенок коронарных артерий – отложением в тканях стенок сосудов солей кальция.
Атеросклероз постепенно приводит к сужению просвета артерий и снижению эластичности их стенок. Когда сужение просвета достигает определенного критического значения, развивается ишемическая болезнь сердца – хронический дефицит кислорода в миоцитах, которая без лечения способна привести к острой ишемии миокарда, то есть, к инфаркту.
Факторы риска развития инфаркта миокарда
Кроме атеросклероза к настоящему времени достоверно установлены и другие факторы риска развития инфаркта миокарда (ИМ):
- артериальная гипертензия. Гипертония приводит к постоянной перегрузке миокарда, которому приходится с усилием проталкивать необходимое количество крови, насыщенной кислородом, в аорту и отходящие от нее артерии. Перегрузка миокарда повышает его собственную потребность в кислороде и увеличивает риск развития ишемии и инфаркта даже при относительно незначительном дефиците крови, насыщенной этим газом;
- сахарный диабет также является фактором высокого риска развития инфаркта. Обусловлено это тем, что избыток глюкозы в крови диабетика с одной стороны пагубно действует на кровеносные сосуды, а с другой – ухудшает способность гемоглобина эритроцитов связываться с кислородом. В результате органы и ткани у больных диабетом начинают страдать от дефицита кислорода;
- наличие инфаркта миокарда в анамнезе. У людей, ранее уже перенесших инфаркт миокарда, повышенный риск развития повторного инфаркта сохраняется на протяжении десятилетий;
- наследственность (включая, в том числе генетическую предрасположенность к гипертонии, сахарному диабету, ожирению и т. д.);
- табакокурение (в том числе пассивное). Продукты горения табака обладают способностью сужать коронарные артерии, что также может спровоцировать инфаркт;
- ожирение и сидячий образ жизни. Обе эти патологии взаимосвязаны и способны вызвать уже упоминавшийся атеросклероз, а также гипертонию, болезни обмена веществ, которые сами по себе могут стать причиной инфаркта;
- возраст. Даже у очень здоровых людей вероятность развития инфаркта несколько повышается после 45-50 лет.
Источник
Патогенез инфаркта миокарда. Механизмы развития инфаркта миокардаРассмотрим последовательно три составные части патогенеза инфаркта миокарда, а также связь между патогенезом и клиникой. Наиболее характерное проявление атеросклероза — это фиброзная атеросклеротическая бляшка, т. е. фиброатерома. Её “внешние черты” определяются двумя факторами (М. J. Davies, N. Woolf, 1991): а) соотношением липидного и соединительнотканного компонентов; Не существует какого-то типового “чертежа” атеросклеротической бляшки. От строения бляшки зависит клиническое течение заболевания (развитие осложнений). Именно разрыв таких поражений часто приводит у сорокалетних мужчин к тромбозу коронарной артерии с дальнейшим развитием обширного инфаркта (аневризмы сердца) или к внезапной смерти. Как отмечают М. J. Davies (1990); R. Т. Lee, P. Libby (1997), два варианта нарушения целостности бляшки могут приводить к тромбозу венечной артерии:
Разрыв атеросклеротической бляшки с полным или частичным тромбозом коронарной артерии — наиболее частая причина развития коронарных катастроф: нестабильной стенокардии, инфаркта миокарда, внезапной смерти (V. Fuster et al., 1992). Образование необтурирующих или кратковременно закупоривающих коронарную артерию тромбов обусловливает такие клинические проявления ИБС, как нестабильная стенокардия (с болями в состоянии покоя) и мелкоочаговый инфаркт миокарда. Обтурирующий (на протяжении длительного времени) тромбоз — патогенетическая основа крупноочагового (трансмурального) инфаркта миокарда (R. L. Ridolfi, G. M. Hutchins, 1977). Формирование вследствие разрыва бляшки как обтурирующего, так и не обтурирующего тромба может приводить к внезапной смерти. Кроме того, выброс в кровоток атероматозного содержимого расположенной в аорте бляшки может вызвать эмболию артерий мозга и других органов. Это объясняется хорошим развитием коллатеральных сосудов при длительно существующих стенозирующих бляшках (в ответ на часто возникающую ишемию миокарда — приступы стенокардии). Чем же отличаются на микроскопическом уровне “уязвимые” бляшки, которые, разорвавшись, могут вызвать острую коронарную недостаточность, от стабильных? “Уязвимые” бляшки: – “эксцентричны”, т. е. занимают лишь часть окружности артерии; – богаты липидами (липидное ядро занимает > 50 % их общего объёма); Уточним, что клетки воспаления (макрофаги, Т-лимфоциты), концентрация которых повышена в нестабильной бляшке, продуцируют различные цитокины, в частности интерлейкин 6 (interleukin 6, сокращённо IL6), которые могут активировать гладкомышечные клетки (S. Kinlay, P. Ganz, 1997). Программированная гибель (апоптоз) гладкомышечных клеток в оболочке бляшки, причины развития которой сейчас только изучаются, также может повышать вероятность разрыва бляшки (R. Т. Lee, P. Libby, 1997). – Также рекомендуем “Нестабильная атеросклеротическая бляшка. Диагностика нестабильной бляшки” Оглавление темы “Причины и диагностика инфаркта миокарда”: |
Источник
Патогенез инфаркта миокарда. Механизм развития инфаркта миокарда.Как правило, без атеросклероза коронарных артерий нет и инфаркта миокарда. Адекватность коронарного кровообращения метаболическим запросам миокарда определяется тремя основными факторами: величиной коронарного кровотока, составом артериальной крови и потребностью миокарда в кислороде. Для образования тромба в коронарной артерии обычно необходимы тоже три фактора: патологические изменения в ее интиме вследствие атеросклероза, активация в системе тромбообразования (рост коагуляции, агрегации тромбоцитов и эритроцитов, наличие сладж-феномена в МЦК, снижение фибринолиза) и пусковой фактор, способствующий взаимодействию двух первых (например, спазм артерии). Атеросклероз коронарных артерий прогрессирует с годами и суживает их просвет, порождая атеросклеротические бляшки. Затем вследствие действия факторов, способствующих разрыву (рост напряжения по всей окружности бляшки, ухудшение реологических свойств крови, большое количество воспалительных клеток, инфекция), нарушается целостность бляшки: обнажается ее липидное ядро, эрозируется эндотелий и обнажаются коллагеновые волокна. К дефекту прилипают активированные тромбоциты и эритроциты, чем запускается каскад свертывания и формирование тромбоцитарных пробок с последующим наслоением фибрина Возникает резкое сужение просвета коронарной артерии, вплоть до ее полной окклюзии Обычно от формирования тромбоцитарного тромба до тромботической окклюзии коронарной артерии проходит 2—6 дней, что клинически соответствует периоду нестабильной стенокардии. Хроническая тотальная закупорка коронарной артерии не всегда связана с последующим развитием ИМ От коллатерального кровотока, как и от других факторов (например, от уровня метаболизма миокарда, размеров и локализации зоны его поражения, снабжавшейся закупоренной артерией, скорости развития коронарной обструкции), зависит жизнеспособность клеток миокарда Коллатеральное кровообращение обычно хорошо развито у больных с тяжелой Ст (сужением просвета более чем на 75% в одной или нескольких коронарных артериях), выраженной гипоксией (тяжелые анемия, ХОБЛ и врожденные «синие» пороки) и ГЛЖ Наличие тяжелого стеноза коронарной артерии (более 90%) с регулярно повторяющимися периодами ее полной окклюзии позволяет существенно ускорить развитие коллатералей. Частота развития коронарных коллатералей через 1—2 недели после инфаркта миокарда варьирует, достигая 75-100% у больных с персистирующей окклюзией коронарных артерий и только 20—40% у пациентов с субтотальной окклюзией В случаях 1, 2, отмеченных на рисунке, инфаркт миокарда обычно не развивается вследствие доставки крови из соседней коронарной или другой артерии, а формируется в случае 3 (когда спазмирована дополнительно питающая миокард артерия) или 4 (ее просто нет) На фоне существенного сужения коронарной артерии разрыв атеросклеротической бляшки, приводящий к ИМ, происходит под действием триггеров, например ФН или стресса. Стресс (эмоциональный или физический) стимулирует выброс катехоламинов (они оказывают гистотоксический эффект) и повышает потребление кислорода миокардом. Сердце — это важная рефлексогенная зона. Негативный психоэмоциональный стресс (смерть близких, их тяжелая болезнь, выяснение отношений с начальством и др ) часто является «спичкой, дающей факел» – ИМ Инфаркт миокарда может спровоцировать и чрезмерная ФН (например, марафон, статический подъем больших тяжестей) даже у молодых лиц. Развитие инфаркта миокарда после острой окклюзии коронарной артерии. – Также рекомендуем “Банкетный инфаркт миокарда. Морфология инфаркта миокарда.” Оглавление темы “Инфаркт миокарда.”: |
Источник