Патофизиология острого инфаркта миокарда
Инфаркт миокарда (ИМ) представляет собой гибель участка миокарда в результате длительной тяжелой ишемии. До настоящего времени это наиболее значимая форма ИБС. Около 1,5 млн человек в США ежегодно переносят ИМ.
а) Заболеваемость и факторы риска. ИМ может произойти практически в любом возрасте, однако частота его возникновения увеличивается с годами, особенно в случае генетической предрасположенности к атеросклерозу. Около 10% ИМ возникает у лиц моложе 40 лет и 45% — у лиц моложе 65 лет. Частота ИМ у лиц с белым и темным цветом кожи одинакова. На протяжении всей жизни риск ИМ у мужчин значительно выше, чем у женщин. Женщины защищены от ИМ и других болезней сердца в репродуктивном периоде, за исключением случаев, когда есть условия, предрасполагающие к атерогенезу.
Однако снижение уровня эстрогенов после менопаузы ассоциируется с быстрым увеличением заболеваемости ИБС, и ИБС становится наиболее распространенной причиной смерти женщин пожилого и старческого возраста. Тем не менее в настоящее время не считают, что заместительная гормональная терапия в постменопаузе защищает от атеросклероза и ИБС в достаточной степени.
б) Патогенез. Рассмотрим механизмы развития и последствия ишемии миокарда.
Окклюзия коронарных артерий. В типичных случаях ИМ наиболее вероятна следующая последовательность событий:
1. Первичным процессом является внезапное изменение атеросклеротической бляшки — геморрагия, эрозия, изъязвление, разрыв или растрескивание.
2. Когда обнажаются субэндотелиальный коллаген и некротическое содержимое бляшки, тромбоциты на этом участке адгезируют и активируются, высвобождая содержимое своих гранул, затем происходит агрегация с образованием микротромбов.
3. Медиаторы, высвобождаемые тромбоцитами, стимулируют спазм сосудов.
4. Тканевой фактор активирует процесс коагуляции, дополнительно увеличивая размер тромба.
5. Часто тромб, увеличиваясь в размерах, полностью закрывает просвет сосуда в течение нескольких минут.

Предложенная последовательность процессов основана на:
(1) данных аутопсии пациентов, умерших от острого ИМ;
(2) данных ангиографии, указывающих на высокую частоту тромботической окклюзии вскоре после ИМ;
(3) выраженном положительном эффекте коронарной реваскуляризации (например, с помощью тромболизиса, ангиопластики, применения стентов или хирургического вмешательства) после ИМ;
(4) обнаружении при ангиографии остаточных изменений атеросклеротических бляшек после тромболизиса.
Коронарная ангиография, выполненная в течение 4 час от начала ИМ, выявляет тромб в коронарной артерии в 90% случаев, а через 12-24 час от начала ИМ — только в 60% случаев, что свидетельствует о некоторой степени разрешения окклюзии благодаря фибринолизу и/или ослаблению спазма.
В 10% случаев трансмуральный ИМ происходит в отсутствие типичной патологии коронарных сосудов. В таких ситуациях ответственными за снижение коронарного кровотока могут быть другие механизмы:
– спазм сосудов. Может быть вызван различными причинами, например злоупотреблением кокаином, и может ассоциироваться с агрегацией тромбоцитов;
– эмболия. Эмболы попадают в коронарные артерии из левого предсердия при фибрилляции предсердий, пристеночном тромбозе в левых отделах сердца, вегетациях при инфекционном эндокардите, наличии внутри сердца протезного материала либо из правых отделов сердца или периферических вен {парадоксальные эмболы), проникая через открытое овальное окно;
– ишемия в отсутствие коронарного атеросклероза и тромбоза. Вероятно, к ишемии приводят такие нарушения во внутристеночных коронарных сосудах, как васкулит, гематологические заболевания (например, серповидно-клеточная анемия, амилоидоз) и расслоение стенки сосуда, а также снижение артериального давления (шок) или неправильная «защита» миокарда во время операции на сердце.
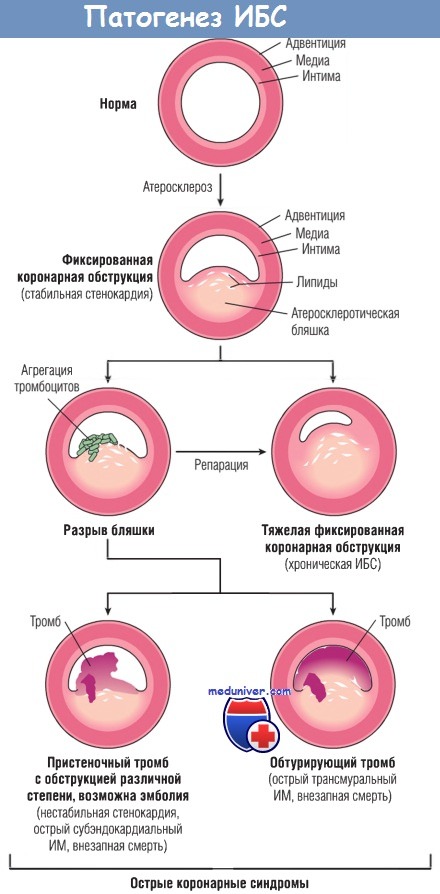
Прогрессирование поражений коронарных артерий и их связь с острыми коронарными синдромами.
ИБС — ишемическая болезнь сердца; ИМ — инфаркт миокарда.
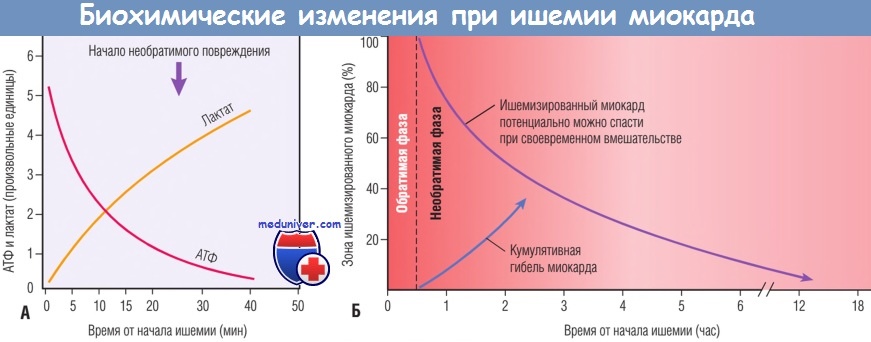
Временная последовательность ранних биохимических изменений и развития некроза после начала тяжелой ишемии миокарда.
(А) Ранние изменения состоят в утрате аденозинтрифосфата (АТФ) и накоплении лактата.
(Б) В течение» 30 мин после начала даже тяжелой ишемии повреждение миокарда потенциально обратимо. Затем происходит прогрессирующая утрата жизнеспособности, которая завершается через 6-12 час.
Благоприятный эффект реперфузии максимален, если ее удается выполнить достаточно рано, и эффект снижается, если реперфузию выполняют позднее.
в) Реакция миокарда. Обструкция коронарной артерии снижает доставку крови в определенную область миокарда, вызывая ишемию, дисфункцию миокарда и возможную гибель кардиомиоцитов. Анатомическая область, снабжаемая кровью из этой артерии, является зоной риска. Исход зависит главным образом от тяжести поражения и продолжительности ограничения кровотока.
Ранним биохимическим последствием ишемии миокарда является прекращение аэробного метаболизма в течение нескольких секунд после начала ишемии, приводящее к недостаточному образованию высокоэнергетических фосфатов (креатинфосфата и аденозинтрифосфата) и накоплению потенциально вредных метаболитов (в частности, лактата). В результате исключительной зависимости функции миокарда от кислорода тяжелая ишемия индуцирует утрату сократимости уже в течение 1 мин. Прекращение функции способно вызвать острую сердечную недостаточность задолго до гибели клеток миокарда.
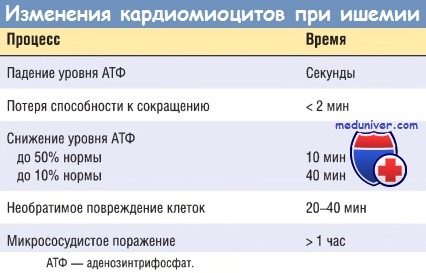
Ультраструктурные изменения (включая расслабление миофибрилл, истощение запасов гликогена, набухание клеток и митохондрий) также происходят в течение нескольких минут от начала ишемии. Тем не менее эти ранние изменения потенциально обратимы. Как показали экспериментальные и клинические исследования, лишь тяжелая ишемия длительностью 20-30 мин или более приводит к необратимому повреждению (некрозу) кардиомиоцитов. Ультраструктурные изменения при необратимом повреждении кардиомиоцитов (в первую очередь структурные дефекты сарколеммы) наблюдаются лишь после длительной, тяжелой ишемии миокарда (это происходит при снижении кровоснабжения до 10% нормы или ниже).
Ключевым признаком ранней фазы некроза кардиомиоцитов служит нарушение целостности сарколеммы, что позволяет внутриклеточным макромолекулам высвобождаться из клеток в интерстициальную ткань сердца и в конечном итоге — в микрососудистое русло и лимфатические сосуды области инфаркта. Тесты, позволяющие определить уровень белков миокарда в крови, имеют большое значение для диагностики и лечения ИМ (см. далее). При увеличении длительности тяжелой ишемии нарушается микроциркуляция. Прогрессирование этих процессов во времени представлено в таблице ниже.
В большинстве случаев острого ИМ необратимое повреждение сердца происходит после определенного периода времени, как правило через 2-4 час. Это дает возможность провести раннее вмешательство на коронарных сосудах для восстановления перфузии и спасти как можно больше миокарда, находящегося в зоне повышенного риска.
Прогрессирование ишемического некроза в миокарде в общем виде представлено на рисунке ниже. Ишемия наиболее выражена в зоне субэндокарда, т.е. необратимое поражение ишемизированных кардиомиоцитов происходит в первую очередь в субэндокардиальной зоне. При более обширной ишемии «фронт» гибели клеток распространяется, захватывая все большую площадь. На локализацию, размеры и морфологические признаки острого ИМ влияют следующие факторы:
– локализация, тяжесть и скорость развития коронарной обструкции вследствие атеросклероза и тромбоза;
– размер сосудистого ложа, перфузируемого сосудами, подвергшимися обструкции;
– продолжительность окклюзии;
– метаболические потребности миокарда и его потребность в кислороде в зоне повышенного риска;
– степень развития коллатеральных кровеносных сосудов;
– наличие, локализация и тяжесть коронарного спазма;
– другие факторы, например ЧСС, сердечный ритм и степень оксигенации крови.
Необратимое повреждение миокарда обычно завершается в течение 6 час от начала тяжелой ишемии миокарда. В тех случаях, когда система коллатеральных коронарных артерий развита в достаточной степени под влиянием хронической ишемии, этот срок удлиняется и может превысить 12 час.
Определение области миокарда, которую перфузируют основные коронарные артерии, помогает установить корреляцию между уровнем сосудистой обструкции и зоной ИМ. Передняя нисходящая ветвь левой коронарной артерии кровоснабжает большую часть верхушки сердца (дистальный отдел желудочков), переднюю стенку левого желудочка и передние две трети межжелудочковой перегородки. Коронарную артерию (правую коронарную или огибающую), перфузирующую заднюю треть межжелудочковой перегородки, называют доминантной (несмотря на то что передняя нисходящая и огибающая артерии вместе перфузируют большую часть миокарда левого желудочка).
При доминантной правой коронарной артерии, что встречается у 80% индивидов, огибающая артерия перфузирует только латеральную стенку левого желудочка, а правая коронарная артерия снабжает всю свободную стенку правого желудочка, заднебазальную стенку левого желудочка и заднюю треть межжелудочковой перегородки. Таким образом, повреждение левого желудочка может вызвать окклюзия как правой, так и левой коронарной артерии. Правая и левая коронарные артерии функционируют как концевые артерии, хотя анатомически в большей части сердца присутствуют многочисленные межкоронарные анастомозы (сосудистые соединения, обеспечивающие коллатеральное кровообращение).
В здоровом сердце через коллатерали проходит небольшое количество крови, однако, когда артерия резко сужена, кровь из системы с высоким давлением в систему с низким давлением проходит через коллатерали и вызывает их расширение. Таким образом, расширение и развитие коллатералей под влиянием ишемии могут играть важную роль в кровоснабжении областей миокарда, которые без этого могут быть лишены необходимой перфузии.
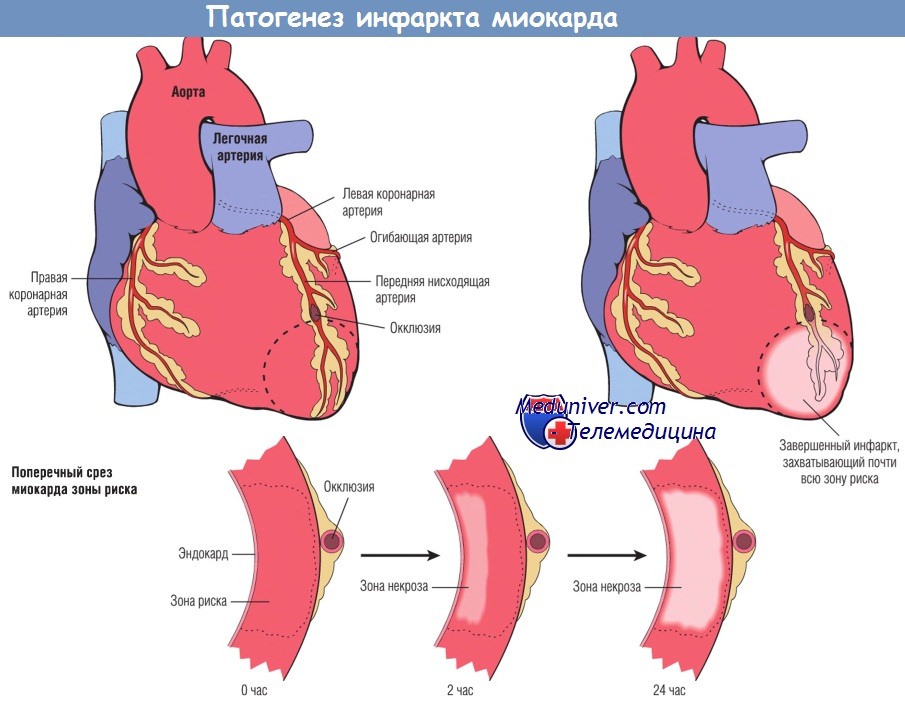
Развитие инфаркта миокарда после острой окклюзии коронарной артерии.
Некроз начинается в небольшой области миокарда под эндокардом, в центре ишемизированной зоны.
Область, перфузируемая обтурированной артерией, является зоной риска поражения миокарда (область внутри пунктирной линии).
Обратите внимание, что очень узкая область миокарда, находящаяся непосредственно под эндокардом, не подвергается некрозу, т.к. в нее поступает кислород из крови путем диффузии непосредственно из полости желудочка.

– Рекомендуем ознакомиться со следующей статьей “Различия трансмурального и субэндокардиального инфаркта миокарда”
Оглавление темы “Патогенез ишемической болезни сердца”:
- Механизмы развития (патофизиология) ишемической болезни сердца
- Механизмы развития (патофизиология) стенокардии
- Механизмы развития (патофизиология) инфаркта миокарда
- Различия трансмурального и субэндокардиального инфаркта миокарда
- Морфология инфаркта миокарда
- Механизмы развития (патофизиология) реперфузии инфаркта миокарда
- Клиника и маркеры инфаркта миокарда
- Механизмы развития (патогенез) осложнений инфаркта миокарда
- Механизмы развития (патогенез) хронической ИБС
- Механизмы развития (патогенез) внезапной сердечной смерти
Источник
Инфаркт миокарда
– патологическое состояние сердца и
всего организма, которое развивается
вследствие прекращения или резкого
падения объёмной скорости кровотока в
определенных сегментах стенок сердечных
камер в результате обтурации венечных
артерий атеросклеротическими бляшками
и тромбами.
Выделяют так
называемые «факторы риска» ИМ и ИБС,
которые делятся на:
Первичные,
непосредственно отражающиеся на
здоровье – несбалансированное питание,
курение, злоупотребление алкоголем,
гиподинамия, стресс.Вторичные –
заболевания или синдромы, способствующие
развитию сердечно-сосудистых болезней:
гиперхолестеринемия, артериальная
гипертензия, диабет, ревматизм и т.д.
Кроме того, нельзя
недооценивать наследственную
предрасположенность к ИБС.
Наряду с традиционными
представлениями об этиологии и патогенезе
ИМ, последнее время все большее
распространение получила концепция
инфаркта миокарда как стресса. Согласно
концепции Меерсона Ф.З. в патогенезе
ИБС и ИМ существенную роль играют:
Стрессорная
гиперхолестеринемия и гиперлипидемия,
сопровождающиеся усилением реакций
ПОЛ.Первичное
стрессорное повреждение миокарда,
проявляющееся выраженными метаболическим
и структурными изменениями ткани
сердца.Гиперкатехолемия,
приводящая к спазму коронарных сосудов
и развитию вторичных ишемических
повреждений. Вероятно, сосудистый спазм
представляет собой универсальный
патологический феномен, который может
возникнуть и спонтанно, вследствие
предрасположенности коронарных сосудов
к спастическим реакциям. Спазм может
быть пусковым или отягчающим моментом
в генезе ИМ.Избыток катехоламинов
активирует процессы свертывания крови
и образования тромбов в сосудах сердца.
Выделяющиеся при этом вазоактивные
вещества ( простагландины, тромбоксан
) усиливают и пролонгируют спазм этих
сосудов.Длительная
стресс-реакция снижает резистентность
сердца к гипоксии и ишемии.Повышается
сопротивление сосудистого русла и
увеличивается нагрузка на сердце.Снижается тонус
емкостных сосудов, в основном портальной
системы, что приводит к патологическому
депонированию крови и уменьшению объёма
циркулирующей крови.Гипервентиляция
приводит к развитию алколоза и повышению
напряжения кислорода в крови, что
вызывает снижение коронарного кровотока.
Таким образом,
стресс-реакция во многих случаях не
только предшествует ишемическому
повреждению сердца. Но и предопределяет
его развитие.
Основу патогенеза
ИМ составляют:
– падение насосной
функции сердца вплоть до развития
кардиогенного шока;
– потерявшая
приспособительное значение патогенная
боль как стимул защитно-патогенных
реакций, которые почти сразу превращаются
в звенья патогенеза острой сердечной
недостаточности и кардиогенного шока;
– прогрессирующая
гиперкоагулемия (патологически высокая
свёртываемость крови).
В клинико-патофизиологическом
отношении инфаркт миокарда прежде всего
характеризует асинхронное сокращение
сегментов стенок желудочка, пораженного
циркуляторной гипоксией. Острое снижение
выброса крови левым желудочком в аорту
происходит в результате обусловленного
циркуляторной гипоксией падения
сократительной способности клеток
рабочего миокарда. Уже через 15 сек после
наступления ишемии, клетки сократительного
миокарда жертвуют своей функцией, чтобы
сохранить жизнеспособность через
ограничение энерготрат в условиях
гипоксического гипоэргоза.
Вне зоны инфаркта
развиваются диссеминированные очаги
поражения мышечных клеток, обусловленных
кардиотоксическим действием катехоламинов
и коронарогенной гипоксией. Повреждения
эти обратимы. При благополучном течении
ИМ вслед за некротическими изменениями
развивается репаративная стадия, в
процессе которой очаг некроза замещается
соединительной тканью, трансформирующейся
в рубец, а убыль мышечной массы
компенсируется за счет регенерационной
гипертрофии сохранившихся миокардиоцитов.
Репарация проявляется довольно рано –
через 24 часа, а максимум достигается
через 6-7 суток.
Чаще
инфаркт миокарда поражает мышцу левого
желудочка.
В
первые сутки очаг некроза практически
не отличается
от неповрежденной ткани миокарда и
имеет не сплошной, а мозаичный характер,
поскольку среди погибших миокардиоцитов
и некротизированных
участков встречаются частично
и даже полностью нормально функционирующие
клетки и группы клеток. На вторые сутки
инфаркта миокарда зона некроза постепенно
отграничивается от здоровой ткани и
между
ними формируется периинфарктная
зона, т.е.
область,
расположенная на границе зоны некроза
и здорового миокарда. В последней, в
свою очередь, можно выделить зону
очаговой
дистрофии,
граничащую с некротическим участком,
и
зону обратимой
ишемии, примыкающую
к
неповрежденному
миокарду. Изменения, возникшие
в зоне очаговой дистрофии, частично
обратимы,
а в периинфарктной зоне при благоприятном
развитии событий могут быть полностью
обратимыми.
Полная
или частичная обратимость повреждений
может сохраняться в течение 3-5 ч с
момента
возникновения ишемии.
Установлено,
что зона некроза, превышающая 50%
и более массы миокарда левого желудочка,
приводит
к развитию тяжелой недостаточности
кровообращения,
часто несовместимой с жизнью.
Эволюция
зоны некроза постепенно приводит, с
одной стороны, к ограничению области
инфаркта
миокарда, а с другой – к развитию процессов
миомаляции
(размягчение
мышечной ткани). При
этом на периферии очага некроза
формируется
молодая грануляционная ткань, а внутри
идет
рассасывание погибших кардиомиоцитов.
Этот
период (примерно 7-10 сут. от начала
заболевания)
является наиболее опасным в отношении
разрыва
сердца, когда
на фоне клинического
улучшения может наступить быстрая
смерть больного.
При благоприятном развитии инфаркта
миокарда в течение 3 нед заболевания в
зоне некроза
начинает интенсивно формироваться
соединительная
ткань. Плотный рубец при трансмуральном
инфаркте миокарда окончательно образуется
только через 3-4 мес. При мелкоочаговом
инфаркте миокарда фиброзный рубец
может
образоваться через 2-3 нед.
При
типичном начале инфаркта миокарда в
основе
его клинической картины лежат сильные
боли,
симптомы сердечной недостаточности,
аритмии,
повышение температуры, лейкоцитоз,
увеличение СОЭ, гиперферментемия.
Боль
–
этот важнейший симптом инфаркта чаще
всего заставляет обратиться пациента
к врачу.
Полагают, что основной
причиной болей при этом заболевании
является
накопление в зоне ишемии лактата, который
раздражает нервные окончания афферентных
симпатических волокон. Кроме того,
важная
роль в генезе болей отводится
простагландинам
и брадикинину, которые в больших
количествах
накапливаются в ишемизированной ткани.
Вместе с тем в организме существуют
вещества
– опиоидные пептиды, которые обладают
обезболивающей активностью. Следовательно,
выраженность болевой симптоматики во
многом
может определяться «балансом между
медиаторами
болевого рефлекса (лактат, простагландины,
брадикинин) и опиоидными пептидами.
Примерно
в 50% наблюдений боли при инфаркте
миокарда появляются внезапно. Суммарная
продолжительность ангинозных болей,
превышающая
1 ч, свидетельствует о возможном развитии
инфаркта миокарда. Локализация болей
при инфаркте миокарда в некоторой
степени
определяется расположением очага
некроза в
мышце сердца.
Симптомы
сердечной недостаточности (одышка,
тахикардия, отеки и гипотензия) относятся
к типичным проявлениям инфаркта миокарда.
Появление этих симптомов связано с
нарушением насосной функции сердца,
которая снижается
прямо пропорционально размеру очага
некроза.
Если размер зоны инфаркта составляет
50%
от массы левого желудочка, то такое
поражение миокарда, как правило,
несовместимо с жизнью,
поскольку центральная гемодинамика в
этом случае страдает настолько, что
нарушается
кровоснабжение жизненно важных органов.
Нарушения
сердечного ритма
практически всегда
сопровождают развитие инфаркта миокарда,
а при его безболевой форме могут стать
ведущим
симптомом заболевания (аритмический
инфаркт
миокарда).
Основной
причиной аритмий в первые 6 ч инфаркта
миокарда является изменение
электрофизиологических
свойств кардиомиоцитов в зоне
ишемии. Из-за дефицита энергетических
субстратов,
вызванного гипоксией, они перестают
сокращаться, но сохраняют способность
к проведению
электрического импульса по своим
мембранам. Однако вследствие недостатка
АТФ эффективность
работы энергозависимых ионных насосов
в клетках существенно страдает, а сами
ионные каналы повреждаются. Это ведет
к замедлению
процессов деполяризации и реполяризации,
что создает благоприятные условия для
возникновения
аритмий. На более поздних сроках
инфаркта клетки рабочего миокарда в
зоне ишемии
гибнут, а более устойчивые к гипоксии
клетки
проводящей системы сохраняют свою
жизнеспособность,
но их электрофизиологические
характеристики существенно меняются.
Проведение
импульса по волокнам Пуркинье,
расположенным в некротизированном
миокарде,
замедляется, а у клеток проводящей
системы
появляется способность к спонтанной
деполяризации. В итоге формируется
источник аномального
эктопического автоматизма сердца.
Следует
подчеркнуть, что все вышеперечисленные
симптомы инфаркта миокарда (боль,
признаки
сердечной недостаточности, аритмии)
вообще
могут отсутствовать. В этом случае
говорят
обессимптомной(«немая»,
silent)
форме инфаркта
миокарда, при которой больной не
обращается
за медицинской помощью, а заболевание
часто остается незамеченным.
Повышение
температуры, лейкоцитоз, увеличение
СОЭ, гиперферментемиятакже
являются характерными признаками,
составляющими
клиническую картину инфаркта миокарда.
Коронарный
кровоток в зоне ишемии никогда не
падает ниже 10% от нормального уровня,
поэтому
в кровь из пораженного миокарда поступают
продукты распада кардиомиоцитов. При
этом
содержание данных веществ в плазме
крови
возрастает прямо пропорционально
размерам очага
некроза. В результате формируется
симптомокомплекс,
получивший название резорбционного
синдрома.
В
частности, уже в конце первых
– начале вторых суток начинает повышаться
температура тела, что связано с резорбцией
некротических
масс. Для картины периферической
крови в это время характерен нейтрофильный
лейкоцитоз (до 15-109/л
– 20-109/л
и более)
со сдвигом влево. Скорость оседания
эритроцитов
(СОЭ) начинает возрастать спустя 1-3 сут.
после возникновения заболевания и
сохраняется
на повышенном уровне 3-4 нед, иногда
дольше.
Для
инфаркта миокарда характерна также
гиперферментемия,
т. е. повышение активности ферментов
в плазме крови. При возникновении некроза
они поступают из некротизированных
миокардиальных
клеток в кровь. При появлении
инфаркта миокарда или подозрении на
него активность ферментов крови:
креатинфосфокиназы
(КФК), аспартатаминотрансферазы (АСАТ,
или
ACT),
лактатдегидрогеназы (ЛДГ) должна
определяться
серийно. Чем больше очаг некроза,
тем выше активность КФК в плазме крови.
На
этом принципе основан даже метод
косвенного
определения размеров инфаркта миокарда
по математическим формулам.
Информативным
показателем развития инфаркта
миокарда может быть также повышение в
крови уровня миоглобина. Уровень
миоглобина
в крови больных крупноочаговым инфарктом
миокарда
может повышаться в 4-10 раз и более по
сравнению с нормой (она колеблется от
5 до 80 нг/мл). Содержание миоглобина
нормализуется
через 20-40 ч после начала заболевания.
По степени и длительности повышения
уровня миоглобина
в крови больных можно судить о величине
зоны некроза и о прогнозе заболевания.
Осложнения
инфаркта миокарда.
Осложнения
инфаркта весьма существенно отягощают
его течение и часто являются непосредственной
причиной
летальности и инвалидизации пациентов
при данном заболевании. Различают ранние
и поздние
осложнения острой коронарной патологии.
Ранние
осложнения могут возникать в первые
дни, часы и даже минуты инфаркта миокарда.
К ним относятся кардиогенный шок, острая
сердечная недостаточность, острая
аневризма
сердца, разрывы сердца, тромбоэмболические
осложнения,
нарушения ритма и проводимости,
перикардиты,
острые поражения желудочно-кишечного
тракта.
Поздние
осложнения возникают в подостром периоде
рубцевания инфаркта миокарда. Это
постинфарктный
перикардит (синдром Дресслера),
хроническая аневризма сердца, хроническая
сердечная недостаточность и другие
Саногенетические
механизмы, формирующиеся при инфаркте
миокарда:
-Усиление
коллатерального кровообращения.
Кровоснабжение инфицированной области
может быть улучшено за счет расширения
других ветвей той коронарной артерии,
в одной из ветвей которой нарушена
проводимость, за счет коронарных артерий,
которые частично перекрывают зону
кровоснабжения обтурированной артерии.
-Усиление
парасимпатических влияний на миокард.
Парасимпатические влияния на миокард
уменьшают частоту сердечных сокращений
и ослабляют силу сердечных сокращений
(отрицательное хронотропное и инотропное
влияние). И то и другое уменьшает
потребность миокарда в кислороде,
нехватка которого резко ощущается при
ишемии миокарда.
-Выработка эндотелием
коронарных сосудов вазодилататорных
биологически активных веществ и
метаболитов. Поврежденный атеросклерозом
эндотелий коронарных сосудов в меньшей
степени, чем неповрежденный эндотелий,
способен вырабатывать эти вещества.
Однако они всё же в нем вырабатываются.
В определенных условиях такие вещества
как аденозин, оксид азота, простагландины,
способны предупредить или снизить
степень вазоконстрикции.
Кардиогенный
шок – это
критическое состояние, которое развивается
вследствие острой артериальной
гипотензии, обусловленной резким
падением насосной функции левого
желудочка.
Первичное звено
патогенеза кардиогенного шока – это
быстрое снижение ударного объема левого
желудочка, которое приводит к артериальной
гипотензии, несмотря на компенсаторный
спазм резистивных сосудов и рост общего
периферического сосудистого сопротивления
(ОПСС), направленные на восстановление
артериального давления.
В силу резкого
угнетения сократительной способности
сердечной мышцы у больных в состоянии
кардиогенного шока невозможно
компенсаторное возрастание минутного
объема кровообращение (МОК) в результате
адренергической нейрогуморальной
стимуляции сердца в ответ на артериальную
гипотензию и циркуляторную гипоксию.
Кроме артериальной гипотензии, доставку
кислорода клетке при кардиогенном шоке
снижает юкстакапиллярное шунтирование
вследствие компенсаторно-патогенного
спазма сосудов сопротивления. Артериальная
гипотензия и снижение кровотока по
обменным капиллярам вследствие спазма
мельчайших артерий, артериол и
прекапиллярных сфинктеров нарушают
кровоток в органах на периферии и
вызывают основные симптомы кардиогенного
шока.
При кардиогенном
шоке артериальная гипотензия сразу же
начинает выступать одним из основных
звеньев патогенеза.
Артериальной
гипотензия как следствие падения
ударного объема левого желудочка
развивается тогда, когда некробиотическим
изменениям более чем одна треть массы
миокарда левого желудочка. Такие
нарушения сердечного ритма как полная
поперечная блокада сердца, брадиаритмии,
политопная желудочковая тахисистолия
ведут к дискоординации сокращений
предсердий и желудочков, снижению
времени диастолического наполнения
левого желудочка, падению его ударного
объема и кардиогенному шоку.
Компенсаторные
реакции в ответ на артериальную гипотензию
и циркуляторную гипоксию при кардиогенном
шоке включают:
– преимущественно
нейрогенный спазм вен в результате
усиления симпатических сосудосуживающих
влияний;
– активацию
ренин-ангиотензин-альдостеронового
механизма, в том числе и в результате
системной адренергической стимуляции;
– компенсаторную
аутогемоделюцию, т.е. мобилизацию
жидкости из интерстициального сектора
в сосудистый вследствие изменения на
системном уровне соотношения между
пре- и посткапиллярным сосудистым
сопротивлением.
Биологическая
роль данных компенсаторных реакций –
поддержание МОК и АД через рост общего
венозного возврата, задержку в организме
натрия и воды, увеличение внутрисосудистого
жидкостного спектра и возрастание ОПСС.
При кардиогенном шоке эти защитные
реакции увеличивают пред – и постнагрузку,
а значит, повышают утилизацию свободной
энергии кардиомиоцитами. Рост работы
клеток сократительного миокарда повышает
несоответствие между потребностью
сердца в кислороде и доставкой его к
нему.
Основная
патофизиологическая особенность
кардиогенного шока – это изначально
присущие компенсаторным реакциям
свойства звеньев патогенеза, действие
которых приводит к прогрессированию
шока и его необратимости. Кроме того,
при кардиогенном шоке поражен основной
эффектор компенсаторных реакций,
направленных на поддержание МОК –
сердце.
О внезапной
сердечной смерти
хочется сказать особо. Внезапной
коронарной смертью (внезапной сердечной
смертью) называют неожиданную смерть,
возникшую мгновенно или в пределах 1
ч после появления первых симптомов
коронарной
катастрофы (ангинозные боли, аритмия).
Чаще
всего (более 90% случаев) внезапная
сердечная
смерть наступает у пациентов, имевших
до
этого заболевания сердца, но находившихся,
с
точки зрения врача, в относительно
стабильном,
неопасном для жизни состоянии.
В США от ВСС ежегодно погибает около400000
человек, больше половины из которых
считались абсолютно здоровыми.
Непосредственными
причинами внезапной сердечной смерти
являются фибрилляция желудочков и
желудочковая
тахикардия (80% случаев), а также
асистолия или резкая брадикардия (20%).
К
причинам ВСС у взрослых относят:
постинфарктный
кардиосклероз, кардиомиопатии (особенно
гипертрофическую), миокардиты, аномалии
проводящей системы (например, синдром
Вольфа-Паркинсона-Уайта
– WPW),
синдром удлиненного
интервала Q-T.
У лиц молодого возраста
внезапная сердечная смерть может быть
следствием
спазма коронарных артерий даже при
отсутствии
коронарного атеросклероза. При
патологоанатомическом
исследовании у них не удается
выявить никаких морфологических
изменений
в сердечной мышце. В этом случае причиной
ВСС считается стрессорное повреждение
сердца.
Патогенез ВСС до
конца не изучен. Еще Леонардо да Винчи
отмечал взаимосвязь между поражением
сердечных сосудов и внезапной смертью,
хотя в тоже время не было известно ни о
факторах риска, ни о причинах её
возникновения. По современным
представлениям, непосредственной
причиной развития ВСС является
электрическая нестабильность сердца,
приводящая к трепетанию или фибрилляции
желудочков, которые могут возникать
как в острую фазу ИМ, так и в результате
стрессовых ситуаций. В этих случаях
происходит активация симпатоадреналовой
системы, гиперкатехоламинемия, повышается
потребность миокарда в кислороде. На
ЭКГ – депрессия сегмента ST,
желудочковые экстрасистолы.
Соседние файлы в папке патфиз лекции+методы
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
