Острый инфаркт миокарда постановка диагноза
“Сначала победи, потом сражайся”
ОПРЕДЕЛЕНИЕ ОСТРОГО КОРОНАРНОГО СИНДРОМА
Клинические симптомы острой ишемии миокарда, включая инфаркт миокарда и нестабильную стенокардию, обычно вызванные атеросклерозом коронарных артерий и ассоциирующиеся с повышением риска сердечной смерти (ACC/AHA).
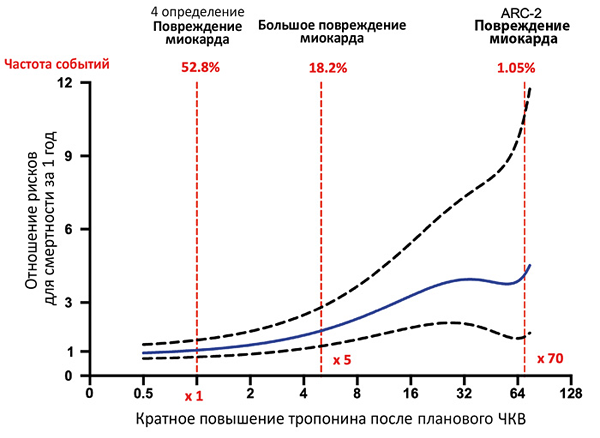
Спектр повреждений миокарда (ESC/ACC/AHA/WHF)
ТИПЫ ИНФАРКТА МИОКАРДА (ESC/ACCF/AHA/WHF)
• Тип 1: Коронарный атеротромбоз.
• Тип 2: Дисбаланс между снабжением миокарда кислородом и потребностью, не связанный с коронарным тромбозом.
• Тип 3: Сердечная смерть.
• Тип 4a: Последствия коронарного вмешательства.
• Тип 4b: Тромбоз стента.
• Тип 4c: Рестеноз внутри стента или после ангиопластики.
• Тип 5: Последствия коронарного шунтирования.
Расслоение коронарной артерии
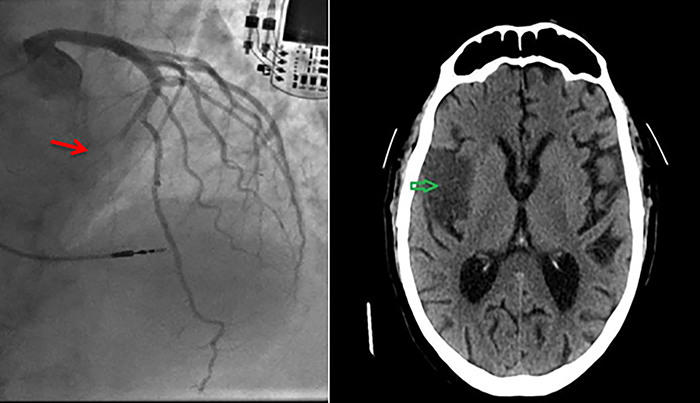
Расслоение и дистальный тромбоз передней нисходящей коронарной артерии.
Алгоритм диагностики острого коронарного синдрома (ESC)
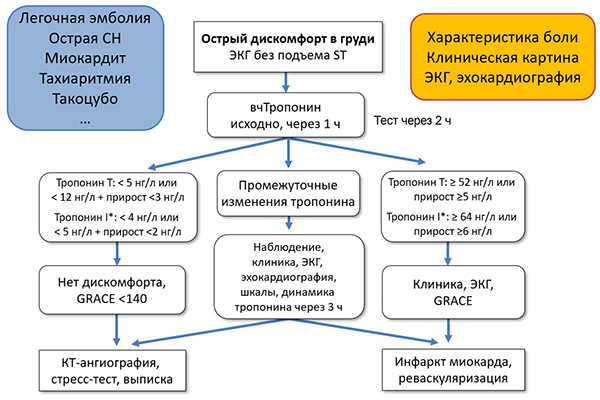
* – Abbott-hs-cTnI-Architect
КРИТЕРИИ ДИАГНОЗА ИНФАРКТА МИОКАРДА (ESC/ACCF/AHA/WHF)
Инфаркт миокарда 1–2 типов
Острое повреждение миокарда с клиникой миокардиальной ишемии и повышением и/или снижением сердечного тропопнина, если хотя бы одно значение выше порогового уровня (99 перцентиля) и присутствует хотя бы один признак:
• симптомы ишемии миокарда;
• новые ишемические изменения ЭКГ;
• формирование патологических зубцов Q на ЭКГ;
• визуализационные признаки новой потери жизнеспособного миокарда или нарушений локальной сократимости, характерные для ишемической этиологии;
• внутрикоронарный тромб при ангиографии или аутопсии (не для 2 типа).
Инфаркт миокарда 3 типа
Сердечная смерть с симптомами, возможно связанными с ишемией миокарда, сопровождающаяся предположительно новыми ишемическими изменениями ЭКГ или фибрилляцией желудочков, если смерть наступила до получения образцов крови или до повышения уровня биомаркеров или инфаркт миокарда выявлен при аутопсии.
Инфаркт миокарда 4 типа
В период до 48 ч после чрескожного коронарного вмешательства уровень тропонина повысился >5 раз от порогового уровня при исходно нормальном уровне или >20% при исходно повышенном содержании (стабильном или снижающемся). Дополнительно присутствует хотя бы один признак: симптомы ишемии миокарда, новые ишемические изменения или патологический зубец Q на ЭКГ, визуализационные признаки новой потери жизнеспособного миокарда или нарушений локальной сократимости, характерные для ишемической этиологии, ангиографические признаки снижения кровотока вследствие процедуры, тромбоз стента или рестеноз.
Инфаркт миокарда 5 типа
В период до 48 ч после коронарного шунтирования уровень тропонина повысился >10 раз от порогового уровня при исходно нормальном уровне или >20 % и >10 раз от порогового уровня при исходно повышенном содержании (стабильном или снижающемся). Дополнительно присутствует хотя бы один признак: патологический зубей Q на ЭКГ, ангиографические признаки окклюзии шунта или нативной коронарной артерии, визуализационные признаки новой потери жизнеспособного миокарда или нарушений локальной сократимости, характерные для ишемической этиологии.
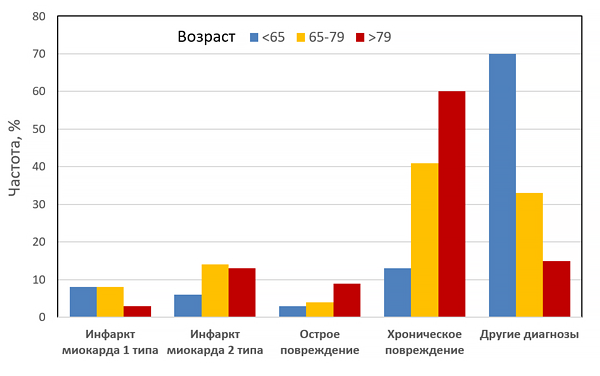
Инфекция и риск инфаркта миокарда
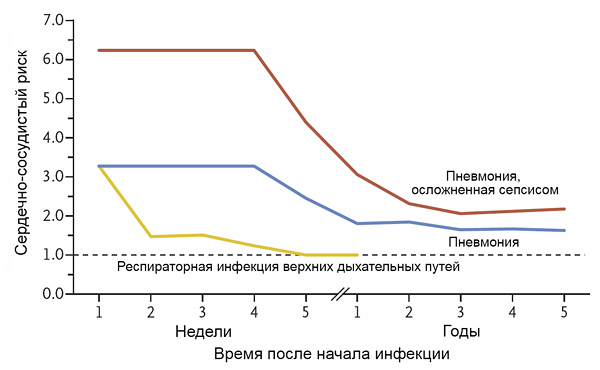
Musher D, et al. N Engl J Med. 2019;2:171–6.
КРИТЕРИИ ПЕРЕНЕСЕННОГО ИНФАРКТА МИОКАРДА (ESC/ACCF/AHA/WHF)
• Патологические зубцы Q c симптомами или без них при отсутствии неишемических причин.
• Визуализационные признаки (эхокардиография, сцитниграфия) утраты жизнеспособного миокарда, характерные для ишемической этиологии.
• Патоморфологические признаки перенесенного инфаркта миокарда.
Морфология
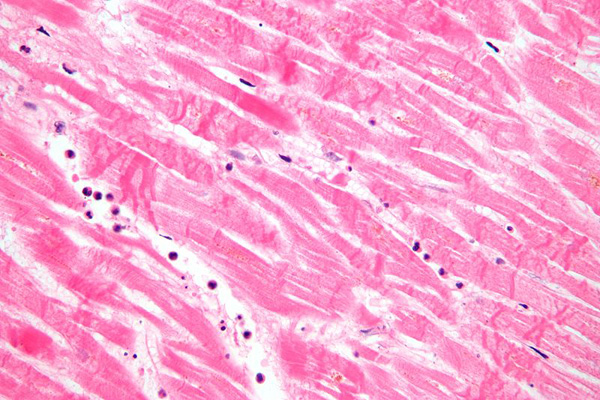
Коагуляционный некроз и волнистые волокна при однодневном инфаркте миокарда. Широкие пространства между погибшими волокнами включают отек жидкости и редкие нейтрофилы.
ПАТОГЕНЕЗ ИНФАРКТА МИОКАРДА
• Тромб при разрыве или эрозии атеросклеротической бляшки.
• Спазм на фоне атеросклероза, дистальная эмболия.
• Некоронарогенный факторы: лихорадка, тахикардия, тиреотоксикоз (вазоспазм), анемия, гипоксемия, гипотензия, аллергия (вазоспазм).
Морфология бляшки и риск сосудистых катастроф
Stone G, et al. N Engl J Med. 2011;364:226–35.
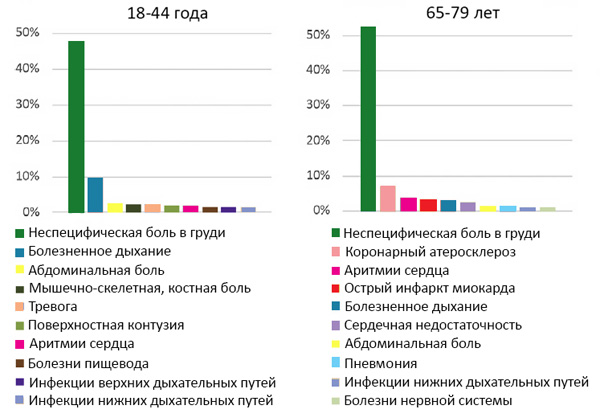
ДИАГНОСТИКА КЛИНИЧЕСКАЯ
Типичная
• Дискомфорт или боли в грудной клетке, более 20 мин,
отсутствие связи с положением тела, кашлем и дыханием, нет эффекта нитроглицерина.
Атипичная
• Дискомфорт в шее, челюсти, руках, между лопаток, эпигастрии.
• Одышка.
• Общая слабость.
• Обморок.
• Острое нарушение мозгового кровообращения.
• Тошнота, рвота.
• Без симптомов.
Инфаркт миокарда и внешняя температура
Tofield A. Eur Heart J. 2017;38:140.
ДИНАМИКА БИОМАРКЕРОВ ПОВРЕЖДЕНИЯ (NACB; ESC)
| Маркер | Начало подъема, ч | Пик концентрации, ч | Длительность подъема |
| вчТропонин Т | 1 | 24–48 | 5–14 сут |
| вчТропонин I | 1 | 24–36 | 4–7 сут |
| Креатинкиназа-МВ | 4 | 24 | 24–36 ч |
| Миоглобин | 2 | 6–8 | 12–24 ч |
ЭЛЕКТРОКАРДИОГРАММА (ESC/ACCF/AHA/WHF)
Острая ишемия миокарда (нет БЛНПГ или гипертрофии левого желудочка)
• Новые ишемические изменения в двух смежных отведениях.
• Подъем ST ≥1 мм, исключая отведения V2–3.
• Подъем ST ≥2 мм у мужчин (≥2.5 мм до 40 лет) и ≥1.5 мм у женщин в V2–3.
• Новая горизонтальная или нисходящая депрессия сегмента ST ≥0.5 мм.
• Новая инверсия зубца Т ≥1 мм при доминирующих зубцах R или R/S >1.
Предшествующий инфаркт миокарда
• Комплексы QS или зубцы Q ≥0.03 сек и глубиной ≥1 мм в двух смежных отведениях.
• Комплексы QS или зубцы Q ≥0.02 сек в V2–3.
• Зубец R ≥0.04 сек в V1–2 и соотношение R/S ≥1 в сочетании с конкордантным положительным зубцом T без нарушения проводимости.
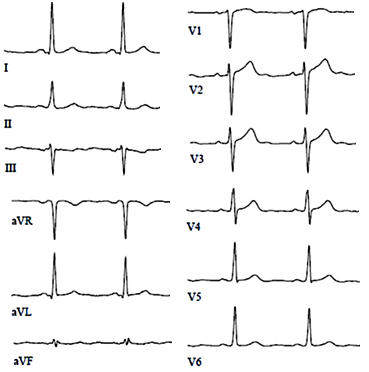
ЭКГ при полной окклюзии левой нисходящей артерии
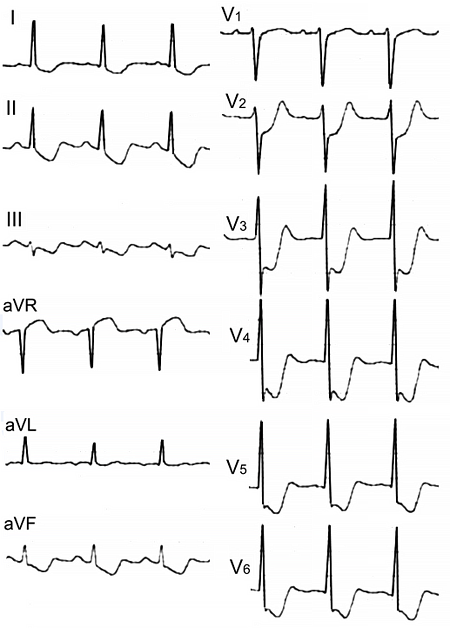
ЭКГ при окклюзии левой главной коронарной артерии
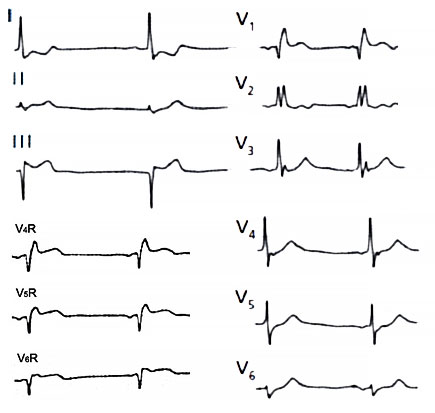
ЭКГ при инфаркте миокарда правого желудочка
ОСЛОЖНЕНИЯ ИНФАРКТА МИОКАРДА
• Острая сердечная недостаточность: кардиогенный шок, отек легкого.
• Разрыв миокарда.
• Фибрилляция желудочков, асистолия.
• Аритмии сердца: желудочковая тахикардия, дисфункция/синдром слабости синусового узла, атриовентрикулярная блокада.
• Аневризма левого желудочка.
• Внутрисердечный тромбоз.
• Осложнения, связанные с лечением: гастроинтестинальные язвы и кровотечения, геморрагический инсульт, гипотензия.
Ошибка диагностики инфаркта миокарда
Перфорация пищевода с пенетрацией миокарда, вызванная мясной костью.
Пациент 73 лет, сильная боль в груди, ЧСС 112 в мин., АД 90/50 мм рт. ст. Erdal U, et al. J Med Case Rep. 2015;9:57.
НЕАТЕРОСКЛЕРОТИЧЕСКИЕ ПРИЧИНЫ ИНФАРКТА МИОКАРДА
• Васкулит, артериит.
• Гипертрофия левого желудочка.
• Эмболия в коронарные артерии (холестерин, воздух, септические эмболы).
• Врожденные аномалии коронарных артерий.
• Травма коронарных артерий.
• Коронарный вазоспазм.
• Химические вещества: кокаин, амфетамины, эфедрин.
• Гипоксемия: тяжелая анемия, дыхательная недостаточность.
• Острый аортальный синдром.
• Другие болезни: синдром Марфана, болезнь Кавасаки, прогерия.
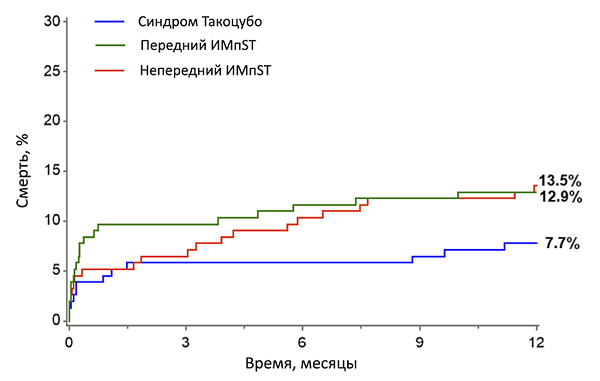
КРИТЕРИИ КАРДИОМИОПАТИИ ТАКОЦУБО (Mayo Clinic)
• Подозрение на острый инфаркт миокарда с прекордиальными болями и подъемом ST в острую фазу.
• Преходящая гипокинезия или акинезия средних и верхушечных областей левого желудочка и функциональная гиперкинезия базальных отделов при эхокардиографии.
• Нормальные коронарные артерии (сужение <50%) в первые 24 ч после начала симптомов.
• Отсутствие значительной травмы головы, внутримозгового кровоизлияния, подозрения на феохромоцитому, миокардит или гипертрофическую кардиомиопатию.
Правосторонний отек легкого

Отек верхней доли справа, связанный с острой митральной регургитаций при инфаркте папиллярных мышц.
КЛАССИФИКАЦИЯ ОСТРЫХ КОРОНАРНЫХ СИНДРОМОВ
ST на электрокардиограмме
• Инфракт миокарда с подъемом ST.
• Острый коронарный синдром/инфаркт миокарда без подъема ST.
• Острое повреждение миокарда.
Типы (причины)
• 1–5 типы.
Локализация по ЭКГ
• Перегородка: V1–2.
• Передняя стенка левого желудочка: V3–4.
• Боковая стенка левого желудочка: V5–6.
• Задняя стенка левого желудочка: V7–9.
• Нижняя стенка левого желудочка: V2–3, aVF.
• Правый желудочек: V3R–4R.
Особые формы
• Необструктивная коронарная болезнь.
• Расслоение коронарной артерии.
• Коронарная ангиопластика.
• Тромбоз стента.
ФОРМУЛИРОВКА ДИАГНОЗА
• ОКС без подъема ST (12:40, 12.03.2020), высокий риск. [I24.9]
• Инфаркт миокарда с подъемом ST передне-септальной области левого желудочка (тромболизис фортеплазе 4:20, 12.04.2019). Killip III. Мономорфная желудочковая тахикардия. [I21.0]
• Инфаркт миокарда без подъема ST боковой стенки левого желудочка (12.04.2019), высокий риск. [I21.0]
• Инфекционный эндокардит (2010, 10.02.2020), недостаточность аортального клапана, ХСН III ФК. Инфаркт миокарда 2 типа, без подъема ST, передней стенки левого желудочка (24.02.2020).
• Пароксизмальное типичное трепетание предсердий (1:1), осложненное инфарктом миокарда 2 типа (14.11.2019). [I48.3]
• Стентирование передней нисходящей коронарной артерии (Xience, 10.11.2019). Инфаркт миокарда 4б типа, без подъема ST, передний (10.11.2019). [I21.4]
• Инфаркт миокарда без подъема ST (29.11.2015), ассоциированный с амфетамином. [I21.4]
Прогноз инфаркта миокарда 1 и 2 типов (SWEDEHEART)
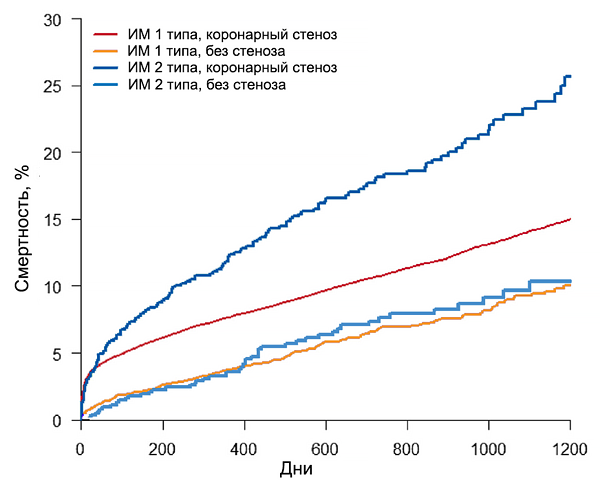
Baron T, et al. Am J Med. 2016;129:398–406.
ВИДЫ РЕПЕРФУЗИИ ПРИ ОСТРОМ КОРОНАРНОМ СИНДРОМЕ С ПОДЪЕМОМ ST
• Тромболизис (фибринолиз): тканевой активатор плазминогена (алтеплаза, тенектеплаза), стрептокиназа, фортеплазе.
• Инвазивная: первичное чрескожное коронарное вмешательство.
• Фармаконвазивная: тромболизис (догоспитальный) с последующим чрескожным коронарным вмешательством.
Бригада неотложной помощи
ПОКАЗАНИЯ ДЛЯ РЕПЕРФУЗИИ ПРИ ОСТРОМ КОРОНАРНОМ СИНДРОМЕ С ПОДЪЕМОМ ST (ACCF/AHA; ESC)
Общие показания
• <12 ч от начала дискомфорта в груди.
• Подъем ST ≥1 мм в 2 смежных отведениях (V1–6 или I, aVL или II, III, aVF или V3–4R).
• Клинические и/или электрокардиографические признаки сохраняющейся/рецидивирующей ишемии миокарда в период >12 ч.
Инвазивная реперфузия
• Предпочтительный метод при соответствующих сроках и опытном операторе.
• Острая сердечная недостаточность Killip III–IV.
• Тромболитики неэффективны или противопоказаны.
• Пациент переносит рентгенконтрастные препараты.
Тромболизис
• Задержка инвазивной реперфузии ≥120 мин после диагноза.
• <2–3 ч от начала симптомов при низком риске кровотечений, задержка инвазивной реперфузии.
• Отсутствие противопоказаний к тромболитикам.
• Анафилаксия на рентгенконтрасты.
Годовая смертность и время реперфузии (CAPTIM, WEST)
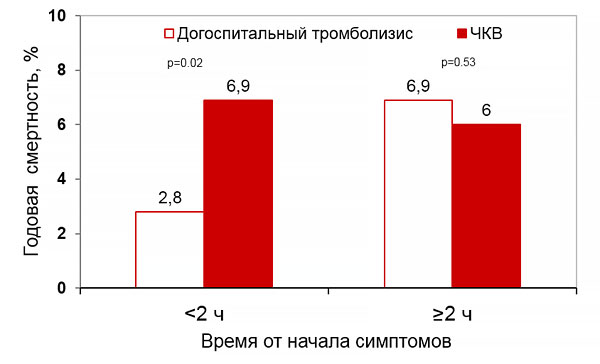
Westerhout C, et al. Am Heart J. 2011;161:283–90.
ПРОТИВОПОКАЗАНИЯ ДЛЯ ТРОМБОЛИЗИСА (ACCF/AHA)
Абсолютные
• Любая предшествующая внутримозговая геморрагия.
• Известное заболевание сосудов головного мозга (например, артериовенозная мальформация).
• Злокачественное новообразование центральной нервной системы.
• Ишемический инсульт в течение 3 мес, исключая первые 4.5 ч.
• Подозрение на расслоение аорты.
• Активное кровотечение или геморрагическое заболевание (исключая месячные).
• Закрытая травма головы или лица в течение 3 мес.
• Хирургия головного или спинного мозга в течение 2 мес.
• Тяжелая неконтролируемая гипертензия (без эффекта от неотложного лечения).
Относительные
• В анамнезе хроническая, тяжелая, плохо контролируемая артериальная гипертензия.
• Тяжелая артериальная гипертензия при поступлении (АД систолическое >180 или АД диастолическое >110 мм рт. ст.).
• Ишемический инсульт >3 мес в анамнезе.
• Деменция.
• Внутримозговая патология, не относящаяся к абсолютным противопоказаниям.
• Длительная (>10 мин) или травматичная реанимация.
• Большая хирургия до 3 нед.
• Недавнее (2–4 нед) внутреннее кровотечение.
• Некомпрессируемые пункции (например, биопсия печени или люмбальная).
• Беременность или первая неделя после родов.
• Терапия оральными антикоагулянтами.
• Активная гастродуоденальная язва.
• Инфекционный эндокардит.
• Тяжелые заболевания печени.
Время до первичной ангиопластики и летальность
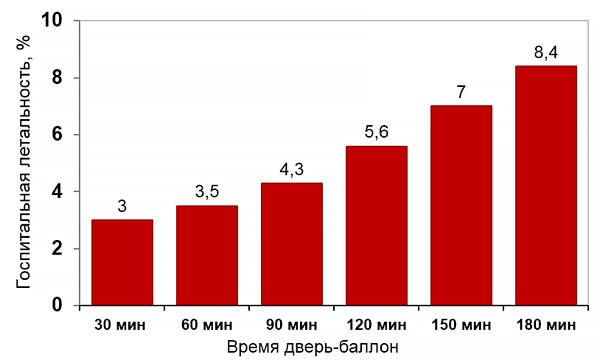
Rathore S, et al. BMJ. 2009;338:b1807.
ПОКАЗАНИЯ ДЛЯ ИНВАЗИВНОГО ЛЕЧЕНИЯ ПРИ ОКС БЕЗ ПОДЪЕМА ST (ESC)
Экстренное лечение
• Рефрактерные ангинозные боли.
• Острая сердечная недостаточность (III–IV класс по Killip).
• Жизнеопасные аритмии (фибрилляция желудочков, желудочковая тахикардия).
• Повторные изменения ST-T, особенно с подъемом ST.
Ранее (<24 ч) лечение
• Повышение и снижение уровня тропонина, характерное для ИМ.
• Динамические изменения ST или T (симптомные или латентные).
• Высокий риск (шкала GRACE >140, mini-GRACE >112, PURSUIT >14).
В период госпитализации
• Диабет.
• Снижение функции почек (рСКФ <60 мл/мин/1.73 м²).
• Сниженная функция левого желудочка (ФВ <40%).
• Ранняя постинфарктная стенокардия.
• Недавнее чрескожное коронарное вмешательство.
• Предшествующее коронарное шунтирование.
• Умеренный риск (шкала GRACE 109–140).
Сравнение баллонной контрпульсации и внутрисердечного насоса при шоке
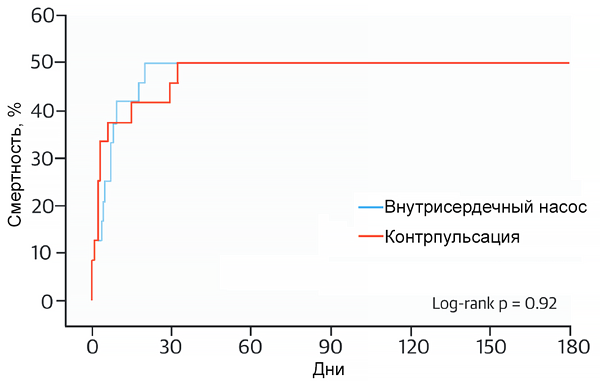
Ouweneel D, et al. J Am Coll Card. 2017;69:278.
ЛЕЧЕНИЕ МЕДИКАМЕНТОЗНОЕ
• Дезагреганты: аспирин + тикагрелор или прасугрел (при ЧКВ) или клопидогрел.
• Фондапаринукс или эноксапарин или нефракционированный гепарин (инфузия).
• Бета-блокаторы: атенолол, метопролол, пропранолол.
• ИАПФ: лизиноприл, зофеноприл, каптоприл.
• Нитраты (инфузия нитроглицерина): при рецидивирующих болях, сердечной недостаточности, гипертензии.
ВТОРИЧНАЯ ПРОФИЛАКТИКА
• Противотромботические препараты: аспирин, тикагрелор, прасугрел, клопидогрел.
• Бета-блокаторы: атенолол, бисопролол, карведилол, метопролол.
• ИАПФ: лизиноприл, эналаприл, рамиприл, зофеноприл.
• Статины: розувастатин 20–40 мг, аторвастатин 80 мг.
• Коррекция факторов риска: снижение АД <130/80 мм рт. ст., отказ от курения, контроль гликемии (HbA1c 6.5–7% не допуская гипогликемии) с помощью ингибиторов натрий-глюкозного котранспортера 2 или антагонистов глюкагоноподобного пептида 1, физические нагрузки, средиземноморская диета.
Источник
Примеры формулировки диагноза
1. ИБС. Трансмуральный инфаркт миокарда (Q-инфаркт) передней стенки левого желудочка с
распространением на перегородку и верхушку. Острый период. Пароксизмальная мерцательная аритмия.
Кардиогенный шок.
2. ИБС. Инфаркт миокарда задней стенки без зубца Q. Подострый период.
Лечение неосложненного инфаркта миокарда представляет собой одновременно и сложную и
понятную задачу. С одной стороны, разработаны достаточно подробные стандарты и формуляры терапии
подобных пациентов. С другой стороны, в ходе развития инфаркта возможно появление различного рода
осложнений и поворот ситуации в непредвиденную сторону даже казалось бы на фоне относительно
2. Реваскуляризация.
3. Ограничение зоны некроза и профилактика ремоделирования. Важнейшим вмешательством,
способным предотвратить фатальные осложнения, следует считать адекватное обезболивание пациента.
Для этой цели применяются наркотические анальгетики — морфин (1%), тримепиридин (промедол, 1-2%)
или фентанил (0,005%). Последний имеет преимущество, так как оказывает быстрый эффект, а в связи с
ускоренной фармакокинетикой создает условия для многократных повторный введений. Широкое
применение получил метод нейролептанальгезии, представляющий собой сочетанное введение
наркотического анальгетика фентанила и нейролептика дроперидола (0,25%). При этом достигается
оптимальный эффект: наркотический анальгетик вызывает сильное и адекватное обезболивание, а
нейролептик способствует уменьшению субъективного восприятия пациентом боли, потенцирует действие
анальгетика. С учетом гипотензивного эффекта дроперидола этот метод показан при инфарктах миокарда,
развивающихся на фоне повышенного артериального давления. Следует учесть, что при гипотонии
нейролептики надо вводить с осторожностью. С этой целью можно изменить соотношение вводимых
фентанила и дроперидола, которое обычно составляет 1:1. Все другие методы обезболивания инфаркта
малоэффективны.
Вопрос о возможности восстановления проходимости коронарного кровотока в зоне окклюзии
начал привлекать внимание врачей с момента понимания патогенеза инфаркта миокарда. Однако первые
попытки тромболизиса оказались не вполне удачными. У ряда пациентов при успешной реваскуляризации
отмечалось появление серьезных аритмий, иногда завершающихся фатально. При выяснении причин этого
явления было установлено, что зона некроза не представляет собой однородную структуру. В ней
присутствуют полоски живого миокарда толщиной в 2-3 клетки, которые располагаются ближе к
эндокарду. Иногда эти участки сохраняются непосредственно в сформировавшихся рубцах. При
восстановлении коронарного кровотока возможна активация этих клеток с соединением их в общую сетку.
Таким образом, создаются условия для возникновения механизма re-entry, являющегося
пусковым элементом тяжелых нарушений сердечного ритма. Этому способствуют также
реоксигенационные изменения, приводящие к активации свободнорадикальных реакций и
распространению некроза. Поэтому наиболее целесообразно использование этого метода в первые 4 часа от
появления симптомов заболевания, когда еще нет полноценного некроза и вероятность восстановления
кардиомиоцитов максимальна.
Медикаментозная реваскуляризация проводится с помощью препаратов, относящихся к группе
фибринолитиков. Механизм их действия связан с переводом циркулирующего в крови плазминогена в
активный фермент плазмин, который вызывает лизис и разрушение тромба. К ним относят
вырабатываемый β-гемолитическим стрептококком фибринолитик стрептокиназу, и тканевой активатор
плазминогена (альтеплаза). Препараты вводят внутривенно болюсно с последующей внутривенной
инфузией в течение 30-60 минут. Показанием служит достоверный инфаркт миокарда с подъемом сегмента
ST. Признаком успешного тромболизиса служит купирование болевого синдрома, снижение сегмента ST на
ЭКГ и ранний пик активности КФК (до 12 часов) вследствие выхода в кровь продуктов из зоны некроза.
Другим методом восстановления коронарного кровотока может считаться чрескожная
баллонная ангиопластика. На ранних стадиях коронарной окклюзии до организации тромба возможно
восстановление проходимости артерии катетеризацией ее с проведением баллона ниже места сужения.
Этот метод применяется при наличии технических возможностей, кардиогенном шоке и плохо
купирующемся болевом синдроме.
Поддержать проходимость коронарной артерии необходимо назначением антикоагулянтов
прямого действия, к которым относят разнообразные гепарины. Простой гепарин вводят болюсом 5000 ед,
с последующим внутривенным введением 1000 ед/час. Более эффективны и безопасны низкомолекулярные
(фракционированные) гепарины.
Применение этих препаратов следует прекратить через 48 часов, кроме случаев мерцательной
аритмии, повторной ишемии миокарда, передневерхушечном инфаркте для профилактики острых тром-
боэмболических осложнений.
Вполне понятно, что длительный прием гепарина больными инфарктом миокарда невозможен в
силу большого числа побочных эффектов. Между тем риск повышенного тромбообразования как
системного, так и внутрикоронарного требует продолжения противосвертывающей терапии. С этой целью
наиболее целесообразным следует считать использование препаратов из класса антиагрегантов. Вне
конкуренции в этой группе остается ацетилсалициловая кислота (аспирин). Его назначают с первых дней
инфаркта и на длительное время, иногда пожизненно. Препарат показан всем лицам с инфарктом миокарда
за исключением случаев истинной аллергии к препарату. Назначается перорально во время еды в суточной
дозе 325 мг. Использование специальных форм для кардиологических больных делает возможным прием
препарата даже при сопутствующей патологии желудочно-кишечного тракта.
Нитраты уменьшают ишемию и боль, осуществляют гемодинамическую разгрузку левого
желудочка уменьшением венозного возврата. Так как явления левожелудочковой недостаточности в той
или иной мере выраженности присутствуют у большинства пациентов с инфарктом, то в первые 24^48
часов целесообразно внутривенное введение нитроглицерина всем больным с постепенным повышением
дозы с 5-10 до 200 мкг/мин. При развитии сердечной астмы и отека легких, назначение нитроглицерина
служит методом выбора.
После купирования болевого синдрома и проведения адекватной тромболитической и
противосвертывающей терапии главной задачей остается ограничение зоны некроза и профилактика
постинфарктного ремоделирования. Так как ключевым патогенетическим звеном этих процессов является
нейрогуморальная активация, то именно препараты из группы нейрогуморальных модуляторов следует
назначать в первую очередь.
Прежде всего, эта цель достигается назначением β-блокаторов. При отсутствии
противопоказаний их назначают в первые сутки от начала заболевания. Следует избегать раннего
назначения лицам с брадикардией, гипотонией, нижним инфарктом миокарда, признаками сердечной
недостаточности, сниженной фракцией выброса левого желудочка, атриовентрикулярной блокадой,
хронической обструктивной болезнью легких. Прием (β -блокаторовов должен проводиться не менее 2-3
лет.
В связи с тем, что у большинства больных инфарктом миокарда отмечаются явления сердечной
недостаточности, оптимальным следует считать назначение (3-блокаторов, эффективность и безопасность
которых доказана при нарушениях сократительной функции миокарда. К ним относят селективные
препараты метопролол (Эгилок, «Egis») 25-50 мг 2 раза в сутки, или метопрололретард (Эгилок-ретард,
«Egis») в тех же дозах однократно; бисопролол 2,5-10 мг 1 раз в сутки; а также неселективный |3-блокатор
карведилол (Кориол, «KRKA») в дозе 3,125-6,25 мг 2 раза в сутки. Лечение начинают с минимальных доз, а
при хорошей переносимости ее постепенно повышают.
Многоцентровыми исследованиями последних лет доказана эффективность ингибиторов АПФ
для профилактики постинфарктного ремоделирования. Их назначают со вторых суток инфаркта и
применяют длительное время. Что касается конкретных препаратов, то возможности выбора в настоящее
время очень велики. Это кап-топрил 12,5-50 мг 3 раза в сутки, эналаприл (Энап, «KRKA») 2,5-10 мг/сут, в
два приема, рамиприл (Хартил, «Egis») 2,5-5 мг 1 раз в сутки, лизиноприл 10-20 мг 1 раз в сутки,
фозиноприл (Моноприл, BMS) 10-20 мг 1 раз в сутки, периндоприл (Престариум, «Sender») 4-8 мг в 1 раз в
сутки.
Если говорить о так называемой метаболической терапии, включающей витамины,
антиоксиданты и антигипоксанты, то их эффективность в остром периоде инфаркта не получила серьезной
доказательной базы.
Таким образом, к моменту выписки больной инфарктом миокарда должен получать три
обязательных препарата: аспирин, β-блокатор, ингибитор АПФ. Прочие препараты, применяемые для
лечения хронических форм ИБС, назначаются по показаниям, о которых говориться в соответствующей
лекции.
Лечение осложнений инфаркта миокарда проводится в соответствии с общепринятыми
стандартами терапии. Так лечение острой левожелудочковой недостаточности включает в себя применение
морфина, инфузию нитратов и диуретики. При кардиогенном шоке назначают вазоактивные
симпатомиметики (добутамин или допамин), глюкокортикоиды и противошоковую инфузионную терапию
под контролем давления в малом круге.
Лечение синдрома Дресслера заключается в применении НПВС. При их неэффективности
назначают глюкокортикоиды в стандартных дозировках с постепенным уменьшением дозы и отменой в
течение 2-4 недель.
Несколько слов о немедикаментозных методах лечения инфаркта миокарда, к которым следует
отнести хирургическое лечение и баллонную коронарную ангиопластику. Оперативное лечение в остром
периоде показано при угрожающих жизни разрывах стенки миокарда, сосочковых мышц и
межжелудочковой перегородки. При нарастании острой сердечной недостаточности показана аневриз-
мэктомия. Естественно по ходу таких операций решается вопрос о целесообразности аортокоронарного
Формулирование диагноза постинфарктного кардиосклероза
При формулировании диагноза постинфарктного кардиосклероза надо учитывать срок, прошедший после инфаркта миокарда. Этот диагноз устанавливается спустя 8 нед со дня возникновения или последнего рецидива острого инфаркта миокарда. Диагноз постинфарктного кардиосклероза сохраняется на протяжении всей жизни больного, даже если отсутствуют другие проявления ИБС и на ЭКГ исчезли признаки рубцового поражения миокарда. Пример формулировки диагноза: «ИБС, постинфарктный кардиосклероз».
Если у больного имеются нарушения сердечного ритма или признаки сердечной недостаточности, то их отмечают в диагнозе с указанием формы аритмии и стадии недостаточности кровообращения. Например: «ИБС, постинфарктный кардиосклероз, постоянная форма мерцательной аритмии, НК IIБ».
Если у больного имеется стенокардия, то ее указывают в диагнозе перед кардиосклерозом. Например: «ИБС, стенокардия напряжения ФК IV, постинфарктный кардиосклероз, атриовентрикулярная блокада II степени, НК IIА».
В современной классификации ИБС отсутствует привычный термин «атеросклеротический кардиосклероз». Необходимость в первой части термина, указывающей на ишемический генез патологии миокарда, отпала в связи с формулировкой «ИБС» в основном диагнозе. Вторая часть термина должна была указывать на то, что у больного под влиянием тяжелой ишемии развились диффузные мелкорубцовые поражения миокарда (в отличие от постинфарктных рубцов). Этим подчеркивался «органический» характер ишемического поражения как более значимый в противовес менее значимым «функциональным» поражениям.
На практике этот диагноз часто ставился больным ИБС с изменениями ЭКГ покоя. Однако по ЭКГ невозможно дифференцировать ишемические и «мелкорубцовые» изменения миокарда. Так, после успешной операции аортокоронарного шунтирования могут полностью исчезнуть многолетние изменения ЭКГ покоя, которые считались проявлениями кардиосклероза. У большинства больных изменения ЭКГ имеют иной генез.
«Стенокардия», В.С. Гасилин
Читайте далее:
Затруднения в формулировке диагноза ИБС
Кафедра внутренних болезней №3, поликлинической терапии и общеврачебной практики
^ ЧАСТЬ I. ОКС С ПОДЪЕМОМ СЕГМЕНТА ST
(КРУПНООЧАГОВЫЙ ИНФАРКТ МИОКАРДА)
1. ДИАГНОСТИКА ИНФАРКТА МИОКАРДА
1.1. Диагностические критерии ИМ (ESC/ACC, 2000 г.)
Критерии острого, развивающегося или недавнего ИМ
Один из критериев достаточен для диагноза острого, развивающегося или недавнего ИМ:
1) Типичное повышение и постепенное снижение (тропонины) или более быстрое повышение и снижение (КФК-МВ) биохимических маркеров некроза миокарда в сочетании как минимум с одним из следующих признаков:
а) ишемические симптомы;
б) изменения ЭКГ, свидетельствующие об ишемии (элевация или депрессия сегмента ST);
в) появление патологического зубца Q на ЭКГ;
г) коронарная интервенция (например, коронарная ангиопластика).
2) Патологоанатомические признаки острого ИМ.
Критерии подтвержденного ИМ
Один из критериев достаточен для диагноза подтвержденного ИМ:
1) Появление нового патологического зубца Q на нескольких ЭКГ. Пациент может помнить или не помнить предшествующие симптомы. Биохимические маркеры некроза миокарда могут нормализоваться в зависимости от времени, прошедшего с момента начала инфаркта.
2) Патологоанатомические признаки зажившего или заживающего ИМ.
Болевой синдром:
локализация – загрудинная; эпигастральная область;
иррадиация – широкая (в плечи, предплечья, ключицы, шею, нижнюю челюсть (чаще слева), левую лопатку, межлопаточное пространство);
характер – давящий, жгучий, сжимающий, распирающий;
продолжительность – от 20-30 минут до нескольких часов;
болевой синдром часто сопровождается возбуждением, чувством страха, двигательным беспокойством и вегетативными реакциями, потливостью, гипотензией, тошнотой, рвотой, не купируется нитроглицерином.
^ 1.2. Электрокардиографическая диагностика инфаркта миокарда
Острейший период: формирование высокого остроконечного зубца
Т (ишемия) и подъем сегмента ST (повреждение). Сегмент ST имеет горизонтальную, вогнутую, выпуклую или косовосходящую форму, может сливаться с зубцом Т, образуя монофазную кривую. В отведениях, характеризующих противоположные инфаркту зоны миокарда, может регистрироваться реципрокная депрессия сегмента ST.
Острый период: появляется патологический зубец Q или комплекс
QS. Патологическим считается зубец Q продолжительностью более 0,03 с и амплитудой более. амплитуды зубца R в отведениях I, aVL, V1-V6 или более. амплитуды зубца R в отведениях II, III и aVF. Зубец R может уменьшиться или исчезнуть, а в противоположных отведениях – увеличиться. Подострый период: сегмент ST возвращается к изолинии, формируется отрицательный зубец Т.
Период рубцевания (постинфарктный кардиосклероз): амплитуда отрицательного зубца Т уменьшается, со временем он становится изоэлектричным и положительным. Сегмент ST на изолинии. Зубец Q обычно сохраняется, однако в ряде случаев он может уменьшиться или исчезнуть за счет компенсаторной гипертрофии здорового миокарда.
Данные изменения ЭКГ характерны для инфаркта миокарда с зубцом Q (крупноочагового, трансмурального). ИМ без зубца Q (мелкоочаговый, интрамуральный, субэндокардиальный) диагностируется на основании динамических изменений сегмента ST и зубца T.
^ 1.2. Электрокардиографическая диагностика инфаркта миокарда
Острейший период: формирование высокого остроконечного зубца Т (ишемия) и подъем сегмента ST (повреждение). Сегмент ST имеет горизонтальную, вогнутую, выпуклую или косовосходящую форму, может сливаться с зубцом Т, образуя монофазную кривую. В отведениях, характеризующих противоположные инфаркту зоны миокарда, может регистрироваться реципрокная депрессия сегмента ST.
Острый период: появляется патологический зубец Q или комплекс QS. Патологическим считается зубец Q продолжительностью более 0,03 с и амплитудой более. амплитуды зубца R в отведениях I, aVL, V1-V6 или более амплитуды зубца R в отведениях II, III и aVF. Зубец R может уменьшиться или исчезнуть, а в противоположных отведениях – увеличиться.
Подострый период: сегмент ST возвращается к изолинии, формируется отрицательный зубец Т.
Период рубцевания (постинфарктный кардиосклероз): амплитуда отрицательного зубца Т уменьшается, со временем он становится изоэлектричным и положительным. Сегмент ST на изолинии. Зубец Q обычно сохраняется, однако в ряде случаев он может уменьшиться или исчезнуть за счет компенсаторной гипертрофии здорового миокарда.
Данные изменения ЭКГ характерны для инфаркта миокарда с зубцом Q (крупноочагового, трансмурального). ИМ без зубца Q (мелкоочаговый, интрамуральный, субэндокардиальный) диагностируется на основании динамических изменений сегмента ST и зубца T.
^ Топическая диагностика инфаркта миокарда по данным ЭКГ
Локализация инфаркта
Признаки
Прямые Реципрокные
23.03.14 Истории из жизни (исцеление: инфаркта миокарда, рака крови, новорожденного)
Лечение в Израиле (29) Пороки сердца у детей
Источник
