Острый инфаркт миокарда донекротическая стадия
Исследовали морфологические изменения миокарда и содержание глюкозы, калия, кальция, натрия в перикардиальной жидкости у скоропостижно умерших от острого инфаркта миокарда в донекротической стадии на догоспитальном этапе. Установлено, что острый инфаркт миокарда в донекротической стадии может протекать в двух морфологических формах — либо с трансмуральной, либо субэндо- или субэпикардиальной локализацией ишемического процесса в стенке левого желудочка. Трансмуральное поражение характеризуется большим объемом ишемического поражения левого желудочка, генерализованным спазмом артериальной системы сердца, изменением кардиомиоцитов с нарушением их энергетического обмена и сократительной способности. При субэндо- или субэпикардиальной локализации очаги ишемического повреждения перемежаются с участками нормального кровоснабжения. Одинаковый характер нарушений реологических свойств крови с тромбозом микроциркуляторного русла и количества маркеров фибрилляции желудочков сердца между этими двумя формами создают предпосылки для увеличения зоны некроза в миокарде и обусловливают высокий риск нарушений ритма.
Согласно клинической классификации, острый коронарный синдром (ОКС) включает в себя различные формы ишемической болезни сердца — нестабильную стенокардию (НС) и острый инфаркт миокарда (ОИМ). Наиболее ранняя диагностика ОКС базируется на электрокардиографии и определении уровня кардиоспецифичных маркеров в сыворотке крови, в частности, кардиоспецифичного тропонина I. Первые признаки ишемического повреждения миокарда на электрокардиограмме (ЭКГ) характеризуются подъемом или депрессией сегмента ST, инверсией зубца T (ОКС с подъемом сегмента ST или ОКС без подъема сегмента ST). В течение последующих 2—3 дней от момента сердечного приступа на ЭКГ возможно появление зубца Q — маркера крупноочагового некроза миокарда. В зависимости от результатов ЭКГ и концентрации кардиоспецифичного тропонина I в сыворотке крови определяют прогноз и тактику лечения [1—4].
Морфологическая классификация предусматривает деление острых форм ишемической болезни сердца на острую коронарную недостаточность и ОИМ. Для их посмертной диагностики наряду с гистологическим методом применяют определение активности аспартатаминотрансферазы, лактатдегидрогеназы и содержания кардиоспецифичного тропонина I в перикардиальной жидкости, которая представляет собой ультрафильтрат крови и межклеточной жидкости [5—9], определяют концентрацию ионов калия, натрия и кальция в миокарде [10—13].
Таким образом, клинические данные свидетельствуют, что уже в первые 3 сут от момента сердечного приступа ОИМ представляет собой различные варианты течения заболевания. Морфологические критерии, позволяющие на секционном материале дифференцировать различные формы ОИМ, отсутствуют.
Цель настоящего исследования — выявить морфологические изменения миокарда, различия в содержании глюкозы и электролитов в перикардиальной жидкости в зависимости от объема ишемического повреждения левого желудочка (ЛЖ) при ОИМ в донекротической стадии (ОИМДС) у скончавшихся на догоспитальном этапе.
Материал и методы
Работа выполнена на материале 38 случаев смерти от ОИМДС с трансмуральным (n=23) и субэндокардиальным или субэпикардиальным (n=15) поражением стенки ЛЖ. Среди умерших от трансмурального ОИМДС было 17 мужчин и 6 женщин, средний возраст которых составил 50,1±2,8 года. В крови у 10 человек был обнаружен этиловый спирт в концентрации менее 3‰. От субэндо- или субэпикардиального ОИМДС скончались 11 мужчин и 4 женщины, средний возраст которых достигал 51,6±2,7 года (p>0,05). У 6 человек в крови был обнаружен этиловый спирт в концентрации менее 3‰. Случаев одновременного сочетания субэндо- и субэпикардиального ОИМДС у одного больного мы не наблюдали. Во всех без исключения наблюдениях медицинская помощь не оказывалась.
С момента наступления смерти до исследования трупа проходило не более 1 сут. В связи с тем что донекротическая стадия ОИМ длится первые 24 ч от момента сердечного приступа и в миокарде отсутствует сформировавшийся очаг некроза, для гистологического исследования приводили забор образцов сердца по унифицированной методике. Вырезали 5 кусочков ЛЖ на середине расстояния между верхушкой и митральным клапаном из передней, боковой, задней стенки и межжелудочковой перегородки, а также из верхушки [14]. Материал фиксировали в растворе 10% нейтрального формалина, заливали в парафин. Срезы окрашивали гематоксилином и эозином, хромотропом 2В водным голубым. Неокрашенные микропрепараты изучали в поляризованном свете. Статистический анализ микроскопических данных проводили с использованием процента положительных значений изучаемого признака, выраженного в долях единицы (Р), аргумента нормального распределения и углового преобразования Фишера [15].
Перикардиальную жидкость получали в процессе аутопсии до эвисцерации органокомплекса и центрифугировали при 1500 об/мин в течение 15 мин. В полученном материале определяли содержание калия, натрия и кальция с помощью атомно-абсорбционного спектрометра «Квант-2А» с компьютерным программным обеспечением. Глюкозу определяли стандартным набором реактивов для глюкозооксидазного метода (набор «Фотоглюкоза»).
Результаты и обсуждение
При макроскопическом исследовании в группах с трансмуральным и субэндо- или субэпикардиальным ишемическим поражением масса сердца составила 352,93±12,23 г. Толщина стенки ЛЖ достигала 1,54±0,02 см, что незначительно превышало норму (1,1—1,4 см; p>0,05).
Топографический анализ позволил выявить, что при ОИМДС ишемический процесс локализуется в 1—2 соседних областях миокарда, независимо от глубины поражения стенки ЛЖ и содержания этилового спирта в крови умерших. Наиболее часто поражаются передняя и задняя стенки, в меньшей степени верхушка и межжелудочковая перегородка (табл. 1).
Таблица1. Частота (%) локализации ишемического процесса в ЛЖ сердца
Примечание. ЛЖ — левый желудочек. Здесь и в табл. 2—4: ОИМДС — острый инфаркт миокарда, донекротическая стадия.
Гистологическое исследование микропрепаратов, окрашенных гематоксилином и эозином, хромотропом 2В водным голубым (световая микроскопия), позволило оценить изменения в артериальной системе сердца, венозного и микроциркуляторного русла, нарушения реологических свойств крови. Ишемические повреждения кардиомиоцитов выявляли с помощью световой и поляризационной микроскопии (табл. 2).
Таблица 2. Патоморфологические микроскопические признаки (Р)
Примечание. Здесь и в табл. 4 * — p<0,05; ** — p<0,01.
Во всех исследованных группах спазм коронарных артерий преобладал над дистонией и обычным просветом сосудов. Одновременно было обнаружено, что при трансмуральном поражении стенки ЛЖ имеется статистически значимое трансформирование вытянутой формы клеток эндотелия в округлую. При субэндо- или субэпикардиальной локализации ишемического процесса чаще встречались интрамуральные артерии с обычным просветом. Для трансмурального поражения стенки ЛЖ были характерны гиперхромная окраска клеток эндотелия интрамуральных артерий и спазм артериол. Полученные данные согласуются с мнением, что тонус артерий зависит от состояния эндотелия, которому принадлежит важная роль в возникновении спазма и ишемии миокарда [16, 17].
При оценке венозного и микроциркуляторного русла обнаружено полнокровие сосудов с явлениями стаза крови и сладж-феномена, образование микротромбов без достоверных различий между сравниваемыми группами. Важным показателем нарушения реологических свойств крови был феномен образования «плазматических сосудов», который встречался более чем в 59% случаев (p>0,05) при любой локализации ишемического процесса в стенке ЛЖ.
Отмечались утолщение, волнообразная деформация и фрагментация сердечных мышечных волокон, как в очагах ишемии, так и вне их. Случаи трансмуральной ишемии миокарда достоверно отличались от субэндо- или субэпикардиальной локализации по слабо различимой сарколемме — морфологическому показателю повышенной проницаемости стенки кардиомиоцитов.
Поляризационная микроскопия независимо от локализации ОИМДС характеризовалась сочетанием контрактурных повреждений кардиомиоцитов III степени, внутриклеточного миоцитолиза и первичного глыбчатого распада миофибрилл. Указанные признаки являются морфологическими маркерами ишемического повреждения кардиомиоцитов с формированием зон коагуляционного и колликвационного некроза с одновременной потерей сократительной способности миокарда [6, 9, 18, 19].
Однако при трансмуральном поражении стенки ЛЖ количество контрактурных повреждений кардиомиоцитов II степени (участков гиперсокращения) было достоверно больше, чем при субэндо- или субэпикардиальном ОИМДС. Для последних характерны контрактурные повреждения кардиомиоцитов I степени, носящие обратимый характер. В то же время отсутствовали достоверные различия между сравниваемыми группами по количеству участков с трещинами и диссоциацией мышечных волокон, которые являются маркерами фибрилляции желудочков сердца [7, 20]. Таким образом, при ОИМДС с трансмуральным поражением стенки ЛЖ дегенеративные изменения кардиомиоцитов были более выражены.
В подгруппах с наличием этанола как при трансмуральной, так при субэндо- или субэпикардиальной ишемии достоверно чаще встречались микротромбы в микроциркуляторном русле, что совпадает с результатами ранее проведенных исследований [21, 22]. Небольшое увеличение толщины стенки ЛЖ на первый взгляд можно интерпретировать как незначительную гипертрофию миокарда. Однако при одновременном наличии в микропрепаратах периваскулярного и межмышечного отека, утолщения кардиомиоцитов, острых ишемических повреждений сердечных мышечных волокон (см. табл. 2) описанное изменение следует рассматривать как морфологический признак отека миокарда [23].
В перикардиальной жидкости выявлены достоверные различия концентрации кальция и глюкозы в зависимости от локализации ОИМДС. Для трансмурального поражения были характерны снижение уровня глюкозы и повышенное содержания кальция (табл. 3). Наличие этилового спирта в крови умерших вызвало некоторое повышение концентрации калия, кальция и снижение содержания глюкозы, которое было статистически незначимо (табл. 4).
Таблица 3. Показатели перикардиальной жидкости (M±m)
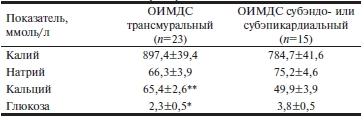
Таблица 4. Показатели перикардиальной жидкости взависимости от содержания этилового спирта в крови умерших(M±m)
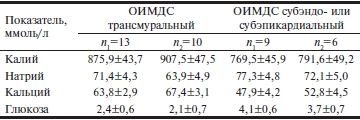
Примечание. n1 — подгруппы без содержания этилового спирта, n2 — подгруппы с содержанием этилового спирта.
Выявленные морфологические изменения кардиомиоцитов и показателей перикардиальной жидкости можно объяснить особенностью строения сердечного мышечного волокна, а также различным объемом ишемического повреждения ЛЖ. Структурной единицей кардиомиоцитов является саркомер, в состав которого входит тропониновый комплекс (I, Т, С). Тропонин С (cTnC) выполняет роль депо кальция, в котором каждая молекула белка связывает 4 иона кальция [24]. Появление контрактурных повреждений кардиомиоцитов III степени, участков внутриклеточного миоцитолиза и первичного глыбчатого распада миофибрилл свидетельствует о распаде тропонинового комплекса [9] с высвобождением свободного кальция из него в цитоплазму кардиомиоцита. Одновременно за счет повышенной проницаемости сарколеммы сердечных мышечных волокон кальций переходит из цитоплазмы клетки в перикардиальную жидкость [7, 12, 13, 25, 26], а возникновение дополнительных участков гиперсокращения мышечных волокон в виде контрактурных повреждений кардиомиоцитов II степени при трансмуральной ишемии миокарда свидетельствует о перегрузке кальцием цитоплазмы кардиомиоцитов. Следствием этих структурных изменений кардиомиоцитов является потеря сократительной способности миокарда.
При трансмуральной ишемии, захватывающей все слои стенки с локализацией в 1—2 соседних топографических областях (см. табл. 1), объем повреждения миокарда ЛЖ значительно больше, чем при субэндо- или субэпикардиальной ишемии с аналогичной топографической локализацией. Поэтому больший объем ишемического повреждения обусловливает резкое уменьшение запасов гликогена в миокарде и потерю его сократительной способности на большем участке. Следовательно, повышение концентрации кальция и снижение содержания глюкозы в перикардиальной жидкости отражают объем ишемического поражения миокарда ЛЖ.
Таким образом, острый инфаркт миокарда в донекротической стадии на догоспитальном этапе может протекать в двух морфологических формах — либо с трансмуральной, либо с субэндо- или субэпикардиальной локализацией ишемического процесса в стенки ЛЖ. Трансмуральное распространение характеризуется большим объемом ишемического поражения сердечной мышцы, генерализованным спазмом артериальной системы сердца с изменением формы и окраски клеток эндотелия, тромбозом микроциркуляторного русла, выраженными дегенеративными изменениями кардиомиоцитов с нарушением их энергетического обмена и сократительной способности.
При субэндо- или субэпикардиальной локализации очаги ишемического повреждения перемежаются с участками нормального кровоснабжения, менее выражены нарушения энергетического обмена и потеря сократительной способности миокарда. Вместе с тем независимо от объема поражения левого желудочка между двумя формами острого инфаркта миокарда в донекротической стадии имеется сходство по характеру нарушения реологических свойств крови с тромбозом микроциркуляторного русла и количеству маркеров фибрилляции желудочков сердца, что в итоге создает предпосылки для увеличения зоны некроза в миокарде и обусловливает высокий риск нарушения ритма.
Наличие этилового спирта в крови умерших от острого инфаркта миокарда в донекротической стадии как при трансмуральной, так при субэндо- или субэпикардиальной ишемии повышает микротромбообразование в микроциркуляторном русле. Однако это не приводит к дополнительному увеличению объема ишемического поражения миокарда левого желудочка.
1. Боден У., Маккей Р. Формирование оптимальной стратегии лечения острых коронарных синдромов. Междунар мед журн 2001;4:3—8.
2. Грацианский Н.А. Лечение и предупреждение обострений ишемической болезни сердца (острых коронарных синдромов). Междунар журн мед практики 2000;11:44—56.
3. Раббани Л.Е. Острые коронарные синдромы — не только некроз миоцитов. Междунар мед журн 2002;1:7—12.
4. Theroux P., Fuster V. Acute coronary syndromes: unstable angina and non-Q wave myocardial infarction. Circulation 1998;97:1195—1206.
5. Автандилов Г.Г., Шагылыджов К. Патологоанатомическая диагностика ишемической болезни сердца. Метод рекоменд. М 1978;35.
6. Целлариус Ю.Г., Семенова Л.А., Непомнящих Л.М. Патологоанатомическая диагностика преднекротичеких изменений и инфаркта методом поляризационной микроскопии. Метод рекоменд. М 1979;23.
7. Кактурский Л.В. Внезапная сердечная смерть: современное состояние проблемы. Арх патол 2005;3:8—11.
8. Берестовская В.С., Залогина Е.М., Козлов А.В. и др. «Сердечные» маpкеpы в пеpикаpдиальной жидкости при скоропостижной смерти от ишемической болезни сердца. Клин лаб диагн 2000;9:42.
9. Иванов И.Н., Резник А.Г., Дзик Н.В. Взаимосвязь микроскопических изменений миокарда с биохимическими показателями перикардиальной жидкости при острых формах ишемической болезни сердца. Арх патол 2006;3:18—20.
10. Меницкая В.И. Определение коэффициента отношения концентрации электролитов натрия и калия при судебно-медицинской диагностике ишемических изменений в миокарде человека. Проблемы идентификации в теории и практике судебной медицины: Матер 4 Всерос съезда судебных медиков. М: Владимир 1996:42—43.
11. Тимофеев И.В. Патология лечения. Руководство для врачей. Ст-Петербург: Северо Запад 1999;656.
12. Bolli R., Marban E. Molecular and cellular mechanisms of myocardial stunning. Physiol Rev 1999;79:609—634.
13. Heusch G., Schulz R. Features of short-term myocardial hibernation. Mol Cell Biochem 1998;186:185—193.
14. Мазуренко М.Д., Зимина Ю.В. Микроморфологические изменения миокарда при скоропостижной смерти от ишемической болезни сердца. Теория и практика судебной медицины: Труды Петербургского научного общества судебных медиков. Под ред. М.Д. Мазуренко. Ст-Петербург 1998;2:128—131.
15. Гублер Е.В. Информатика в патологии, клинической медицине и педиатрии. Л: Медицина 1990;175.
16. Бувальцев В.И. Дисфункция эндотелия как новая концепция профилактики и лечения сердечно-сосудистых заболеваний. Междунар мед журн 2001;3:22—34.
17. Zeiher A.M., Krause T., Schachinger V. Impaired endothelium-dependent vasodilation of coronary resistance vessels is associated with exerciseinduced myocardial ischemia. Circulation 1995;91:2345—2352.
18. Иванов И.Н., Резник А.Г. Микроскопические изменения миокарда при острых формах ишемической болезни сердца. Суд-мед эксперт 2006;1:3—6.
19. Непомнящих Л.М. Основные формы острых повреждений кардиомиоцитов по данным поляризационной микроскопии миофибрилл. Бюл экспер биол 1996;1:4—13.
20. Капустин А.В. Морфологические признаки нарушения проведения возбуждения в миокарде. Суд-мед эксперт 2005;3:6—8.
21. Резник А.Г. Особенности микроскопической картины миокарда умерших от острых форм ишемической болезни сердца на фоне алкогольной интоксикации. Актуальные вопросы судебной медицины и экспертной практики: Сб науч труд, посвященный 70-летию образования Красноярского края. Красноярск 2004:61—62.
22. Резник А.Г., Иванов И.Н. Влияние алкогольной интоксикации на микроскопическую картину миокарда при острых формах ишемической болезни сердца. Современные проблемы клинической патоморфологии. Тез Всерос конф с междунар участием. Ст-Петербург 2005:223—225.
23. Резник А.Г., Иванов И.Н. Морфология миокарда в случаях смерти от острых форм ишемической болезни сердца. Арх патол 2007;4:32—35.
24. Мари Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека: В 2 томах. Т. 2. Пер. с англ. М: Мир 1993;415.
25. Ескунов П.Н. Изменение проницаемости сарколеммы кардиомиоцитов после кратковременной тотальной ишемии. Бюл экспер биол 1993;1:80—82.
26. Резник А.Г. Информативность электролитов и глюкозы перикардиальной жидкости при острых формах ишемической болезни сердца. Арх патол 2008;4:47—49.
Резник А.Г. – к.м.н., соискатель кафедры судебной медицины с курсом вещественных доказательств ГОУ ДПО Санкт-Петербургская медицинская академия последипломного образования Росздрава.
Источник
Наиболее тяжёлое проявление ИБС, характеризующееся развитием ишемического некроза миокарда через 18-24 часа от начала ишемии.
Классификация. В зависимости от времени возникновения выделяют:
первичный (острый) инфаркт миокарда,
рецидивирующий (развивающийся в течение 4 недель после острого),
повторный (развивающийся после 4 недель после острого)
По отношению к оболочкам сердца:
Стадии инфаркта миокарда.
Некротическая стадия. Макроскопически – белый инфаркт с геморрагическим венчиком неправильной формы. Микроскопически выявляется участок некроза с лизисом ядер, глыбчатым распадом цитоплазмы с зоной демаркацией по перифферии.
Стадия рубцевания начинается с развития демаркации, лейкоциты выделяют протеолитические ферменты, тем самым, способствуя лизису погибших миокардиоцитов. На 3-4 день выявляются макрофаги, появляются фибробласты, на 7-10 день формируется грануляционная ткань, которая развивается в течение 1-2 недель. Эта стадия продолжается около 2 месяцев с формированием рубца (крупноочаговый постинфарктный кардиосклероз).
ХИБС обычно развивается у пожилых пациентов, иногда сопровождается хронической сердечной недостаточностью разной степени тяжести. Морфологическими признаками являются: стенозирующий коронарный атеросклероз, крупно- и мелкоочаговый кардиосклероз, гипертрофия миокарда, очаги повреждения разной степени тяжести. При мелкоочаговом кардиосклерозе определяются мелкие (до 1-2 мм) очаги соединительной ткани, при крупноочаговом кардиосклерозе — постинфарктные рубцы. Хроническая аневризма сердца отражает заживлении и рубцевание зоны некроза с выпячиванием истончённой стенки. В области аневризмы выявляется соединительная ткань различной степени зрелости, остатки некротизированной ткани, сохранившиеся мышечные волокна. В полости аневризмы нередко образуется пристеночный тромб. Причиной смерти при ХИБС является хроническая сердечная недостаточность и тромбоэмболический синдром.
1. Гранулёма сифилиса. Возбудитель – бледная спирохета, палочка Шаудина–Гофмана. В развитии приобретённого сифилиса различают три периода: первичный, вторичный, третичный. Гранулёма – гумма – характерна для третичного периода (от лат. gummi – клей). Обычно гумма одиночная, солитарная. Гумма может локализоваться в разных органах и тканях: костях, коже, печени, головном мозге и др. Макроскопически представляет собой опухолеподобный узел от нескольких миллиметров до 2–3 см, центральная часть которого занята клейкой тягучей массой (волокнистый некроз), по периферии – плотная соединительная ткань. Микроскопически внутренний слой этой волокнистой капсулы, граничащий с некротической массой, представлен лимфоцитами, обилием плазматических клеток (клетки Маршалко–Унны), немного эпителиоидных клеток, фибробластов, единичных гигантских клеток Пирогова–Лангханса. В гранулёме много капилляров, ретикулярных волокон. Кроме гумм в третичный период, который обычно развивается спустя несколько лет (4–5 и более) после заражения, может развиваться диффузное гранулематозное воспаление – гуммозная инфильтрация. Состав инфильтрата такой же, как в гумме. При этом быстро проявляется тенденция к склерозу. Гуммозная инфильтрация чаще возникает в средней и наружной оболочках аорты и носит название сифилитического мезаортита. В исходе – склероз с резкой деформацией тканей.
Гранулёма проказы (лепры). Возбудитель – палочка Хансена, окрашивается в красный цвет по Цилю–Нильсену. При этом заболевании поражается кожа, периферическая нервная система и другие ткани. Гранулёма – лепрома – состоит преимущественно из крупных макрофагов с вакуолизированной цитоплазмой, в которой обнаруживаются палочки Хансена в виде сигарет в пачке (клетки Вирхова), а также лимфоцитов, плазматических клеток, фибробластов.
Принято различать три клинико-анатомические формы лепры в зависимости от резистентности организма: 1) с высокой резистентностью – туберкулоидная, 2) с низкой – лепроматозная, 3) промежуточная – диморфная.
При туберкулоидной форме, которая протекает клинически доброкачественно, иногда с самоизлечением, в гранулёме обнаруживают эпителиоидные клетки, гигантские клетки Пирогова–Лангханса. Поражение кожи диффузное с множеством пятен, бляшек с последующей депигментацией. В нервных волокнах определяется диффузная инфильтрация эпителиоидными клетками. Изменения внутренних органов не характерны.
Гранулёма риносклеромы. Возбудитель – палочка Волковича–Фриша. Возникает воспаление слизистой дыхательных путей, носа с разрастанием своеобразной грануляционной ткани плотной консистенции, суживающей их просветы. Макроскопически ткань буро-красного цвета, поверхность слизистых мелкобугристая. Микроскопически гранулёмы состоят из лимфоцитов, эпителиоидных клеток, плазматических клеток, крупных макрофагов – клеток Микулича (со светлой нежнопенистой цитоплазмой, иногда содержащей возбудителя), телец Русселя (плазматические клетки с накоплением в них гиалина), фибробластов. Гранулёмы очень быстро подвергаются склерозу, что приводит к стенозу дыхательных путей, иногда асфиксии.
Гранулёма сапа. Возбудитель – бацилла сапа. Поражаются слизистая носа, кожа, лёгкие. Развиваются узелки, гранулёмы, состоящие из эпителиоидных клеток, нейтрофильных лейкоцитов и характерным кариорексисом. Возникает гнойное расплавление с особой тягучестью сапного гноя.
Топографически различают: субэндокардиальньный инфаркт; интрамуральньный инфаркт (при локализации в средней части стенки сердечной мышцы); трансмуральный инфаркт (при некрозе всей толщи сердечной мышцы.
По локализации выделяют: инфаркт передней, задней и боковой стенок левого желудочка, межжелудочковой перегородки, верхушки сердца и обширный инфаркт.
трансмуральный инфаркт миокарда.
различают три стадии:
В ишемической (донекротической) стадии, соответствующей первым 18—24 ч с момента приступа ишемии, макроскопически инфаркт не распознается. Отмечаются лишь дряблость, бледность, иногда пестрота и отечность миокарда в области ишемии. Свежий тромб в коронарной артерии — наиболее важный признак для того, чтобы констатировать инфаркт в этой стадии.
Макроскопическая диагностика ишемическая стадия инфаркта миокарда возможна при использовании солей тетразолия, теллурита калия. В участках ишемии, где активность окислительно-восстанови тельных ферментов резко ослаблена, зерна формазана восстановленный теллур не выпадают, поэтому участки ишемии выглядят светлыми на темном фоне неизмененного миокарда.
Ряд морфологов и клиницистов эту стадию называет острой очаговой ишемической дистрофией миокарда (которую описывали ранее) и рассматривает как самостоятельную форму острой ИБС. В этом случае в развитии инфаркта миокарда выделяют только две последующие стадии.
Некрозсердечной мышцы, вызванный прекращением притока крови к сердечной мышце.
Заболевание, которое характеризуется прекращением питания участка миокарда, что может быть связано с закупоркой коронарных артерий или с их разрывом, в результате развивается некроз сердечной мышцы.
Причины:
1. внезапное прекращение коронарного кровотока из-за резкого и длительного спазма венечной артерии, образования тромба или атеросклеротической бляшки.
Обычно инфаркт локализуется в области верхушки, передней и боковой стенок левого желудочка сердца, что связано с закупоркой или разрывом левой венечной артерии.
Стадии инфаркта:
1. ишемическая (донекротическая)- первые 18-24часа. Нарушение кровоснабжения участка миокарда, т.е. закупорка венечных артерий тромбом. Макроскопически изменения миокарда не видны. Смерть в ишемическую стадию может наступить от кардиогенного шока, фибрилляции желудочков, асистолии (остановки сердца).
2. некротическая стадия – развивается к концу первых суток, после приступа стенокардии. Участок подвергается некрозу, развиваются дистрофические изменения кардиомиоцитов, вокруг участка некроза формируется красная полоса гиперемированных сосудов и кровоизлияний- демаркационная (пограничная) линия, отделяющая участок некроза от непораженного миокарда. В эту стадию возможны осложнения: расплавление участка некроза (миомаляция), с последующим разрывом стенки миокарда , тампонада сердца (заполенние кровью полости перикарда), острая аневризма аорты (которая может разорваться и привести к тампонаде сердца). В эту стадию может наступить смерть от фибрилляции желудочков или образование острой аневризмы сердца (выбухание стенки желудочка)→разрыв аневризмы, тромбоэмболия.
3. стадия организации –лейкоциты и макрофаги очищают поле воспаления от некротических масс. Участок некроза замещается сначала грануляционной тканью, которая в течении 8 недель созревает в соединительную ткань, на его месте остается рубец. Возникает крупноочаговый кардиосклероз. Миокард вокруг рубца подвергается гипертрофии. Таким образом инфаркт миокарда длится 8 недель.
Рис. 27. Инфаркт миокарда (поперечные срезы сердца).
1 — ишемический инфаркте геморрагическим венчиком задней стенки левого желудочка;
2 — обтурирующий тромб в нисходящей ветви левой венечной артерии;
3—разрыв стенки сердца. На схемах (внизу): а — заштрихована зона инфаркта
(стрелкой показан разрыв); б — заштрихованы уровнисрезов
Осложнения инфаркта:
1. острая сердечная недостаточность, которая проявляется сердечной астмой.
2. кардиогенный шок (1 стадия)-30-50% случаев
3. нарушение ритма работы сердца (аритмии, асистолия, фибрилляция желудочков)
4. разрыв миокарда с образованием тампонады
5. расплавление участка некроза (миомаляция)
6. острая аневризма и разрыв сердца
7. пристеночный тромбоз
8. острое падение АД→гипоксия →отёк легких, пневмония, острый венозный застой органов.
При развитии инфаркта миокарда смерть может наступить на любом этапе заболевания.
Рис.28. Инфаркт миокарда, разрыв сердца
Рис. 29. Тампонада полости перикарда при разрыве сердца на почве инфаркта.
Полость сердечной сорочки
Рис. 30. Хроническая аневризма сердца
Рис. 32. Инфаркт миокарда и острая
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
