Острое повреждение почек у больных с инфарктом миокарда
- Архив журнала
/ - 2016
/ - №10
Острое почечное повреждение у больных инфарктом миокарда в клинической практике
Н.Ю. Боровкова (1), А.С. Ильина (1), А.А. Спасский (2), Н.Н. Боровков (1), М.Ю. Серопян (3), М.П. Нистратова (3)
(1) Кафедра госпитальной терапии ГБОУ ВПО «Нижегородская государственная медицинская академия» Минздрава РФ, Нижний Новгород; (2) Кафедра клинической фармакологии лечебного факультета ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России, Москва; (3) ГБУЗ НО «Нижегородская областная клиническая больница им. Н.А. Семашко», Нижний Новгород
В представленном обзоре литературы обсуждается проблема острого почечного повреждения (ОПП) у больных острым инфарктом миокарда (ИМ), нередко встречающаяся в практической деятельности врача. Рассматриваются вопросы распространенности почечного повреждения при ИМ, его осложнений, патогенетические механизмы развития, современная диагностика и подходы к терапии. Особое внимание уделяется биомаркерам почечного повреждения, которые могут быть полезными для ранней диагностики ОПП в клинической практике. Анализируются возможности цитопротективной терапии в отношении защиты как миокарда, так и почек.
Литература
1. Мензоров М.В., Шутов А.М., Серов В.А. и др. Острое повреждение почек у больных инфарктом миокарда с подъемом сегмента ST. Нефрология. 2012;1:40–4.
2. Авдошина С.В., Виллевальде С.В., Ефремовцева М.А., Кобалава Ж.Д. Значение биомаркеров в диагностике и определении прогноза острого почечного повреждения у больных с острым коронарным синдромом без подъема сегмента ST. Вестник Российского университета дружбы народов. 2014;2:92–5.
3. Зайцева В.П., Нанчикеева М.Л., Буланов Н.М. Острое повреждение почек у пациентов с острым инфарктом миокарда. Нефрология и диализ. 2013;4:369.
4. Marenzi G., Assanelli E., Campodonico J., De Metrio M., Lauri G. Acute kidney injury in ST-segment elevation acute myocardial infarction complicated by cardiogenic shock at admission. Crit. Care Med. 2010;38:438–44.
5. Ronco C., House A.A., Haapio M. Cardiorenal syndrome: refining the definition of a complex symbiosis gone wrong. Intensive Care Med. 2008;34:957–62.
6. Parikh C.R., Coca S.G., Wang Y., Masoudi F.A. Long-term prognosis of acute kidney injury after acute myocardial infarction. Arch. Intern. Med. 2008;168:987–95.
7. Мензоров М.В., Шутов А.М., Макеева Е.Р., Серов В.А., Саенко Ю.В., Страхов А.А. Острое повреждение почек и внутригоспитальная летальность у больных острым инфарктом миокарда с подъемом сегмента ST. Фундаментальные исследования. 2012;12:100–3.
8. Сигитова О.Н., Богданова А.Р. Прогно-зирование риска острого почечного повреждения у больных ишемической болезнью сердца. Вест. современ. клинич. мед. 2013;6(вып. 5):18–23.
9. Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney Int. 2012;2(Suppl.):1–138.
10. Мензоров М.В., Шутов А.М., Макеева Е.Р., Михайлова Е.В., Парфенова Е.А. Роль липокалина, ассоциированного с желатиназой нейтрофилов в раннем прогнозировании острого повреждения почек у больных острым коронарным синдромом. Фундаментальные исследования. 2013;9:698–702.
11. Honore P.M., et al. Biomarkers for early diagnosis of acute kidney injury in the intensive care unit: ready for prime time use at the bedside. Intensive Care. 2012;24.
12. Рей С.И. Острое почечное повреждение. Современные аспекты диагностики, профилактики и лечения. Медицинский алфавит. Неотложная медицина 2013;4:43–50.
13. Кобалава Ж.Д., Виллевальде С.В., Ефремовцева М.А., Моисеев В.С. Биомаркеры острого повреждения почек: современные представления и перспективы. Терапевтический архив. 2014;6:88–93.
14. Уразаева Л.И., Максудова А.Н. Биомаркеры раннего повреждения почек: обзор литературы. Практическая медицина. 2014;1(Вып. 80):125–30.
15. Смирнов А.В., Каюков И.Г., Дегтерева О.А., Добронравов В.А., Румянцев А.Ш., Раффрафи Т.Н., Зверьков Р.В. Проблемы диагностики и стратификации тяжести острого повреждения почек. Нефрология. 2009;13(3):9–18.
16. Шаленкова М.А., Михайлова З.Д., Климкин П.Ф. Уровень липокалина в моче и острое повреждение почек у больных острым коронарным синдромом. Медицинский альманах. 2014;3:180–83.
17. Мензоров М.В., Шутов А.М. Липокалин, ассоциированный с желатиназой нейтрофилов в прогнозировании острого повреждения почек у больных острым коронарным синдромом. Клин. медицина. 2014;3:54–8.
18. Mishra J., Mori K., Ma Q., Kelly C., Yang J., Mitsnefes M., Barasch J., Devarajan P. Amelioration of ischemic acute renal injury by neutrophil gelatinase-associated lipocalin. J. Am. Soc. Nephrology. 2004;15:3073–82.
19. Mori K., Lee H.T., Rapoport D., Drexler I.R., Foster K., Yang J., Schmidt-Ott K.M., Chen X., Li J.Y., Weiss S., Mishra J., Cheema F.H., Markowitz G., Suganami T., Sawai K., Mukoyama M., Kunis C., D’Agati V., Devarajan P., Barasch J. Endocytic delivery of lipocalin-siderophore-iron complex rescues the kidney from ischemia-reperfusion injury. J. Clin. Investig. 2005;115:610–21.
20. Schmidt-Ott K.M., Mori K., Kalandadze A., Li J.Y., Paragas N., Nicholas T., Devarajan P., Barasch J. Neutrophil gelatinase-associated lipocalin-mediated iron traffic in kidney epithelia. Curr. Opin. Nephrol. Hypertens. 2006;15:442–49.
21. Парван М.А., Николаев А.Ю., Вокуев И.А., Хоробрых В.В. Липокалин-2 – ранний биомаркер острого повреждения почек. Лечащий врач. 2013;1:45–7.
22. Вельков В.В. Новые возможности для ранней диагностики субклинических, хронических и острых ренальных повреждений. М., 2014. 231 с.
23. Mishra J., Dent C., Tarabishi R., Mitsnefes M.M., Ma Q., Kelly C., Ruff S.M., Zahedi K., Shao M., Bean J., Mori K., Barasch J., Devarajan P. Neutrophil gelatinase-associated lipocalin (NGAL) as a biomarker for acute renal injury after cardiac surgery. Lancet. 2005;365:1231–38.
24. Wagener G., Jan M., Kim M., Mori K., Barasch J., Sladen R.N., Lee H.T. Association between increases in urinary neutrophil gelatinase-associated lipocalin and acute renal dysfunction after adult cardiac surgery. Anesthesiology. 2006;105:485–91.
25. Mishra J., Ma Q., Kelly C., Mitsnefes M.M., Mori K., Barasch J., Devarajan P. Kidney NGAL is a novel early marker of acute injury following transplantation. Pediatric Nephrol. 2006;21:856–63.
26. Климкин П.Ф. Прогнозирование течения острого коронарного синдрома в зависимости от уровня некоторых маркеров острого повреждения почек в различных биологических средах. Дисс. канд. мед. наук. Нижний Новгород, 2014.
27. Mishra J., Mori K., Ma Q., Kelly C., Barasch J., Devarajan P. Neutrophil gelatinase-associated lipocalin: a novel early urinary biomarker for cisplatin nephrotoxicity. Am. J. Nephrol. 2004;24:307–15.
28. Mitsnefes M.M., Kathman T., Mishra J., Kartal J., Khoury P.R., Nickolas T.L., Barasch J., Devarajan P. Serum NGAL as a marker of renal function in children with chronic kidney disease. Pediatric Nephrol. 2007;22:101–8.
29. Bolignano D., Coppolino G., Campo S., et al. Urinary neutrophil gelatinase-associated lipocalin (NGAL) is associated with severity of renal disease in proteinuric patients. Nephrology Dialysis Transplantation. 2008;23:414–16.
30. Плющ М.Г., Ярустовский М.Б., Абрамян М.В., Назарова Е.И., Подщеколдина О.О. Нейтрофильный желатиназо-ассоциированный липокалин – ранний маркер острого повреждения почек у пациентов после открытых операций на сердце и сосудах. Бюллетень Научного центра сердечно-сосудистой хирургии им. А.Н. Бакулева РАМН. 2012;13(3):53–9.
31. Schmidt-Ott K.M., Mori K., Li J.Y., Kalandadze A., Cohen D.J., Devarajan P., Barasch J. Dual Action of Neutrophil Gelatinase – Associated Lipocalin. J. Am. Soc. Nephrol. 2007;18:407–13.
32. Ma Q., Devarajan P. Induction of proapoptotic Daxx following ischemic acute kidney injury. Kidney International 2008;74:310–18.
33. Arany I. When less is more: apoptosis during acute kidney injury. Kidney International. 2008;74:261–62.
34. Castaneda M.P., Swiatecka-Urban A., Mitsnefes M.M., et al. Activation of mitochondrial apoptotic pathways in human renal allografts after ischemia-reperfusion injury. Transplantation 2003;76:5054.
35. Srichai M.B., Hao C., Davis L., Golovin A., Zhao M., Moeckel G., Dunn S., Bulus N., Harris R.C., Zent R., Breyer M.D. Apoptosis of the thick ascending limb results in acute kidney injury. J. Am. Soc. Nephrol. 2008;19:1538–46.
36. Шафранская К.С., Кашталап В.В., Баздырев Е.Д., Барбараш О.Л. Возможности диагностики острого повреждения почек с использованием липокалина, ассоциированного с желатиназой нейтрофилов (NGAL) в кардиологии (обзор литературы). Сибирский медицинский журн. 2011;26(4):15–9.
37. Крачак Д.И., Шестакова Л.Г., Островский Ю.П., Бушкевич М.И., Коржова А.В. Ранняя диагностика острого повреждения почек при выполнении операций с искусственным кровообращением. Медицинский альманах. 2013;4:45–8.
38. Пролетов Я.Ю., Саганова Е.С., Смирнов А.В. Биомаркеры в диагностике острого повреждения почек. Сообщение I. Нефрология. 2014;18(4):25–35.
39. Grubb A., Nyman U., Bjork J., et al. Simple cystatin C-based prediction equations for glomerular filtration rate compared with the modification of diet in renal disease prediction equation for adults and the Schwartz and the Counahan-Barratt prediction equations for children. Clinical Chemistry. 2005;51:1420–31.
40. Dharnidharka V.R., Kwon C., Stevens G. Serum cystatin C is superior to serum creatinine as a marker of kidney function: a meta-analysis. Am. J. Kidney Dis. 2002;40:221–26.
41. Briguori C., Visconti G., Rivera N., Focaccio A., Golia B., Giannone R., Castaldo D., De Micco F., Ricciardelli B., Colombo A. Cystatin C and contrast-induced acute kidney injury. Circulation. 2010;121:2117.
42. Боровкова Н.Ю., Кузнецова Т.Е. Цистатин С в диагностике хронической болезни почек у больных хронической сердечной недостаточностью в клинической практике. Архив внутренней медицины. 2014;6(20):38–41.
43. Боровкова Н.Ю., Овчинникова Т. Е., Серопян М.Ю., Нистратова М.П. Цистатин С в диагностике хронической болезни почек у больных сердечной недостаточностью. Сборник материалов Пленума Правления Научного общества нефрологов России. 2012;106–7.
44. Royakkers A.A., Korevaar J.C., van Suijlen J.D., Hofstra L.S., Kuiper M.A., Spronk P.E., Schultz M.J., Bouman C.S. Serum and urine cystatin C are poor biomarkers for acute kidney injury and renal replacement therapy. Intensive Care Med. 2011;37:493–501.
45. Spahillari A., Parikh C.R., Sint K., et al. Serum cystatin C-versus creatinine-based definitions of acute kidney injury following cardiac surgery: a prospective cohort study. Am. J. Kidney Disease. 2012;60:922–29.
46. Han W.K., Bailly V., Abichandani R., Thadhani R., Bonventre J.V. Kidney injury molecule-1 (KIM-1): A novel biomarker for human renal proximal tubule injury. Kidney International. 2002;62:237–44.
47. Vaidya V.S., Ramirez V., Ichimura T., Bobadilla N.A., Bonventre J.V. Urinary kidney injury molecule-1: a sensitive quantitative biomarker for early detection of kidney tubular injury. Am. J. Physiol. Renal Physiol. 2006;290:517–29.
48. Harmankaya O., Ozturk Y., Basturk T., Obek A. Urinary excretion of N-acetyl-beta-D-glucosaminidase in newly diagnosed essential hypertensive patients and its changes with effective antihypertensive therapy. Intern. Urol. Nephrol. 2001;32:583–84.
49. Matsushima H., Yoshida H., Machiguchi T., et al. Urinary albumin and TGF 1 levels as renal damage indices in patients with congestive heart failure. Clin. Experim. Nephrol. 2002;6:21–9.
50. Parikh C.R., Devarajan P. New biomarkers of acute kidney injury. Crit. Care Med. 2008;36:159–65.
51. Price R.G. The role of NAG (N-acetyl-beta-D-glucosaminidase) in the diagnosis of kidney disease including the monitoring of nephrotoxicity. Clinical Nephrol. 1992;38:14–9.
52. Liangos O., Tigbiouart H., Perianayagam M., Kolyada A., Han W.K., Wald R., Bonventre J.V., Jaber B.L. Comparative analysis of urinary biomarkers for early detection of acute kidney injury following cardiopulmonary bypass. Biomarkers. 2009;14(6):423–31.
53. Susantitapbong P., Siribamrungwong M., Doi K., Noiri E., Terrin N., Jaber B.L. Performance of urinary liver-type fatty acid-binding protein in acute kidney injury a meta-analysis. Am. J. Kidney Dis. 2013;3:430–39.
54. Zbeng J., Xiao Y., Yao Y., Xu G., Li C., Zhang Q., Li H., Han L. Comparison of urinary biomarkers for aerly detection of acute kidney injury after cardiopulmonary bypass surgery in infants and young children. Pediatric Cardiol. 2013;4:880–86.
55. Kamijo-Ikemori A., Ichikawa D., Matsui K., Yokoyama T., Sugaya T., Kimura K. Urinary L-type fatty acid binding protein (L-FABP) as a new urinary biomarker promulgated by the Ministry of Health, Labour and Welfare in Japan. Rinsho Byori. 2013;61:635–40.
56. Damman K., Masson S., Hillege H.L., Voors A.A., van Veldhuisen D.J., Rossignol P., Proietti G., Barbuzzi S., Nicolosi G.L., Tavazzi L., Maggioni A.P., Latini R. Tubular damage and worsening renal function in chronic heart failure. JACC Heart Fail. 2013;5:417–24.
57. Национальные рекомендации по диагностике и лечению больных острым инфарктом миокарда с подъемом сегмента ST ЭКГ. Кардиоваск. Тер. и профил. 2007;6:415–500.
58. Рекомендации Европейского общества кардиологов/Европейской ассоциации кардиоторакальных хирургов по реваскуляризации миокарда. Росс. кардиол. журн. 2015;2:5–81.
59. Мензоров М.В., Шутов А.М., Парфенова Е..А., Морозова И.В., Шарафутдинова А.Ф. Тип тромболитика и частота острого повреждения почек у больных острым инфарктом миокарда с подъемом сегмента ST. Нефрология и диализ. 2013;4:336.
60. Мензоров М.В., Шутов А.М., Серов В.А., Макеева Е.Р. Тромболизис и острое повреждение почек у больных с инфарктом миокарда. Нефрология и диализ. 2014;1:162–68.
61. Мензоров М.В., Шутов А.М., Морозова И.В., Цортумян А.С., Прокина О.Ф. Острое повреждение почек у больных инфарктом миокарда с подъемом сегмента ST при использовании различных тромболитических препаратов. Ульяновский медико-биол. журн. 2013;2:7–13.
62. Сигитова О.Н., Богданова А.Р. Острое повреждение почек у больных ишемической болезнью сердца после коронарной реваскуляризации: анализ факторов риска развития и исходов. Клинич. нефрол. 2013;3:34–7.
63. Иоселиани Д.Г., Филатов А.А., Роган С.В. и др. Восстановление кровотока в инфарктответственной венечной артерии при остром инфаркте миокарда: эффективно или только эффектно? Международный журн. интервенционной кардиоангиологии 2003;1:33–9.
64. Третье универсальное определение инфаркта миокарда. Росс. кардиол. журн. 2013;2 (Прил. 1):1–16.
65. Арутюнов Г.П., Дмитриев Д.В., Мелентьев А.С. Опыт применения препарата Милдронат для лечения острого инфаркта миокарда. Клинич. геронтол. 1996;1:3–7.
66. Рысев А.В., Загашвили И.В., Шейпак Б.Л., Литвиненко В.А. Опыт применения цитопротекторов при остром коронарном синдроме и инфаркте миокарда. Terra Nova. 2003;1:12–4.
67. Недошивин А.О. Миокардиальный цитопротектор Милдронат в кардиологической практике. https://meddd.ru/kardiologiya/optimizatsiya-energeticheskogo-metabolizma-u-bolnyih-/miokardialnyiy-tsitoprotektor-mildronat-v-terapii.
68. Спасский А.А. Возможности восстановления коронарного кровообращения и профилактика реперфузионного повреждения миокарда у больных острым инфарктом миокарда. Фарматека. 2010;3:95–100.
69. Стаценко М.Е., Туркина С.В. Алгоритм дифференцированного назначения цитопротекторов у пациентов с хронической сердечной недостаточностью и нарушениями углеводного обмена. Терапия. 2015;3:27–34.
70. Михин В.П. Кардиоцитопротекторы – новое направление клинической кардиологии. Архивъ внутренней медицины. 2011;1:21–8.
71. Васюк Ю.А., Куликов К.Г., Кудряков О.Н., Крикунова О.В. Митохондриальная дисфункция в патогенезе острого инфаркта миокарда: принципы диагностики и терапии миокардиальными цитопротекторами. Российские медицинские вести. 2008;13(2):36–41.
72. Ланкин В.З., Тихазе А.К., Беленков Ю.Н. Свободнорадикальные процессы в норме и при патологических состояниях. М., 2001. 78 с.
73. Хлебодаров Ф.Е., Михин В.П. Влияние Милдроната на функцию эндотелия, суточный профиль артериального давления и внутрисердечную гемодинамику у больных артериальной гипертензией. Человек и его здоровье, курский научно-практический вестник. 2009;2:125–29.
74. Шевцова В.А. Опыт применения мельдония у длительно иммобилизированных пациентов с цереброваскулярными заболеваниями. Терапия. 2015;1:8–12.
Об авторах / Для корреспонденции
Н.Ю. Боровкова – д.м.н., проф. кафедры госпитальной терапии ГБОУ ВПО «Нижегородская государственная медицинская академия» Минздрава РФ, Нижний Новгород; e-mail: borovkov-nn@mail.ru
Похожие статьи
- Пациент с психовегетативным синдромом: помогает врач общей практики
- Прогностические маркеры при герминогенных опухолях яичка. Перспективы исследований
- Аутоиммунный гастрит в фокусе клинициста и морфолога
- Запоры у детей: диагностика и лечение на догоспитальном этапе
- Прогностическая значимость уровня мозгового натрийуретического пептида у больных, перенесших обострение ишемической болезни сердца
Источник
Цель исследования состояла в оценке частоты и выраженности острого повреждения почек (ОПП) по критериям RIFLE и AKIN у больных острым инфарктом миокарда с подъемом сегмента ST (ОИМпST), определении связи ОПП с летальностью и эффективностью тромболитической терапии (ТЛТ). Обследованы 146 больных (117 мужчин, 29 женщин, средний возраст 56,7±10,8 года) с ОИМпST, которым выполнена ТЛТ стрептокиназой. ОПП диагностировали и классифицировали по критериям RIFLE и AKIN по креатинину (RIFLECr, AKINCr) и диурезу (RIFLEou, AKINou). ТЛТ была эффективна у 104 (71%) больных. ОПП выявлено у 74 (51%) пациентов по критериям RIFLECr, у 86 (59%) по критериям AKINCr, у 51 (35%) по критериям RIFLEou и AKINou. Умерли 8 (5%) больных. Результаты логистического регрессионного анализа свидетельствовали, что ОПП по RIFLEou или AKINou, независимо от пола, возраста и времени от возникновения клинической картины до момента госпитализации, ассоциировано с летальностью (относительный риск 12,9 при 95% доверительном интервале от 1,45 до 115,58; p=0,002). Таким образом, более чем у 50% больных ОИМпST имеется ОПП по критериям RIFLECr и AKINCr. Частота ОПП по RIFLEou и AKINou на 40% меньше, чем при оценке по AKINCr и на ⅓ меньше по сравнению с оценкой по RIFLECr. Наличие ОПП ассоциировано с отсутствием эффекта от ТЛТ и повышением летальности.
Острый инфаркт миокарда (ОИМ) является фактором риска развития острого повреждения почек (ОПП) [1, 2]. В основе лечения больных ОИМ с подъемом сегмента ST (ОИМпST) лежит реперфузионная терапия: чрескожное коронарное вмешательство (ЧКВ), аортокоронарное шунтирование (АКШ) или тромболитическая терапия (ТЛТ) [3]. ЧКВ и АКШ предполагают выполнение коронарографии, которая в 2—25% случаев осложняется контраст-индуцированной нефропатией [4]. В этой связи у больных данной категории трудно оценить истинную частоту ОПП, обусловленную ОИМ.
ОПП повышает летальность, а также смертность в течение года после ОИМпST [5]. У больных ОИМпST, осложненным кардиогенным шоком, которым проводилось первичное ЧКВ, частота ОПП составила 55%, а относительный риск смерти — 12,3 (при 95% доверительном интервале — ДИ от 1,78 до 84,9; p<0,001) [6]. Отдаленные результаты лечения больных зависят от тяжести повреждения почек в остром периоде инфаркта миокарда; так, риск смерти в течение 10 лет при легком ОПП составляет
15%, при умеренном — 23% и при тяжелом — 33% [7].
К сожалению, перечисленные данные трудно сравнивать, поскольку они основаны на различных критериях диагностики ОПП. С целью стандартизации диагностики и оценки тяжести ОПП экспертами Acute Dialysis Quality Initiative (ADQI) group (2004) была предложена система стратификации тяжести ОПП — классификация RIFLE (Risk, Injury, Failure, Loss, End-stage renal disease) [8]. В 2007 г. критерии RIFLE были модифицированы: предложены более мягкие критерии диагностики и деление ОПП на 3 стадии, увеличен период диагностики с 24 до 48 ч. Критерии получили название AKIN (Acute Kidney
Injury Network) [9].
Обе системы критериев апробированы и применяются для диагностики, оценки тяжести и исходов ОПП при различных заболеваниях, травмах, экзогенных отравлениях [10—13]. Однако частота и тяжесть ОПП по критериям RIFLE и AKIN у больных ОИМпST, которым выполнялась ТЛТ, не ясны. Кроме того, не установлено, являются ли изменения диуреза и уровня креатинина сыворотки одинаково чувствительными параметрами для диагностики и оценки тяжести ОПП у больных ОИМ.
Целью исследования явились оценка частоты и выраженности ОПП, диагностированного по критериям
RIFLE и AKIN у больных ОИМпST, которым выполнялась ТЛТ, а также уточнение связи ОПП с эффективностью ТЛТ и летальностью.
Материал и методы
Обследованы 146 больных ОИМпST, которым в 2008—2010 гг. в отделении неотложной кардиологии Центральной городской клинической больницы Ульяновска выполнена ТЛТ стрептокиназой. Для исключения влияния различной эффективности тромболитических препаратов на результаты исследования в него не включали пациентов, у которых в качестве тромболитика использовали альтеплазу, тенектеплазу или пуролазу. Всего было 117 (80%) мужчин и 29 (20%) женщин, средний
возраст больных составил 56,7±10,8 года. Характеристика больных представлена в таблице. Диагностику ОИМпST, наличие показаний и противопоказаний к ТЛТ, оценку ее эффективности осуществляли согласно Рекомендациям ВНОК (2007) [3]. Тяжесть острой сердечной недостаточности оценивали по классификации Killip (1967). ОПП диагностировали и классифицировали по критериям
RIFLE [8] и AKIN [9], по уровню креатинина сыворотки (RIFLECr, AKINCr) и диурезу (RIFLEou, AKINou).
Только у 3 (2%) больных в анамнезе имелась информация о предшествующем заболевании почек. Мы не располагали информацией об уровне креатинина сыворотки до заболевания, в этой связи исходным считали уровень креатинина, соответствующий расчетной скорости клубочковой фильтрации (СКФ) 75 мл/мин/1,73 м2 [8]. Ни у одного из обследованных нами больных не было показаний к катетеризации мочевого пузыря, поэтому определение диуреза основывалось на самостоятельном мочеиспускании больных.
Статистическую обработку данных проводили с использованием программы Statistica for Windows 6.0.
Достоверность различий между параметрами определяли по t-критерию Стьюдента при нормальном распределении или критерию Манна—Уитни, если распределение отличалось от нормального. Проводили корреляционный анализ в зависимости от вида распределения (с использованием критериев Пирсона или Кендалла). Для сравнения 2 групп по качественному признаку использовали
критерий χ2 Пирсона. Для исследования связи бинарного признака с несколькими количественными и качественными признаками применяли логистический регрессионный анализ. В случае нормального распределения данные представлены в виде M±SD, где M — среднее арифметическое, SD — стандартное отклонение. При распределении, отличном от нормального, данные представлены в виде медианы (Me) и интерквартильного размаха (25-й процентиль; 75-й процентль). Различия считали достоверными при р<0,05.
Результаты
Среднее время от появления клинической картины заболевания до момента госпитализации составило
2,7±1,2 ч, причем в срок до 6 ч госпитализированы 137 (94%) больных. ТЛТ была эффективна у 104 (71%) больных. У 12 (8%) пациентов тяжесть острой сердечной недостаточности соответствовала III и IV классу по Killip.
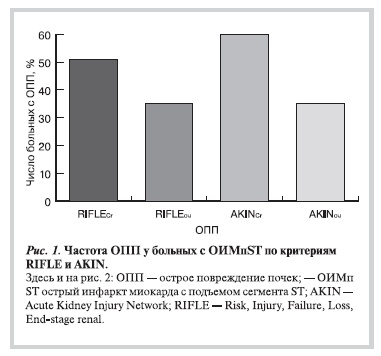
Диурез составил 0,6±0,29 мл/ч/кг. ОПП согласно критериям RIFLEou и AKINou, наблюдалось у 51 (35%) пациента. Концентрация креатинина в сыворотке крови составила 103,9±39,62 мкмоль/л. ОПП по критериям AKINCr диагностировано у 86 (59%), по критериям RIFLECr — у 74 (51%; p=0,16). На рис. 1 представлены результаты диагностики ОПП по критериям RIFLECr, RIFLEou и AKINCr, AKINou.
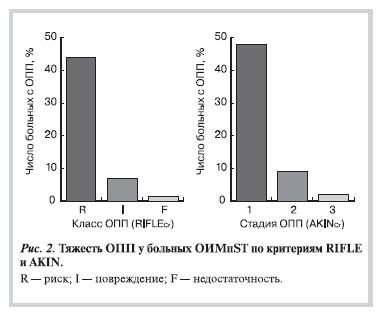
Согласно классификации RIFLECr выявлены следующие классы повреждения почек: у 64 — пациентов
риск (R), у 9 — повреждение (I), у 1 — недостаточность (F). Согласно критериям AKINCr у 71 диагностирована I стадия, у 13 — II стадия и у 2 — III стадия ОПП (рис. 2). Гемодиализ потребовался только одному больному, у которого был класс F по RIFLECr и III стадия по AKINCr.
Возраст больных с ОПП и без ОПП существенно не различался как при диагностике по RIFLECr (55,7±11,21 и 57,3±9,25 года; p=0,38), RIFLEou (57,8±11,44 и 55,9±10,23 года; p=0,42), так и по AKINCr (55,6±10,95 и 57,7±9,20 года; p=0,29) и AKINou (57,8±11,44 и 55,9±10,23 года; p=0,42). У больных с эффективным тромболизисом были меньше уровень креатинина (100,4±41,79 и 113,1±31,90 мкмоль/л; p=0,02), выше скорость клубочковой фильтрации (76,8±32,11 и 63,7±20,62 мл/мин/1,73 м2; p=0,03). Выявлена обратная связь между эффективностью тромболизиса и выраженностью ОПП по RIFLECr (r= ‒0,13; p=0,04).

Отек легких развился у 6 (4%) больных, причем у всех развился передний ОИМпST. ОПП по RIFLEou или
AKINou выявлялось чаще у больных c передним (у 32 из 76), чем у пациентов с задним (у 19 из 70) ОИМпST (χ2=4,21; p=0,04).
Клиническая смерть развилась в период пребывания в стационаре у 16 (11%) больных, из них 8 не удалось реанимировать. Летальность больных ОИМпST с ОПП по RIFLECr и без ОПП достоверно не различалась (χ2=0,001; p=0,98), как и по AKINCr (χ2=0,13; p=0,71). В то же время у больных ОИМпST с ОПП по RIFLEou, AKINou летальность была выше, чем у больных без ОПП (χ2=10,29; p=0,001). Логистический регрессионный анализ позволил выявить, что ОПП по RIFLEou или AKINou независимо от пола, возраста и времени от возникновения клинической картины до момента госпитализации ассоциировано с летальностью (относительный риск 12,9 при 95% ДИ от 1,45 до 115,58; p=0,002).
Обсуждение
Различные критерии диагностики не только затрудняют выявление и оценку тяжести ОПП, но и не позволяют сравнивать результаты, полученные разными авторами, что послужило причиной разработки критериев RIFLE и AKIN. В многочисленных исследованиях продемонстрирована возможность использования критериев RIFLE и AKIN для диагностики ОПП и оценки прогноза у больных с ОПП различной этиологии [10—13].
Острое повреждение почек нами чаще диагностировалось при использовании критериев AKINCr, чем критериев RIFLECr — у 59 и 51% больных соответственно. Ряд авторов отмечают, что более мягкий критерий диагностики ОПП в AKINCr может привести к более частому выявлению легкого повреждения почек (1-я стадия), а, следовательно, и общего числа больных с ОПП [11], чем по критериями RIFLECr. Анализ результатов лечения 120 123 больных в 57 реанимационных отделениях показал, что ОПП несколько чаще диагностировалось по критериям AKINCr, чем по критериям RIFLECr, но при
этом прогностическая значимость критериев не различалась [10].
Как критерии RIFLE, так и AKIN предполагают оценку функции почек по двум параметрам — уровню креатинина в сыворотке крови и (или) диурезу [8, 9]. Мнения о том, какой критерий предпочтительнее, противоречивы. В одном из исследований возможности диагностики ОПП по критерию уровня креатинина в сыворотке и по критерию диуреза были изучены у больных реанимационного отделения, при этом обязательным условием включения больного в исследование было наличие постоянного катетера в мочевом пузыре. В таких условиях при тщательном мониторировании почасового диуреза
диагностика ОПП по диурезу оказалась более точной. При этом авторы отмечают, что принятая в клинике оценка суточного диуреза не позволяет адекватно оценить почасовой диурез [14].
У обследованных нами больных ОИМ не было показаний к катетеризации мочевого пузыря, поэтому точное измерение почасового диуреза было невозможно. В этой связи нам не кажется неожиданной недостаточная эффективность (низкая чувствительность) диагностики ОПП по диурезу у больных ОИМ. Учитывая высокую частоту развития мочевой инфекции, ассоциированной c катетеризацией мочевого пузыря [15], диагностика ОПП по диурезу у больных без четких показаний к катетеризации мочевого пузыря затруднена.
Более того, при нетяжелом ОПП диурез в ряде случаев в большей степени зависит от состояния гидратации, чем от поражения почек. Кроме того, больным нередко вводятся диуретики, которые, увеличивая диурез, не улучшают прогноз ОПП [16]. Все перечисленное заставляет осторожно относиться к возможностям ранней диагностики ОПП при ОИМ по диурезу.
Вместе с тем не вызывает сомнения важность олигурии как клинического параметра. Летальность у наших больных не была связана с ОПП, диагностированным по уровню креатинина, что обусловлено наличием преимущественно нетяжелого ОПП — RIFLE (R) или AKIN
(1-я стадия). При этом ОПП, диагностированное по диурезу, имело прогностическое значение, летальность больных была значительно выше. Таким образом, представляется важным диагностировать ОПП как по уровню креатинина, так и по диурезу.
Классификации RIFLE и AKIN имеют общий недостаток — базальный уровень креатинина сыворотки рассчитывается исходя из предположения, что он соответствует уровню креатинина, при котором расчетная СКФ равна 75 мл/мин/1,73 м2 [8]. Очевидно, что если за нижнюю границу нормы принять другую СКФ, то частота ОПП будет отличаться [17]. В частности, ряд авторов рассчитывали базальный уровень креатинина исходя из СКФ 90 мл/мин/1,73 м2 [18]. Кроме того, у госпитализированных больных с ОИМ нельзя исключить наличие хронической болезни почек (ХБП), распространенность которой у больных кардиологических отделений нашей клиники составляет 34% [19].
В последние годы активно обсуждается роль биомаркеров (Neutrophil gelatinase-associated lipocalin — NGAL и др.) для диагностики и оценки прогноза ОПП [20—22]. Не вдаваясь в обсуждение диагностической и прогностической ценности биомаркеров, следует отметить, что критерии диагностики ОПП должны быть доступны широкому кругу лечебных учреждений, в противном случае
клиническая классификация теряет смысл и становится уделом отдельных лечебных учреждений. Сторонники использования биомаркеров для диагностики ОПП проводят параллели с острым коронарным синдромом, при котором определение маркеров повреждения кардиомиоцитов (тропонин) является общепринятым. Между тем клиническая ситуация при ОПП отличается от ситуации при остром коронарном синдроме, при котором повышение уровня тропонина является ключевым при определении тактики ведения больного. При ОПП решение о начале терапии, замещающей функцию почек, будет основываться на клинических данных и вряд ли биомаркеры раннего повреждения почек повлияют на это решение. Что касается раннего лечения больных с ОПП, то при преренальной азотемии наличие негативных тестов на биомаркеры почечного повреждения может привести к недооценке ситуации и выбору ошибочной тактики лечения. Кроме того, уровень NGAL выше у больных с ХБП [23]. В целом можно согласиться с мнением W.V. Biesen и соавт., что время биомаркеров при ОПП еще не наступило [24].
Заключение
Более чем у 50% больных острым инфарктом миокарда с подъемом сегмента ST, которым выполнялась тромболитическая терапия стрептокиназой, имеется острое повреждение почек по уровню креатинина сыворотки по критериям Acute Kidney Injury Network и Risk, Injury, Failure, Loss, End-stage renal disease. Частота острого повреждения почек, диагностированного по диурезу, на 40% меньше по сравнению с оценкой уровня креатинина сыворотки по Acute Kidney Injury Network и на ⅓ меньше
по сравнению с оценкой по RIFLECr. Наличие острого повреждения почек согласно уровню креатинина сыворотки по критерию Risk, Injury, Failure, Loss, End-stage renal disease ассоциировано с отсутствием эффекта от тромболитической терапии. У больных с острым повреждением почек по диурезу по критериям Acute Kidney Injury Network и критериям Risk, Injury, Failure, Loss, End-stage renal disease летальность выше, чем у больных острым инфарктом миокарда с подъемом сегмента ST без острого повреждения почек.
1. Leblanc M., Kellum J.A., Gibney R.T. et al. Risk factors for acute renal failure: inherent and modifiable risks. Curr Opin Crit Care 2005;11:533—536.
2. Смирнов А.В., Каюков И.Г., Добронравов В.А. и др. Острое повреждение почек — новое понятие в нефрологии. Клин нефрол 2009;1:11—15.
3. Национальные рекомендации по диагностике и лечению больных острым инфарктом миокарда с подъемом сегмента ST ЭКГ. Кардиоваск тер и проф 2007;6:Приложение 1.
4. Mehran R., Aymong E.D., Nikolsky E. et al. A simple risk score for prediction of contrast-induced nephropathy after percutaneous coronary intervention: development and initial validation. J Am Coll Cardiol
2004;44:1393—1399.
5. Goldberg A., Hammerman H., Petcherski S. et al. In-hospital and 1-year mortality of patients who develop worsening renal function following acute ST-elevation myocardial infarction. Am Heart J 2005;150:330—337.
6. Marenzi G., Assanelli E., Campodonico J. et al. Acute kidney injury in ST-segment elevation acute myocardial infarction complicated by cardiogenic shock at admission. Crit Care Med 2010;38:438—444.
7. Parikh C.R., Coca S.G., Wang Y. et al. Long-term Prognosis of Acute Kidney Injury After Acute Myocardial Infarction. Arch Intern Med 2008;168:987—995.
8. Bellomo R., Ronco C., Kellum J.A. et al. Acute renal failure-definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group Crit Care 2004;8: 204—212.
9. Mehta R.L., Kellum J.A., Shah S. et al. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury. Crit Care 2007;11:31.
10. Bagshaw S.M., George C., Bellomo R. A comparison of the RIFLE and AKIN criteria for acute kidney injury in critically ill patients. Nephrol Dial Transplant 2008;23:1569—1574.
11. Englberger L., Suri R.M., Li Z. et al. Clinical accuracy of RIFLE and Acute Kidney Injury Network (AKIN) criteria for acute kidney injury in patients undergoing cardiac surgery. Crit Care 2011;15:16.
12. Joannidis M., Metnitz B., Bauer P. et al. Acute kidney injury in critically ill patients classified by AKIN versus RIFLE using the SAPS 3 database. Intensive Care Med 2009;35:1692—1702.
13. Chang C.H., Lin C.Y., Tian Y.C. et al. Acute kidney injury classification: comparison of AKIN and RIFLE criteria. Shock 2010;33:247—252.
14. Macedo E., Malhotra R., Claure-Del Granado R. et al. Defining urine output criterion for acute kidney injury in critically ill patients. Nephrol Dial Transplant 2011;26:509—515.
15. Chenoweth C.E., Saint S. Urinary tract infections. Infectious Disease Clinics of North America 2011;25:103—115.
16. Mahesh B., Yim B., Robson D. et al. Does furosemide prevent renal dysfunction in high-risk cardiac surgical patients? Results of a doubleblinded prospective randomised trial. Eur J Cardiothorac Surg
2008;33:370—376.
17. Siew E.D., Matheny M.E., Ikizler T.A. et al. Commonly used surrogates for baseline renal function affect the classification and prognosis of acute kidney injury. Kidney Int 2010;77:536—542.
18. Basu G., Chrispal A., Boorugu H. et al. Acute kidney injury in tropical acute febrile illness in a tertiary care centre — RIFLE criteria validation. Nephrol Dial Transplant 2011;26:524—531.
19. Шутов А.М., Курзина Е.В., Серов В.А., Ивашкина Т.Н. Митральная регургитация у больных с хронической сердечной недостаточностью ассоциирована со снижением функционального состояния почек. Нефрология 2008;1:19—23.
20. Koyner J.L., Vaidya V.S., Bennett M.R. et al. Urinary biomarkers in the clinical prognosis and early detection of acute kidney injury. Clin J Am Soc Nephrol 2010;5:2154—2165.
21. Self W.H., Barrett T.W. Novel biomarkers: help or hindrance to patient care in the emergency department? Ann Emerg Med 2010;56:60—61.
22. Cruz D.N., Cal M., Garzotto F. et al. Plasma neutrophil gelatinaseassociated lipocalin is an early biomarker for acute kidney injury in an adult ICU population. Intensive Care Med 2010;36:444—451.
23. Shavit L., Dolgoker I., Ivgi H. et al. Neutrophil gelatinase-associated lipocalin as a predictor of complications and mortality in patients undergoing non-cardiac major surgery. Kidney Blood Press Res
2011;34:116—124.
24. Biesen W.V., Massenhove J.V., Hoste E. et al. Defining acute kidney injury: playing hide-and-seek with the unknown man? Nephrol Dial Transplant 2011;26:399—401.
ФГБОУ ВПО Ульяновский государственный университет
Кафедра терапии и профессиональных болезней медицинского факультета
Мензоров М.В. – к.м.н., ст. преподаватель кафедры.
Шутов А.М. – д.м.н., проф., зав. кафедрой.
Серов В.А. – к.м.н., доцент кафедры.
Михайлова Е.В. – студентка 5 курса.
E-mail: menzorov.m.v@yandex.ru
Источник
