Особенности личности при инфаркте миокарда


ЗНАЕТЕ ЛИ ВЫ?
Медведенко И.В (2 курс, леч. ф-т)
ГБОУ ВПО ЧелГМА Минздрава России
Кафедра социальной работы психологии и педагогики
Научный руководитель – к.м.н., доц. Атаманов А.А.
Профилактика заболеваний сердечно-сосудистой системы в последние десятилетия находится в центре внимания многих специалистов.
Основная проблема на сегодняшний день – это предупреждение инфаркта миокарда. Важное значение в профилактике сердечно-сосудистых заболеваний имеют психологические особенности больных.
Цель исследования:изучить психологические особенности больных, перенесших инфаркт миокарда, и разработать предложения по психопрофилактике наиболее значимых из них.
Материалы и методы: Обследовано 40 пациентов(23 мужчин и 17 женщин), перенесших инфаркт миокарда (ИМ), в возрасте от 45 до 83 лет. Контрольную группу составили 40 человек, соответствующего пола и возраста, не имеющие патологии сердечно-сосудистой системы..
Клинические методы исследования: диагноз ИМ ставился на основании критериев ВОЗ, изменений ЭКГ и повышения активности ферментов АСТ, АЛТ более чем на 50%. Психический статус оценивали по критериям МКБ-10 раздела F.
Психологические методы исследования: профиль функциональной сенсо-моторной асимметрииизучали с помощью совокупных проб. У каждого больного определяли ведущую руку, ногу, глаз и ухо.Особенности личности изучали при помощи теста цветовых выборов Люшерапутёмрасположения карточеквосьми цветов по степени их субъективной приятности. Уровень агрессивности изучали опросникомБасса-Дарки.Уровень депрессии определяли опросником CES-D .
Результаты исследования: Крупноочаговый ИМ перенесли 54% пациентов, 46 % – мелкоочаговый. Первый инфаркт перенесли 60 % больных, повторный – 30 % , три и более – 10 % больных. У 43% обследованных пациентов были выявлены проявления основных невротических синдромов: тревожного, кардиофобического, астенического и других. Профили сенсо-моторной ассиметрии и личностные особенности были крайне вариабельными, однако объединяли всех обследованных более высокие, чем в контроле, проявления агрессивности. Таким образом, «мишенью» психопрофилактических мероприятий были выбраны проявления речевой и физической агрессии. Больным были предложены упражнения по аутогенной тренировке, которые были опробованы в рамках индивидуального коммуникативного тренинга.
Выводы:
1) В острой стадии ИМ ведущими синдромами являлись тревожный и кардиофобический, в постинфарктном – астенический, ипохондрический и депрессивный.
2) Среди психологических особенностей больных с заболеваниями сердечно-сосудистой системы преобладали характеристики, указывающие на высокий уровень агрессивности.
3) Больные с угрозой развития инфаркта миокарда нуждались в проведении профилактических мероприятий, направленных на снижение уровня агрессивности. Методом выбора являлся индивидуальный коммуникативный тренинг.
ПРЕИМУЩЕСТВА ВНУТРИВЕННОГО ПЕРИФЕРИЧЕСКОГО КАТЕТЕРА ПО СРАВНЕНИЮ С ДРУГИМИ СПОСОБАМИ ВВЕДЕНИЯ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ У БОЛЬНЫХ С САХАРНЫМ ДИАБЕТОМ.
Медведенко И.В. (2курс, леч. ф-т)
ГБОУ ВПО ЧелГМА Минздрава России
Кафедра «Топографической анатомии и оперативной хирургии»,
Кафедра «Сестринского дела, ухода за больными, менеджмента»
Научный руководитель – Асс., к.м.н. Широбокова М.В.
Сахарный диабет (СД) является глобальной проблемой здравоохранения. В соответствии с официальной статистикой, по данным Международной Федерации Диабета, к 2025 году в мире будет насчитываться около 400 млн. больных сахарным диабетом. Кроме того, прогнозируется, что к 2025 году СД будет страдать 7% населения мира, из которых на долю сахарного диабета 2 типа придется 92-97%. Катетеризация вен таких больных является наиболее важным, но опасным составляющим лечебного процесса. Необходимо помнить, что диаметр игла ПВК в данной ситуации играет главную роль. Связано это с тем, что у больных СД, вязкая кровь и из-за большого диаметра иглы могут развиться серьезные, жизнеугрожающие осложнения.
Подобно протезам, катетеры, введенные в вены, способствуют инфицированию, создавая канал связи между окружающей средой и стерильной внутренней средой организма. Вероятность инфицирования места катетеризации определяет степень обеспечения асептики и длительность пребывания катетера. Риск инфекции может быть уменьшен (но не исключен) при использовании хирургически имплантированного силиконового катетера для длительной венозной катетеризации с тщательным соблюдением стерильности процедуры. Место установки не должно быть склонно к бактериальному загрязнению (например, не стоит устанавливать катетер в области паха).
Цель исследования: Выявить наиболее удобный и безопасный внутривенный периферический катетер.
Материалы и методы исследования:
В исследовании приняло 15 человек (9 м и 6 ж), в возрасте от 45-60 лет. Диагноз сахарный диабет ставился по данным лабораторного исследования. Были также пациенты, которым СД был поставлен впервые. У исследуемой группы исследовался диаметр иглы катетера и размер, а также препараты, которые вводились через катетеры.
Результаты исследования: Исследование показало что большинство лекарственных веществ больным, страдающим сахарным диабетом целесообразно вводить через катетеры малого диаметра и размера, дабы не вызвать сгущение и застой крови. Характеристики катетера 22G и 20 G- в основном использовались и даже благоприятны в 80 % случаев, 24 G – 15%, 26 G и 18 G 2%.Что соответственно необходимо учитывать при постановки ПВК больным сахарным диабетом.
Выводы: Для пациентов, страдающих сахарным диабетом и нуждающихся во внутривенном введении препаратов в течение короткого или не слишком продолжительного времени, место установки катетера на руках следует менять каждые 48-72 часа. Необходимо поддерживать полную асептику при установленном сосудистом катетере (частая смена одежды и аппликация мазей, содержащих антибиотики, на место введения). Несмотря на высокий риск инфекции при использовании катетеров, показаний к профилактическому назначению антибиотиков до или во время катетеризации нет. Так как катетеры малых размеров и малых диаметров не приведут к возникновению серьезных осложнений.
ИСХОДНЫЙ УРОВЕНЬ ЗНАНИЙ ИСТОРИИ МЕДИЦИНЫ СТУДЕНТОВ 1 КУРСА ЛЕЧЕБНОГО ФАКУЛЬТЕТА, ВЫЯВЛЕННЫЙ НА ОСНОВЕ ТЕСТИРОВАНИЯ
Медведенко И.В. (2 курс, леч. ф-т)
ГБОУ ВПО ЧелГМА Минздрава России
Общественного здоровья и здравоохранения
Научный руководитель – к.м.н., доц. Тарасова И.С., к.м.н. асс. Цытович А.Л.
Актуальность. История медицины – это наука, изучающая возникновение медицинских знаний, их развитие в тесной связи со сменой общественно-экономических формаций и историей культуры народов, современное состояние медицинской теории и практики, перспективы развития медицинских знаний [Сорокина Т.С., 2004]. Изучение истории медицины приводит к пониманию глобальности общечеловеческих проблем и задач в области медицины и охраны здоровья населения.
Изучая прошлое медицины, мы имеем реальную возможность оценить достижения современной медицины и уяснить перспективы её развития [Лисицын Ю.П., 2004]. Знание истории медицины имеет большое значение для формирования мировоззрения будущего врача, обогащая его теоретическими знаниями, воспитывая чувство гуманизма и патриотизма [Сорокина Т.С., 2004; Иванов Н.Г., 1985]. Дисциплина также учит уяснять закономерности развития медицины и взаимосвязь с общим историческим процессом, достижениями в естествознании и культуре. Что необходимо для выявления перспективы развития медицины в целом.
Поэтому возникла необходимость выявить исходный уровень знаний у студентов, пришедших на курс изучения, и восполнить пробелы в знаниях для представления полной картины развития медицинской науки с древнейших времен до наших дней [Троянский Г.Н. и др., 2000].
Цель исследования. Определить исходный уровень знания истории медицины у студентов лечебного факультета, пришедших на курс обучения. Провести тестирование студентов для определения исходного уровня знаний студентов. Выявить минимальное и максимальное количество правильных ответов в блоке вопросов. Определить пробелы в знаниях и восполнить их в курсе истории медицины.
Материалы и методы. В исследуемой выборке участвовало 353 студента лечебного факультета, исследуемые были протестированы по основным темам истории медицины. Тест состоял из 50 вопросов с 5 вариантами ответов, один из которых правильный, включал в себя 5 основных блоков «Медицина древнего времени», «Развитие медицины в 20 веке», «Вклад Ломоносова в медицину и медицинское образование», «Развитие медицины в средние века», «История военной медицины».
Результаты и их обсуждение. В 1, 12, 13, 17, 24, 26, 28, 29, 31, 33, 34, 38 вопросах, исследуемая группа допустила меньше всего ошибок, что составляет 23% неправильных ответов. Больше всего ошибок допускали в вопросах 2, 3, 4, 5, 6, 7, 9, 22, 27, 30, 35, 36, 37, 39, 40, 44, 45, 50, что составляет 35% неправильных ответов. В остальных вопросах уровень правильных ответов в пределах нормы. В блоках вопросов правильные ответы составили: «История военной медицины» 40 % правильных ответов, «Вклад Ломоносова в медицину и медицинское образование» 57% правильных ответов. В блоке «Медицина древнего времени », 91% правильных ответов, «Развитие медицины в средние века», «Развитие медицины в 20 веке», студенты показали уровень правильных ответов так же 91 %.
Выводы. Таким образом, проведя анализ результатов тестирования, исследуемая группа показала наименьший уровень знаний в блоке «История военной медицины» 60 % неправильных ответов, «Вклад Ломоносова в медицину и медицинское образование» 43% неправильных ответов. В блоке «Медицина древнего времени», «Развитие медицины в средние века», «Развитие медицины в 20 веке», студенты показали хороший уровень правильных ответов, что составило 91%, соответственно 9% неправильных ответов.
Исходный уровень знаний истории медицины студентов 1 курса стоматологического и медико – профилактического факультетов, выявленный на основе тестирования
Медведенко И.В.(2 курс, леч.ф-т)
ГБОУ ВПО ЧелГМА Минздрава России
Общественного здоровья и здравоохранения
Научный руководитель – к.м.н., доц. Тарасова И.С., к.м.н. асс. Цытович А.Л
Актуальность. История медицины издавна привлекала врачей. Еще в V веке до нашей эры появилась книга «О древней медицине». Гиппократ писал: «Врач должен знать, что было известно до него, если он не желает обманывать себя и других». Выдающийся клиницист средних веков Аль-Рази в начале Х века подчеркивал в своем труде «Китаб ал-мансур»: «Тысяча врачей быть может уже тысячу лет трудились над усовершенствованием медицины. Поэтому тот, кто читает их произведения прилежно и стараясь вникнуть в их смысл, открывает в течение короткой жизни гораздо больше, чем, если бы он тысячу лет бегал по больным».
Принцип исторического подхода, исторического изучения является важным принципом в любой отрасли знаний и деятельности. При ознакомлении с историей любой науки, в том числе с историей медицины перед исследователем стоят две задачи: во-первых, познание фактов и, во-вторых, уяснение закономерностей, связывающих эти факты.
Изучая прошлое медицины, мы имеем реальную возможность оценить достижения современной медицины и уяснить перспективы её развития. Знание истории медицины имеет большое значение для формирования мировоззрения будущего врача, обогащая его теоретическими знаниями, воспитывая чувство гуманизма и патриотизма.
Дисциплина также учит уяснять закономерности развития медицины и взаимосвязь с общим историческим процессом, достижениями в естествознании и культуре. Что необходимо для выявления перспективы развития медицины в целом.
Поэтому возникла необходимость выявить исходный уровень знаний у студентов, пришедших на курс изучения, и восполнить пробелы в знаниях для представления полной картины развития медицинской науки с древнейших времен до наших дней.
Цель исследования. Определить исходный уровень знания истории медицины у студентов, пришедших на курс обучения. Провести тестирование студентов для определения исходного уровня знаний студентов. Выявить минимальное и максимальное количество правильных ответов в блоке вопросов. Определить пробелы в знаниях и восполнить их в курсе истории медицины.
Материалы и методы. В исследуемой выборке участвовало 55 студентов стоматологического и 28 студентов медико-профилактического факультета, исследуемые были протестированы по основным темам истории медицины. Тест состоял из 50 вопросов с 5 вариантами ответов, один из которых правильный, включал в себя 5 основных блоков «Медицина древнего времени», «Развитие медицины в 20 веке», «Вклад Ломоносова в медицину и медицинское образование», «Развитие медицины в средние века», «История военной медицины».
Результаты и их обсуждение. В 12, 13, 14, 17, 25, 26, 33, 41, 43, 47 вопросах, исследуемая группа допустила меньше всего ошибок, что составляет 18% неправильных ответов. Больше всего ошибок допускали в вопросах 2, 3, 4, 5, 6, 7, 8, 9, 11, 16, 35, 36, 44, 45, 46, что составляет 42 % неправильных ответов. В остальных вопросах уровень правильных ответов в пределах нормы, что составляет более 70%.
Заключение: Таким образом, «История военной медицины» 18 % неправильных ответов «Вклад Ломоносова в медицину и медицинское образование» 24% неправильных ответов. В блоке «Медицина древнего времени», 60% неправильных ответов «Развитие медицины в средние века» 32%, «Развитие медицины в 20 веке», студенты показали уровень отвечаемости 24 % неправильных ответов.
ЭПИДЕМИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ХРОНИЧЕСКОГО ВИРУСНОГО ГЕПАТИТА КАК ФАКТОРА ПРОДВИНУТОГО ФИБРОЗА ПЕЧЕНИ
Мелихова Ю.И. (5 курс, леч. ф-т), Чипчиков Э.Ю. (5 курс, леч. ф-т)
ГБОУ ВПО ЧелГМА Минздрава России
Кафедра инфекционных болезней
Научный руководитель – к.м.н., асс. Шип С.А.
Актуальность. Хронические вирусные гепатиты (В, С, D) на стадии продвинутого фиброза печени наносят значительный социально-экономический ущерб и значительно повышают риск специфических и неспецифических осложнений [Ивашкин В.Т. и др., 2006 , Краснова Л.И., 2010, Павлов Ч.С., 2008].
Цель исследования. Изучить эпидемиологические характеристики больных хроническими вирусными гепатитами (В, С, Д) на стадии продвинутого фиброза печени.
Материалы и методы. Было обследовано 113 больных, состоящих на учете в Гепатитном Центре Челябинской области. Основной критерий включения больных – наличие по результатам непрямой эластометрии печени фиброза в стадии F3-F4 согласно шкале Metavir.
Результаты и их обсуждение. Среди пациентов: 51,33% (58) – мужчины; 48,67% (55) – женщины. 61,06% (69) пациентов проживают в областном центре – городе Челябинск, 38,94% (44) являются жителями области. Возраст пациентов на момент постановки им диагноза хронический вирусный гепатит варьировал от 17 до 74 лет. При этом пациенты в возрасте 17-20 лет составили 1,77% (2); 20-29 лет – 13,27% (15); 30-39 лет – 23,01% (26); 40-49 лет – 26,55% (30); 50-59 лет – 23,89% (27); 60-69 лет – 8,85% (10); 70-74 лет – 2,65% (3). Распределение больных в зависимости от профессиональной деятельности: лица физического труда – 22,12% (25), умственного труда – 15,93% (18), не дифференцируемый характер трудовой деятельности установлен у 13,27% (15). Таким образом, работающие составили 51,33% (58), не работающие или пенсионеры – 48,67% (55). Распределение больных в зависимости от этиологии хронического вирусного гепатита: HCV – 78,76% (89); HBV – 12,39% (14); HBV+HСV – 4,42% (5); HBV+HDV – 3,54% (4); HBV+HCV+HDV – 0,88% (1). Таким образом, больные с микст-гепатитами (HBV+HСV, HBV+HDV, HBV+HCV+HDV) составили 8,85% (10) от общего числа пациентов. Распределение больных по степени активности инфекционного процесса: минимальная – 58,41% (66); умеренная – 29,20% (33). Диагноз «цирроз печени вирусной этиологии» фигурирует только у 23,01% (26) больных, в то же время у 76,99% (87 больных) – диагноз «цирроз печени» – не выставлен. Временной интервал между моментом постановки диагноза «хронический вирусный гепатит» и установлением фиброза F3-F4 методом непрямой эластометрии: менее 2 лет – 51,79% (58), от 2 до 5 лет – 24,11% (27), 6 лет и более – 24,11% (27).
Выводы. Установлены эпидемиологические и инструментальные изменения у больных хроническими вирусными гепатитами (В, С, Д) на стадии продвинутого фиброза печени.
Источник
Инфаркт миокарда – очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Клинически проявляется жгущими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Развившийся инфаркт миокарда служит показанием к экстренной госпитализации в кардиологическую реанимацию. При неоказании своевременной помощи возможен летальный исход.
Общие сведения
Инфаркт миокарда – очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Клинически проявляется жгущими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Развившийся инфаркт миокарда служит показанием к экстренной госпитализации в кардиологическую реанимацию. При неоказании своевременной помощи возможен летальный исход.
В возрасте 40-60 лет инфаркт миокарда в 3–5 раз чаще наблюдается у мужчин в связи с более ранним (на 10 лет раньше, чем у женщин) развитием атеросклероза. После 55-60 лет заболеваемость среди лиц обоего пола приблизительно одинакова. Показатель летальности при инфаркте миокарда составляет 30—35%. Статистически 15—20% внезапных смертей обусловлены инфарктом миокарда.
Нарушение кровоснабжения миокарда на 15-20 и более минут приводит к развитию необратимых изменений в сердечной мышце и расстройству сердечной деятельности. Острая ишемия вызывает гибель части функциональных мышечных клеток (некроз) и последующее их замещение волокнами соединительной ткани, т. е. формирование постинфарктного рубца.
В клиническом течении инфаркта миокарда выделяют пять периодов:
- 1 период – предынфарктный (продромальный): учащение и усиление приступов стенокардии, может продолжаться несколько часов, суток, недель;
- 2 период – острейший: от развития ишемии до появления некроза миокарда, продолжается от 20 минут до 2 часов;
- 3 период – острый: от образования некроза до миомаляции (ферментативного расплавления некротизированной мышечной ткани), длительность от 2 до 14 суток;
- 4 период – подострый: начальные процессы организации рубца, развитие грануляционной ткани на месте некротической, продолжительность 4-8 недель;
- 5 период – постинфарктный: созревание рубца, адаптация миокарда к новым условиям функционирования.
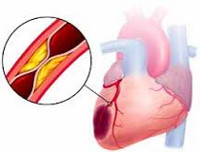
Инфаркт миокарда
Причины инфаркта миокарда
Инфаркт миокарда является острой формой ИБС. В 97—98% случаев основой для развития инфаркта миокарда служит атеросклеротическое поражение венечных артерий, вызывающее сужение их просвета. Нередко к атеросклерозу артерий присоединяется острый тромбоз пораженного участка сосуда, вызывающий полное или частичное прекращение кровоснабжения соответствующей области сердечной мышцы. Тромбообразованию способствует повышенная вязкость крови, наблюдаемая у пациентов с ИБС. В ряде случаев инфаркт миокарда возникает на фоне спазма ветвей венечных артерий.
Развитию инфаркта миокарда способствуют сахарный диабет, гипертоничесая болезнь, ожирение, нервно-психическое напряжение, увлечение алкоголем, курение. Резкое физическое или эмоциональное напряжение на фоне ИБС и стенокардии может спровоцировать развитие инфаркта миокарда. Чаще развивается инфаркт миокарда левого желудочка.
Классификация инфаркта миокарда
В соответствии с размерами очагового поражения сердечной мышцы выделяют инфаркт миокарда:
- крупноочаговый
- мелкоочаговый
На долю мелкоочаговых инфарктов миокарда приходится около 20% клинических случаев, однако нередко мелкие очаги некроза в сердечной мышце могут трансформироваться в крупноочаговый инфаркт миокарда (у 30% пациентов). В отличие от крупноочаговых, при мелкоочаговых инфарктах не возникают аневризма и разрыв сердца, течение последних реже осложняется сердечной недостаточностью, фибрилляцией желудочков, тромбоэмболией.
В зависимости от глубины некротического поражения сердечной мышцы выделяют инфаркт миокарда:
- трансмуральный – с некрозом всей толщи мышечной стенки сердца (чаще крупноочаговый)
- интрамуральный – с некрозом в толще миокарда
- субэндокардиальный – с некрозом миокарда в зоне прилегания к эндокарду
- субэпикардиальный – с некрозом миокарда в зоне прилегания к эпикарду
По изменениям, фиксируемым на ЭКГ, различают:
- «Q-инфаркт» – с формированием патологического зубца Q, иногда желудочкового комплекса QS (чаще крупноочаговый трансмуральный инфаркт миокарда)
- «не Q-инфаркт» – не сопровождается появлением зубца Q, проявляется отрицательными Т-зубцами (чаще мелкоочаговый инфаркт миокарда)
По топографии и в зависимости от поражения определенных ветвей коронарных артерий инфаркт миокарда делится на:
- правожелудочковый
- левожелудочковый: передней, боковой и задней стенок, межжелудочковой перегородки
По кратности возникновения различают инфаркт миокарда:
- первичный
- рецидивирующий (развивается в срок 8 недель после первичного)
- повторный (развивается спустя 8 недель после предыдущего)
По развитию осложнений инфаркт миокарда подразделяется на:
- осложненный
- неосложненный
По наличию и локализации болевого синдрома выделяют формы инфаркта миокарда:
- типичную – с локализацией боли за грудиной или в прекардиальной области
- атипичные – с атипичными болевыми проявлениями:
- периферические: леволопаточная, леворучная, гортанно-глоточная, нижнечелюстная, верхнепозвоночная, гастралгическая (абдоминальная)
- безболевые: коллаптоидная, астматическая, отечная, аритмическая, церебральная
- малосимптомную (стертую)
- комбинированную
В соответствии с периодом и динамикой развития инфаркта миокарда выделяют:
- стадию ишемии (острейший период)
- стадию некроза (острый период)
- стадию организации (подострый период)
- стадию рубцевания (постинфарктный период)
Симптомы инфаркта миокарда
Предынфарктный (продромальный) период
Около 43% пациентов отмечают внезапное развитие инфаркта миокарда, у большей же части больных наблюдается различный по продолжительности период нестабильной прогрессирующей стенокардии.
Острейший период
Типичные случаи инфаркта миокарда характеризуются чрезвычайно интенсивным болевым синдромом с локализацией болей в грудной клетке и иррадиацией в левое плечо, шею, зубы, ухо, ключицу, нижнюю челюсть, межлопаточную зону. Характер болей может быть сжимающим, распирающим, жгучим, давящим, острым («кинжальным»). Чем больше зона поражения миокарда, тем более выражена боль.
Болевой приступ протекает волнообразно (то усиливаясь, то ослабевая), продолжается от 30 минут до нескольких часов, а иногда и суток, не купируется повторным приемом нитроглицерина. Боль сопряжена с резкой слабостью, возбуждением, чувством страха, одышкой.
Возможно атипичное течение острейшего периода инфаркта миокарда.
У пациентов отмечается резкая бледность кожных покровов, липкий холодный пот, акроцианоз, беспокойство. Артериальное давление в период приступа повышено, затем умеренно или резко снижается по сравнению с исходным (систолическое < 80 рт. ст., пульсовое < 30 мм мм рт. ст.), отмечается тахикардия, аритмия.
В этот период может развиться острая левожелудочковая недостаточность (сердечная астма, отек легких).
Острый период
В остром периоде инфаркта миокарда болевой синдром, как правило, исчезает. Сохранение болей бывает вызвано выраженной степенью ишемии околоинфарктной зоны или присоединением перикардита.
В результате процессов некроза, миомаляции и перифокального воспаления развивается лихорадка (от 3-5 до 10 и более дней). Длительность и высота подъема температуры при лихорадке зависят от площади некроза. Артериальная гипотензия и признаки сердечной недостаточности сохраняются и нарастают.
Подострый период
Болевые ощущения отсутствуют, состояние пациента улучшается, нормализуется температура тела. Симптомы острой сердечной недостаточности становятся менее выраженными. Исчезает тахикардия, систолический шум.
Постинфарктный период
В постинфарктном периоде клинические проявления отсутствуют, лабораторные и физикальные данные практически без отклонений.
Атипичные формы инфаркта миокарда
Иногда встречается атипичное течение инфаркта миокарда с локализацией болей в нетипичных местах (в области горла, пальцах левой руки, в зоне левой лопатки или шейно-грудного отдела позвоночника, в эпигастрии, в нижней челюсти) или безболевые формы, ведущими симптомами которых могут быть кашель и тяжелое удушье, коллапс, отеки, аритмии, головокружение и помрачение сознания.
Атипичные формы инфаркта миокарда чаще встречаются у пожилых пациентов с выраженными признаками кардиосклероза, недостаточностью кровообращения, на фоне повторного инфаркта миокарда.
Однако атипично протекает обычно только острейший период, дальнейшее развитие инфаркта миокарда становится типичным.
Стертое течение инфаркта миокарда бывает безболевым и случайно обнаруживается на ЭКГ.
Осложнения
Нередко осложнения возникают уже в первые часы и дни инфаркта миокарда, утяжеляя его течение. У большинства пациентов в первые трое суток наблюдаются различные виды аритмий: экстрасистолия, синусовая или пароксизмальная тахикардия, мерцательная аритмия, полная внутрижелудочковая блокада. Наиболее опасно мерцание желудочков, которое может перейти в фибрилляцию и привести к гибели пациента.
Левожелудочковая сердечная недостаточность характеризуется застойными хрипами, явлениями сердечной астмы, отека легких и нередко развивается в острейший период инфаркта миокарда. Крайне тяжелой степенью левожелудочковой недостаточности является кардиогенный шок, развивающийся при обширном инфаркте и обычно приводящий к летальному исходу. Признаками кардиогенного шока служит падение систолического АД ниже 80 мм рт. ст., нарушение сознания, тахикардия, цианоз, уменьшение диуреза.
Разрыв мышечных волокон в зоне некроза может вызывать тампонаду сердца – кровоизлияние в полость перикарда. У 2-3% пациентов инфаркт миокарда осложняется тромбоэмболиями системы легочной артерии (могут стать причиной инфаркта легких или внезапной смерти) или большого круга кровообращения.
Пациенты с обширным трансмуральным инфарктом миокарда в первые 10 суток могут погибнуть от разрыва желудочка вследствие острого прекращения кровообращения. При обширном инфаркте миокарда может возникать несостоятельность рубцовой ткани, ее выбухание с развитием острой аневризмы сердца. Острая аневризма может трансформироваться в хроническую, приводящую к сердечной недостаточности.
Отложение фибрина на стенках эндокарда приводит к развитию пристеночного тромбоэндокардита, опасного возможностью эмболии сосудов легких, мозга, почек оторвавшимися тромботическими массами. В более позднем периоде может развиться постинфарктный синдром, проявляющийся перикардитом, плевритом, артралгиями, эозинофилией.
Диагностика инфаркта миокарда
Среди диагностических критериев инфаркта миокарда важнейшими являются анамнез заболевания, характерные изменения на ЭКГ, показатели активности ферментов сыворотки крови. Жалобы пациента при инфаркте миокарда зависят от формы (типичной или атипичной) заболевания и обширности поражение сердечной мышца. Инфаркт миокарда следует заподозрить при тяжелом и продолжительном (дольше 30-60 минут) приступе загрудинных болей, нарушении проводимости и ритма сердца, острой сердечной недостаточности.
К характерным изменениям ЭКГ относятся формирование отрицательного зубца Т (при мелкоочаговом субэндокардиальном или интрамуральном инфаркте миокарда), патологического комплекса QRS или зубца Q (при крупноочаговом трансмуральном инфаркте миокарда). При ЭхоКГ выявляется нарушение локально сократимости желудочка, истончение его стенки.
В первые 4-6 часов после болевого приступа в крови определяется повышение миоглобина – белка, осуществляющего транспорт кислорода внутрь клеток.Повышение активности креатинфосфокиназы (КФК) в крови более чем на 50% наблюдается спустя 8—10 ч от развития инфаркта миокарда и снижается до нормы через двое суток. Определение уровня КФК проводят через каждые 6-8 часов. Инфаркт миокарда исключается при трех отрицательных результатах.
Для диагностики инфаркта миокарда на более поздних сроках прибегают к определению фермента лактатдегидрогеназы (ЛДГ), активность которой повышается позже КФК – спустя 1-2 суток после формирования некроза и приходит к нормальным значениям через 7-14 дней. Высокоспецифичным для инфаркта миокарда является повышение изоформ миокардиального сократительного белка тропонина – тропонина-Т и тропонина-1, увеличивающихся также при нестабильной стенокардии. В крови определяется увеличение СОЭ, лейкоцитов, активности аспартатаминотрансферазы (АсАт) и аланинаминотрансферазы (АлАт).
Коронарная ангиография (коронарография) позволяет установить тромботическую окклюзию коронарной артерии и снижение желудочковой сократимости, а также оценить возможности проведения аортокоронарного шунтирования или ангиопластики – операций, способствующих восстановлению кровотока в сердце.
Лечение инфаркта миокарда
При инфаркте миокарда показана экстренная госпитализация в кардиологическую реанимацию. В остром периоде пациенту предписывается постельный режим и психический покой, дробное, ограниченное по объему и калорийности питание. В подостром периоде больной переводится из реанимации в отделение кардиологии, где продолжается лечение инфаркта миокарда и осуществляется постепенное расширение режима.
Купирование болевого синдрома проводится сочетанием наркотических анальгетиков (фентанила) с нейролептиками (дроперидолом), внутривенным введением нитроглицерина.
Терапия при инфаркте миокарда направлена на предупреждение и устранение аритмий, сердечной недостаточности, кардиогенного шока. Назначают антиаритмические средства (лидокаин), ß-адреноблокаторы (атенолол), тромболитики (гепарин, ацетилсалициловая к-та), антогонисты Са (верапамил), магнезию, нитраты, спазмолитики и т. д.
В первые 24 часа после развития инфаркта миокарда можно произвести восстановление перфузии путем тромболизиса или экстренной баллонной коронарной ангиопластики.
Прогноз при инфаркте миокарда
Инфаркт миокарда является тяжелым, сопряженным с опасными осложнениями заболеванием. Большая часть летальных исходов развивается в первые сутки после инфаркта миокарда. Насосная способность сердца связана с локализацией и объемом зоны инфаркта. При повреждении более 50% миокарда, как правило, сердце функционировать не может, что вызывает кардиогенный шок и гибель пациента. Даже при менее обширном повреждении сердце не всегда справляется нагрузками, в результате чего развивается сердечная недостаточность.
По истечении острого периода прогноз на выздоровление хороший. Неблагоприятные перспективы у пациентов с осложненным течением инфаркта миокарда.
Профилактика инфаркта миокарда
Необходимыми условиями профилактики инфаркта миокарда являются ведение здорового и активного образа жизни, отказ от алкоголя и курения, сбалансированное питание, исключение физического и нервного перенапряжения, контроль АД и уровня холестерина крови.
Источник
