Оперативное вмешательство при сердечной недостаточности
При неэффективности терапевтического лечения ХСН и критическом обострении ситуации приходится прибегать к хирургическим и механическим методам лечения. Несмотря на их большое разнообразие, уровень доказательности эффективности и безопасности их применения, как правило, весьма низок и ограничивается отдельными эмпирическими наблюдениями. Кроме того, следует отметить, что проведение любых методов лечения подразумевает одновременное максимально эффективное медикаментозное лечение ХСН (по принципам, изложенным выше). То есть хирургия или электрофизиология не вместо, а вместе с медикаментозным лечением ХСН.
В первую очередь необходимо выделить как наиболее популярное вмешательство – операцию по реваскуляри-зации миокарда (аорто-коронарное или маммарно-коронарное шунтирование). Смертность больных в результате оперативных вмешательств прямо коррелирует с ФВ ЛЖ. Поэтому хирурги предпочитают отказываться от операций у пациентов с ФВ <35%. В связи с этим доказательства эффективности реваскуляризации миокарда у больных ХСН имеют лишь теоретическое обоснование и опыт разрозненных исследований. В настоящее время проводятся специальные крупномасштабные исследования по изучению этого вопроса (STICH).
Операция по коррекции митральной регургитации (вмешательства на клапане) позволяет улучшать симптомы ХСН у тщательно отобранной подгруппы больных (уровень доказанности В). Влияние на прогноз неизвестно.
Операция кардиомиопластики с использованием лоскута широчайшей мышцы спины неэффективна и не может быть рекомендована для лечения ХСН (класс рекомендаций I, уровень доказанности В).
Операция частичной вентрикулотомии (операция Батисты), или хирургическое ремоделирование сердца, оказалась также неэффективной и в настоящее время не может быть рекомендована для лечения ХСН (класс рекомендаций I, уровень доказанности В).
Операция трансплантации сердца традиционно считается средством выбора в лечении финальной стадии ХСН, не поддающейся эффективному терапевтическому воздействию. Однако какие-либо контролируемые исследования по оценке эффективности трансплантации сердца отсутствуют (уровень доказанности С). Вместе с тем эмпирические наблюдения подтверждают клиническую эффективность и хороший прогноз при правильном выборе показаний к оперативному лечению.
Главными ограничениями к эффективному использованию этого метода следует считать:
- отсутствие достаточного количества донорских сердец,
- проблему отторжения пересаженного сердца, требующую мощной и крайне дорогой иммуносупрессивной терапии,
- болезнь коронарных артерий пересаженного сердца, не имеющую эффективного лечения.
Суммируя вышесказанное, можно констатировать, что трансплантация сердца не имеет серьезного будущего и, как подтверждение тому – пик использования этой методики в США пришелся на 1994 год, после чего количество вмешательств неуклонно снижается.
Главной альтернативой трансплантации может быть использование аппаратов вспомогательного кровообращения, получивших название искусственных желудочков сердца.
Вначале эти устройства использовались у больных ХСН и критическим нарушением гемодинамики, ожидающих операции по пересадке сердца (мост к трансплантации). Однако затем выяснилось, что через несколько месяцев работы вспомогательного аппарата происходило частичное восстановление функций собственного сердца.
На сегодняшний день механические искусственные желудочки сердца стали весьма миниатюрными и достаточно надежными в техническом отношении. Они полностью имплантируются в полость тела пациента и через поверхность кожных покровов к ним подходит только провод, подающий электроэнергию от портативной аккумуляторной батареи, которую пациент носит на поясе.
Созданы и успешно применяются в клинической практике особо миниатюрные искусственные желудочки, представляющие собой микротурбину приводимую в движение маленьким электродвигателем, делающим до 50 тыс. оборотов в минуту. Микротурбина и электромотор находятся на конце катетера, который путем пункции бедренной артерии проводится в аорту и устанавливается в полости ЛЖ. Подобная система способна перекачивать из полости ЛЖ в аорту до 6 литров крови в минуту, что обеспечивает полную гемодинамическую разгрузку желудочка и способствует восстановлению его сократительной способности.
На сегодня в специальных исследованиях доказано, что постановка искусственного ЛЖ улучшает прогноз больных с критической ХСН (уровень доказанности В). По своей эффективности (влиянию на выживаемость) метод постановки искусственного ЛЖ превосходит все терапевтические методы лечения.
Главным ограничением к использованию в России может оказаться высокая стоимость.
Другими ограничениями являются осложнения, главными из которых остаются вторичная инфекция, а также тромбоз аппарата и тромбоэмболические осложнения.
Для предотвращения прогрессирования ремоделирования желудочков применяется операция окутывания сердца эластичным сетчатым каркасом. Предварительные результаты использования этой методики показывают, что она предотвращает прогрессирование СН, нарастание дилатации сердца, развитие регургитации на клапанах, улучшает функциональное состояние больных и повышает действенность медикаментозной терапии. В случае использования на начальных стадиях дилатационной кар-диомиопатии имплантация сетчатого каркаса во многих случаях обеспечивает обратное развитие процесса патологического ремоделирования желудочков. Вместе с тем данная методика пока находится на этапе своего становления, и для подтверждения ее эффективности необходимы результаты клинических исследований.
Хроническая сердечная недостаточность
Рекомендации ВНОК
Опубликовал Константин Моканов
Источник
Хирургическое лечение сердечной недостаточности. Ишемическая кардиомиопатия
В настоящее время, несмотря на наличие современных методов лечения сердечной недостаточности, практикующие врачи часто сталкиваются с пациентами, у которых на фоне оптимально подобранного лечения продолжают прогрессировать симптомы СН. Действительно, вопреки многообразию существующих схем лекарственной терапии и таких электрофизиологических методов лечения, как двухкамерная стимуляция, ИКД, у многих пациентов так и не удается достичь оптимального качества жизни и хорошего прогноза.
Хирургические методы лечения СН могут быть полезными в следующих случаях: (1) с целью уменьшения ишемии миокарда; (2) для коррекции дисфункции клапанного аппарата; (3) с целью восстановления или уменьшения механических последствий ремоделирования миокарда; (4) для выполнения трансплантации сердца, когда остальные методы лечения были неэффективны.
Исторически к хирургическим вмешательствам у пациентов с СН и низкой фракцией выброса левого желудочка (ФВ ЛЖ) относились как к операциям очень высокого риска. Тем не менее современные исследования выявили, что у таких пациентов в раннем послеоперационном периоде количество осложнений и летальность могут находиться на допустимом уровне, а эффективность лечения и выживаемость на поздних стадиях заболевания значительно улучшаются.

В статьях будут рассмотрены все возможные методы хирургической коррекции при СН: реваскуляризация КА, реконструктивные операции на клапанах сердца, реконструкция ЛЖ, использование устройств для пассивной поддержки сердечной деятельности и трансплантация сердца. Для получения положительного эффекта некоторым пациентам достаточно выполнить только одну операцию (например, АКШ или реконструкцию клапана), тогда как у других необходимо применить несколько методов одновременно (например, АКШ в сочетании с реконструкцией митрального и трехстворчатого клапанов либо с реконструкцией ЛЖ при апикальной аневризме ЛЖ).
Ишемическая кардиомиопатия
Термин ишемическая кардиомиопатия используют для описания миокардиальной дисфункции, развивающейся вторично на фоне окклюзирующего и/или обструктивного поражения коронарного русла. Несмотря на то что ранее ишемическую кардиомиопатию считали второй по значимости причиной развития СН (после гипертензии), результаты Framingham Study показали, что именно ИКМП является основной причиной СН. Данный раздел посвящен хирургической реваскуляризации КА у пациентов с ИКМП.
Ишемическая кардиомиопатия можно представить как взаимосвязь трех патофизиологических процессов: (1) гибернации миокарда, определяемой как постоянное нарушение сократимости миокарда в покое, вызванное снижением коронарного кровотока, которое может быть частично или полностью обратимо посредством реваскуляризации миокарда; (2) «оглушения» миокарда (или станнинга) — относительно продолжительного или транзиторного состояния жизнеспособного миокарда, развивающегося в результате реперфузии за счет притока свободных радикалов кислорода и потери сократительными белками чувствительности к кальцию; (3) необратимой смерти КМЦ, приводящей к ремоделированию желудочка и нарушению сократительной функции.
– Также рекомендуем “Аортокоронарное шунтирование. Показания для реваскуляризации миокарда”
Оглавление темы “Хирургия сердечной недостаточности”:
- Хирургическое лечение сердечной недостаточности. Ишемическая кардиомиопатия
- Аортокоронарное шунтирование. Показания для реваскуляризации миокарда
- Риск аортокоронарного шунтирования. Улучшение функции левого желудочка после АКШ
- Функциональное улучшение после АКШ. Влияние аорто-коронарного шунтирования на продолжительность жизни
- Хирургия недостаточности митрального клапана. Эффективность операций при митральной регургитации
- Влияние коррекции недостаточности митрального клапана на продолжительность жизни. Коррекция недостаточности трехстворчатого клапана
- Протезирование аортального клапана. Показания к операции на аортальном клапане
- Реконструкция левого желудочка. Показания к реконструкции левого желудочка
- Устройства поддержки сердечной деятельности (УПСД). Устройства СоrСар и Раrасоr
- Трансплантация сердца. Распределение донорских сердец
Источник
Трансплантация сердца.
В РБ органная трансплантация осуществляется в соответствии с законом, в основе которого лежит “презумпция согласия”: забор органа может быть осуществлен после констатации смерти мозга, если пожелания обратного не выражены пациентом до смерти.
Реципиент.
Основная цель подбора реципиентов состоит в том, чтобы идентифицировать больных с конечной стадией СН, невосприимчивых к медицикаментозному лечению, но обладающих потенциалом для возобновления нормальной активной жизни.
Показания к трансплантации сердца.
Реципиентами является больные с терминальной стадией СН, не подлежащие медикаментозной терапии или альтернативным хирургическим методам лечения сердечной недостаточности. Прогноз однолетней выживаемости без трансплантации < 50%. Объективными критериям такого прогноза являются: ФВ ЛЖ < 20%, Na сыворотки крови < 135 мэкв/л, давление заклинивания в легочной артерии > 25 мм рт.ст, уровень норадреналина в плазме > 600 пкг/мл, кардиоторакальный индекс > 0,6, снижение максимального VO2 < 10 мл/кг/мин. на фоне максимальной медикаментозной поддержки.
Первичное обследование реципиента включает тщательный анализ анамнеза и объективное исследование: рентгенографию грудной клетки, нагрузочный тест на максимальное потребление кислорода (VO2), рутинные гематологические и биохимические тесты, серологические исследование на наличие инфекционных заболеваний определение человеческого лимфоцитарного антигена (HLA). Проведение зондирование сердца с тонометрией правых отделов сердца с целью исключения необратимой легочной гипертензии перед постановкой пациентов в лист ожидания для трансплантации сердца – обязательно.
Фармакологический мост к трансплантации.
Больные с критической стадией терминальной недостаточности требуют лечения в отделении интенсивной терапии инфузионными инотропными средствами. У больных с недостаточным эффектом медикаментозного лечения используется интрааортальная баллонная контрпульсация.
Механический мост к трансплантации. У потенциальных реципиентов, которые остаются гемодинамически нестабильными в течение 24-48 часов при максимальной фармакологической поддержке применяются устройства моно-, бивентикулярного обхода желудочков или полное искусственное сердце.
Донор подвергается скринингу в три этапа. Первый этап заключается в сборе точной информации относительно возраста пациента, роста, веса, пола, группы крови и Rh-фактора, причины смерти, лабораторных данных, включая биохимические тесты, и серологические исследования на инфекционные заболевания (цитомегаловирус, гепатиты В и С). Второй этап скрининга включает дальнейшее исследование в поисках потенциальных противопоказаний: оценивается ЭКГ, грудная рентгенография, насыщение О2 артериальный крови и ЭхоКГ. Финальный этап скрининга донора происходит во время операции забора органа: оценивается функция желудочков, клапанная или коронарная патология.
Совместимость донора и реципиента.
Критерии совместимости базируются на соответствии группы крови по АВО и размере тела пациента. Вес донора должен быть в пределах 30% веса. Проводится скрининг реципиента на титр человеческого лимфоцитарного антигена (HLA). Положительная перекрестная реакция – абсолютное противопоказание к трансплантации. Увеличение количества реактивных антител (PRA) больше 10-15% указывает на повышенную чувствительность реципиента к аллоантигенам.
В РНПЦ для трансплантации сердца используется классическая методика N.Shumway.
Успешные и долгосрочные результаты ортотопической трансплантации сердца сделали ее методом выбора для пациентов с отсутствием эффекта от медикаментозного лечения. Однако, очевидные ограничения трансплантации, включающие потребность в иммунодепрессии и дефицит донорских органов не позволяют использовать этот метод лечения у всех пациентов. В РНПЦ для решения этой проблемы широко используются альтернативные хирургические методы лечения СН.
Реваскуляризация миокарда.
Успешная реваскуляризация миокарда у больных с ФВ < 30% может быть выполнена с невысокой госпитальной летальностью. Идеальными пациентами для выполнения реваскуляризации миокарда являются больные с хорошим дистальным коронарным руслом, наличием достаточно большого объема гибернирующего миокарда и отсутствием правожелудочковой недостаточности. Диагностика жизнеспособного миокарда с помощью сцинтиграфии, позволяющей отличить гибернирующий миокард от соединительнотканного рубца, также как и стрессЭхоКГ с добутамином является обязательными тестами для прогноза восстановления функции желудочков в послеоперационном периоде. Кроме того, с целью прогнозирования исхода операции проводится исследование уровня мозгового натрийуретического пептида (BNP). Уровень BNP < 400 пкг/мл является благоприятным прогностическим признаком исхода операции.
Коррекция недостаточности артриовентрикулярных клапанов.
Функциональная недостаточность атриовентрикулярных клапанов наблюдается почти у всех пациентов ишемической или дилатационной кардиомиопатией. Ишемия приводит к развитию прямой дисфункции или разрыву папиллярных мышц и формированию митральной недостаточности. Снижение контрактильности миокарда ЛЖ вызывает дилатацию его полости, дисторсию задней папиллярной мышцы и усиливает митральную регургитацию. Оратный сброс крови в левое предсердие увеличивает перегрузку объемом ЛЖ и еще больше усиливает ишемию миокарда. Возникает порочный круг, прервать который может только восстановление запирательной функции митрального клапана.
Для этого коррекции митральной недостаточности используются опорные кольца с измененной пространственной геометрией, которые позволяют снизить рецидив митральной недостаточности в отдаленном послеоперационном периоде.
Хирургическое ремоделирование левого желудочка.
Патологическое ремоделирование ЛЖ у больных с кардиомиопатией приводит к увеличению объема желудочка и напряжению его стенки. После того, как ЛЖ приобретает сферическую форму, меняется ориентация кардиомиоцитов. При одной и той же фракции укорочения фракция выброса в сферическом желудочке значительно уменьшается. При естественном течении заболевания 5-летняя выживаемость при КСИЛЖ < 100 мл/м2 составляет 85%, а при КСИЛЖ > 100 мл/м2- 53%. Таким образом, любое вмешательство, направленное на оптимизацию этих отношений, оправдано, а благоприятный прогноз для пациента возможен при снижении КСИЛЖ < 90 мл/м2 .
Способ циркулярной пластики.
Способ циркулярной пластикиразработан с учетом восстановления геометрической формы и объема ЛЖ, близких к физиологической норме для данного пациента. Расчет нужного объема производится как функция нормального ударного индекса.
Оперативная техника.
Циркулярные швы, идущие в толще тканей на глубине не менее 5 миллиметров, накладывают со стороны эндокарда с шагом рассчитанным на основании эхокардиографических данных. Формируется конус ЛЖ с заранее рассчитанным конечнодиастолическим объемом.
После восстановления сердечной деятельности с помощью транспищеводной ЭхоКГ проводится оценка хирургического ремоделирования ЛЖ.
| 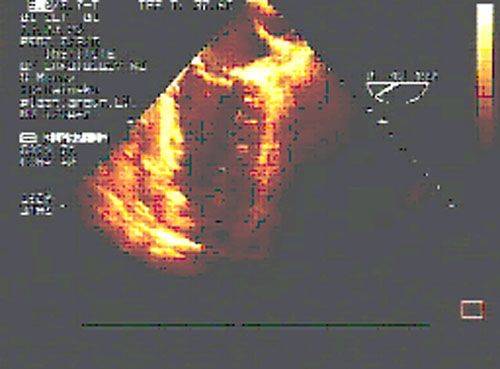 |
| до операции | после операции |
Поддерживающее устройство сердца.
Цель использования разработанного в РНПЦ устройства состоит в пассивной поддержке желудочков и предотвращении дальнейшей их дилатации. Экспериментальные исследования показали возможность уменьшения объема желудочков, снижение напряжение стенки, улучшение контрактильности миокарда и рост ФВ. Гистологические исследования животных также демонстрировали уменьшение гипертрофии миоцитов и интерстициального фиброза, а также снижение титра биохимических маркеров СН.
Ресинхронизация сердца.
Внутри- и межжелудочковая диссинхрония, связанная с задержкой внутри- и межжелудочкового проведения, является существенным компонентом патогенеза выраженной хронической сердечной недостаточности.
При СН изменяется внутри- и межкамерное взаимодействие. Нормальный физиологический асинхронизм между межжелудочковой перегородкой (МЖП) и задней стенкой ЛЖ (около 60 мсек.) нарастает и приводит к дисфункции ЛЖ.
Ресинхронизация сердца позволяет изменить степень электромеханической асинхронии предсердий и желудочков. Критерием прогнозирования успеха кардиосинхронизации является исходная пролонгация интервала QRS >130 мсек. Наиболее информативным критерием является оценка внутрижелудочковой механической задержки сокращения – увеличение исходного внутри- или межжелудочкового механического асинхронизма > 50 мсек.
Оперативная техника.
Коррекция указанных нарушений осуществляется путем имплантации многокамерного кардиостимулятора с раздельной стимуляцией правого предсердия и желудочков. Для этого три электрода проводятся через подключичную вену и фиксируются к стенке правого предсердия, в верхушке ПЖ и через коронарный синус в левой боковой вене ЛЖ у основания сердца.
При открытых операциях реваскуляризации миокарда, ремоделирования ЛЖ или пластики митрального клапана электроды фиксируются эпикардиально – в правом предсердии и у основания сердца к обоим желудочкам.
Обязательным условием эффективности ресинхронизации является оптимизация работы кардиостимулятора.
Вспомогательное кровообращение.
Вследствие постоянного дефицита донорских органов большой группе пациентов целесообразно использовать длительную механическую поддержку кровообращения как основной терапии. Для этих целей могут быть использованы устройство Thoratec в виде моно или бивентрикулярногго обхода или аксиальный насос “HeartMate II”.
Источник