Новые методы лечения инфаркта
Российский кардиологический научно-производственный комплекс Минздрава РФ, Москва
Сегодня инфаркт миокарда (ИМ) остается таким же серьезным заболеванием, как и несколько десятилетий назад. Вот только один из примеров, доказывающих тяжесть этой болезни: около 50% больных умирают до того, как успевают встретиться с врачом. Вместе с тем совершенно очевидно, что риск ИМ для жизни и здоровья стал значительно ниже. После того, как 35 лет назад были разработаны основные принципы палат интенсивного наблюдения за коронарными больными и эти палаты начали реально работать в практике здравоохранения, существенно повысилась эффективность лечения и профилактики нарушений ритма и проводимости сердца больных ИМ и снизилась госпитальная летальность. В 70-е годы она составляла более 20%, однако в последние 15 лет, после того как была доказана роль тромбоза в патогенезе острого ИМ и показано благоприятное влияние тромболитической терапии, в целом ряде клиник летальность сократилась в 2 раза и более. Надо сказать, что основные принципы и рекомендации по лечению острого ИМ, впрочем, как и для большинства других серьезных патологий, основываются не только на опыте и знаниях отдельных клиник, направлений, школ, но и на результатах крупных многоцентровых исследований, подчас проводящихся одновременно во многих сотнях больниц в разных странах мира. Конечно, это позволяет врачу в стандартных клинических ситуациях быстрее находить правильное решение.
Основными задачами лечения острого ИМ можно назвать следующие: купирование болевого приступа, ограничение размеров первичного очага поражения миокарда и, наконец, профилактика и лечение осложнений. Типичный ангинозный приступ, развивающийся у подавляющего числа больных при ИМ, связан с ишемией миокарда и продолжается до тех пор, пока не происходит некроз тех кардимиоцитов, которые должны погибнуть. Одним из доказательств именно этого происхождения боли служит быстрое ее исчезновение, при восстановлении коронарного кровотока (например, на фоне тромболитической терапии).
Купирование болевого приступа
Сама по себе боль, воздействуя на симпатическую нервную систему, может существенно увеличивать частоту сердечных сокращений, артериальное давление (АД), а также работу сердца. Именно эти факторы обусловливают необходимость как можно быстрее купировать болевой приступ. Целесообразно дать больному нитроглицерин под язык. Это может ослабить боль в том случае, если больной не получал ранее нитроглицерин в связи с этим приступом. Нитроглицерин может быть в форме таблеток или аэрозоля. Не нужно прибегать к его применению при систолическом АД ниже 90 мм рт.ст.
Во всем мире для купирования болевого приступа используются морфин который вводят внутривенно дробно от 2 до 5 мг каждые 5–30 мин по необходимости до полного (по возможности) купирования боли. Максимальная доза составляет 2–3 мг на 1 кг массы тела больного. Внутримышечного введения морфина следует избегать, так как результат в этом случае непредсказуем. Побочные действия крайне редки (в основном, это гипотония, брадикардия) и довольно легко купируются путем придания ногам возвышенного положения, введения атропина, иногда плазмозамещающей жидкости. У пожилых людей нечасто встречается угнетение дыхательного центра, поэтому у них морфин следует вводить в уменьшенной (даже половинной) дозе и с осторожностью. Антагонистом морфина является налоксон, который также вводят внутривенно, он снимает все побочные явления, в том числе угнетение дыхания, вызванное опиатами. Не исключается применение и других наркотических анальгетиков, например промедола и иных препаратов этого ряда. Предположение о том, что нейролептанальгезия (сочетание фентанила и дроперидола) обладает рядом преимуществ, не получило клинического подтверждения. Попытки замены морфина комбинацией ненаркотических анальгетиков и нейролептиков в этой ситуации неоправданны.
Тромболетическая терапия
Основным патогенетическим методом лечения ИМ является восстановление проходимости окклюзированной коронарной артерии. Чаще всего для достижения этого используют либо тромболитическую терапию, либо механическое разрушение тромба при транслюминальной коронарной ангиопластике. Для большинства клиник нашей страны наиболее реалистично сегодня применение первого способа.
Процесс некроза развивается у человека крайне быстро и в основном заканчивается, как правило, уже через 6–12 ч от начала ангинозного приступа, поэтому чем быстрее и полноценнее удается восстановить кровоток по тромбированной артерии, тем более сохранной будет функциональная способность миокарда левого желудочка и в конечном итоге меньше летальность. Оптимальным считается начало введения тромболитических препаратов через 2–4 ч от начала болезни. Успех лечения будет большим, если удастся сократить промежуток времени до начала тромболитической терапии, что может быть осуществлено двумя путями: первый – раннее выявление и госпитализация больных в стационар и быстрое принятие решения о соответствующем лечении, второй – начало терапии на догоспитальном этапе. В наших исследованиях показано, что начало тромболитической терапии на догоспитальном этапе позволяет добиться выигрыша во времени, в среднем около 2,5 ч. Такой способ тромболитической терапии, если он проводится врачами специализированной бригады кардиологической помощи, является относительно безопасным. При отсутствии противопоказаний тромболитическую терапию целесообразно проводить всем больным в первые 12 ч болезни. Эффективность тромболитической терапии выше (снижение летальности на 42–47%), если она начата в течение 1-го часа болезни. При сроках более 12 ч применение тромболитических препаратов проблематично и должно решаться с учетом реальной клинической ситуации. Особенно показана тромболитическая терапия пожилым людям, пациентам с передним ИМ, а также в тех случаях, когда ее начинают достаточно рано. Обязательное условие для начала тромболитической терапии – наличие элеваций сегмента ST на ЭКГ или признаков блокады ножек пучка Гиса. Тромболитическая терапия не показана, если элевации сегмента ST отсутствуют, независимо от того, как выглядит конечная фаза QRS на ЭКГ – депрессии, отрицательные Т или отсутствие каких-либо изменений. Раннее начало терапии тромболитиками позволяет спасти до 30 больных из 1000 леченых.
Сегодня основным путем введения тромболитических препаратов является внутривенный. Все используемые препараты, тромболитики первого поколения, такие как стрептокиназа (1 500 000 ЕД в течение 1 ч) – урокиназа (3 000 000 ЕД в течение 1 ч), второго поколения – тканевой активатор плазминогена (100 мг болюсом плюс инфузия), проурокиназа (80 мг болюсос плюс инфузия 1 ч) – являются высокоэффективными тромболитиками.
Риск терапии тромболитиками общеизвестен – это возникновение кровотечений, из наиболее опасных – кровоизлияние в мозг. Частота геморрагических осложнений невелика, например количество инсультов при применении стрептокиназы не превышает 0,5%, а при использовании тканевого активатора плазминогена – 0,7–0,8%. Как правило, в случае серьезных геморрагий вводят свежезамороженную плазму и, конечно, прекращают введение тромболитика. Стрептокиназа может вызывать аллергические реакции, которые, как правило, удается предотвратить профилактическим введением кортикостероидов – преднизолона или гидрокортизона. Другое осложнение – гипотония, которая чаще наблюдается при использовании препаратов, созданных на основе стрептокиназы, нередко она сопровождается брадикардией. Обычно это осложнение удается купировать после прекращения инфузии тромболитика и введения атропина и адреналина, иногда требуется применение плазмозаменителей и инотропных средств. Сегодня абсолютными противопоказаниями к тромболитической терапии считаются подозрение на расслоение аорты, активное кровотечение и предшествующий геморрагический инсульт.
В среднем тромболитические препараты получает всего лишь одна треть больных ИМ, а в нашей стране эта цифра существенно ниже. Тромболитики не вводят в основном в связи с поздним поступлением больных, наличием противопоказаний или неопределенностью изменений на ЭКГ. Летальность среди больных, не получающих тромболитики, остается по-прежнему высокой и составляет от 15 до 30%.
b–адреноблокаторы
В 1-е сутки после ИМ повышается симпатическая активность, поэтому использование b-адреноблокаторов, которые снижают потребление кислорода миокардом, уменьшают работу сердца и напряжение стенки желудочка, стало обоснованием их применения у этой категории больных. Ряд крупных многоцентровых исследований, в которых изучалась эффективность внутривенного введения b-блокаторов в 1-е сутки ИМ, показал, что они снижают летальность за 1-ю неделю примерно на 13–15%. Эффект несколько выше, если лечение начинается в первые часы болезни, и отсутствует, если использовать эти препараты со 2–3-го дня заболевания. b-блокаторы уменьшают и количество повторных инфарктов в среднем на 15–18%. Механизм влияния b-блокаторов на летальность – это уменьшение случаев фибрилляции желудочков и разрывов сердца.
Лечение b-блокаторами начинают с внутривенного введения (метопролол, атенолол, пропранолол) – 2–3 раза или столько, сколько потребуется, чтобы оптимально снизить частоту сердечных сокращений. В последующем переходят на прием препаратов внутрь: метопролол 50 мг каждые 6 ч в первые 2 сут, атенолол по 50 мг каждые 12 ч в течение суток, а затем подбирают дозу индивидуально для каждого больного. Основные показания к применению b-блокаторов – признаки симпатической гиперактивности, такие как тахикардия при отсутствии признаков сердечной недостаточности, гипертония, болевой синдром, наличие ишемии миокарда. b-Блокаторы, несмотря на наличие противопоказаний к их применению, например брадикардии (число сердечных сокращений меньше 50 в 1 мин), гипотонии (систолическое АД ниже 100 мм рт.ст.), наличие блокад сердца и отека легких, а также бронхоспазма, применяются тем не менее у подавляющего числа больных ИМ. Однако способность препаратов уменьшать летальность не распространяется на группу b-блокаторов с собственной симпатомиметической активностью. Если больной начал лечиться b-блокаторами, прием препарата следует продолжать до тех пор, пока не появятся серьезные противопоказания.
Применение антиагрегантов и антикоагулянтов
Применение при остром ИМ дезагрегантов, в частности ацетилсалициловой кислоты, способствует уменьшению тромбоза, причем максимальный эффект препарата достигается достаточно быстро после приема первоначальной дозы 300 мг и стабильно поддерживается при ежедневном приеме ацетилсалициловой кислоты в небольших дозах – от 100 до 250 мг/сут. При исследованиях, проведенных у многих тысяч больных оказалось, что применение ацетилсалициловой кислоты снижает 35-дневную летальность на 23%. Противопоказана ацетилсалициловая кислота при обострении язвенной болезни, при его непереносимости, а также при бронхиальной астме, провоцируемой этим препаратом. Длительное применение препарата существенно снижает частоту повторныех инфарктов – до 25%, поэтому прием ацетилсалициловой кислоты рекомендуется на неопределенно долгое время.
Еще одна группа препаратов, воздействующих на тромбоциты, это блокаторы гликопротеина IIВ/IIIА тромбоцитов. В настоящее время известна и доказана эффективность применения двух представителей данного класса – это абсиксимаб и тирофебан. По механизму действия эти препараты выгодно отличаются от ацетилсалициловой кислоты, так как блокируют большинство известных путей активации тромбоцитов. Препараты препятствуют образованию первичного тромбоцитарного тромба, причем действие их иногда бывает достаточно продолжительным – до полугода. Мировой опыт пока еще невелик, в нашей стране работа с этими препаратами только начинается. Из антитромботических препаратов по-прежнему широко используется антикоагулянт гепарин, который в основном назначают для профилактики повторных инфарктов, для предупреждения тромбозов и тромбоэмболий. Схемы и дозы введения его хорошо известны. Дозу подбирают так, чтобы частичное тромбопластиновое время увеличилось в 2 раза по сравнению с нормой. Средняя доза – это 1000 ЕД/ч в течение 2–3 дней, подкожное введение гепарина рекомендуется при медленной активизации пациентов.
В настоящее время имеются данные об использовании низкомолекулярных гепаринов, в частности эноксипарина и фрагмина. Основные их преимущества состоят в том, что они фактически не требуют лабораторного контроля за показателями свертываемости крови и специальной аппаратуры, например инфузионных насосов, для их введения, а главное – они существенно эффективнее чем нефракционированные гепарины. Не потеряло своей значимости применение непрямых антикоагулянтов, особенно при венозных тромбозах, выраженной сердечной недостаточности, наличии тромба в левом желудочке.
Антагонисты кальция
В качестве стандартной терапии ИМ антагонисты кальция в настоящее время фактически не используются, так как не оказывают благоприятного влияния на прогноз, а применение их с научной точки зрения малообоснованно.
Нитраты
Внутривенное введение нитратов при ИМ в первые 12 ч заболевания уменьшает размер очага некроза, влияет на основные осложнения ИМ, включая летальные исходы и частоту развития кардиогенного шока. Применение их снижает летальность до 30% в первые 7 дней болезни, это наиболее очевидно при инфарктах передней локализации. Прием нитратов внутрь начиная с 1-х суток заболевания не приводит ни к улучшению, ни к ухудшению прогноза к 30-му дню болезни. Внутривенное введение нитратов должно быть стандартной терапией для всех пациентов, поступивших в первые часы болезни, с передним ИМ и систолическим АД выше 100 мм рт.ст. Начинают введение нитроглицерина с невысокой скоростью, например 5 мкг/мин, постепенно увеличивают ее, достигая уменьшения систолического давления на 15 мм рт.ст. У больных с артериальной гипертонией снижение АД возможно до 130–140 мм рт.ст. Как правило, терапию нитратами проводят в течение 24 ч, если не появляется необходимости продолжения этой терапии, в частности при сохраняющихся болях, связанных с ишемией миокарда, или признаках сердечной недостаточности.
Ингибиторы АПФ
В последнее десятилетие в лечении больных ИМ прочно заняла свое место большая группа ингибиторов ангиотензинпревращающего фермента (иАПФ). Это в первую очередь определяется тем, что данные препараты способны приостанавливать расширение, дилатацию левого желудочка, истончение миокарда, т.е. воздействовать на процессы, приводящие к ремоделированию миокарда левого желудочка и сопровождающиеся серьезным ухудшением сократительной функции миокарда и прогноза. Как правило, лечение иАПФ начинают через 24–48 ч от момента развития ИМ, чтобы снизить вероятность артериальной гипертонии. В зависимости от исходно нарушенной функции левого желудочка терапия может продолжаться от нескольких месяцев до многих лет. Установлено, что лечение каптоприлом в дозе 150 мг/сут у пациентов без клинических признаков недостаточности кровообращения, но при наличии фракции выброса ниже 40% существенно улучшало прогноз. В группе леченых смертность была ниже на 19%, на 22% было меньше случаев сердечной недостаточности, требовавшей лечения в условиях стационара. Таким образом, АПФ (каптоприл 150 мг/сут, рамиприл 10 мг/сут, лизиноприл 10 мг/сут и др.) целесообразно назначать большинству больных ИМ, независимо от его локализации и наличия или отсутствия сердечной недостаточности. Однако эта терапия более эффективна при сочетании клинических признаков сердечной недостаточности и данных инструментальных исследований (низкая фракция выброса). В этом случае риск летального исхода снижается на 27%, т.е. это предотвращает смертельные исходы у каждых 40 из 1000 леченых больных в течение года.
Уже во время пребывания больного в стационаре целесообразно детально исследовать его липидный спектр. Сам по себе острый ИМ несколько уменьшает содержание свободного холестерина в крови. При наличии данных о существенных изменениях этого показателя, например при уровне общего холестерина выше 5,5 ммоль/л, целесообразно рекомендовать больному не только гиполипидемическую диету, но и прием препаратов, в первую очередь статинов.
Таким образом, в настоящее время врач располагает значительным арсеналом средств, позволяющих помочь больному ИМ и свести к минимуму риск возникновения осложнений. Конечно, основной путь достижения этой цели – применение тромболитических препаратов, но вместе с тем использование b-блокаторов, аспирина, АПФ и нитратов может существенным образом повлиять на прогноз и исход заболевания.
Эналаприл:
Эднит
(Gedeon Richter)
Энап
(KRKA)
Основные задачи лечения острого инфаркта миокарда: 1) купирование болевого приступа 2) ограничение размеров первичного очага поражения миокарда 3)профилактика и лечение осложнений
При отсутствии противопоказаний тромболитическую терапию целесообразно проводить всем больным в первые 12 ч болезни
Внутривенное введение нитратов должно быть терапией для всех пациентов с передним инфарктом миокарда и систолическим АД выше 100 мм рт.ст.
СХЕМА ЛЕЧЕНИЯ ОСТРОГО ИНФАРКТА МИОКАРДА
Источник
Новые технологии лечения инфаркта миокарда включают в себя использование хирургических роботов, протезирование сердца, использование стволовых клеток и генотерапии.
2019. Для лечения атеросклероза создали биоразлагаемые стенты
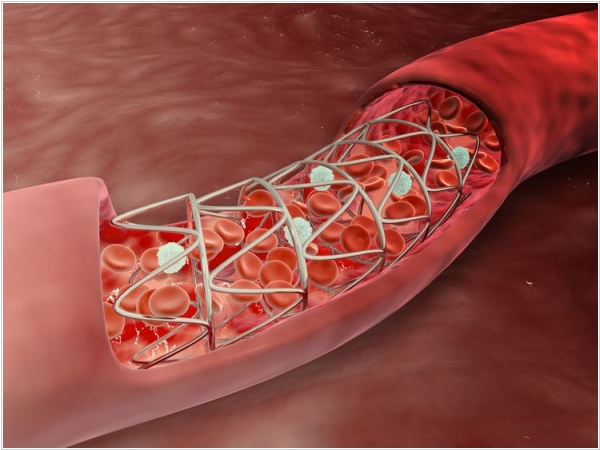
При инфаркте миокарда в сердечную артерию устанавливают стент, который играет роль распорки и содействует разрушению атеросклеротических бляшек на стенках сосуда. Обычные металлические стенты устанавливают на 2-3 недели, однако если стент врастает в сосуд – удалить его нельзя, и он может стать причиной хронического воспаления. Исследователи из Сибирского федерального университета и Красноярского центра сердечно-сосудистой хирургии создали стенты из биоразлагаемых полимеров. После выполнения своей задачи они сами постепенно разрушаются и выводятся из кровотока без вреда для организма. При контакте нового материала с клетками крови не наблюдается негативных эффектов, что должно существенно облегчить лечение атеросклероза.
2019. Стволовые клетки помогут восстановить сердце после инфаркта
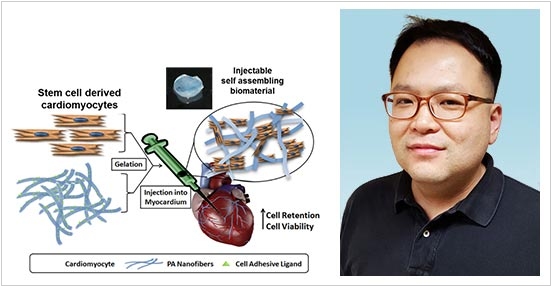
При инфаркте миокарда часть клеток сердечной мышцы и сосудов гибнет. В результате способность сердца перекачивать кровь снижается – развивается сердечная недостаточность. При обширных повреждениях единственным эффективным лечением считается пересадка сердца. Ученые из Городского университета Гонконга под руководством доктора Бэна Кивона (на фото) придумали решить эту проблему введением стволовых клеток двух типов: кардиомиоцитов (выращенных из индуцированных плюрипотентных стволовых клеток) и мезенхимальных стволовых клеток (извлеченных из костного мозга). Первые должны сформировать мышечную ткань, а вторые – кровеносные сосуды. Ученые довели крысу до инфаркта, а потом успешно провели регенерацию сердца. Теперь думают, как довести до инфаркта животное покрупнее.
2018. ИИ определяет инфаркт миокарда по кардиограмме

Инфаркт миокарда происходит при закупорке сосудов, которые доставляют к сердечным мышцам насыщенную кислородом кровь. Если такое состояние длится достаточно долго (20–40) минут, то часть мышечной ткани может погибнуть. Сегодня одним из наиболее точных методов диагностирования заболевания считается электрокардиография (ЭКГ). Однако расшифровка результатов может занять несколько часов. При этом, чем раньше больному будет предоставлено лечение, тем больше у него шансов избежать серьезных осложнений или даже летального исхода. Команда немецких врачей под руководством Нильса Стродтхоффа из Института Генриха Герца создала систему искусственного интеллекта, которая умеет распознавать инфаркт миокарда по ЭКГ. Хотя у них было довольно маленькая обучающая выборка – 148 электрокардиограмм, им удалось создать нейросеть, точность которой приближается к точности реальных врачей. А результат выдается практически мгновенно.
2018. Лечение инфаркта стволовыми клетками разрешили проверить на людях
Японские ученые из Осакского университета под руководством кардиохирурга Ёсики Савы получили разрешение Министерства здравоохранения Японии на использование индуцированных стволовых клеток в клинике для лечения последствий инфаркта. «Заплатки» из стволовых клеток, полученных из собственных клеток пациентов, должны способствовать регенерации поврежденной сердечной мышцы. Во время операции на сердце эти слои накладываются на поврежденные, например, в результате инфаркта, участки мышцы. По утверждению ученых, клетки «заплатки» не интегрируются в ткань, но выделяют ростовые факторы, способствующие регенерации миокарда. Технология была успешно опробована на животных, и теперь, после одобрения правительством, группа Савы собирается опробовать подход на первых трех пациентах, а затем еще на десяти.
2016. Гаджет для диагностики атеросклероза коронарных артерий

Коронарные артерии постепенно забиваются холестериновыми бляшками, при этом возникает опасность инфаркта. Но врачи не всегда вовремя могут предупредить пациента о «загрязнении» коронарных артерий, вследствие чего человек может умереть, или попасть в больницу уже со значительными проблемами. Американская компания Aum Cardiovascular создала уникальное устройство, предназначенное для проверки коронарных артерий без необходимости инвазивного вмешательства. Достаточно приложить его к груди в течении 20 минут. Турбулентность, возникающая при прохождении крови через артерии, генерирует аудио сигнал, который улавливается и анализируется устройством. После процедуры собранные данные отправляются в сервис Aum Cardiovascular и через некоторое время приходит диагноз от врача. Система уже имеет европейскую сертификацию.
2015. Наномедицина добралась до атеросклероза
Доктор Омид Фархозад, известный нам своей технологией лечения рака с помощью наночастиц, взялся за еще одну не менее смертоносную болезнь – атеросклероз (образование бляшек в сосудах, которые приводят к инсультам и инфарктам). Со своими коллегами из Женского Госпиталя Бригхэма он разработал и успешно протестировал на мышах новую технологию доставки антивоспалительных лекарств к склеротическим бляшкам. Лекарства доставляются биоразлагаемыми наночастицами, которые запрограммированы на соединение с клетками-макрофагами, образующими воспалительный процесс в местах повреждения сосудов. Лекарство позволяет стабилизировать рост бляшки и снизить опасность закупорки сосуда. Главной трудностью пока является то, что в отличии от рака, атеросклероз – это процесс, происходящий в течении многих лет, и необходимо практически полностью снизить влияние препарата на те макрофаги, которые делают полезную работу.
2014. Novartis создал революционное лекарство для лечения сердечной недостаточности

Швейцарский фармацевтический гигант Novartis создал новое лекарство, которое уже назвали главным прорывом в медикаментозном лечении болезней за последние 10 лет. Таблетки под кодовым названием LCZ696 позволят значительно снизить смертность и количество госпитализаций после сердечного приступа. В течении многих лет ученые пытались разработать эффективное лекарство от сердечной недостаточности, но постоянно сталкивались с проблемой пагубных побочных эффектов (сильное понижение давления, отеки под кожей). На этот раз, вроде, все получилось. Клинические испытания LCZ696 были проведены на более 8 тысячах пациентов, и их результаты оказались настолько хороши, что лекарство должно появиться в продаже уже в первом квартале 2015 года. Оно будет стоить около $7 за дневную дозу и (по прогнозам) принесет Novartis $2 млрд до 2019 года.
2011. Топ 10 причин смерти в богатых и бедных странах

Всемирная организация здравоохранения опубликовала свой рейтинг Топ 10 причин смерти в зависимости от благополучия страны (или от уровня дохода). Это логично, т.к. например, в Швейцарии и в Сомали обычно умирают по разным причинам. Всего получилось 3 рейтинга: высокий уровень дохода, средний и низкий. Как и следовало ожидать, в слаборазвитых странах основной причиной смерти являются инфекции, а в высокоразвитых – малоподвижный образ жизни, переедание и старость (т.е. сердечные болезни, рак, дегенерация мозга). Нам, вероятно, надо ориентироваться на средний и высокий. Рейтинги приведены ниже: ***
Источник
