Нейтрофилез при инфаркте миокарда

Классификация
Сами нейтрофильные лейкоциты бывают двух основных видов: сегментоядерные (зрелые) и палочкоядерные (молодые). Палочкоядерные нейтрофилы в норме составляют от 1 до 5% от общего количества лейкоцитов, сегментоядерные – от 35 до 65% . По соотношению молодых и зрелых клеток выделяют нейтрофилезы с ядерным сдвигом и без него. Ядерный сдвиг влево подразумевает увеличение количества молодых форм нейтрофилов и подразделяется на следующие виды:
- Гипорегенераторный. Незначительное увеличение палочкоядерных нейтрофильных лейкоцитов. Причиной являются инфекционные, воспалительные заболевания с легким течением.
- Регенераторный. Характеризуется появлением в крови метамиелоцитов (промежуточных форм между миелобластными клетками и гранулоцитами). Встречается во время инфекций со средней степенью тяжести (брюшной тиф, пневмония).
- Гиперрегенераторный. Выраженная гиперактивация гранулоцитарного ростка костного мозга с нарушением созревания гранулоцитов. В крови резко увеличено число палочкоядерных нейтрофилов, метамиелоцитов, промиелоцитов, иногда присутствуют миелобласты. Возможна анэозинофилия (полное отсутствие эозинофилов). Такая форма нейтрофилеза наблюдается в самом начале гнойно-воспалительных процессов (сепсис, абсцессы, флегмоны).
- Дегенеративный. Наряду с увеличенным числом палочкоядерных лейкоцитов в крови появляется большое количество деструктивно измененных сегментоядерных нейтрофилов (токсическая зернистость, пикноз ядер). Свидетельствует об угнетении функциональной активности костного мозга. Характерен для разгара тяжелых инфекций.
При нейтрофилезе, имеющем ядерный сдвиг вправо, в гемограмме отмечается отсутствие молодых форм гранулоцитов и появление гиперсегментированных (содержащих более 5 сегментов) нейтрофилов. Нейтрофилез без ядерного сдвига сопровождается увеличением только сегментоядерных нейтрофилов. По отношению к другим видам лейкоцитов выделяют:
- Относительный нейтрофилез. Увеличение процентного соотношения нейтрофилов (у взрослых более 75%, у детей до 5 лет – более 55%) в лейкоцитарной формуле, общее количество лейкоцитов нормальное.
- Абсолютный нейтрофилез. Увеличение числа нейтрофилов при одновременном повышении уровня лейкоцитов.

Причины нейтрофилеза
Физиологические причины
Существует так называемый физиологический нейтрофилез, или псевдонейтрофилез. Его возникновение связано не с усилением продукции нейтрофилов, а их перераспределением, т.е. изменением соотношения пристеночного и циркулирующего пула нейтрофилов в сторону последних. Псевдонейтрофилез наблюдается при стрессе, интенсивной физической нагрузке, воздействии тепла или холода, после приема пищи. Также нередко нейтрофилы увеличены во время беременности, у новорожденного ребенка.
Инфекции у детей
У ребенка дошкольного возраста (до 5-6 лет) из-за физиологического снижения уровня нейтрофилов вследствие лейкоцитарного перекреста имеется повышенная восприимчивость к бактериальным инфекциям. У детей нейтрофилы увеличиваются главным образом при скарлатине, стрептококковой ангине. В детской популяции довольно часто встречается такая опасная инфекция, как дифтерия. Также среди дошкольников распространены паразитарные инвазии (аскаридоз, энтеробиоз, токсокароз). При этих заболеваниях помимо нейтрофилеза в крови наблюдается высокая эозинофилия.
Инфекции у взрослых
Наиболее часто нейтрофилы бывают увеличены при бактериальных инфекциях. Основная функция нейтрофилов – противоинфекционная защита макроорганизма, а именно, уничтожение бактерий. Также они принимают участие в борьбе с вирусами, паразитами. Мигрируя через сосудистую стенку, нейтрофилы направляются к очагу локализации патогенного микроорганизма. Выделяя цитокины и медиаторы воспаления, нейтрофилы активируют другие компоненты иммунной системы (комплемент, Т-В-лимфоциты).
Нейтрофильные лейкоциты сначала фагоцитирут (поглощают) инфекционный агент, затем секретирует ферменты деградации (лизоцим, лактоферрин, фосфатазы) и активные формы кислорода (супероксид-анион, гидроксильный радикал, перекись водорода), что способствует гибели микроорганизмов. Нейтрофилез быстро нарастает, достигает максимума параллельно разгару заболевания, постепенно снижается после антибактериальной терапии.
Наиболее распространенной причиной нейтрофилеза у взрослых являются острые локализованные бактериальные (пневмония, синусит, пиелонефрит) или специфические инфекции (брюшной тиф). Для них типичен умеренный нейтрофилез. Реже причиной становятся тяжелые генерализованные инфекции (бактериальный эндокардит, сепсис, менингококковый менингит), характеризующиеся высоким нейтрофилезом с гиперрегенераторным или дегенеративным сдвигом.
Острые хирургические патологии
Довольно часто нейтрофилы бывают увеличены при острой абдоминальной патологии (холецистит, панкреатит, прободение язвы желудка или 12-перстной кишки), гнойных процессах (флегмона, абсцесс). Нейрофилия у ребенка часто встречается при аппендиците. Увеличение числа нейтрофильных лейкоцитов при данных заболеваниях выступает как реакция на воспалительный процесс. Точно установлена коррелирующая связь между тяжестью воспаления и степенью повышения нейтрофилов. Обычно наблюдается высокий нейтрофилез с дегенеративным сдвигом лейкоцитарной формулы влево, который быстро регрессирует после экстренного оперативного вмешательства. Однако нейтрофилы могут оставаться и в пределах нормы.
Повреждение или распад тканей
К таким состояниям относятся инфаркты различных органов (миокарда, легких, кишечника), полостные операции, гангрены, панкреонекроз. Причиной нейтрофилеза является стимуляция продуктами распада гранулоцитопоэза в костном мозге. Дополнительную роль играет реактивная нейтрофилия, возникающая из-за выброса в кровь большого количества гормонов стресса (катехоламинов, глюкокортикостероидов).
Также возникновению нейтрофилеза при данных состояниях способствует присоединение вторичной инфекции (например, пневмонии вследствие инфаркта легкого). Степень нейтрофилеза коррелирует с объемом поврежденной, некротизированной ткани, зачастую достигает очень высоких значений (особенно у ребенка), может сохраняться длительное время, снижается по мере выздоровления.
Ревматологические заболевания
Нейтрофилез может наблюдаться при некоторых хронических воспалительных патологиях ревматической природы. Есть предположение, что медиаторы, цитокины, аутоантитела, которые образуются в процессе ревматического воспаления, стимулируют костномозговую выработку нейтрофильных гранулоцитов. Обычно появление нейтрофилеза наряду с другими лабораторными маркерами, такими как повышенная скорость оседания эритроцитов, С-реактивный белок, свидетельствует об обострении заболевания.
После противовоспалительного лечения концентрация нейтрофилов постепенно возвращается к норме. У взрослых особенно высокий нейтрофилез характерен для острой подагрической атаки, некротизирующих васкулитов (узелкового полиартериита, гранулематоза с полиангиитом). У ребенка нейтрофилы увеличены чаще всего при дерматомиозите.
- Болезни суставов: ревматоидный артрит, анкилозирующий спондилоартрит (болезнь Бехтерева).
- Диффузные болезни соединительной ткани (коллагенозы): системная красная волчанка, системная склеродермия, болезнь Шегрена.
- Воспалительные заболевания кишечника: болезнь Крона, неспецифический язвенный колит.
- Системные васкулиты: неспецифический аортоартериит Такаясу, гигантоклеточный артериит Хортона.
Онкологические заболевания
Нейтрофилез иногда может свидетельствовать о злокачественной опухоли. Его возникновению способствуют два механизма – распад опухолевой ткани и способность некоторых опухолевых клеток секретировать гранулоцитарные колониестимулирующие факторы роста (паранеопластический синдром). Наиболее часто нейтрофилез встречается у пациентов с раком молочной железы, легкого, толстого кишечника, яичников. Нейтрофилез нарастает медленно, по мере роста опухоли, достигает умеренных цифр, постепенно регрессирует после химиотерапии либо быстро приходит в норму после хирургического удаления неоплазии.
Гематологические болезни
Высокий нейтрофилез наблюдается при онкогематологических заболеваниях. Он может достигать очень высоких цифр (до 100 тыс.) при миелопролиферативных болезнях (острый, хронический миелолейкоз). При лимфопролиферативных патологиях (неходжкинские лимфомы, лимфосаркомы) нейтрофилез чуть менее выражен, практически всегда сопровождается абсолютным лимфоцитозом. У ребенка чаще причиной становится лимфогранулематоз (лимфома Ходжкина).
Помимо самого нейтрофилеза, у больных с острыми лейкозами в крови встречается базофильно-эозинофильная ассоциация, большое количество бластных клеток и отсутствие промежуточных форм (лейкемический провал). Механизм нейтрофильного лейкоцитоза лежит в злокачественной трансформации гемопоэтической стволовой клетки. Показатели гранулоцитов приходят в норму только после нескольких курсов полихимиотерапии или пересадки костного мозга.
Редкие причины
- Эндокринные расстройства: болезнь или синдром Иценко-Кушинга, тиреотоксический криз.
- Заболевания крови: гемолитические анемии, истинная полицитемия, злокачественная анемия Аддисона-Бирмера.
- Эндогенная интоксикация: хроническая почечная недостаточность, печеночная недостаточность, диабетический кетоацидоз.
- Феномен гиперактивации костного мозга: после агранулоцитоза, лечения мегалобластной анемии.
- Использование лекарственных препаратов: адреналин, сердечные гликозиды, глюкокортикостероиды, литий.
- Интоксикация ртутью, свинцом.
- Воздействие ионизирующего излучения.
Диагностика
Обнаружение нейтрофилеза требует проведения дифференциальной диагностики. Для этого нужно обратиться к врачу-терапевту. В целях получения первичной информации проводится сбор анамнеза – как давно появились симптомы, имелся ли в последнее время контакт с инфекционными больными, было ли повышение температуры тела, боли, кожные высыпания.
Если есть подозрение на острую хирургическую абдоминальную патологию, обязательно производится пальпация живота на предмет напряженности мышц передней брюшной стенки, наличие положительного симптома Щеткина-Блюмберга. Однако необходимо учитывать, что у ребенка в возрасте до 9 лет данные признаки выявить затруднительно. Для подтверждения диагноза назначается дополнительное обследование, включающее:
- Анализы крови. Проводится подсчет общего количества и процентного содержания всех видов лейкоцитов. Измеряется концентрация эритроцитов, тромбоцитов, воспалительных маркеров (СОЭ, СРБ). Изучается морфология гранулоцитов (токсическая зернистость, кариопикноз). При септическом состоянии определяется уровень пресепсина, прокальцитонина. Проверяется наличие аутоантител (антител к ДНК, топоизомеразе, антинейтрофильные).
- Выявление возбудителя. Для идентификации патогенного микроорганизма проводится бактериологический посев, микроскопия мокроты, мочи, мазка с зева и миндалин. Для диагностики гельминтозов выполняется анализ кала на яйца глист, анализ крови на специфические иммуноглобулины, у ребенка берется соскоб с перианальных складок.
- УЗИ. Признаком пиелонефрита на УЗИ брюшной полости является расширение, уплотнение чашечно-лоханочной системы почек, панкреатита – увеличение, диффузные изменения паренхимы поджелудочной железы, холецистита – утолщение стенок желчного пузыря, часто наличие камней.
- Рентген. На рентгенограммах грудной клетки при пневмонии видны очаги инфильтрации, затемнения. При прободении язвы на снимках находят наличие свободного газа в брюшной полости («симптом серпа»). При воспалительных заболеваниях суставов на рентгене отмечается сужение суставной щели, краевой остеопороз.
- ЭКГ. На электрокардиографии при инфаркте миокарда выявляется подъем сегмента ST, блокада левой ножки пучка Гиса, желудочковая тахикардия, другие нарушения ритма сердца. При тромбоэмболии легочной артерии, приводящей к инфаркту легкого, обнаруживаются признаки перегрузки правых отделов сердца – глубокий зубец Q в III, зубец S в I отведении, высокий остроконечный зубец P (P-пульмонале) в отведениях II, III, aVF.
- Гистологические исследования. Окончательно поставить диагноз онкологического заболевания можно только на основании биопсии. Основной признак солидных опухолей – большое количество атипичных клеток. При лейкозах в биоптате костного мозга отмечают гиперплазию гранулоцитарного ростка, преобладание бластных клеток, в тканях лимфоузла при лимфомах – диффузную пролиферацию клеток с бластной морфологией.

Коррекция
Консервативная терапия
Прямых способов нормализации числа нейтрофильных гранулоцитов не существует. Для борьбы с нейтрофилезом необходимо проводить лечение основного заболевания, на фоне которого он развился. Кратковременная нейтрофилия после еды, стресса или физической работы не требует никакого вмешательства, так как не является признаком болезни или патологического состояния. Нейтрофилез, возникший вследствие оперативного вмешательства, также лечить не нужно. В случае же стойкого нейтрофилеза стоит обратиться к врачу для выяснения причины и назначения дифференцированного лечения:
- Противомикробной (антипаразитарной) терапии. При бактериальной инфекции применяются антибиотики (амоксициллин, цефиксим). При генерализованных инфекциях (сепсис, бактериальный эндокардит) необходимо использовать комбинацию из 2-х антибактериальных препаратов. При глистной инвазии у ребенка назначаются противогельминтные средства (мебендазол).
- Гемореологической терапии. При инфарктах любой локализации, вызванных тромбозами или тромбоэмболиями, применяются антиагрегантные (ацетилсалициловая кислота), антикоагулянтные (низкомолекулярный, нефракционированный гепарин), иногда тромболитические лекарства (алтеплаза).
- Антисекреторной и антиферментной терапии. С целью уменьшения выделения соляной кислоты при язвенной болезни используются ингибиторы протонной помпы (омепразол, пантопразол), H2-блокаторы (фамотидин, ранитидин). Для подавления деструктивного действия протеолитических ферментов поджелудочной железы при остром панкреатите и панкреонекрозе эффективны ингибиторы ферментов (апротинин).
- Противовоспалительного лечения. Для достижения ремиссии ревматологических заболеваний назначаются лекарственные средства, купирующие воспалительный процесс. К ним относятся глюкокортикостероиды (преднизолон), производные 5-аминосалициловой кислоты (сульфасалазин), иммуносупрессанты (циклофосфамид, метотрексат).
- Химиотерапии. Для терапии злокачественных опухолей применяются химиотерапевтические препараты (цитостатики, антиметаболиты, антагонисты гормонов) в сочетании с радиотерапией. При онкогематологических болезнях необходима комбинация нескольких противоопухолевых средств.
Хирургическое лечение
Многие заболевания, сопровождающиеся нейтрофилезом (в основном, это острые абдоминальные патологии), требуют экстренного хирургического вмешательства – лапароскопической аппендэктомии, лапаротомии и ушивания язвенного дефекта, холецистэктомии, вскрытия и дренирования гнойника и пр. При миелопролиферативных патологиях в случае неэффективности консервативной терапии прибегают к трансплантации стволовых клеток.
Прогноз
Только по одному нейтрофилезу невозможно предсказать прогноз. Все зависит от заболевания, которое послужило фоном для возникновения нейтрофилии. Например, транзиторное увеличение количества нейтрофилов после стресса, приема пищи или у ребенка в первые сутки жизни носит абсолютно доброкачественный, преходящий характер. И наоборот, тяжелые гнойно-септические патологии, онкологические болезни имеют довольно большую частоту летальных исходов. Поэтому любое превышение референсных значений нейтрофилов (тем более высокое и стойкое) требует обращения к врачу.
Источник
При приступе инфаркта миокарда в крови больного происходят биохимические изменения. Потому для подтверждения диагноза и выявления срока давности недуга проводят анализ крови. При инфаркте миокарда он позволяет уточнить диагноз и дополняет другие методы исследования. Ниже представляется перечень информации об изменениях в крови.
Биохимические изменения
Внимание! При инфаркте миокарда в кровь выбрасывается определенное количество специфических белков (тропонин, миоглобин), которые позволяю диагностировать приступ.
При приступе некроза кардиомиоциты выделяют огромное количество белка тропонина. Чтобы поставить диагноз, необходимо выявить уровень данного белка к моменту восстановления перфузии. Поскольку определяется уровень белка прикроватно, это позволяет облегчить диагностику, которая может быть осложнена при сомнительном результате ЭКГ.
После того как с момента приступа прошло около 4-6 часов, возрастает уровень некоторых специфичных ферментов. К ним относится КФК (креатинфосфокиназа). Пик активности КФК достигается после суток с момента приступа. Нормализуется содержание данного фермента после 2-3 суток. Пика КФК может достичь и через 12 часов на фоне тромболизиса.
Однако повышение КФК не может служить единственным и точным показателем инфаркта миокарда, так как оно наблюдается и при повреждении скелетных мышц или при гипотиреозе.
Более специфичным показателем служит активность МВ-фракций КФК. Например, если активность КФК при повреждении скелетных мышц наблюдается, то МВ-фракция не так активна. Это связано с тем, что она имеется в большей степени именно в сердечных тканях.
Если сравнивать динамику всей КФК и отдельной МВ-фракции, то вторая быстрее достигает своей максимальной точки. Нормализация, следовательно, тоже достигается раньше (через 1,5 суток).
Повышенная активность МВ-фракций наблюдается и при миокардите, после хирургических вмешательств на сердечной мышце или гипотиреозе, но в данных случаях динамика не такая, как при инфаркте. В этом случае уровень МВ-фракции выше КФК на 2,5 процента. Выявление активности МВ-фракций и общего КФК проводится через 12 и 24 часа после приступа.
Вышеописанная МВ-фракция присутствует в МВ1 и МВ2 изоформе. Для диагностирования инфаркта миокарда применяют анализ отношения МВ2 к МВ1. К примеру, более чем у 90% пациентов уже через 4-6 часов с момента приступа данное соотношение превышает коэффициент 1,5.
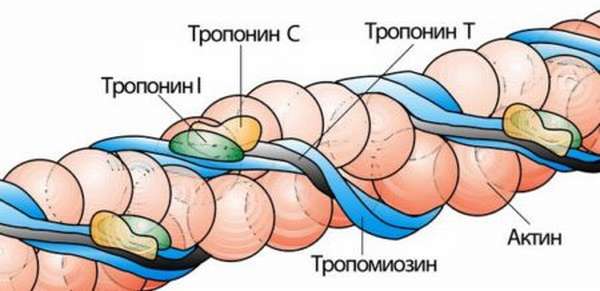
Высокоспецифичный признак инфаркта миокарда – уровень сердечных тропонинов T и I. Распознать произошедший инфаркт по ним можно уже после 3 часов с момента приступа, так как уровень этих белков начинает повышаться и сохраняется на несколько суток. Это позволяет выявить некроз сердечной мышцы даже при поступлении больных через 48 часов после появления ангинозных неприятных ощущений в груди.
Более того, данный метод диагностирования весьма информативен потому, что позволяет прогнозировать течение недуга. Согласно проведенным исследованиям, чем выше уровень тропонина I и чем раньше анализ на тропонин T дает положительный результат, тем хуже прогноз.
После некроза коронарной артерии уже через 2 часа в кровь поступает белок миоглобин. Но из-за того что почки очень быстро выводит его из организма, специфичной важности данный показатель не представляет.
Спустя через 1-2 сутки с момента приступа активизируется фермент ЛДГ (лактатдигидрогеназа). Пик ее приходится на 3-5 сутки и нормализуется ЛДГ к 8-10 суткам.
Внимание! Раньше использовали метод выявления уровня ЛДГ у больных, поступивших через 2-3 суток, когда КФК уже приходит в норму. В последнее время для постановки диагноза определяют уровень тропонина.
Показатели крови при инфаркте миокарда
Делая краткий вывод, можно отметить биохимические изменения в крови после приступа инфаркта.
Ферменты
Для диагностирования используют показатели следующих ферментов:
- АСТ. Повышение уровня данного фермента проходит в 1-2 сутки и нормализуется к 3-4 суткам.
- КФК. Повышение данного фермента начинается уже после 4-8 часов с момента некроза сердечной мышцы и достигает пика через сутки. Нормализация КФК проходит в последующие 2-3 суток.
- ЛДГ. Активизируется ЛДГ через 2-3 суток и достигает максимального уровня через 4-6 суток. Вызвать повышение могут и иные патологии, которые не связаны с инфарктом миокарда, повышение ЛДГ не считается 100% показателем некроза сердечной мышцы.
Как видно, каждый из ферментов имеет свои особенности, которые позволяют установить диагноз инфаркт миокарда в различное время после появления первых ощущений.
Лейкоцитоз
При инфаркте миокарда данный показатель может возрасти до 12-15 тыс. кубическом миллиметре. В некоторых случаях пик может быть больше, а нормализация данного показателя происходит через несколько недель после приступа инфаркта миокарда. Количество лейкоцитов увеличивается большей частью за счет молодых нейтрофилов, поэтому происходит нейтрофильный сдвиг лейкоцитарной формулы влево, что становится диагностически значимым признаком.
Скорость оседания эритроцитов
Повышение СОЭ происходит спустя несколько суток после некроза сердечной мышцы, высокий уровень сохраняется несколько недель.
Сердечно-сосудистые заболевания часто сопровождаются повышенным содержанием тяжелых металлов в крови. Повышенное содержание кадмия или алюминия оказывает токсичное воздействие. А уровень некоторых важных для жизнедеятельности микроэлементов снижается – хром, медь, марганец.
Ниже рассмотрены несколько тяжелых металлов и их негативное воздействие на организм при избыточном содержании:
- Свинец. Вызывает разрушение эндокринной системы. Помимо сердца и сосудов, поражается печень. Следствием повышенного уровня свинца становится артериальная гипертензия и атеросклероз. У пациентов появляются следующие осложнения:
- аритмия,
- тахикардия,
- синусовая брадикардия,
- васкулит.
- Кадмий. При избытке данного тяжелого металла может возникнуть отравление печени, развиться кардиопатия и нарушиться регуляция гипофиза. Повышенное содержание кадмия вызывает развитие повторных атеросклеротических бляшек, артериальной гипертензии.
- Мышьяк. Из-за большого количества мышьяка в организме сосуды теряют способность пропускать кровь. Утолщение сосудов ведет к развитию кардиогенного шока.
Изменения в содержании тяжелых металлов происходит из-за приступа инфаркта миокарда, а они, в свою очередь, могут развить осложнения.
Полная диагностика

Сложность диагностирования инфаркта миокарда заключается в том, что многие его симптомы способны маскироваться под другие заблевания. Например, нестабильная стенокардия протекает с теми же ангинозными болями в загрудинной области. Иногда боль при приступе стенокардии тоже отдается в руки или спину.
Но стенокардию можно отличить от инфаркта. Если после успокоения человека болевые ощущения не проходят, то это не стенокардия, а инфаркт миокарда. Даже 3-4 дозы нитроглицерина не погасят дискомфорт и жжение при инфаркте, как при стенокардии.
Чтобы правильно диагностировать патологию, пациенту придется принять непосредственное участие в этом процессе. У больного врач собирает анамнез, в котором требуется ответить на следующие вопросы:
- Время начала приступа и продолжительность.
- Был ли эффект от принятия обычных медикаментов.
- Сколько раз приступ повторялся, и с какой периодичностью.
- Изменялись ли ощущения при успокоении или при изменении положения тела.
Внимание! Анамнез становится важной частью диагностики. Опытный врач отталкивается от него при слабовыраженных симптомах.
При сахарном диабете нередко приступ инфаркта миокарда имеет смазанные симптомы, что связано с поражением нервных окончаний. При появлении подозрений на инфаркт миокарда следует срочно обратиться за медицинской помощью, даже если ощущения не ярко выраженные.
Для постановки диагноза используют не только биохимический анализ крови. Вот перечень обследований, которые проходит пациент:
- Электрокардиография. Данное обследование позволяет врачу получить полную картину о функционировании сердечной мышцы. Квалифицированный врач сможет точно определить факт некроза клеток сердечной мышцы по нескольким показателям. Оценивается высота остроконечного зубца T, появление зубца Q, изменение сегмента ST. Для лучшей оценки состояния ЭКГ проводят периодично с получасовым перерывом. При каждом снятии данных проводится оценка динамики некроза.
- Биохимия. После полученных результатов ЭКГ подтверждением диагноза становится анализ крови. Как уже отмечено, при поступлении больного сразу после приступа инфаркта миокарда у него наблюдается увеличенное СОЭ. В крови обнаруживаются маркеры, подтверждающие некроз сердечной мышцы. Другой специфичный показатель – белок тропонин, который появляется при приступе инфаркта миокарда, а в нормальном состоянии не наблюдается.
- Эхокардиография. В качестве дополнительного обследования проводят эхокардиографию, если полученные результаты ЭКГ не позволяют выстроить ясную картину. К тому же это обследование позволяет определить наличие иных недугов, например, ишемической болезни. С другой стороны, эхокардиография может отменить диагноз инфаркта.
- Рентгенография. В некоторых случаях пациенту с жалобами на ангинозные ощущения в груди могут назначить рентгенографическое исследование, на котором специалист сможет определить, имеется ли застой в легких – признак инфаркта миокарда.
Как и у анализа крови, у других методов диагностирования есть свои особенности, которые позволяют определить приблизительное время начала некроза. Если после обследования поставлен диагноз инфаркт миокарда, больного определяют на стационарное лечение. Только стационарно можно предотвратить дальнейшее развитие некроза и спасти жизнь пациенту.
Читайте также: Тропониновый тест при инфаркте миокарда – правила проведения, расшифровка результатов
Загрузка…
Источник
