Нарушения кровообращения при инфаркте

Инфаркт миокарда – очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Клинически проявляется жгущими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Развившийся инфаркт миокарда служит показанием к экстренной госпитализации в кардиологическую реанимацию. При неоказании своевременной помощи возможен летальный исход.
Общие сведения
Инфаркт миокарда – очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Клинически проявляется жгущими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Развившийся инфаркт миокарда служит показанием к экстренной госпитализации в кардиологическую реанимацию. При неоказании своевременной помощи возможен летальный исход.
В возрасте 40-60 лет инфаркт миокарда в 3–5 раз чаще наблюдается у мужчин в связи с более ранним (на 10 лет раньше, чем у женщин) развитием атеросклероза. После 55-60 лет заболеваемость среди лиц обоего пола приблизительно одинакова. Показатель летальности при инфаркте миокарда составляет 30—35%. Статистически 15—20% внезапных смертей обусловлены инфарктом миокарда.
Нарушение кровоснабжения миокарда на 15-20 и более минут приводит к развитию необратимых изменений в сердечной мышце и расстройству сердечной деятельности. Острая ишемия вызывает гибель части функциональных мышечных клеток (некроз) и последующее их замещение волокнами соединительной ткани, т. е. формирование постинфарктного рубца.
В клиническом течении инфаркта миокарда выделяют пять периодов:
- 1 период – предынфарктный (продромальный): учащение и усиление приступов стенокардии, может продолжаться несколько часов, суток, недель;
- 2 период – острейший: от развития ишемии до появления некроза миокарда, продолжается от 20 минут до 2 часов;
- 3 период – острый: от образования некроза до миомаляции (ферментативного расплавления некротизированной мышечной ткани), длительность от 2 до 14 суток;
- 4 период – подострый: начальные процессы организации рубца, развитие грануляционной ткани на месте некротической, продолжительность 4-8 недель;
- 5 период – постинфарктный: созревание рубца, адаптация миокарда к новым условиям функционирования.
Инфаркт миокарда
Причины инфаркта миокарда
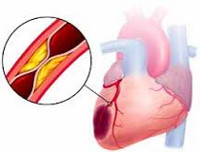
Инфаркт миокарда является острой формой ИБС. В 97—98% случаев основой для развития инфаркта миокарда служит атеросклеротическое поражение венечных артерий, вызывающее сужение их просвета. Нередко к атеросклерозу артерий присоединяется острый тромбоз пораженного участка сосуда, вызывающий полное или частичное прекращение кровоснабжения соответствующей области сердечной мышцы. Тромбообразованию способствует повышенная вязкость крови, наблюдаемая у пациентов с ИБС. В ряде случаев инфаркт миокарда возникает на фоне спазма ветвей венечных артерий.
Развитию инфаркта миокарда способствуют сахарный диабет, гипертоничесая болезнь, ожирение, нервно-психическое напряжение, увлечение алкоголем, курение. Резкое физическое или эмоциональное напряжение на фоне ИБС и стенокардии может спровоцировать развитие инфаркта миокарда. Чаще развивается инфаркт миокарда левого желудочка.
Классификация инфаркта миокарда
В соответствии с размерами очагового поражения сердечной мышцы выделяют инфаркт миокарда:
- крупноочаговый
- мелкоочаговый
На долю мелкоочаговых инфарктов миокарда приходится около 20% клинических случаев, однако нередко мелкие очаги некроза в сердечной мышце могут трансформироваться в крупноочаговый инфаркт миокарда (у 30% пациентов). В отличие от крупноочаговых, при мелкоочаговых инфарктах не возникают аневризма и разрыв сердца, течение последних реже осложняется сердечной недостаточностью, фибрилляцией желудочков, тромбоэмболией.
В зависимости от глубины некротического поражения сердечной мышцы выделяют инфаркт миокарда:
- трансмуральный – с некрозом всей толщи мышечной стенки сердца (чаще крупноочаговый)
- интрамуральный – с некрозом в толще миокарда
- субэндокардиальный – с некрозом миокарда в зоне прилегания к эндокарду
- субэпикардиальный – с некрозом миокарда в зоне прилегания к эпикарду
По изменениям, фиксируемым на ЭКГ, различают:
- «Q-инфаркт» – с формированием патологического зубца Q, иногда желудочкового комплекса QS (чаще крупноочаговый трансмуральный инфаркт миокарда)
- «не Q-инфаркт» – не сопровождается появлением зубца Q, проявляется отрицательными Т-зубцами (чаще мелкоочаговый инфаркт миокарда)
По топографии и в зависимости от поражения определенных ветвей коронарных артерий инфаркт миокарда делится на:
- правожелудочковый
- левожелудочковый: передней, боковой и задней стенок, межжелудочковой перегородки
По кратности возникновения различают инфаркт миокарда:
- первичный
- рецидивирующий (развивается в срок 8 недель после первичного)
- повторный (развивается спустя 8 недель после предыдущего)
По развитию осложнений инфаркт миокарда подразделяется на:
- осложненный
- неосложненный
По наличию и локализации болевого синдрома выделяют формы инфаркта миокарда:
- типичную – с локализацией боли за грудиной или в прекардиальной области
- атипичные – с атипичными болевыми проявлениями:
- периферические: леволопаточная, леворучная, гортанно-глоточная, нижнечелюстная, верхнепозвоночная, гастралгическая (абдоминальная)
- безболевые: коллаптоидная, астматическая, отечная, аритмическая, церебральная
- малосимптомную (стертую)
- комбинированную
В соответствии с периодом и динамикой развития инфаркта миокарда выделяют:
- стадию ишемии (острейший период)
- стадию некроза (острый период)
- стадию организации (подострый период)
- стадию рубцевания (постинфарктный период)
Симптомы инфаркта миокарда
Предынфарктный (продромальный) период
Около 43% пациентов отмечают внезапное развитие инфаркта миокарда, у большей же части больных наблюдается различный по продолжительности период нестабильной прогрессирующей стенокардии.
Острейший период
Типичные случаи инфаркта миокарда характеризуются чрезвычайно интенсивным болевым синдромом с локализацией болей в грудной клетке и иррадиацией в левое плечо, шею, зубы, ухо, ключицу, нижнюю челюсть, межлопаточную зону. Характер болей может быть сжимающим, распирающим, жгучим, давящим, острым («кинжальным»). Чем больше зона поражения миокарда, тем более выражена боль.
Болевой приступ протекает волнообразно (то усиливаясь, то ослабевая), продолжается от 30 минут до нескольких часов, а иногда и суток, не купируется повторным приемом нитроглицерина. Боль сопряжена с резкой слабостью, возбуждением, чувством страха, одышкой.
Возможно атипичное течение острейшего периода инфаркта миокарда.
У пациентов отмечается резкая бледность кожных покровов, липкий холодный пот, акроцианоз, беспокойство. Артериальное давление в период приступа повышено, затем умеренно или резко снижается по сравнению с исходным (систолическое < 80 рт. ст., пульсовое < 30 мм мм рт. ст.), отмечается тахикардия, аритмия.
В этот период может развиться острая левожелудочковая недостаточность (сердечная астма, отек легких).
Острый период
В остром периоде инфаркта миокарда болевой синдром, как правило, исчезает. Сохранение болей бывает вызвано выраженной степенью ишемии околоинфарктной зоны или присоединением перикардита.
В результате процессов некроза, миомаляции и перифокального воспаления развивается лихорадка (от 3-5 до 10 и более дней). Длительность и высота подъема температуры при лихорадке зависят от площади некроза. Артериальная гипотензия и признаки сердечной недостаточности сохраняются и нарастают.
Подострый период
Болевые ощущения отсутствуют, состояние пациента улучшается, нормализуется температура тела. Симптомы острой сердечной недостаточности становятся менее выраженными. Исчезает тахикардия, систолический шум.
Постинфарктный период
В постинфарктном периоде клинические проявления отсутствуют, лабораторные и физикальные данные практически без отклонений.
Атипичные формы инфаркта миокарда
Иногда встречается атипичное течение инфаркта миокарда с локализацией болей в нетипичных местах (в области горла, пальцах левой руки, в зоне левой лопатки или шейно-грудного отдела позвоночника, в эпигастрии, в нижней челюсти) или безболевые формы, ведущими симптомами которых могут быть кашель и тяжелое удушье, коллапс, отеки, аритмии, головокружение и помрачение сознания.
Атипичные формы инфаркта миокарда чаще встречаются у пожилых пациентов с выраженными признаками кардиосклероза, недостаточностью кровообращения, на фоне повторного инфаркта миокарда.
Однако атипично протекает обычно только острейший период, дальнейшее развитие инфаркта миокарда становится типичным.
Стертое течение инфаркта миокарда бывает безболевым и случайно обнаруживается на ЭКГ.
Осложнения
Нередко осложнения возникают уже в первые часы и дни инфаркта миокарда, утяжеляя его течение. У большинства пациентов в первые трое суток наблюдаются различные виды аритмий: экстрасистолия, синусовая или пароксизмальная тахикардия, мерцательная аритмия, полная внутрижелудочковая блокада. Наиболее опасно мерцание желудочков, которое может перейти в фибрилляцию и привести к гибели пациента.
Левожелудочковая сердечная недостаточность характеризуется застойными хрипами, явлениями сердечной астмы, отека легких и нередко развивается в острейший период инфаркта миокарда. Крайне тяжелой степенью левожелудочковой недостаточности является кардиогенный шок, развивающийся при обширном инфаркте и обычно приводящий к летальному исходу. Признаками кардиогенного шока служит падение систолического АД ниже 80 мм рт. ст., нарушение сознания, тахикардия, цианоз, уменьшение диуреза.
Разрыв мышечных волокон в зоне некроза может вызывать тампонаду сердца – кровоизлияние в полость перикарда. У 2-3% пациентов инфаркт миокарда осложняется тромбоэмболиями системы легочной артерии (могут стать причиной инфаркта легких или внезапной смерти) или большого круга кровообращения.
Пациенты с обширным трансмуральным инфарктом миокарда в первые 10 суток могут погибнуть от разрыва желудочка вследствие острого прекращения кровообращения. При обширном инфаркте миокарда может возникать несостоятельность рубцовой ткани, ее выбухание с развитием острой аневризмы сердца. Острая аневризма может трансформироваться в хроническую, приводящую к сердечной недостаточности.
Отложение фибрина на стенках эндокарда приводит к развитию пристеночного тромбоэндокардита, опасного возможностью эмболии сосудов легких, мозга, почек оторвавшимися тромботическими массами. В более позднем периоде может развиться постинфарктный синдром, проявляющийся перикардитом, плевритом, артралгиями, эозинофилией.
Диагностика инфаркта миокарда
Среди диагностических критериев инфаркта миокарда важнейшими являются анамнез заболевания, характерные изменения на ЭКГ, показатели активности ферментов сыворотки крови. Жалобы пациента при инфаркте миокарда зависят от формы (типичной или атипичной) заболевания и обширности поражение сердечной мышца. Инфаркт миокарда следует заподозрить при тяжелом и продолжительном (дольше 30-60 минут) приступе загрудинных болей, нарушении проводимости и ритма сердца, острой сердечной недостаточности.
К характерным изменениям ЭКГ относятся формирование отрицательного зубца Т (при мелкоочаговом субэндокардиальном или интрамуральном инфаркте миокарда), патологического комплекса QRS или зубца Q (при крупноочаговом трансмуральном инфаркте миокарда). При ЭхоКГ выявляется нарушение локально сократимости желудочка, истончение его стенки.
В первые 4-6 часов после болевого приступа в крови определяется повышение миоглобина – белка, осуществляющего транспорт кислорода внутрь клеток.Повышение активности креатинфосфокиназы (КФК) в крови более чем на 50% наблюдается спустя 8—10 ч от развития инфаркта миокарда и снижается до нормы через двое суток. Определение уровня КФК проводят через каждые 6-8 часов. Инфаркт миокарда исключается при трех отрицательных результатах.
Для диагностики инфаркта миокарда на более поздних сроках прибегают к определению фермента лактатдегидрогеназы (ЛДГ), активность которой повышается позже КФК – спустя 1-2 суток после формирования некроза и приходит к нормальным значениям через 7-14 дней. Высокоспецифичным для инфаркта миокарда является повышение изоформ миокардиального сократительного белка тропонина – тропонина-Т и тропонина-1, увеличивающихся также при нестабильной стенокардии. В крови определяется увеличение СОЭ, лейкоцитов, активности аспартатаминотрансферазы (АсАт) и аланинаминотрансферазы (АлАт).
Коронарная ангиография (коронарография) позволяет установить тромботическую окклюзию коронарной артерии и снижение желудочковой сократимости, а также оценить возможности проведения аортокоронарного шунтирования или ангиопластики – операций, способствующих восстановлению кровотока в сердце.
Лечение инфаркта миокарда
При инфаркте миокарда показана экстренная госпитализация в кардиологическую реанимацию. В остром периоде пациенту предписывается постельный режим и психический покой, дробное, ограниченное по объему и калорийности питание. В подостром периоде больной переводится из реанимации в отделение кардиологии, где продолжается лечение инфаркта миокарда и осуществляется постепенное расширение режима.
Купирование болевого синдрома проводится сочетанием наркотических анальгетиков (фентанила) с нейролептиками (дроперидолом), внутривенным введением нитроглицерина.
Терапия при инфаркте миокарда направлена на предупреждение и устранение аритмий, сердечной недостаточности, кардиогенного шока. Назначают антиаритмические средства (лидокаин), ß-адреноблокаторы (атенолол), тромболитики (гепарин, ацетилсалициловая к-та), антогонисты Са (верапамил), магнезию, нитраты, спазмолитики и т. д.
В первые 24 часа после развития инфаркта миокарда можно произвести восстановление перфузии путем тромболизиса или экстренной баллонной коронарной ангиопластики.
Прогноз при инфаркте миокарда
Инфаркт миокарда является тяжелым, сопряженным с опасными осложнениями заболеванием. Большая часть летальных исходов развивается в первые сутки после инфаркта миокарда. Насосная способность сердца связана с локализацией и объемом зоны инфаркта. При повреждении более 50% миокарда, как правило, сердце функционировать не может, что вызывает кардиогенный шок и гибель пациента. Даже при менее обширном повреждении сердце не всегда справляется нагрузками, в результате чего развивается сердечная недостаточность.
По истечении острого периода прогноз на выздоровление хороший. Неблагоприятные перспективы у пациентов с осложненным течением инфаркта миокарда.
Профилактика инфаркта миокарда
Необходимыми условиями профилактики инфаркта миокарда являются ведение здорового и активного образа жизни, отказ от алкоголя и курения, сбалансированное питание, исключение физического и нервного перенапряжения, контроль АД и уровня холестерина крови.
Источник
ИНФАРКТ МИОКАРДА – заболевание сердца, обусловленное острой недостаточностью его кровоснабжения, с возникновением очага некроза в сердечной мышце; важнейшая клиническая форма ишемической болезни сердца.
Главные факторы патогенеза: коронаротромбоз (острая закупорка просвета артерии), приводящий к крупноочаговому, чаще к трансмуральному, некрозу миокарда; коронаростеноз (острое сужение просвета артерии набухшей атеросклеротической бляшкой, пристеночным тромбом) с крупноочаговым, как правило, инфарктом миокарда; стенозирующий распространенный коронаросклероз (резкое сужение просвета 2-3 коронарных артерий) обычно на фоне значительно выраженного миокардиосклероза, приводящий к так называемым мелкоочаговым, чаще-субэндокардиальным инфарктам миокарда. Последняя категория инфарктов миокарда отнюдь не является “мелкой” по своему клиническому значению, по частоте осложнений и по последствиям для больного, в особенности это касается субэндокардиальных инфарктов в тех случаях, когда они обнаруживаются электрокардиографически во всех стенках левого желудочка сердца (летальность при таких инфарктах миокарда существенно превышает летальность при трансмуральных инфарктах).
Симптомы, течение. Началом инфаркта миокарда считают появление приступа интенсивной и продолжительной (более 30 мин, нередко многочасовой) загрудинной боли (ангинозное состояние), не купирующейся повторными приемами нитроглицерина; реже в картине приступа преобладает удушье или боль сосредотачивается в подложечной области (астматическая и гастралгическая формы острого инфарктного приступа). Осложнения острого приступа: кардиогенный шок; острая левожелудочковая недостаточность вплоть до отека легких; тяжелые тахиаритмии с артериальной гипотензией, внезапная клиническая смерть следствие фибрилляции желудочков (реже асистолии). Желудочковые эктопические аритмии в первые часы после острого приступа часто отражают восстановление проходимости венечной артерии (лизис тромба), наступившее либо спонтанно, либо под действием тромболитической терапии (стрептодеказа и другие тромболитические препараты).
В остром периоде наблюдаются артериальная гипертензия (часто значительная), исчезающая после стихания боли и не требующая применения гипотензивных препаратов; учащение пульса (не всегда); повышение температуры тела (со 2-3-х суток); гиперлейкоцитоз, сменяющийся стойким повышением СОЭ; в сыворотке крови – преходящий прирост гликемии, азотемии, уровня фибриногена, активности ферментов – креатинкиназы и ее миокардиального изофермента (в пределах первых 48 ч), АсАТ (в пределах 72 ч), ЛДГ и ее изофермента ЛДГ1 (в пределах 5 сут); эпистенокардический перикардит (боль в области грудины, особенно при дыхании, нередко шум трения перикарда, выслушиваемый у левого края грудины).
На серии ЭКГ отмечаются значительный, часто куполообразный подъем сегментов ST, затем – появление уширенных (не менее 0,04 с) зубцов Q, снижение амплитуды зубцов R или возникновение QS-формы желудочкового комплекса (иногда лишь спустя 24- 48 ч и даже 3-5 дней от начала инфаркта миокарда) в отведениях, соответствующих преимущественной локализации очага (зоны) поражения в сердечной мышце. Около 1/4 всех крупноочаговых инфарктов миокарда либо не сопровождаются убедительными изменениями на ЭКГ (особенно при повторных инфарктах, при внутрижелудочковых блокадах), либо такие изменения выявляются лишь в дополнительных отведениях. Диагностически доказательны изменения не на одной ЭКГ, а только определенная последовательность изменений комплекса QRS и сегмента ST, зарегистрированная на серии ЭКГ.
Осложнения госпитального периода инфаркта миокарда: эйфория, некритичное поведение, вплоть до психотического состояния; возобновление болей в груди вследствие рецидива инфаркта, появления фибринозного перикардита, резких колебаний частоты и регулярности ритма сердца, присоединения инфаркта легкого (плеврит!), формирование внешнего разрыва миокарда; пароксизмы тахиаритмии, а также ранние (вблизи зубца Т предшествующего кардиокомплекса) политопные и групповые желудочковые экстрасистолы; атриовентрикулярная блокада II-III степени; синдром слабости синусового узла: аневризма левого желудочка; внезапная смерть (аритмия терминального характера или разрыв сердца с гемотампонадой перикарда); острая сердечная недостаточность; кардиогенный шок; тромбоэмболии в системе легочной артерии. Редкие осложнения: эмболический инфаркт головного мозга; тромбоэмболии ветвей брыжеечной артерии; профузное кровотечение из острых трофических язв слизистой оболочки желудка, кишечника; острое расширение желудка; эмболия артерий нижних конечностей; “постинфарктный синдром” (Дресслера); разрыв межжелудочковой перегородки; разрыв”папиллярной мышцы.
Сердечная недостаточность нередко проявляется впервые лишь тогда, когда больной начинает ходить, и оказывается причиной “поздних” инфарктов легких (тромбоэмболия ветвей легочной артерии).
Диагноз инфаркта миокарда доказателен при одновременном наличии у больного клинической картины ангинозного приступа (или астматического его эквивалента), гиперферментемии в типичные сроки, характерных изменений на ЭКГ, описанных выше. Типичная клиническая картина болевого приступа с появлением (в характерной последовательности) гиперлейкоцитоза, гипертермии, увеличенной СОЭ, признаков перикардита заставляет предполагать инфаркт миокарда и проводить соответствующее лечение больного даже в том случае, если на ЭКГ отсутствуют доказательные для инфаркта изменения. Диагноз подтверждается анализом дальнейшего течения болезни (выявление гиперферментемии, осложнений, в особенности левожелудочковой недостаточности). Подобным же образом обосновывается ретроспективное диагностическое предположение об инфаркте миокарда, осложняющем течение других болезней или послеоперационного периода.
Для диагноза мелкоочагового инфаркта необходимо наличие у больного названных выше 3 компонентов, но интенсивность и продолжительность болевого приступа, реактивные сдвиги со стороны крови, температуры тела, активности ферментов сыворотки, а также изменения ЭКГ выражены обычно в меньшей степени. Достоверность диагноза, основанного лишь на появлении отрицательных зубцов Т” на ЭКГ в отсутствие убедительных клинико-лабораторных данных, сомнительна. Как правило, мелкоочаговый инфаркт наблюдается у лиц, много лет страдающих ишемической болезнью сердца и кардиосклерозом с различными его осложнениями, число и тяжесть которых, а также наклонность к рецидивированию возрастают с присоединением инфаркта, чем и определяются как продолжительность и отягощенность течения последнего, так и серьезность ближайшего и отдаленного его прогнозов. Если же он возникает в ранней, начальной фазе ишемической болезни сердца, то нередко оказывается предвестником тяжелого трансмурального инфаркта сердца, развивающегося несколько дней или недель спустя. Этими двумя особенностями определяются клиническая и прогностическая оценки мелкоочагового инфаркта и выбор тактики лечения. Дифференциальный диагноз инфаркта миокарда проводится с перикардитом (см.), с эмболией легочной артерии (см), со спонтанным пневмотораксом (см.), с массивным внутренним кровотечением (см.), с острым панкреатитом (см.), с расслаивающей гематомой аорты (см.). Мелкоочаговый инфаркт миокарда отличают от коронарогенной очаговой дистрофии миокарда, от дисгормональной (климактерической) кардиопатии (см. Кардиалгии). Лечение. Основная помощь при инфаркте миокарда:
непрерывное воздействие нитратами; 2) введение либо препарата, лизирующего тромб, либо прямого антикоагулянта внутривенно; 3) применение препарата, блокирующего бета-адренергические влияния на сердце; 4) введение хлорида калия в составе поляризующей смеси. Совокупность этих мер, в особенности если они приняты в первые часы заболевания, направлена на ограничение размера повреждения миокарда в инфарктной и периинфарктной зонах.
При ангинозном состоянии нитроглицерин применяют без промедления, сначала сублинпвально (0,0005 г в таблетке или 2 капли 1 % спиртового раствора) многократно с интервалом в 2-3 мин до тех пор, пока интенсивность ангинозной боли существенно слабеет, а тем временем устанавливают систему для в/в капельных инфузий и продолжают воздействие нитроглицерином с помощью в/в непрерывного его введения. С этой целью йодный (не спиртовой!) 0,01 % раствор нитроглицерина, содержащий 100 мкг препарата в 1 мл, разводят стерильным изотоническим раствором хлорида натрия с таким расчетом, чтобы скорость в/в введения нитроглицерина больному могла составлять 50 мкг/мин и увеличивая ее каждую минуту добиваются стабильного антиангинального действия (обычно – со скоростью не свыше 200- 250-300 мкг/ мин); действенную скорость сохраняют на продолжительное время. Только полное отсутствие облегчения ангинозных болей, несмотря на адекватное применение нитроглицерина, оправдывает введение больному в/в (не в/м и не п/к!) наркотических анальгетиков: либо смеси из 1-2 мл 2% раствора промедола, 1-2 мл 50% анальгина и 1 мл 1% раствора димедрола в 20 мл 5-10% раствора глюкозы; либо (в отсутствие брадикардии, артериальной гипотензии)- 1 мл 0,25% раствора дроперидола с 1 мл 0,005% раствора фентанида; либо (в отсутствие артериальной гипертензии) 30 мг (т. е. 1 мл) пентазоцина (фортрала). Потенцируют анальгезию ингаляцией смеси закиси азота и кислорода (1:1) либо введением в/в медленно (!) 20 мл 20% раствора натрия оксибутирата (гамма-оксимасляная кислота). Не следует спешить с гипотен-зивной терапией при артериальной гипертензии в первые часы инфаркта миокарда. Нитроглицерин -при невозможности в/в его введения – продолжают давать в таблетках сублингвально, поддерживая антиангинальное действие препарата аппликацией на кожу 2% мази с нитроглицерином.
Гепарин вводят в/в, начиная с 1000 ЕД, затем предпочтительна непрерывная в/в инфузия гепарина со скоростью 1000 ЕД за 1 час, либо дробное введение в вену (можно пункцией катетера) не реже чем каждые 2 ч (!) по 2000 ЕД. В стационаре продолжают в/в введение гепарина (1000 ЕД в час), контролируемое повторными коагулограммами либо временем свертывания крови (оно должно возрасти в 2-3 раза). Предпочтительна тромболитическая терапия, проводимая при том условии, что больной доставлен в стационар в первые часы инфаркта миокарда (сегменты SТна ЭКГ еще приподняты куполообразно) и что блок интенсивного наблюдения стационара располагает навыками, необходимыми для ведения больных в период тромболизиса; последний осуществляют стрептодеказой (обычно в дозе 3 000 000 ЕД) или другим тромболитическим препаратом.
Одновременно с гепарином (в особенности вслед за введением стрептодеказы либо другого тромболитического препарата) продолжают введение нитроглицерина (лучше в/в непрерывно) и налаживают введение в вену больного поляризующей смеси (500 мл 10% раствора глюкозы + 1,5 г калия хлорида) +10-12 ЕД инсулина), в сочетании с которой можно вводить и гепарин и другие препараты. Целесообразна установка венозного катетера в крупную вену с расчетом на долгосрочное его использование. Вводят больному в/в капельно на протяжении примерно получаса обзидан в дозе 7-8 мг; 4 ч спустя по окончании инфузий обзидана препарат начинают давать внутрь, обычно в дозе 20-40 мг на прием каждые 4-6ч. Завершая гепаринотерапию, переходят от внутривенного его введения к инъекциям в подкожный жировой слой передней брюшной стенки (только не внутримышечно!) по 7500-5000 ЕД 2-4 раза в сутки. Прием антиагрегантов начинают с 3-4-го дня болезни, как правило, таким препаратом служит ацетилсалициловая кислота, принимаемая по 100 мг (редко по 200 мг) 1 раз вдень (после еды). Необходим контроль реакции на кровь в кале.
Инфузионную гепаринотерапию продолжают- при неосложненном течении инфаркта миокарда -5-7 дней; соли калия – внутрь в виде растворов калия хлорида или ацетата, либо препаратов “пенистый калий” или солнатрекс (с пищей); инфузий нитроглицерина постепенно заменяют на аппликации мази с 2% нитроглицерина; прием антиагреганта (ацетилсалициловой кислоты) не следует прекращать до завершения периода реабилитации больного. Активность больного в постели – с первого дня, присаживание – со 2-4-го дня, вставание и ходьба по палате – на 7-9-11 -и дни. Рекомендуется эластическое бинтование ног, в особенности у тучных лиц (не массаж!). Сроки перевода больного на режим амбулаторной или санаторной реабилитации, а также возвращение к работе и трудоустройство (по заключению ВТЭК) определяются индивидуально.
Лечение осложнений. Частые желудочковые экстрасистолы высоких градаций по Лауну (ранние типа R на Т, политопные, групповые, “пробежки” тахикардии) в первые часы инфаркта миокарда могут быть следствием реканализации (в том числе спонтанной) просвета коронарной артерии, но вместе с тем – предвестником скорого возникновения желудочковой тахикардии либо фибрилляции желудочков. Поэтому необходимо ввести в/в струйно медленно 10- 20 мл 1% раствора ксикаина (ксилокаина, лидокаина), затем туже дозу превентивно вводят капельно на протяжении часа (если надо-повторно). Единичные экстрасистолы не требуют лечения. При наджелудочковой экстрасистолии -капельная инфузия поляризующей смеси; при пароксизмах наджелудочковой тахикардии, мерцания или трепетания предсердий, если они вызывают симптомы сердечной и сосудистой недостаточности,-также инфузия поляризующей смеси в сочетании с введением 1 мл 0,025% раствора дигоксина (не коргликона!) и 1-2 мл 25% раствора кордиамина в/в, в отсутствие таких симптомов – наблюдение, так как эти виды аритмий обычно преходящи. При пароксизме желудочковой тахикардии немедленная дефибрилляция предпочтительнее попыток проведения лекарственной терапии.
При атриовентрикулярной блокаде II-III степени изадрин (новодрин) 0,005 г (рассосать таблетку во рту) или орципреналин сульфат (алупент) 0,02 г (рассосать) либо в/в капельно в виде 1-2 мл 0,05% раствора в 200-300 мл изотонического раствора натрия хлорида со скоростью 12-16 капель в 1 мин; продолжительность и повторность применения устанавливают в зависимости от сдвигов в степени блокады. Если полная АВ-блокада при инфаркте миокарда задней (нижней) стенки нередко оказывается преходящей, то при переднеперегородочном инфаркте миокарда она резко ухудшает ближайший прогноз и требует электрокардиостимуляции, не всегда, к сожалению, улучшающей прогноз. Блокада ветвей пучка Гиса обычно не требует специального медикаментозного лечения.
При первых даже минимальных признаках острой сердечной, чаще левожелудочковой недостаточности в любом из периодов болезни показано применение препаратов сосудорасширяющего действия (нитраты, антагонисты кальция) предпочтительно в/в продолжительными периодами, но можно и внутрь (нитраты и в виде мази). Застойные явления вынуждают к назначению диуретических препаратов (фуросемид, гипотиазид, триамтерен, триампур, верошпирон), которые применяются малыми и умеренными дозами, но повторно, по мере надобности.
При отеке легких дать нитроглицерин под язык и при этом по возможности начать в/в введение нитроглицерина (см. выше), увеличивая скорость его введения вплоть до достижения убыли симптомов отека. Паническое настроение больного может потребовать введения в/в или подкожно 1 мл 1 % раствора морфина или других наркотических анальгетиков. Наряду с этим вводят в/в 6-8 мл раствора фуросемида в качестве диуретика (в отсутствие признаков кардиогенного шока). Только при резком повышении диастолического АД применяют регулируемое (опасность коллапса!) его снижение капельным в/в введением до 250 мг арфонада в 250- 300 мл 5% раствора глюкозы, скорость которого (число капель в минуту) подбирают, измеряя АД каждые 1-2 мин.
При кардиогенном шоке, т. е. при артериальной гипотензии, сочетающейся с анурией либо олигурией (менее 8 капель мочи в 1 мин по катетеру) и с острой сердечной недостаточностью (застойные явления в легких с одышкой, цианозом; синдром малого сердечного выброса; отек легких), необходимо прежде всего купировать ангинозную боль, как это описано при ангинозном приступе. Под обязательным контролем центрального венозного давления приступают к инфузии либо растворов, восполняющих сниженный объем циркулирующей крови – реополиглюкин 100-200 и даже 300 мл в/в с осторожностью (опасность отека легких); либо раствора дофамина в 5 % глюкозе или в изотоническом растворе хлорида натрия (из расчета 25 мг дофамина на 125 мл раствора; при этом скорость введения 1 мл в 1 мин, т. е. 16- 18 капель в 1 мин, будет соответствовать инфузии 200 мкг препарата за 1 мин). Скорость введения дофамина может и должна изменяться в зависимости от реакции сердечной деятельности и сосудистого тонуса, а также объема отделяемой почками мочи. Прогноз крайне серьезен, в особенности если кардиогенный шок сочетается с отеком легких. Признаком преодоления кардиогенного шока служит возобновление диуреза в объеме 1 мл и более в минуту; не следует ориентироваться только на повышение уровня АД. В специализированных отделениях выбор тактики лечения шока и контроль за ходом лечения облегчаются получением информации о давлении в легочной артерии, об объеме циркулирующей крови, о параметрах центральной гемодинамики, оксигенизации и рН крови, величине минутного диуреза, а также о рентгенографической картине кровенаполнения легких и некоторых других данных.
При тромбоэмболии ветвей легочной артерии гепаринотерапия необходима тем более, чем более достоверен диагноз; ее следует сочетать с лечением недостаточности сердца (нередко латентной), являющейся причиной периферического, часто бессимптомного флеботромбоза (источник тромбоэмболии). В специализированных отделениях проводится тромболитическая терапия (см. выше).
Понравилась статья? Сохрани:
← Вернуться в раздел
Информация, представленная на сайте является справочной.
Обязательно проконсультируетесь с врачом.
Источник
