Морфология донекротическая стадия инфаркта миокарда
Морфология стадий инфаркта миокарда. В ишемической (донекро-
тической) стадии, соответствующей первым 18 — 24 ч с момента присту-
па ишемии, при визуальном исследовании инфаркт не распознается. Отме-
чаются лишь дряблость, бледность, иногда пестрота и отечность миокарда
в области ишемии. Свежий тромб в венечной артерии — наиболее важный
признак для того, чтобы констатировать инфаркт в этой стадии.
В донекротической стадии макроскопическая диагностика инфаркта миокарда возможна при
использовании солей тетразолия, теллурита калия. В участках ишемии, где активность окисли-
тельно-восстановительных ферментов резко ослаблена, зерна формазана и восстановленный тел-
лур не выпадают, поэтому участки ишемии выглядят светлыми на темном фоне неизменного
миокарда.
При исследовании под световым микроскопом первые изменения в зоне
ишемии наблюдаются через 6 —8 ч после начала приступа стенокардии. Они
проявляются паретическим расширением капилляров, стазом эритроцитов,
отеком интерстициальной ткани. Кардиомиоциты набухшие, лишены гликоге-
на, хотя и сохраняют поперечную исчерченность. Через 10—18 ч к этим изме-
нениям присоединяются кровоизлияния и лейкодиапедез, скопления лейкоци-
тов по периферии зоны ишемии. Мышечные волокна теряют исчерченность,
они интенсивно окрашиваются эозином, фуксином, пиронином и реактивом
Шиффа, что свидетельствует о некробиотических изменениях. Окрашенные
акридиновым оранжевым они дают в люминесцентном микроскопе не оран-
жевое, а зеленое свечение, что позволяет отличить зону ишемии от интактно-
го миокарда. К исходу суток развивается характерная микроскопическая кар-
тина некроза кардиомиоцитов, которые теряют ядра, становятся гомогенны-
ми или подвергаются фрагментации. В строме накапливаются гликозамино-
гликаны, она становится метахромагичной. Стенки сосудов набухают,
в просвете их появляются скопления распадающихся эритроцитов. Участок
некроза отграничен скоплениями лейкоцитов.
Наиболее ранние электронно-микроскопические и гистохимические измене-
ния в ишемической стадии, изученные при экспериментальном инфаркте мио-
карда (перевязка венечных артерий сердца), сводятся к уменьшению чис-
ла гранул гликогена, снижению активности окислитель-
но-восстановительных ферментов, особенно дегидрогеназ и ди-
афораз, набуханию и деструкции митохондрий и сарко-
плазматической сети (рис. 215). Эти изменения, связанные с нару-
шением тканевого дыхания, усилением анаэробного гликолиза и разобщением
дыхания и окислительного фосфорилирования, появляются уже через не-
сколько минут от начала ишемии. Важная роль в первичных ишемических
изменениях ультраструктур миокарда принадлежит освобождению к а-
т е х о л а м и н о в и ионным сдвигам (потеря магния, калия и фос-
фора, накопление натрия, кальция и воды), которые определяют гидропи-
чески-деструктивные изменения ультраструктур в поздние сроки ишемической
стадии. Самыми лабильными ультраструктурами становятся митохондрии и
саркоплазматическая сеть, наиболее резистентными — миофибриллы.
Некротическаястадия инфаркта миокарда характеризуется форми-
рованием хорошо видимых при визуальном осмотре фокусов ишемиче-
ского некроза. Как правило, это ишемический (белый) инфаркт
с геморрагическим венчиком (рис. 216, см. на цветн. вкл.). Он мо-
293

Рис. 215. Ишемическая стадия инфаркта миокарда (ишемия в течение 20 мин). Исчезно-
вение гранул гликогена, набухание и гомогенизация митохондрий (М), фрагментация их
крист. Отек саркоплазмы. Мф — миофибриллы. х 21 000.
жет охватывать субэндокардиальные (субэндокардиальный ин-
фаркт), субэпикардиальные (субэпикардиальный инфаркт) от-
делы миокарда, его среднюю часть (интрамуральный инфаркт) или
всю толщу сердечной мышцы (трансмуральный инфаркт). При во-
влечении в некротический процесс эндокарда (субэндокардиальный и трансму-
ральный инфаркты) в ткани его развивается реактивное воспаление, на эн-
дотелии появляются тромботические наложения. При субэ-
пикардиальном и трансмуральном инфарктах нередко наблюдается реактив-
ное воспаление наружной оболочки сердца — фибринозный перикар-
дит.
При гистологическом исследовании область инфаркта представляет собой
некротизированную ткань, в которой периваскулярно сохраняются «островки»

неизмененного миокарда. Область некро-
за отграничена от сохранившегося мио-
карда зоной полнокровия и лейкоцитар-
ной инфильтрации (демаркационное
воспаление) (рис. 217).
Эту стадию характеризуют не только
некротические изменения в очаге инфарк-
та, но и глубокие дисциркуляторные
и обменные нарушения вне этого очага.
Они характеризуются фокусами неравно-
мерного кровенаполнения, кровоизли-
яниями, исчезновением из кардиомио-
цитов гликогена, появлением в них ли-
пидов, деструкцией митохондрий и сарко-
плазматической сети, некрозом мышечных
Рис. 217. Инфаркт миокарда. Участок некроза
(вверху) отграничен от сохранившегося миокарда
(внизу) зоной демаркационного воспаления.
294


Рис. 218. Инфаркт миокарда, разрыв сердца (показан стрелкой).
Рис. 219. Тампонада, полости перикарда при разрыве сердца на почве инфаркта. Полость
сердечной сорочки заполнена кровью.
клеток. Сосудистые нарушения появляются и за пределами сердца, на-
пример в головном мозге, где можно обнаружить неравномерное пол-
нокровие, стазы в капиллярах и диапедезные кровоизлияния.
Стадия организации инфаркта начинается с момента формиро-
вания некроза и отграничения его зоной демаркационного воспаления. В этой
зоне на смену лейкоцитам приходят макрофаги и молодые клетки фиброплас-
тического ряда. Макрофаги принимают участие в резорбции некротических
масс, в их цитоплазме появляются липиды, продукты тканевого детрита. Фиб-
робласты, обладая высокой ферментативной активностью, участвуют в фи-
бриллогенезе. Организация инфаркта происходит как из зоны демаркации, так
и из «островков» сохранившейся ткани в зоне некроза. Этот процесс продол-
жается 7 — 8 нед, однако эти сроки подвержены колебаниям в зависимости от
размеров инфаркта и реактивности организма больного. Новообразованная
соединительная ткань вначале рыхлая, типа грануляционной, затем созревает
в грубоволокнистую рубцовую, в которой вокруг сохранившихся сосудов
видны островки гипертрофированных мышечных волокон. В полости перикар-
да в исходе фибринозного перикардита появляются спайки. В них нередко
образуются сосуды, анастомозирующие с внесердечными коллатералями, что
способствует улучшению кровоснабжения миокарда. Таким образом, при ор-
ганизации инфаркта на его месте образуется плотный рубец. В таких случаях
говорят о постинфарктном крупноочаговом кардиосклерозе
(см. рис. 120). Сохранившийся миокард, особенно по периферии рубца, под-
вергается регенерационной гипертрофии.
295

Рис. 220. Острая аневризма сердца при инфаркте.
Осложнениями инфаркта являются к а р –
диогенйый шок, фибрилляция же-
лудочков, асистолия, острая сер-
дечная недостаточность, миома-
ляция, острая аневризма и разрыв
сердца, пристеночный тромбоз, пе-
рикардит.
Миомаляция, или расплавление некротизи-
рованногс) миокарда, возникает в случаях
преобладания процессов аутолиза мертвой
ткани. Миомаляция ведет к разрыву серд-
ца (рис. 218) и кровоизлиянию в полость
сердечной сорочки (гемоперикард и там-
понада его полости) (рис. 219).
Острая аневризма сердца, т. е. выбухание
некротизированной стенки его (рис. 220), обра-
зуется при обширных инфарктах. Полость
аневризмы обычно тромбируется, что в ка-
кой-то мире «укрепляет» ее стенки, в которых
появляются надрывы эндокарда. Кровь проникает в надрывы эндокарда,
отслаивает его и разрушает некротизированный миокард. Возникает разрыв
сердца и гемоперикард.
Пристеночные тромбы образуются При субэндокардиальном и трансму-
ральном инфарктах, с ними связана опасность тромбоэмболических
осложнений. Перикардит, обычно фибринозный, нередко находят при
субэпикардиальном и трансмуральном инфарктах.
Смерть при острой ишемической болезни сердца может быть связана как
с самим инфарктом миокарда, так и его осложнениями. Непосредственной
причиной смерти становятся фибрилляция желудочков, асистолия, кардио-
генный шок, острая сердечная недостаточность. Смертельными осложнениями
инфаркта миокарда являются разрыв сердца или его острой ане-
вризм ы с кровоизлияниями в полость перикарда, а также смертельные
тромбоэмболии (например, сосудов головного мозга) из полостей серд-
ца, когда источником тромбоэмболии становятся тромбы на эндокарде
в области инфаркта, в острой аневризме, в ушках сердца.
ХРОНИЧЕСКАЯ ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
Патологическая анатомия. Изменения миокарда при хронической ишемиче-
ской болезни сердца характеризуются атеросклеротическим мел-
коочаговым кардиосклерозом (морфологический эквивалент груд-
ной жабы) либо постинфарктным крупноочаговым кардио-
склерозом и образующейся на его основе хронической аневриз-
мой сердца (постинфарктные изменения).
Хроническая аневризма сердца (рис. 221) образуется обычно
в исходе трансмурального обширного инфаркта, когда рубцовая соединитель-
ная ткань, заместившая инфаркт, становится стенкой сердца. Она истончается
и под давлением крови выбухает — образуется аневризматический мешок, за-
полненный слоистыми тромботическими массами. С хронической аневризмой
связаны развитие хронической сердечной недостаточности (в
сердце постоянно находится «остаточйая» кровь), тромбоэмболиче-
ских осложнений и разрыва стенки аневризмы с тампонадой
296

Рис. 221. Хроническая аневриз-
ма сердца.
полости перикарда. Эти
осложнения являются и
более частыми причинами
смерти при хронической
ишемической болезни
сердца. Следует, однако,
помнить, что больному
хронической ишемической
болезнью сердца посто-
янно грозит опасность
развития повторного
инфаркта со всеми
возможными в таких слу-
чаях осложнениями.
КАРДИОМИОПАТИИ
Кардиомиопатии (от греч. kardia — сердце, myos — мышца, pathos —
болезнь) — группа заболеваний, характеризующихся первичными дистрофиче-
скими изменениями миокарда. Эта группа включает различные заболевания
некоронарного (некоронарогенные кардиомиопатии) и неревма-
тического (неревматогенные кардиомиопатии) происхождения,
разные по этиологии и патогенезу, но сходные клинически. Основное клиниче-
ское проявление кардиомиопатии — недостаточность сократитель-
ной функции миокарда.
Классификация. Кардиомиопатии делят на первичные (идиопатические)
и вторичные.
Среди первичных (идиопатических) кардиомиопатии раз-
личают: 1) гипертрофическую (констриктивную); 2) дилатационную (конге-
стивную); 3) рестриктивную (эндомиокардиальный фиброз). Вторичные
кардиомиопатии встречаются при: 1) интоксикациях (алко-
голь, этиленгликоль, соли тяжелых металлов, уремия и др.); 2) инфек-
циях (вирусные инфекции, тифы, трипаносомоз — болезнь Шагаса, трихинел-
лез и др.); 3) болезнях обмена наследственного (тезаурисмозы —
амилоидоз, гликогеноз) и приобретенного (подагра, тиреотоксикоз, гипер-
паратиреоз, авитаминоз, нарушения электролитно-стероидного обмена) харак-
тера ; 4) болезнях органов пищеварения (синдром нарушен-
ного всасывания, панкреатит, цирроз печени и др.).
Патологическая анатомия. Как первичные, так и вторичные кардиомиопа-
тии имеют разнообразные морфологические проявления, хотя в основе тех
и других первично лежит дистрофия миокарда.
Первичная гипертрофическая (констриктивная) к а р-
диомиопатия, имеющая нередко наследственный характер (неспособность
формирования нормальных миофибрилл), может проявляться диффузной
(идиопатическая гипертрофия миокарда) или локальной
(идиопатический гипертрофический субаортальный сте-
ноз) формами: в первом случае отмечается диффузное утолщение миокарда
левого желудочка и межжелудочковой перегородки; правые отделы сердца ги-
пертрофируются редко; размер полостей сердца нормальный или умень-
297
шенный. Во втором случае гипертрофия миокарда охватывает в основном
верхние отделы левого желудочка, что ведет к субаортальному сужению (суб-
аортальный мышечный стеноз). При диффузной и локальной формах кла-
панный аппарат сердца и венечные артерии интактны. Для дилата-
ционной(конгестивной)кардиомиопатии характерно резкое рас-
ширение полостей сердца, мышца которого может быть в той или иной
степени гипертрофирована. Сердце приобретает шаровидную форму, масса его
увеличивается, особенно за счет левого желудочка. Миокард дряблый, туск-
лый, пронизан белесоватыми прослойками. Клапанный аппарат и венечные
артерии сердца не изменены. Нередки тромбы в полостях сердца. Р е с т-
риктивная кардиомиопатия связана с диффузным или очаговым
фиброзом эндокарда левого, реже правого желудочка; иногда в процесс
вовлекается задняя створка митрального клапана. Часто встречаются присте-
ночные тромбы с последующей их организацией. Утолщение эндокарда, иног-
да резко выраженное (до 3 — 5 см), ведет к уменьшению (облитерации) поло-
сти желудочка. Вторичные кардиомиопатии морфологически крайне
полиморфны в связи с разнообразием вызывающих их причин.
Осложнения кардиомиопатии выражаются обычно хронической сердечно-
сосудистой недостаточностью или тромбоэмболическим синдромом в связи
с наличием тромбов в полостях сердца.
РЕВМАТИЧЕСКИЕ БОЛЕЗНИ
Р е в м а г и ч е с к и е болезни — группа заболеваний, для которых харак-
терны системнее поражение соединительной ткани и сосудов, а также наруше-
ния иммунологического гомеостаза (болезни соединительной тка-
ни с иммунными нарушениями). В эту группу входят: ревматизм,
ревматоидный артрит, болезнь Бехтерева, системная красная волчанка, си-
стемная склеродермия, узелковый периартериит, дерматомиозит, сухой син-
дром Шегрена.
Поражение соединительной ткани при ревматических болезнях проявляет-
ся в виде системной прогрессирующей дезорганизаци и
и складывается из ч е т ы р е х ф а з: мукоидного набухания, фибриноидных из-
менений, воспалительных клеточных реакций и склероза. Течение заболеваний
хроническое и волнообразное.
Каждая из ревматических болезней имеет свои клинико-морфоло-
ги ческиеособенности в связи с преимущественной локализацией изме-
нений в тех или иных органах или тканях.
Этиология ревматических болезней изучена недостаточно. Наибольшее
значение придают инфекции (вирус), генетическим факторам,
определяющим нарушения иммунологического гомеостаза, влиянию ряда
физических факторов (охлаждение, инсоляция) и лекарств (лекар-
ственная непереносимость).
В основе патогенеза ревматических заболеваний лежат иммунопа-
тологические реакции — реакции гиперчувствительности как немедлен-
ного, так и замедленного типа в форме иммунного воспаления.
РЕВМАТИЗМ
Ревматизм (синонимы: истинный ревматизм, острый ревматизм, бо-
лезнь Сокольского — Буйо, ревматическая лихорадка, острый ревматический по-
лиартрит) — инфекционно-аллергическое заболевание с волнообразным тече-
нием, периодами обострения (атаки, рецидивы) и затихания (ремиссия). Такое
чередование атак и ремиссий может продолжаться много месяцев и даже лет,
298
иногда ревматизм принимает затяжное и скрытое течение. Заболевают пре-
имущественно дети и подростки, в последние годы отмечено учащение забо-
левания среди взрослых.
Этиология. В возникновении и развитии заболевания доказана роль Р-ге-
молитического стрептококка группы А, а также сенсибилизации организма
стрептококком (рецидивы ангины). Придается значение возрастным и генети-
ческим факторам (ревматизм — полигенно наследуемое заболевание).
Патогенез. При ревматизме возникает сложный и многообразный им-
мунный ответ (реакции гиперчувствительности немедленного и замедленного
типов) на многочисленные антигены стрептококка. Большое значение при-
дается антителам, перекрестно реагирующим с антигенами стрептококка и ан-
тигенами тканей сердца. Некоторые ферменты стрептококка оказывают про-
теолитическое действие на соединительную ткань и способствуют расщепле-
нию комплексов гликозаминогликанов с белками в основном веществе
соединительной ткани. В результате иммунного ответа на компоненты стреп-
тококка и на продукты распада собственных тканей в крови больных по-
является широкий спектр антител, создаются предпосылки для развития ау-
тоиммунных процессов. Ревматизм принимает характер непрерывно-рециди-
вирующего заболевания с чертами аутоагрессии.
Источник
Исследовали морфологические изменения миокарда и содержание глюкозы, калия, кальция, натрия в перикардиальной жидкости у скоропостижно умерших от острого инфаркта миокарда в донекротической стадии на догоспитальном этапе. Установлено, что острый инфаркт миокарда в донекротической стадии может протекать в двух морфологических формах — либо с трансмуральной, либо субэндо- или субэпикардиальной локализацией ишемического процесса в стенке левого желудочка. Трансмуральное поражение характеризуется большим объемом ишемического поражения левого желудочка, генерализованным спазмом артериальной системы сердца, изменением кардиомиоцитов с нарушением их энергетического обмена и сократительной способности. При субэндо- или субэпикардиальной локализации очаги ишемического повреждения перемежаются с участками нормального кровоснабжения. Одинаковый характер нарушений реологических свойств крови с тромбозом микроциркуляторного русла и количества маркеров фибрилляции желудочков сердца между этими двумя формами создают предпосылки для увеличения зоны некроза в миокарде и обусловливают высокий риск нарушений ритма.
Согласно клинической классификации, острый коронарный синдром (ОКС) включает в себя различные формы ишемической болезни сердца — нестабильную стенокардию (НС) и острый инфаркт миокарда (ОИМ). Наиболее ранняя диагностика ОКС базируется на электрокардиографии и определении уровня кардиоспецифичных маркеров в сыворотке крови, в частности, кардиоспецифичного тропонина I. Первые признаки ишемического повреждения миокарда на электрокардиограмме (ЭКГ) характеризуются подъемом или депрессией сегмента ST, инверсией зубца T (ОКС с подъемом сегмента ST или ОКС без подъема сегмента ST). В течение последующих 2—3 дней от момента сердечного приступа на ЭКГ возможно появление зубца Q — маркера крупноочагового некроза миокарда. В зависимости от результатов ЭКГ и концентрации кардиоспецифичного тропонина I в сыворотке крови определяют прогноз и тактику лечения [1—4].
Морфологическая классификация предусматривает деление острых форм ишемической болезни сердца на острую коронарную недостаточность и ОИМ. Для их посмертной диагностики наряду с гистологическим методом применяют определение активности аспартатаминотрансферазы, лактатдегидрогеназы и содержания кардиоспецифичного тропонина I в перикардиальной жидкости, которая представляет собой ультрафильтрат крови и межклеточной жидкости [5—9], определяют концентрацию ионов калия, натрия и кальция в миокарде [10—13].
Таким образом, клинические данные свидетельствуют, что уже в первые 3 сут от момента сердечного приступа ОИМ представляет собой различные варианты течения заболевания. Морфологические критерии, позволяющие на секционном материале дифференцировать различные формы ОИМ, отсутствуют.
Цель настоящего исследования — выявить морфологические изменения миокарда, различия в содержании глюкозы и электролитов в перикардиальной жидкости в зависимости от объема ишемического повреждения левого желудочка (ЛЖ) при ОИМ в донекротической стадии (ОИМДС) у скончавшихся на догоспитальном этапе.
Материал и методы
Работа выполнена на материале 38 случаев смерти от ОИМДС с трансмуральным (n=23) и субэндокардиальным или субэпикардиальным (n=15) поражением стенки ЛЖ. Среди умерших от трансмурального ОИМДС было 17 мужчин и 6 женщин, средний возраст которых составил 50,1±2,8 года. В крови у 10 человек был обнаружен этиловый спирт в концентрации менее 3‰. От субэндо- или субэпикардиального ОИМДС скончались 11 мужчин и 4 женщины, средний возраст которых достигал 51,6±2,7 года (p>0,05). У 6 человек в крови был обнаружен этиловый спирт в концентрации менее 3‰. Случаев одновременного сочетания субэндо- и субэпикардиального ОИМДС у одного больного мы не наблюдали. Во всех без исключения наблюдениях медицинская помощь не оказывалась.
С момента наступления смерти до исследования трупа проходило не более 1 сут. В связи с тем что донекротическая стадия ОИМ длится первые 24 ч от момента сердечного приступа и в миокарде отсутствует сформировавшийся очаг некроза, для гистологического исследования приводили забор образцов сердца по унифицированной методике. Вырезали 5 кусочков ЛЖ на середине расстояния между верхушкой и митральным клапаном из передней, боковой, задней стенки и межжелудочковой перегородки, а также из верхушки [14]. Материал фиксировали в растворе 10% нейтрального формалина, заливали в парафин. Срезы окрашивали гематоксилином и эозином, хромотропом 2В водным голубым. Неокрашенные микропрепараты изучали в поляризованном свете. Статистический анализ микроскопических данных проводили с использованием процента положительных значений изучаемого признака, выраженного в долях единицы (Р), аргумента нормального распределения и углового преобразования Фишера [15].
Перикардиальную жидкость получали в процессе аутопсии до эвисцерации органокомплекса и центрифугировали при 1500 об/мин в течение 15 мин. В полученном материале определяли содержание калия, натрия и кальция с помощью атомно-абсорбционного спектрометра «Квант-2А» с компьютерным программным обеспечением. Глюкозу определяли стандартным набором реактивов для глюкозооксидазного метода (набор «Фотоглюкоза»).
Результаты и обсуждение
При макроскопическом исследовании в группах с трансмуральным и субэндо- или субэпикардиальным ишемическим поражением масса сердца составила 352,93±12,23 г. Толщина стенки ЛЖ достигала 1,54±0,02 см, что незначительно превышало норму (1,1—1,4 см; p>0,05).
Топографический анализ позволил выявить, что при ОИМДС ишемический процесс локализуется в 1—2 соседних областях миокарда, независимо от глубины поражения стенки ЛЖ и содержания этилового спирта в крови умерших. Наиболее часто поражаются передняя и задняя стенки, в меньшей степени верхушка и межжелудочковая перегородка (табл. 1).
Таблица1. Частота (%) локализации ишемического процесса в ЛЖ сердца
Примечание. ЛЖ — левый желудочек. Здесь и в табл. 2—4: ОИМДС — острый инфаркт миокарда, донекротическая стадия.
Гистологическое исследование микропрепаратов, окрашенных гематоксилином и эозином, хромотропом 2В водным голубым (световая микроскопия), позволило оценить изменения в артериальной системе сердца, венозного и микроциркуляторного русла, нарушения реологических свойств крови. Ишемические повреждения кардиомиоцитов выявляли с помощью световой и поляризационной микроскопии (табл. 2).
Таблица 2. Патоморфологические микроскопические признаки (Р)
Примечание. Здесь и в табл. 4 * — p<0,05; ** — p<0,01.
Во всех исследованных группах спазм коронарных артерий преобладал над дистонией и обычным просветом сосудов. Одновременно было обнаружено, что при трансмуральном поражении стенки ЛЖ имеется статистически значимое трансформирование вытянутой формы клеток эндотелия в округлую. При субэндо- или субэпикардиальной локализации ишемического процесса чаще встречались интрамуральные артерии с обычным просветом. Для трансмурального поражения стенки ЛЖ были характерны гиперхромная окраска клеток эндотелия интрамуральных артерий и спазм артериол. Полученные данные согласуются с мнением, что тонус артерий зависит от состояния эндотелия, которому принадлежит важная роль в возникновении спазма и ишемии миокарда [16, 17].
При оценке венозного и микроциркуляторного русла обнаружено полнокровие сосудов с явлениями стаза крови и сладж-феномена, образование микротромбов без достоверных различий между сравниваемыми группами. Важным показателем нарушения реологических свойств крови был феномен образования «плазматических сосудов», который встречался более чем в 59% случаев (p>0,05) при любой локализации ишемического процесса в стенке ЛЖ.
Отмечались утолщение, волнообразная деформация и фрагментация сердечных мышечных волокон, как в очагах ишемии, так и вне их. Случаи трансмуральной ишемии миокарда достоверно отличались от субэндо- или субэпикардиальной локализации по слабо различимой сарколемме — морфологическому показателю повышенной проницаемости стенки кардиомиоцитов.
Поляризационная микроскопия независимо от локализации ОИМДС характеризовалась сочетанием контрактурных повреждений кардиомиоцитов III степени, внутриклеточного миоцитолиза и первичного глыбчатого распада миофибрилл. Указанные признаки являются морфологическими маркерами ишемического повреждения кардиомиоцитов с формированием зон коагуляционного и колликвационного некроза с одновременной потерей сократительной способности миокарда [6, 9, 18, 19].
Однако при трансмуральном поражении стенки ЛЖ количество контрактурных повреждений кардиомиоцитов II степени (участков гиперсокращения) было достоверно больше, чем при субэндо- или субэпикардиальном ОИМДС. Для последних характерны контрактурные повреждения кардиомиоцитов I степени, носящие обратимый характер. В то же время отсутствовали достоверные различия между сравниваемыми группами по количеству участков с трещинами и диссоциацией мышечных волокон, которые являются маркерами фибрилляции желудочков сердца [7, 20]. Таким образом, при ОИМДС с трансмуральным поражением стенки ЛЖ дегенеративные изменения кардиомиоцитов были более выражены.
В подгруппах с наличием этанола как при трансмуральной, так при субэндо- или субэпикардиальной ишемии достоверно чаще встречались микротромбы в микроциркуляторном русле, что совпадает с результатами ранее проведенных исследований [21, 22]. Небольшое увеличение толщины стенки ЛЖ на первый взгляд можно интерпретировать как незначительную гипертрофию миокарда. Однако при одновременном наличии в микропрепаратах периваскулярного и межмышечного отека, утолщения кардиомиоцитов, острых ишемических повреждений сердечных мышечных волокон (см. табл. 2) описанное изменение следует рассматривать как морфологический признак отека миокарда [23].
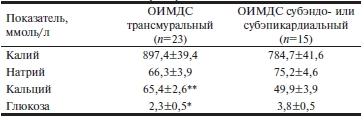
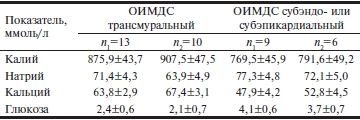
В перикардиальной жидкости выявлены достоверные различия концентрации кальция и глюкозы в зависимости от локализации ОИМДС. Для трансмурального поражения были характерны снижение уровня глюкозы и повышенное содержания кальция (табл. 3). Наличие этилового спирта в крови умерших вызвало некоторое повышение концентрации калия, кальция и снижение содержания глюкозы, которое было статистически незначимо (табл. 4).
Таблица 3. Показатели перикардиальной жидкости (M±m)

Таблица 4. Показатели перикардиальной жидкости взависимости от содержания этилового спирта в крови умерших(M±m)
Примечание. n1 — подгруппы без содержания этилового спирта, n2 — подгруппы с содержанием этилового спирта.
Выявленные морфологические изменения кардиомиоцитов и показателей перикардиальной жидкости можно объяснить особенностью строения сердечного мышечного волокна, а также различным объемом ишемического повреждения ЛЖ. Структурной единицей кардиомиоцитов является саркомер, в состав которого входит тропониновый комплекс (I, Т, С). Тропонин С (cTnC) выполняет роль депо кальция, в котором каждая молекула белка связывает 4 иона кальция [24]. Появление контрактурных повреждений кардиомиоцитов III степени, участков внутриклеточного миоцитолиза и первичного глыбчатого распада миофибрилл свидетельствует о распаде тропонинового комплекса [9] с высвобождением свободного кальция из него в цитоплазму кардиомиоцита. Одновременно за счет повышенной проницаемости сарколеммы сердечных мышечных волокон кальций переходит из цитоплазмы клетки в перикардиальную жидкость [7, 12, 13, 25, 26], а возникновение дополнительных участков гиперсокращения мышечных волокон в виде контрактурных повреждений кардиомиоцитов II степени при трансмуральной ишемии миокарда свидетельствует о перегрузке кальцием цитоплазмы кардиомиоцитов. Следствием этих структурных изменений кардиомиоцитов является потеря сократительной способности миокарда.
При трансмуральной ишемии, захватывающей все слои стенки с локализацией в 1—2 соседних топографических областях (см. табл. 1), объем повреждения миокарда ЛЖ значительно больше, чем при субэндо- или субэпикардиальной ишемии с аналогичной топографической локализацией. Поэтому больший объем ишемического повреждения обусловливает резкое уменьшение запасов гликогена в миокарде и потерю его сократительной способности на большем участке. Следовательно, повышение концентрации кальция и снижение содержания глюкозы в перикардиальной жидкости отражают объем ишемического поражения миокарда ЛЖ.
Таким образом, острый инфаркт миокарда в донекротической стадии на догоспитальном этапе может протекать в двух морфологических формах — либо с трансмуральной, либо с субэндо- или субэпикардиальной локализацией ишемического процесса в стенки ЛЖ. Трансмуральное распространение характеризуется большим объемом ишемического поражения сердечной мышцы, генерализованным спазмом артериальной системы сердца с изменением формы и окраски клеток эндотелия, тромбозом микроциркуляторного русла, выраженными дегенеративными изменениями кардиомиоцитов с нарушением их энергетического обмена и сократительной способности.
При субэндо- или субэпикардиальной локализации очаги ишемического повреждения перемежаются с участками нормального кровоснабжения, менее выражены нарушения энергетического обмена и потеря сократительной способности миокарда. Вместе с тем независимо от объема поражения левого желудочка между двумя формами острого инфаркта миокарда в донекротической стадии имеется сходство по характеру нарушения реологических свойств крови с тромбозом микроциркуляторного русла и количеству маркеров фибрилляции желудочков сердца, что в итоге создает предпосылки для увеличения зоны некроза в миокарде и обусловливает высокий риск нарушения ритма.
Наличие этилового спирта в крови умерших от острого инфаркта миокарда в донекротической стадии как при трансмуральной, так при субэндо- или субэпикардиальной ишемии повышает микротромбообразование в микроциркуляторном русле. Однако это не приводит к дополнительному увеличению объема ишемического поражения миокарда левого желудочка.
1. Боден У., Маккей Р. Формирование оптимальной стратегии лечения острых коронарных синдромов. Междунар мед журн 2001;4:3—8.
2. Грацианский Н.А. Лечение и предупреждение обострений ишемической болезни сердца (острых коронарных синдромов). Междунар журн мед практики 2000;11:44—56.
3. Раббани Л.Е. Острые коронарные синдромы — не только некроз миоцитов. Междунар мед журн 2002;1:7—12.
4. Theroux P., Fuster V. Acute coronary syndromes: unstable angina and non-Q wave myocardial infarction. Circulation 1998;97:1195—1206.
5. Автандилов Г.Г., Шагылыджов К. Патологоанатомическая диагностика ишемической болезни сердца. Метод рекоменд. М 1978;35.
6. Целлариус Ю.Г., Семенова Л.А., Непомнящих Л.М. Патологоанатомическая диагностика преднекротичеких изменений и инфаркта методом поляризационной микроскопии. Метод рекоменд. М 1979;23.
7. Кактурский Л.В. Внезапная сердечная смерть: современное состояние проблемы. Арх патол 2005;3:8—11.
8. Берестовская В.С., Залогина Е.М., Козлов А.В. и др. «Сердечные» маpкеpы в пеpикаpдиальной жидкости при скоропостижной смерти от ишемической болезни сердца. Клин лаб диагн 2000;9:42.
9. Иванов И.Н., Резник А.Г., Дзик Н.В. Взаимосвязь микроскопических изменений миокарда с биохимическими показателями перикардиальной жидкости при острых формах ишемической болезни сердца. Арх патол 2006;3:18—20.
10. Меницкая В.И. Определение коэффициента отношения концентрации электролитов натрия и калия при судебно-медицинской диагностике ишемических изменений в миокарде человека. Проблемы идентификации в теории и практике судебной медицины: Матер 4 Всерос съезда судебных медиков. М: Владимир 1996:42—43.
11. Тимофеев И.В. Патология лечения. Руководство для врачей. Ст-Петербург: Северо Запад 1999;656.
12. Bolli R., Marban E. Molecular and cellular mechanisms of myocardial stunning. Physiol Rev 1999;79:609—634.
13. Heusch G., Schulz R. Features of short-term myocardial hibernation. Mol Cell Biochem 1998;186:185—193.
14. Мазуренко М.Д., Зимина Ю.В. Микроморфологические изменения миокарда при скоропостижной смерти от ишемической болезни сердца. Теория и практика судебной медицины: Труды Петербургского научного общества судебных медиков. Под ред. М.Д. Мазуренко. Ст-Петербург 1998;2:128—131.
15. Гублер Е.В. Информатика в патологии, клинической медицине и педиатрии. Л: Медицина 1990;175.
16. Бувальцев В.И. Дисфункция эндотелия как новая концепция профилактики и лечения сердечно-сосудистых заболеваний. Междунар мед журн 2001;3:22—34.
17. Zeiher A.M., Krause T., Schachinger V. Impaired endothelium-dependent vasodilation of coronary resistance vessels is associated with exerciseinduced myocardial ischemia. Circulation 1995;91:2345—2352.
18. Иванов И.Н., Резник А.Г. Микроскопические изменения миокарда при острых формах ишемической болезни сердца. Суд-мед эксперт 2006;1:3—6.
19. Непомнящих Л.М. Основные формы острых повреждений кардиомиоцитов по данным поляризационной микроскопии миофибрилл. Бюл экспер биол 1996;1:4—13.
20. Капустин А.В. Морфологические признаки нарушения проведения возбуждения в миокарде. Суд-мед эксперт 2005;3:6—8.
21. Резник А.Г. Особенности микроскопической картины миокарда умерших от острых форм ишемической болезни сердца на фоне алкогольной интоксикации. Актуальные вопросы судебной медицины и экспертной практики: Сб науч труд, посвященный 70-летию образования Красноярского края. Красноярск 2004:61—62.
22. Резник А.Г., Иванов И.Н. Влияние алкогольной интоксикации на микроскопическую картину миокарда при острых формах ишемической болезни сердца. Современные проблемы клинической патоморфологии. Тез Всерос конф с ?
