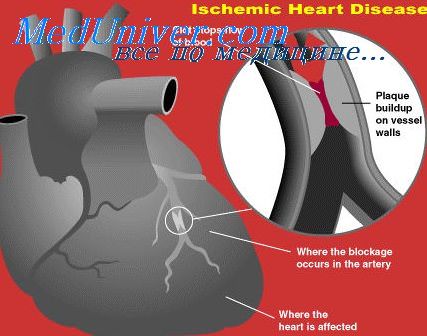
Морфологическим субстратом инфаркта миокарда является
Морфология инфаркта миокарда. Изменения миокарда при инфарктеПрименение новых инструментальных, лабораторных, морфофункциональных методов (сканирование, позитронная томография, УЗИ, цитохимические исследования) в экспериментах и клинике позволили достаточно полно представить течение процессов ишемического повреждения миокарда и развития некроза в зоне кровоснабжения окклюзированного сосуда. В условиях снижения или прекращения доставки кислорода происходит нарушение процессов окисления. Из миоцитов высвобождаются ионы Н+,К+. Внутриклеточно нарастает концентрация Са++. Появляются продукты неполного окисления — супероксидные и гидроксильные свободные радикалы. Немедленно нарушается сократимость и растяжимость миокарда. Развивается набухание и отек клеток, разрушается их мембранная структура, изменяются потоки ионов кальция. В результате резко падает продукция макроэргов, в частности АТФ. Такое состояние прогрессирует. Развивается некроз миоцитов. Ему способствует протеолиз в результате миграции к очагу поражения лейкоцитов. Развитие некроза начинается с центральной (по отношению к области нарушенного кровоснабжения) зоны и распространяется позже на краевые области. Процесс этот не одномоментный. Установлено, что на протяжении известного срока повреждение миокарда остается полностью обратимым. Изложенные выше данные привели к современной концепции патогенеза инфарктного процесса. Принципиально новым положением явилось то, что полная острая обструкция коронарного сосуда не ведет к неизбежности развития ИМ. Эти понятия не синонимы. После полного прекращения кровоснабжения миокард прекращает сократительную деятельность через 20—30 с, но биологическая смерть наступает через 60—120 мин. То есть имеется период обратимой ишемии. При реваскуляризации не позднее 1,5—2 часов ИМ может не развиться вообще, сохраняется возможность полного восстановления морфологии миокарда. В исследованиях был обнаружен и другой важный факт. Полный цикл развития инфарктного процесса в зоне окклюзии завершается на протяжении 4—6 часов. То есть, если через 1—2 часа центральная область некротизирована необратимо, краевая зона сохраняет возможность реституции еще 2—4 часа.
Краевая зона обозначается как “зона риска”. Повреждение миокарда в этой зоне, кроме недостаточного поступления кислорода, усиливается за счет поступления продуктов неполного окисления и избытка ионов кальция из центральной зоны. Ише-мически поврежденный миокард определяют термином “потрясенный ” (stunned) миокард. Основная особенность заключается в понижении его сократимости и растяжимости. Клинически при этом у части больных выявляется дисфункция левого желудочка (ДЛЖ) в виде нарастания одышки, падения растяжимости в диастолу, тахикардии, патологического изменения тонов, появления систолического шума, недостаточности сердца. При ультразвуковом исследовании определяются участки дискинезии миокарда, снижение фракции изгнания левого желудочка сердца. Доплеркардиографически находят падение растяжимости миокарда, что проявляется снижением скорости трансмитрального потока крови в диастолу. Ранним признаком потрясенного миокарда является склонность к аритмии. Его особенностью является также состояние down regulation — сниженной регуляции. Оно характеризуется отсутствием усиления сократимости миокарда в ответ на повышенную нагрузку, например, на инотропное воздействие. Это связано с падением адренорецепции в зоне повреждения. Потрясенный миокард находится на грани сохранения жизни миоцитов, то есть в нем велика угроза развития некроза. Длительность ишемического повреждения миокарда значительно превышает период нарушения кровоснабжения. Изложенные выше данные позволили обосновать новые положения о процессе развития инфаркта миокарда: 2. Между полной окклюзией коронарного сосуда и развитием некроза миокарда есть период времени (т.н. “временное окно”) продолжительностью 1—2 часа, когда процесс полностью обратим, а также отрезок времени, когда он частично обратим (от 2 до 6 часов). 3. При продолжении ишемии более чем 1—1,5 часа в миокарде развивается длительное ишемическое повреждение, которое может привести к распространению некроза, обусловить сердечную недостаточность, тяжелые аритмии. Однако это состояние может быть обратимо. В начале развития внутрикоронарных изменений показана принципиальная возможность профилактики развития ИМ или ограничения его размеров путем восстановления кровообращения. При этом необходимо осуществлять защиту миокарда от развития и прогрессирования ишемического повреждения. Учебное видео ЭКГ при инфаркте миокарда
– Также рекомендуем “Клиника инфаркта миокарда. ЭКГ при инфаркте миокарда” Оглавление темы “Инфаркт миокарда”: |
Источник
В своём развитии инфаркт миокарда проходит три стадии:
I. Ишемическая стадия
Ишемическая стадия инфаркта миокарда длится 18-24 ч и характеризуется развитием ишемической дистрофии сердечной мышцы в области нарушения кровообращения. 60 % больных умирает в эту стадию инфаркта миокарда.
Ишемические повреждения миокарда могут быть обратимыми и необратимыми.
Обратимые ишемические повреждения кардиомиоцитов развиваются в первые 20-60 мин ишемии и в случае прекращения воздействия фактора, их вызывающего, полностью исчезают. Морфологические изменения обнаруживаются при электронной микроскопии и гистохимических исследованиях. Электронная микроскопия позволяет обнаружить набухание митохондрий, деформацию их крист, расслабление миофибрилл. Гистохимически выявляются снижение активности дегидрогеназ, оксидаз, фосфорилаз, уменьшение запасов гликогена, внутриклеточного К+ и увеличение концентрации внутриклеточных Na+ и Са2+.
Необратимые ишемические повреждения кардиомиоцитов возникают через 20-60 мин ишемии. При электронной микроскопии выявляются разрывы сарколемм, отложения Са2+ в митохондриях, разрушение их крист, конденсация хроматина и появление гетерохроматина. Через 10-12 ч необратимые ишемические повреждения кардиомиоцитов можно наблюдать при помощи световой микроскопии. Обнаруживают признаки начала коагуляционного некроза, отёк, полнокровие, диапедез эритроцитов, краевое стояние нейтрофилов.
После 18-24 ч ишемии образуется зона некроза, видимая макроскопически, т. е. формируется инфаркт миокарда.
II. Некротическая стадия
Макроскопически инфаркт миокарда 18 – 24-часовой давности представляет собой нечётко очерченный бледный участок неправильной формы. В более поздние сроки инфаркты характеризуются более чёткими очертаниями и контрастной окраской. Так, инфаркт миокарда давностью несколько суток отличается охряно-желтоватым цветом и окружён тёмно-красным венчиком (ишемический инфаркт с геморрагическим венчиком).
При микроскопическом исследовании сердечной мышцы выделяют три зоны: некротическую, демаркационную и сохранного миокарда.
В зоне некроза определяются следующие три его вида:
1) коагуляционный – локализуется в центральной зоне, кардиомиоциты вытянутой формы, характерны кариопикноз и накопление ионов Са2+;
2) коагуляционный с последующим миоцитолизом – некроз мышечных пучков с явлениями пересокращения, кариолизиса, плазморексиса и плазмолизиса; данный некроз располагается в периферических отделах инфаркта и обусловлен действием ишемии и реперфузии;
3) миоцитолиз – колликвационный некроз – отёк и разрушение митохондрий, накопление в клетке ионов Na+ и воды, развитие вакуольной дегенерации; данные изменения находят по краям инфаркта.
Вокруг зоны некроза формируется зона демаркационного воспаления, представленная в первые дни полнокровными сосудами с диапедезом эритроцитов и лейкоцитарной инфильтрацией (лейкоцитарный вал). Зона демаркационного воспаления наиболее выражена на 2 – 3-е сутки. В последующем происходит смена клеточных коопераций, и в зоне воспаления начинают преобладать макрофаги и фибробласты, а также новообразованные сосуды.
В сохранном миокарде наблюдаются явления отёка.
III. Стадия организации (рубцевания)
С 3-го дня начинается дезинтеграция погибших мышечных клеток, появляются отдельные фибробласты. К 7-му дню по краям некроза формируется грануляционная ткань с большим количеством фибробластов и макрофагов, постепенно замещающая поражённый участок. На 3-й неделе практически вся зона инфаркта замещена созревающими грануляциями, к 4 – 6-й неделе они превращаются в зрелую соединительную ткань. Появляется крупноочаговый кардиосклероз, характеризующий хроническую ишемическую болезнь сердца (ИБС). Однако полностью организация инфаркта миокарда и адаптация сердца к новым условиям заканчивается через 2 – 2,5 мес от начала заболевания. В сохранившемся миокарде прогрессирует гипертрофия мышечной ткани до тех пор, пока масса миокарда не обеспечит его сократительную функцию, адекватную нагрузке.
Таким образом, процесс организации инфаркта миокарда отражает неполную регенерацию (субституцию): очаг некроза замещается рубцом, сохранившиеся кардиомиоциты по периферии гипертрофируются (регенерационная гипертрофия), что позволяет сердцу восполнять сниженную вследствие некроза функцию.
Изменения в сердце, которые можно обнаружить у больного, перенесшего инфаркт миокарда и длительно страдавшего стенокардией:
§ как исход перенесенного ранее инфаркта миокарда у больного должны быть обнаружены крупноочаговый кардиосклероз и гипертрофия миокарда (возникающая в ходе регенерации – регенерационная гипертрофия);
§ морфологическим субстратом длительной стенокардии (повторяющиеся эпизоды загрудинных болей) является диффузный мелкоочаговый кардиосклероз, возникающий на месте мелких фокусов ишемии, как правило, обусловленных длительным спазмом коронарных артерий. Механизм вазоспазма сложен, обусловлен местным выбросом вазоактивных веществ, образующихся при агрегации тромбоцитов на поверхности атеросклеротических бляшек. После разрешения длительного вазоспазма в миокарде восстанавливается кровоток, но это часто приводит к дополнительным повреждениям, связанным с реперфузией, – реперфузионным повреждениям. Диффузный мелкоочаговый кардиосклероз может сопровождаться липофусцинозом кардиомиоцитов.
§ при сердечной декомпенсации в кардиомиоцитах будут отмечаться явления жировой дистрофии вследствие энергетического дефицита и гипоксии. Два основных механизма появления жировых включений в кардиомиоцитах при гипоксии:
1) жировая инфильтрация вследствие нарушения окисления жирных кислот в условиях угнетения аэробного метаболизма;
2) декомпозиция мембран клетки вследствие активации фосфолипаз в условиях повышенного содержания Са2+ в саркоплазме.
Последовательность морфологических изменений в зоне инфаркта сердечной мышцы
| Время от начала приступа | Электронно-микроскопические изменения | Гистологические изменения | Макроскопические изменения |
| 0-20 мин | Обратимое повреждение: набухание митохондрий, деформация их крист, расслабление миофибрилл | __ | __ |
| 10-12 ч | Необратимое повреждение: разрывы сарколемм, отложения Са2+ в митохондриях, разрушение их крист, конденсация хроматина и появление гетерохроматина | Начало коагуляционного некроза, отёк, полнокровие, диапедез эритроцитов, начало инфильтрации нейтрофильными лейкоцитами | __ |
| 18-24 ч | __ | Кариопикноз, бледная окраска цитоплазмы кардиомиоцитов | Бледная окраска зоны инфаркта |
| 24-72 ч | __ | Кариолизис, чёткие границы зоны инфаркта, выраженная лейкоцитарная инфильтрация | Бледная окраска зоны инфаркта, иногда с небольшой гиперемией |
| 3-7 сут | __ | Начало дезинтеграции погибших волокон миокарда и резорбции их макрофагами; развитие грануляционной ткани по краям некроза | Охряно-жёлтая зона инфаркта с фиолетово-красным геморрагическим венчиком |
| 10 сут | __ | Развитый фагоцитоз и развитая грануляционная ткань. Начало фиброза | Ещё более жёлтая зона некроза с красно-коричневым геморрагическим венчиком |
| 6 нед | __ | Развитый рубец |
Исходы инфаркта миокарда:
1. Острая аневризма;
2. Хроническая аневризма;
3. Разрыв сердца;
4. Постинфарктный (крупноочаговый) кардиосклероз и хроническая ишемическая болезнь сердца.
Осложнения инфаркта миокарда:
I. Осложнения раннего периода болезни (до 3 недель):
§ кардиогенный шок;
§ отёк лёгких;
§ нарушения сердечного ритма и проводимости (фибрилляция желудочков, асистолия и др.);
§ миомаляция и разрыв сердца, который чаще происходит в период от 4 до 10 дней после инфаркта. Миомаляция, или расплавление некротизированного миокарда, возникает в случаях преобладания процессов аутолиза мёртвой ткани. Миомаляция ведёт к разрыву сердца, кровоизлиянию в полость перикарда (гемоперикарду) и тампонаде его полости – сдавлению излившейся кровью, что приводит к остановке сердца;
§ острая аневризма сердца, формирующаяся в те же сроки. Стенка острой истинной аневризмы сердца представлена некротизированным миокардом. Острая истинная аневризма сердца, т. е. выбухание его некротизированной стенки, образуется при обширных инфарктах. Полость такой аневризмы обычно тромбируется, в её стенке появляются надрывы эндокарда, кровь проникает в эти надрывы, отслаивает эндокард и разрушает некротизированный миокард. Возникают разрыв сердца и гемотампонада полости перикарда.
Ложная аневризма возникает при разрыве стенки левого желудочка и кровоизлиянии, ограниченном полостью перикарда, приводящем впоследствии к формированию аневризматического мешка с узкой шейкой. Таким образом, стенки ложной аневризмы образованы участками перикарда, а не некротизированным миокардом, как при истинной аневризме левого желудочка.
§ тромбоэмболический синдром, источником которого являются свежие тромботические массы, образующиеся на эндокарде в области инфаркта или в полости аневризмы. Следует отметить, что пристеночные тромбы образуются при субэндокардиальном и трансмуральном инфарктах.
§ фибринозный перикардит, который обычно развивается на 2 – 3-й день после субэпикардиального и трансмурального инфарктов;
§ отрыв некротизированной сосочковой мышцы;
§ перфорация межжелудочковой перегородки.
II. Осложнения позднего периода болезни (1 – 3 мес):
§ хроническая аневризма сердца. Стенка хронической аневризмы сердца представлена соединительной тканью. Соединительнотканная стенка хронической аневризмы разрывается редко, однако хроническая аневризма, как правило, осложняется хронической сердечно-сосудистой недостаточностью. Как острая, так и хроническая аневризма сердца часто сопровождается образованием пристеночных тромбов и тромбоэмболическим синдромом, который может явиться причиной смерти;
§ постинфарктный синдром (синдром Дресслера), который связывают с аутоаллергией вследствие приобретения изменёнными белками в области инфаркта миокарда и периинфарктной зоны аутоантигенных свойств. Синдром проявляется развитием перикардита, плеврита, лихорадки и эозинофилии крови и наблюдается у 1 – 4 % больных, перенесших инфаркт миокарда.
Среди прочих вариантов ИБС (внезапная коронарная смерть, морфологическим субстратом которой является ишемическая дистрофия миокарда; стенокардия; кардиосклероз) инфаркт миокарда является ведущей формой, которая в 30 – 35 % случаев заканчивается смертью.
Причины смерти при инфаркте миокарда:
1. Кардиогенный шок;
2. Фибрилляция желудочков;
3. Асистолия;
4. Острая сердечная недостаточность;
5. Тромбоэмболический синдром;
6. Разрыв сердца, часто в области острой аневризмы с гемотампонадой полости перикарда.
Дата добавления: 2015-07-23 | Просмотры: 3153 | Нарушение авторских прав
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | 55 |
Источник
Развитие морфологических изменений во времени при остром ИМ и последующей организации поражения представлено в таблице ниже.
Почти все трансмуральные инфаркты захватывают по меньшей мере часть левого желудочка (в т.ч. свободную стенку и межжелудочковую перегородку) и почти всю зону кровоснабжения окклюзированной артерии, оставляя лишь узкий ободок (0,1 мм) сохранного субэндокардиального миокарда, жизнеспособность которого поддерживается диффузией кислорода и питательных веществ из желудочка.
15-50% ИМ, вызванных обструкцией правой коронарной артерии, распространяются от задней части свободной стенки левого желудочка до смежной стенки правого желудочка. Изолированный инфаркт правого желудочка возникает редко (в 1-3% случаев), как и инфаркт предсердий.
Частота поражения каждой из трех основных артерий и соответствующие области повреждения миокарда, приводящего к инфаркту (при типичной правосторонней доминантной циркуляции):
• передняя нисходящая артерия (40-50%): инфаркт захватывает переднюю стенку левого желудочка поблизости от верхушки, переднюю часть межжелудочковой перегородки, верхушку по окружности;
• правая коронарная артерия (30-40%): инфаркт локализуется в нижней/задней стенке левого желудочка, задней части межжелудочковой перегородки, в некоторых случаях в нижней/задней свободной стенке правого желудочка;
• огибающая артерия (15-20%): инфаркт поражает латеральную стенку левого желудочка, за исключением области у верхушки.
Острый инфаркт миокарда, в основном в заднебоковой стенке левого желудочка,
выявленный гистохимически по отсутствию окрашивания области некроза (стрелка) хлоридом трифенилтетразолия из-за высвобождения дегидрогеназ после гибели клеток.
Обратите внимание на геморрагию из-за разрыва сердца и рубец на месте старого инфаркта (острие стрелки).
Ориентация препарата: задняя стенка сердца вверху.
Встречаются и другие локализации коронарных поражений, вызывающих инфаркт, например поражение левой основной коронарной артерии, вторичных ветвей передней нисходящей артерии или маргинальных ветвей левой огибающей артерии.
Макро- и микроскопическая картина инфаркта миокарда (ИМ) зависит от продолжительности жизни пациента после события. Области повреждения подвергаются последовательным прогрессирующим морфологическим изменениям, которые начинаются с типичного ишемического коагуляционного некроза (преобладающий механизм клеточной смерти при ИМ, хотя возможен также апоптоз) и переходят в воспаление и репарацию, протекающие очень сходно с ответом тканей на повреждение в других участках организма.
Диагностика острого инфаркта миокарда (ИМ) на ранней стадии (как прижизненная, так и посмертная) может быть затруднена, особенно если смерть наступила в первые несколько часов после появления симптомов. При макроскопическом исследовании изменения обнаруживают в случае смерти пациента через 12 час после начала ИМ, но если пациент умер через 2-3 час, то возможно определить область некроза, погрузив срез миокарда в раствор хлорида трифенилтетразолия.
Такое гистохимическое окрашивание придает красно-коричневый цвет интактному, не пораженному миокарду, где сохраняется активность дегидрогеназ (в частности, лактатдегидрогеназы). Поскольку дегидрогеназы высвобождаются из мертвых клеток через поврежденные мембраны, область инфаркта остается неокрашенной, бледной зоной. Через 12-24 час ИМ можно идентифицировать макроскопически на поперечных срезах как область синевато-коричневого цвета из-за застоя крови.

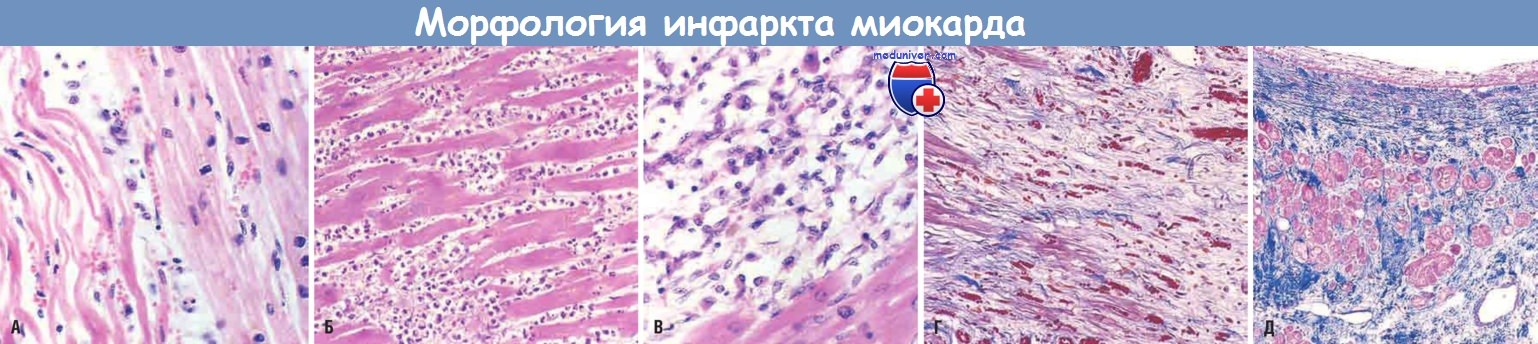
Микроскопическая картина инфаркта миокарда и стадии его репарации.
(А) Через сутки после инфаркта. Видны коагуляционный некроз и извитые кардиомиоциты (удлиненные и узкие по сравнению с расположенными справа сохранными кардиомиоцитами).
Расширенные пространства между погибшими клетками содержат отечную жидкость и нейтрофилы.
(Б) Через 3-4 сут после инфаркта. Плотный полиморфно-ядерный лейкоцитарный инфильтрат в области острого инфаркта миокарда.
(В) Через 7-10 сут после инфаркта. Почти полное удаление некротических клеток путем фагоцитоза.
(Г) Грануляционная ткань характеризуется присутствием рыхлого коллагена и обилием капилляров.
(Д) Заживший инфаркт с замещением некротических клеток плотным коллагеновым рубцом.
Видны немногочисленные оставшиеся кардиомиоциты.
После 24 час миокард в области инфаркта становится дряблым, желтовато-коричневого цвета, а зона ИМ приобретает более четкие границы. Через 10-14 сут зону ИМ окаймляет зона гиперемии из высоковаскуляризованной грануляционной ткани. На протяжении последующих недель у выжившего пациента в пораженной области формируется рубец.
Последовательность развития гистологических изменений вполне предсказуема. Типичные изменения, свойственные коагуляционному некрозу, можно увидеть при микроскопическом исследовании в первые 6-12 час после ИМ. На периферии зоны инфаркта могут присутствовать так называемые волны извитости.
Такие изменения, вероятно, обусловлены интенсивным воздействием сокращающихся жизнеспособных кардиомиоцитов на прилегающие к ним погибшие кардиомиоциты, которые растягиваются с образованием извитости. По краям инфаркта можно обнаружить сублетальные ишемические изменения — вакуольную дегенерацию, или миоцитолиз, — в виде крупных внутриклеточных вакуолей, содержащих, вероятно, воду. Некротические клетки вызывают острое воспаление, достигающее максимума за 1-3 сут.
После этого макрофаги удаляют некротические кардиомиоциты (этот процесс наиболее выражен на 3-7-е сутки), и область повреждения постепенно замещается высоковаскуляризованной грануляционной тканью (наиболее интенсивный процесс идет в течение 1-2 нед). По мере заживления грануляционная ткань замещается фиброзной. В большинстве случаев рубцевание завершается к концу 6-й недели, однако эффективность репарации зависит от размеров поражения.
В процессе заживления участвуют воспалительные клетки, мигрирующие в область повреждения через интактные кровеносные сосуды, которые часто сохраняются только по краям инфаркта. Именно поэтому репарация идет от краев инфаркта к его центру. Инфаркт в конце процесса репарации может оказаться неоднородным по структуре — заживление наиболее выражено на периферии. Как только репарация повреждения завершается, возраст рубца определить невозможно: плотный рубец спустя 8 нед после инфаркта и через 10 лет после него будет выглядеть одинаково.
Инфаркт может распространяться за пределы первоначальной границы в течение нескольких дней или недель в результате рецидивирующего некроза в прилегающих областях (расширение инфаркта). В подобных случаях присутствует центральная область, где заживление произошло раньше (т.е. оно более выражено), чем на периферии инфаркта. Этим процесс расширения инфаркта отличается от описанной ранее картины простого инфаркта, когда репарация на периферии опережает таковую в центре инфаркта.
Расширение инфаркта может произойти в результате ретроградного распространения тромба, проксимального сосудистого спазма, приводящего к недостаточному кровотоку через участок умеренного стеноза, ухудшения сократимости сердца, отложения микроэмболов, состоящих из тромбоцитов и фибрина, или аритмий, нарушающих функцию сердца.

– Рекомендуем ознакомиться со следующей статьей “Механизмы развития (патофизиология) реперфузии инфаркта миокарда”
Оглавление темы “Патогенез ишемической болезни сердца”:
- Механизмы развития (патофизиология) ишемической болезни сердца
- Механизмы развития (патофизиология) стенокардии
- Механизмы развития (патофизиология) инфаркта миокарда
- Различия трансмурального и субэндокардиального инфаркта миокарда
- Морфология инфаркта миокарда
- Механизмы развития (патофизиология) реперфузии инфаркта миокарда
- Клиника и маркеры инфаркта миокарда
- Механизмы развития (патогенез) осложнений инфаркта миокарда
- Механизмы развития (патогенез) хронической ИБС
- Механизмы развития (патогенез) внезапной сердечной смерти
Источник