Механизм развития миокардиальной формы сердечной недостаточности
Миокардиальная форма сердечной недостаточности развивается при непосредственном поражении миокарда, когда из функционирования выбывает участок сердечной мышцы (как, например, при инфаркте миокарда) или снижается сократительная функция миокарда в целом (как, например, при миокардитах, кардиомиопатиях, тотальном коронарокардиосклерозе).
Причины: инфекции, интоксикации,гиповитаминозы, коронарная недостаточность, аутоаллергические процессы.
Данная форма связана с нарушением энергетического обмена сердечной мышцы.
Миокардиальная сердечная недостаточность приводит к нарушению , как систолы(сокращения), так и диастолы (расслабления) сердца.
Патогенез:
1)Нарушение обменных процессов
2)снижение образования энергии
3) снижение сократительной способности
4)снижение работы сердца
5)развивается в условиях гипофункции сердца
• Нарушение энергетического обмена в миокарде могут быть результатом недостаточности окисления, развития гипоксии, снижения активности ферментов, участвующих в окислении субстратов, и разобщение окисления и фосфорилирования
• Недостаточность субстратов для окисления чаще всего возникает вследствие уменьшения кровоснабжения сердца изменения состава притекающей к сердцу крови, а также нарушения проницаемости клеточных мембран.
• Склероз коронарных сосудов является наиболее частой причиной уменьшения кровоснабжения сердечной мышцы. Относительная ишемия сердца может быть результатом гипертрофии, при которой увеличение объёма мышечных волокон не сопровождается соответствующим увеличением числа кровеносных капилляров
• Метаболизм миокарда может быть нарушен как при недостатке(напр., гипогликемия), так и при избытке(напр.,при резком увеличении в притекающей крови молочной, пировиноградной кислот, кетоновых тел) некоторых субстратов. Вследствие сдвига рН миокарда возникают вторичные изменения активности ферментных систем, приводящие к нарушениям метаболизма
2. Патогенез диффузной дыхательной недостаточности.
Механизмы развития гипоксемии при дыхательной недостаточности
1. Альвеолярная гиповентиляция. Давление кислорода в альвеолярном воздухе меньше атмосферного в среднем на 1/3, что обусловлено поглощением О2 кровью и восстановлением его напряжения в результате вентиляции легких. Это равновесие динамическое. При уменьшении вентиляции легких преобладает процесс поглощения кислорода, а вымывание углекислого газа снижается. В результате развиваются гипоксемия и гиперкапния, что может иметь место при различных формах патологии – при обструктивных и рестриктивных нарушениях вентиляции легких, нарушениях регуляции дыхания, поражении дыхательной мускулатуры.
2. Неполная диффузия кислорода из альвеол. Причины нарушения диффузионной способности легких рассмотрены выше (см. раздел 16.1.2).
3. Увеличение скорости потока крови по легочным капиллярам.
Оно приводит к уменьшению времени контакта крови с альвеолярным воздухом, что отмечается при рестриктивных нарушениях вентиляции легких, когда уменьшается емкость сосудистого русла. Это характерно и для хронической обструктивной эмфиземы легких, при которой тоже имеет место уменьшение сосудистого русла.
4. Шунты. В нормальных условиях около 5% потока крови идет мимо альвеолярных капилляров, и неоксигенированная кровь снижает среднее напряжение кислорода в венозном русле малого круга кровообращения. Насыщение артериальной крови кислородом составляет 96-98%. Шунтирование крови может увеличиваться при повышении давления в системе легочной артерии, возникающем при недостаточности левых отделов сердца, хронической обструктивной патологии легких, патологии печени. Шунтирование венозной крови в легочные вены может осуществляться из системы вен пищевода при портальной гипертензии через так называемые портопульмональные анастомозы. Особенностью ги-
поксемии, связанной с шунтированием крови, является отсутствие лечебного эффекта от вдыхания чистого кислорода.
5. Вентиляционно-перфузионные расстройства. Неравномерность вентиляционно-перфузионных отношений свойственна нормальным легким и обусловлена, как уже было отмечено, силами гравитации. В верхних отделах легких кровоток минимальный. Вентиляция в этих отделах тоже снижена, но в меньшей степени. Поэтому от верхушек легких кровь оттекает с нормальным или даже повышенным напряжением О2, однако в связи с небольшим общим количеством такой крови это мало влияет на степень оксигенации артериальной крови. В нижних отделах легких, напротив, кровоток значительно повышен (в большей степени, чем вентиляция легких). Небольшое снижение напряжения кислорода в оттекающей крови при этом способствует развитию гипоксемии, так как увеличивается общий объем крови с недостаточным насыщением кислородом. Такой механизм гипоксемии характерен для застоя в легких, отека легких различной природы (кардиогенного, воспалительного, токсического).
Источник
Характеристика нарушения насосной функции сердечной системы
Острая разновидность миокардиальной недостаточности выражается по-разному. В зависимости от формы проявления этого нарушения выделяют три классификации.
Первая категория характеризуется темпом развития миокардиальной недостаточности.
Всего выделяют три вида:
- острый вид сердечной недостаточности;
- подострый вид сердечной недостаточности;
- хронический вид сердечной недостаточности.
Первая разновидность считается самым опасным нарушением. Она протекает быстро, жизнь пациента в этом случае напрямую зависит от того, насколько быстро окажут помощь человеку. Второй является распространённым в медицинской практике. Если говорить о хронической форме, то её часто называют очень продолжительной. Она развивается на протяжении нескольких недель, месяцев и даже лет.
Наряду с формой, выделяют категорию, которая характеризует нарушение по месту поражения.
Среди них чаще проявляются:
- нарушение деятельности левого желудочка;
- нарушения деятельности правого желудочка;
- нарушение деятельности обоих частей сердца.
Важной является и классификация, которая напрямую отвечает за эффективность механизмов, обеспечивающих компенсацию.
К ним относят:
- компенсированную форму сердечного нарушения;
- субкомпенсированную форму сердечной недостаточности;
- некомпенсированную форму сердечного нарушения.
Сердечной недостаточностью называют нарушение, которое влияет на работу мышцы миокарда, отвечающую за выполнение насосной функции организма. От неё напрямую зависит газообмен и другие важные процессы, обеспечивающие полноценную жизнедеятельность человека.
Причины и механизмы развития миокардиальной формы сердечной недостаточности
Миокардиальная форма сердечной недостаточности развив.при поражении миокарда, когда не работает участок сердечной мышцы ( инфаркт миокарда), либо ↓ сократительная функция миокарда вообще (миокардитах, кардиомиопатиях, тотальном коронарокардиосклерозе). ↑ сократимости миокарда при его растяжении притекающей кровью (механизм Франка-Старлинга).
Обеспечивает ↑ развиваемого миокардом напряжения и скорости сокращения и расслабления. — ↑ напряжения, развиваемого сердцем, осуществляется в ответ на нарастающее растяжение миокарда. В связи с этим механизм Франка-Старлинга называют гетерометрическим, т.е. связанным с возрастанием длины мышечного волокна.
— ↑ скорости сокращения и расслабления кардиомиоцитов развивается в связи с быстрым выбросом Са2 из саркоплазматической сети и ускоренным закачиванием Са2 (Са2 -АТФазы) в цистерны саркоплазмы. ↑ силы сокращений миокарда в ответ на ↑ нагрузку Происходит при неизменной длине миоцитов. Такой механизм называют гомеометрическим, поскольку он реализуется без значительного изменения длины мышечных волокон.
Возрастание сократимости сердца при ↑ ЧСС. ↑ сократимости сердца в результате возрастания симпатико-адреналовых влияний. Характеризуется ↑ частоты и силы сокращений. — Симпатическая иннервация миокарда осуществляется окончаниями аксонов адренергических нейронов шейного верхнего, шейного среднего и звёздчатого (шейно-грудного) ганглиев.
стимуляция бета-адренорецептора адреномиметиком (например, норадреналином) —
Источник
Миокардиальная
форма сердечной недостаточности
развив.при поражении миокарда, когда
не работает участок сердечной мышцы (
инфаркт миокарда), либо ↓ сократительная
функция миокарда вообще (миокардитах,
кардиомиопатиях, тотальном
коронарокардиосклерозе). ↑ сократимости
миокарда при его растяжении притекающей
кровью (механизм Франка-Старлинга).
Обеспечивает ↑ развиваемого миокардом
напряжения и скорости сокращения и
расслабления. – ↑ напряжения, развиваемого
сердцем, осуществляется в ответ на
нарастающее растяжение миокарда. В
связи с этим механизм Франка-Старлинга
называют гетерометрическим, т.е. связанным
с возрастанием длины мышечного волокна.
– ↑ скорости сокращения и расслабления
кардиомиоцитов развивается в связи с
быстрым выбросом Са2+ из саркоплазматической
сети и ускоренным закачиванием Са2+
(Са2+-АТФазы) в цистерны саркоплазмы. ↑
силы сокращений миокарда в ответ на ↑
нагрузку Происходит при неизменной
длине миоцитов. Такой механизм называют
гомеометрическим, поскольку он реализуется
без значительного изменения длины
мышечных волокон. Возрастание сократимости
сердца при ↑ ЧСС. ↑ сократимости сердца
в результате возрастания симпатико-адреналовых
влияний. Характеризуется ↑ частоты и
силы сокращений. – Симпатическая
иннервация миокарда осуществляется
окончаниями аксонов адренергических
нейронов шейного верхнего, шейного
среднего и звёздчатого (шейно-грудного)
ганглиев. – Активация симпатических
нервов вызывает положительный инотропный
эффект. ↑ частота спонтанной деполяризации
мембран водителей ритма, облегчается
проведение импульса в волокнах Пуркинье,
↑ частота и сила сокращения типичных
кардиомиоцитов. – Действие
катехоламинов на кардиомиоциты через
бета1-адренорецепторы обусловлено рядом
последующих событий:
стимуляция бета-адренорецептора
адреномиметиком (например, норадреналином)
-> через G-белок активируется
аденилатциклаза с образованием цАМФ
-> активация цАМФ-зави-симой протеинкиназы
-> фосфорилирование белка р27 сарколеммы
-> в саркоплазму ↑ вход кальция через
открытые потенциалозави-симые Са2+-каналы
-> ↑ кальций-индуцированная мобилизация
Са2+ в цитозоль через активированные
рецепторы рианодина -> в саркоплазме
значительно ↑ концентрация Са2+ ->
связывание Са2+ с тропонином С снимает
ингибирующее действие тропомиозина на
взаимодействие актина с миозином ->
образуется большее количество
актомио-зиновых связей -> ↑ сила
сокращения.
Компенсаторная
гиперфункция сердца – сопровождается
значительным и более или менее длительным
увеличением интенсивности функционирования
сердца. Она обусловливает экспрессию
отдельных генов кардиомиоцитов, прояв.↑
интенсивности синтеза нукл.кислот и
белков. Ускорение синтеза нукл кислот
и белков миокарда приводит к нарастанию
его массы — гипертрофии. Биологическое
значение компенсаторной гипертрофии
сердца заключается в том, что увеличенная
функция органа выполняется его возросшей
массой.
Билет
№ 9
1.Мутация, определение понятия, виды, клиническое значение.
Мутации-измен.генома,
приводящие к ↑ или ↓ кол-ва генетического
материала,к изменению нуклеотидов и их
последовательности.Факторы,вызыв.мутации,называют
мутагенами.
По
причине:1)Спонтанные
возник.под влиянием естественных
мутагенов экзо-или эндогенного
происхождения, без целенаправленного
вмешательства человека(воздействия
естественного фона радиации или
УФ-излучения; ошибок репликации
).2)Индуцированные
вызванные спец.направленными воздействиями
физич.(УФизлучение).химич(тяж.металлы,мышьяк,свинец),биологич(токсины,вирусы).
По
уровню масштаба:1)Генные изменения
молекулярной структуры ДНК, нарушает
функционирование гена и приводит к
развитию генных болезней(фенилкетонурия,
гемофилии, нейрофиброматоз,
муковисцидоз).2)Хромосомные
изменения
структуры
хромосом(делеция,транслокация,инверсия,дуплекация).3)Геномные
при
нарушении расхождения хромосом в мейозе
и при нарушении оплодотворения=>полиплоидия(кратное
гаплоидному набору увеличение
хромосом,3n).
Анеуплоидия ↓ или ↑ числа отдельных
хромосом(моносомия,трисомия).
По
виду клеток где произошла
мутация:1)Гаметические
в половых клетках. 2)Соматические
в соматических клетках — прояв.у того
у кого возникают.
По
значению: 1)Патогенные
гибель эмбриона и к развитию наследственных
и врождённых заболеваний. 2)
Нейтральные(вызывающие
веснушки, изменение цвета волос, радужной
оболочки глаза). 3)Благоприятные
↑
жизнеспособность организма или вида
(тёмная окраска кожных покровов у жителей
африканского континента).
Соседние файлы в предмете Патологическая физиология
- #
- #
- #
- #
- #
- #
23.11.2015288.8 Кб7шпора.odt
Источник
МИОКАРДИАЛЬНАЯ ФОРМА СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ.
Прочитайте:
Прямые повреждения миокарда могут быть вызваны инфекцией, интоксикацией, гипоксией, авитоминозом, нарушением венечного кровообращения и др. факторами. При этом нарушается образование макроэргов в кардиомиоцитах или использование их энергии. Это приводит к понижению сократительной способности сердца, а следовательно – к понижению ударного и минутного объема сердца, что влечет за собой повышение КДО (конечного диастолического объема ) и КДД (конечного диастолического давления) в желудочках сердца, а затем и повышение венозного давления.
Таким образом, всякая СН ведет к понижению МОС и повышению ВД. Это два главных признака и последствия сердечной недостаточности
На внутрисердечные механизмы компенсации накладываются и внесердечны е, они также направлены на восстановление МОС. Итак, недостаточность кровообращения сердечного типа начинается с уменьшения МОС, что влечет за собой понижение давления крови в аорте – это улавливается барорецепторами дуги аорты и синокаротидной зоны и происходит снижение импульсации с барорецепторов, это приводит к повышению тонуса симпатических нервов и определяет полноту клинических проявлений СН (тахикардия, одышка, отеки, цианоз). В результате возбуждения симпатической н.с. увеличивается частота и сила сердечных сокращений. Это определяет существенный признак СН — развитие тахикардии. Кроме того, под влиянием симпатических импульсов происходит сокращение вен, которые в норме содержат до 50 % всей циркулирующей крови. Это приводит к повышению венозного давления, увеличению венозного возврата.
Основные механизмы развития миокардиальной недостаточности
СН вызывается главным образом двумя группами причин:
- оказывающими прямое повреждающее действие на миокард, обусловливающими функциональную перегрузку сердца.
Многочисленные факторы 1-й группы причин СН можно условно разделить на 3 подгруппы в зависимости от их природы:
- физического характера — травма миокарда, сдавление сердца экссудатом, опухолью, действие электрического тока, лучистой энергии и т. п.; химического (в том числе биохимического) характера — высокие концентрации биологически активных веществ: адреналина, тироксина, ангиотензина; большие дозы лекарственных и нелекарственных веществ — разобщителей процесса окислительного фосфорилирования, блокаторов транспорта ионов кальция, ингибиторов транспорта электронов в цепи дыхательных ферментов митохондрий и т. п.; биологического происхождения — токсины, микробы, паразиты, вирусы.
К этой же группе причин СН следует отнести также недостаток (или отсутствие) в организме факторов, необходимых для адекватного функционирования сердца: витаминов, субстратов метаболизма, кислорода, ферментов, соединений, обладающих антиоксидантной активностью. Наиболее часто такая ситуация является следствием коронарной недостаточности.
Факторами, вызывающими СН вследствие перегрузки миокарда, могут быть:
- чрезмерное увеличение количества притекающей к сердцу крови (увеличение «преднагрузки»); значительное повышение сопротивления, которое оказывается при ее изгнании из сердечных полостей в аорту и легочную артерию (увеличение «постнагрузки»); изменения в различных органах и системах: в самом сердце (пороки клапанов, уменьшение массы сократительного миокарда в результате его ишемии, инфаркта или кардиосклероза), в сосудистом русле (артериальная гипертензия. артериовенозное шунтирование), в системе крови (гиперволемия, полицитемия); нейрогуморальная дисрегуляция сердечной деятельности (чрезмерная активация симпатергических влияний на миокард, тиреотоксикоз и т. п.).
Как правило, СН является результатом действия патогенных факторов обеих групп — повреждающих миокард и вызывающих его перегрузку. Однако даже с учетом этого условия в развитии СН всегда можно определить ведущий механизм.
В связи с этим большинство современных исследователей [Meерсон Ф. З. 1965; Мухарлямов Н. М. 1978; Fledkenstein A. etal. 1967] выделяют два основных патофизиологических варианта СН:
- в результате повреждения миокарда («миокардиальная» форма); вследствие функциональной перегрузки сердца («перегрузочная» форма).
В большинстве случаев СН развивается в результате сочетания прямого повреждения миокарда и его перегрузки — смешанная форма СН.
Помимо этих форм (их условно можно назвать первичными, или «кардиогенными»), встречаются также такие, которые обусловлены преимущественно первичным уменьшением притока крови к сердцу при нормальной его сократимости. Они могут быть результатом значительного снижения массы циркулирующей крови, нарушения диастолического расслабления сердца при его сдавлении жидкостью, накапливающейся в полости перикарда (экссудат, кровь), и других подобных состояний. Эти разновидности СН обозначают как вторичные, или «некардиогенные».
В условиях коронарной недостаточности в эксперименте или при ХИБС в клинике сердечная недостаточность нередко возникает при повреждении сердца вследствие его транзиторной ишемии, поскольку всякий приступ стенокардии приводит к преходящему снижению сократимости миокарда, а частые и постоянные приступы стенокардии закрепляют этот эффект [Комаров Ф. И. Ольбинская Л. И. 1978].
Таким образом, независимо от «пускового» механизма сердечной недостаточности (приступы стенокардии, очаговые изменения миокарда после острых инфарктов) развитие ее, степень выраженности, помимо других факторов (характер труда, образ жизни, сопутствующие заболевания и пр.), в значительной мере зависят от состояния коронарного кровообращения. В связи с этим оптимизация коронарного кровотока является одним из важных факторов в комплексе лечебных мероприятий сердечной недостаточности.
«Коронарная и миокардиальная недостаточность»,
Л.И.Ольбинская, П.Ф.Литвицкий
Механизмы экстренной компенсации сократительной функции сердца
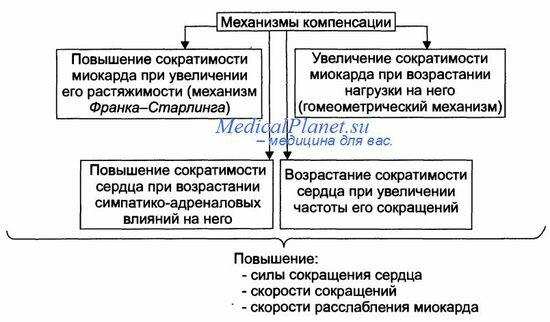
Механизмы экстренной компенсации сниженной сократительной функции сердца приведены на рисунке.
• Повышение сократимости миокарда при его растяжении притекающей кровью (механизм Франка-Старлинга). Обеспечивает увеличение развиваемого миокардом напряжения и скорости сокращения и расслабления.
— Увеличение напряжения. развиваемого сердцем, осуществляется в ответ на нарастающее растяжение миокарда. В связи с этим механизм Франка-Старлинга называют гетерометрическим, т.е. связанным с возрастанием длины мышечного волокна.
— Увеличение скорости сокращения и расслабления кардиомиоцитов развивается в связи с более быстрым выбросом Са 2+ из кальциевых депо (саркоплазматическая сеть) и последующим ускоренным закачиванием Са2+ (Са2+-АТФазы) в цистерны саркоплазматической сети.
 Экстренные механизмы компенсации сниженной сократительной функции сердца
Экстренные механизмы компенсации сниженной сократительной функции сердца
Увеличение силы сокращений миокарда в ответ на повышенную нагрузку. Происходит при неизменной длине миоцитов. Такой механизм называют гомеометрическим, поскольку он реализуется без значительного изменения длины мышечных волокон.
Возрастание сократимости сердца при увеличении ЧСС.
Повышение сократимости сердца в результате возрастания симпатико-адреналовых влияний. Характеризуется увеличением частоты и силы сокращений.
— Симпатическая иннервация миокарда осуществляется окончаниями аксонов адренергических нейронов шейного верхнего, шейного среднего и звёздчатого (шейно-грудного) ганглиев.
— Активация симпатических нервов вызывает положительный инотропный эффект. Увеличивается частота спонтанной деполяризации мембран водителей ритма, облегчается проведение импульса в волокнах Пуркинье, увеличиваются частота и сила сокращения типичных кардиомиоцитов.
— Действие катехоламинов на кардиомиоциты через бета1-адренорецепторы обусловлено рядом последующих событий: стимуляция бета-адренорецептора адреномиметиком (например, норадреналином) -> через G-белок активируется аденилатциклаза с образованием цАМФ -> активация цАМФ-зави-симой протеинкиназы -> фосфорилирование белка р27 сарколеммы -> в саркоплазму увеличивается вход кальция через открытые потенциалозави-симые Са2+-каналы -> усиливается кальций-индуцированная мобилизация Са2+ в цитозоль через активированные рецепторы рианодина -> в саркоплазме значительно повышается концентрация Са2+ -> связывание Са2+ с тропонином С снимает ингибирующее действие тропомиозина на взаимодействие актина с миозином -> образуется большее количество актомио-зиновых связей -> увеличивается сила сокращения.
Компенсаторная гиперфункция сердца
Функционирование названных выше механизмов обеспечивает экстренную компенсацию сократительной функции перегруженного или повреждённого миокарда. Это сопровождается значительным и более или менее длительным увеличением интенсивности функционирования сердца — его компенсаторной гиперфункцией.
Компенсаторная гипертрофия сердца
Гиперфункция миокарда обусловливает экспрессию отдельных генов кардиомиоцитов. Она проявляется увеличением интенсивности синтеза нуклеиновых кислот и белков. Ускорение синтеза нуклеиновых кислот и белков миокарда приводит к нарастанию его массы — гипертрофии. Биологическое значение компенсаторной гипертрофии сердца заключается в том, что увеличенная функция органа выполняется его возросшей массой.
Источник
