Медиаторы воспаления и инсульт
Появление воспалительных процессов в ответ на действие патологического фактора является адекватной реакцией организма. Воспаление – комплексный процесс, который развивается на местном или общем уровне, возникающий в ответ на действие чужеродных агентов. Основная задача развития воспалительной реакции направлена на устранение патологического влияния и восстановление организма. Медиаторы воспаления являются посредниками, принимающими непосредственное участие в этих процессах.
Кратко о принципах воспалительных реакций
Иммунная система – охранник человеческого здоровья. При появлении необходимости она вступает в бой и уничтожает бактерии, вирусы, грибы. Однако при усиленной активизации работы процесс борьбы с микроорганизмами можно увидеть визуально или прочувствовать появление клинической картины. Именно в подобных случаях развивается воспаление как защитный ответ организма.
Различают острый процесс воспалительной реакции и хроническое ее течение. Первый возникает в результате внезапного действия раздражающего фактора (травма, повреждение, аллергическое влияние, инфекция). Хроническое воспаление имеет затяжной характер и не столь выраженные клинические признаки.
В случае местного ответа иммунной системы в зоне травмы или ранения появляются следующие признаки воспалительной реакции:
- болезненность;
- припухлость, отечность;
- гиперемия кожи;
- нарушение функционального состояния;
- гипертермия (подъем температуры).
Стадии развития воспаления
Процесс воспаления основан на одновременном взаимодействии защитных факторов кожи, крови и иммунных клеток. Сразу после контакта с чужеродным агентом организм отвечает местным расширением сосудов в зоне непосредственной травматизации. Происходит увеличение проницаемости их стенок и усиление местной микроциркуляции. Вместе с током крови сюда поступают клетки гуморальной защиты.
Во второй стадии иммунные клетки начинают борьбу с микроорганизмами, оказавшимися в месте повреждения. Начинается процесс, имеющий название фагоцитоз. Клетки-нейтрофилы изменяют свою форму и поглощают патологических агентов. Далее выделяются специальные вещества, направленные на уничтожение бактерий и вирусов.
Параллельно с микроорганизмами нейтрофилы уничтожают и старые мертвые клетки, располагающиеся в зоне воспаления. Таким образом, начинается развитие третьей фазы реакции организма. Очаг воспаления как бы ограждается от всего организма. Иногда в этом месте может ощущаться пульсация. Клеточные медиаторы воспаления начинают продуцироваться тучными клетками, что позволяет очистить травмированную область от токсинов, шлаков и других веществ.

Общие понятия о медиаторах
Медиаторы воспаления – это активные вещества биологического происхождения, выделением которых сопровождаются основные фазы альтерации. Они отвечают за возникновение проявления воспалительных реакций. Например, усиление проницаемости стенок сосудов или местное повышение температуры в зоне травматизации.
Основные медиаторы воспаления выделяются не только при развитии патологического процесса. Их выработка происходит постоянно. Она направлена на регуляцию функций организма на тканевом и клеточном уровнях. В зависимости от направленности действия, модуляторы оказывают эффект:
- аддитивный (добавочный);
- синергетический (потенцирующий);
- антагонический (ослабляющий).
При появлении повреждения или в месте действия микроорганизмов медиаторное звено контролирует процессы взаимодействия воспалительных эффекторов и смену характерных фаз процесса.
Виды медиаторов воспаления
Все воспалительные модуляторы разделяются на две большие группы, в зависимости от их происхождения:
- Гуморальные: кинины, производные комплемента, факторы свертывающей системы крови.
- Клеточные: вазоактивные амины, производные арахидоновой кислоты, цитокины, лимфокины, лизосомальные факторы, активные метаболиты кислорода, нейропептиды.
Гуморальные медиаторы воспаления находятся в организме человека до воздействия патологического фактора, то есть организм имеет запас этих веществ. Их депонирование происходит в клетках в неактивном виде.
Вазоактивные амины, нейропептиды и лизосомальные факторы также являются предсуществующими модуляторами. Остальные вещества, относящие к группе клеточных медиаторов, вырабатываются непосредственно в процессе развития воспалительной реакции.
Производные комплемента
К медиаторам воспаления относятся производные комплимента. Эта группа биологически активных веществ считается самой важной среди гуморальных модуляторов. К производным относятся 22 различных белка, образование которых происходит при активации комплемента (образовании иммунного комплекса или иммуноглобулинов).
- Модуляторы С5а и С3а отвечают за острую фазу воспаления и являются либераторами гистамина, продуцируемого тучными клетками. Их действие направлено на усиление уровня проницаемости клеток сосудов, что осуществляется прямым способом или опосредственно через гистамин.
- Модулятор С5а des Arg повышает проницаемость венул в месте воспалительной реакции и привлекает нейтрофильные клетки.
- С3Ь способствует фагоцитозу.
- Комплекс С5Ь-С9 отвечает за лизис микроорганизмов и патологических клеток.
Эта группа медиаторов продуцируется из плазмы и тканевой жидкости. Благодаря поступлению в патологическую зону, происходят процессы экссудации. При помощи производных комплемента высвобождаются интерлейкин, нейромедиаторы, лейкотриены, простагландины и факторы, активирующие тромбоциты.
Кинины
Эта группа веществ является вазодилататорами. Они образуются в тканевой жидкости и плазме из специфических глобулинов. Основными представителями группы являются брадикинин и каллидин, эффект действия которых проявляется следующим образом:
- участвуют в сокращении мускулатуры гладких групп;
- за счет сокращения сосудистого эндотелия усиливают процессы проницаемости стенки;
- способствуют увеличению артериального и венозного давления;
- расширяют мелкие сосуды;
- вызывают появление боли и зуда;
- способствуют ускорению регенерации и коллагенового синтеза.
Действие брадикинина направлено на открытие доступа плазмы крови к очагу воспаления. Кинины – медиаторы боли воспаления. Они раздражающе действуют на местные рецепторы, вызывая дискомфорт, болезненное ощущение, зуд.
Простагландины
Клеточными медиаторами воспаления являются простагландины. Эта группа веществ относится к производным арахидоновой кислоты. Источниками простагландинов являются макрофаги, тромбоциты, гранулоциты и моноциты.
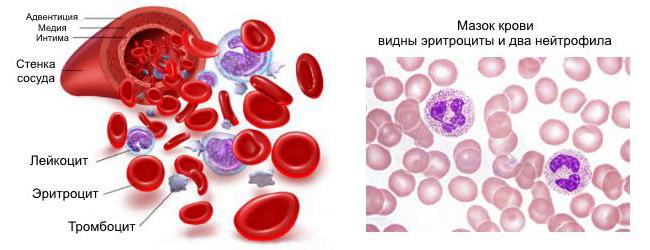
Простагландины – медиаторы воспаления, проявляющие следующую активность:
- раздражение болевых рецепторов;
- расширение сосудов;
- увеличение экссудативных процессов;
- усиление гипертермии в очаге поражения;
- ускорение передвижение лейкоцитов в патологическую зону;
- увеличение отечности.
Лейкотриены
Биологически активные вещества, относящиеся к вновь образующимся медиаторам. То есть в организме в состоянии покоя иммунной системы их количество недостаточно для немедленного ответа раздражающему фактору.
Лейкотриены провоцируют усиление проницаемости сосудистой стенки и открывают доступ лейкоцитам в зону патологии. Имеют значение в генезе воспалительной боли. Вещества способны синтезироваться во всех кровяных клетках, кроме эритроцитов, а также в адвентиции клеток легких, сосудов и тучных клетках.
В случае развития воспалительного процесса в ответ на бактерии, вирусы или аллергические факторы лейкотриены вызывают спазм бронхов, провоцируя развитие отечности. Эффект схожий с действием гистамина, однако более длительный. Орган-мишень для активных веществ – сердце. Выделяясь в большом количестве, они действуют на сердечную мышцу, замедляют коронарный кровоток и усиливают уровень воспалительной реакции.
Тромбоксаны
Эта группа активных модуляторов образуется в тканях селезенки, мозговых клетках, легких и кровяных клетках тромбоцитах. Оказывают спастическое воздействие на сосуды, усиливают процессы тромбообразования при ишемии сердца, способствуют процессам агрегации и адгезии тромбоцитов.
Биогенные амины
Первичные медиаторы воспаления – гистамин и серотонин. Вещества являются провокаторами первоначальных нарушений микроциркуляции в зоне патологии. Серотонин – нейромедиатор, который вырабатывается в тучных клетках, энтерохромаффинах и тромбоцитах.
Действие серотонина меняется в зависимости от его уровня в организме. В обычных условиях, когда количество медиатора является физиологическим, он усиливает спазмированность сосудов и повышает их тонус. При развитии воспалительных реакций количество резко увеличивается. Серотонин становится вазодилататором, повышая проницаемость сосудистой стенки и расширяя сосуды. Причем его действие в сотню раз эффективнее второго нейромедиатора биогенных аминов.

Гистамин – медиатор воспаления, имеющий разностороннее действие на сосуды и клетки. Действуя на одну группу гистаминчувствительных рецепторов, вещество расширяет артерии и угнетает передвижение лейкоцитов. При воздействии на другую – сужает вены, вызывает повышение внутрикапеллярного давления и, наоборот, стимулирует движение лейкоцитов.
Действуя на нейтрофильные рецепторы, гистамин ограничивает их функциональность, на рецепторы моноцитов – стимулирует последние. Таким образом, нейромедиатор может оказывать воспалительное противовоспалительное действие одновременно.
Сосудорасширяющий эффект гистамина усиливается под влиянием комплекса с ацетилхолином, брадикинином и серотонином.
Лизосомальные ферменты
Медиаторы иммунного воспаления вырабатываются моноцитами и гранулоцитами в месте патологического процесса в ходе стимуляции, эмиграции, фагоцитоза, повреждения и смерти клеток. Протеиназы, которые являются основным компонентом лизосомальных ферментов, обладают действием противомикробной защиты, лизируя чужеродные уничтоженные патологические микроорганизмы.
Кроме того, активные вещества способствуют повышению проницаемости сосудистых стенок, модулируют инфильтрацию лейкоцитов. В зависимости от количества выделенных ферментов, они могут усилить или ослаблять процессы миграции лейкоцитарных клеток.
Воспалительная реакция развивается и держится на протяжении долгого времени за счет того, что лизосомальные ферменты активируют систему комплемента, высвобождают цитокины и лимокины, активируют свертывание и фибринолиз.

Катионные белки
К медиаторам воспаления относятся белки, содержащиеся в нейтрофильных гранулах и имеющие высокую микробицидность. Эти вещества действуют непосредственно на чужеродную клетку, нарушая ее структурную мембрану. Это вызывает гибель патологического агента. Далее происходит процесс уничтожения и расщепления лизосомальными протеиназами.
Катионные белки способствуют высвобождению нейромедиатора гистамина, повышают проницаемость сосудов, ускоряют адгезию и миграцию лейкоцитарных клеток.
Цитокины
Это клеточные медиаторы воспаления, продуцируемые следующими клетками:
- моноцитами;
- макрофагами;
- нейтрофилами;
- лимфоцитами;
- эндотелиальными клетками.
Действуя на нейтрофилы, цитокины повышают уровень проницаемости сосудистой стенки. Также они стимулируют лейкоцитарные клетки к умерщвлению, поглощению и уничтожению чужеродные поселившихся микроорганизмов, усиливают процесс фагоцитоза.
После умерщвления патологических агентов цитокины стимулируют восстановление и пролиферацию новых клеток. Вещества взаимодействуют с представителями из своей группы медиаторов, простагландинами, нейропептидами.
Активные метаболиты кислорода
Группа свободных радикалов, которые вследствие наличия у себя непарных электронов, способны вступать во взаимосвязь с другими молекулами, принимая непосредственное участие в развитии воспалительного процесса. К метаболитам кислорода, которые входят в состав медиаторов, относятся:
- гидроксильный радикал;
- гидроперекисный радикал;
- супероксидный анион-радикал.
Источником этих активных вещества служат внешний слой арахидоновой кислоты, фагоцитозный взрыв при их стимуляции, а также окисление малых молекул.
Метаболиты кислорода повышают способность фагоцитозных клеток к уничтожению чужеродных агентов, вызывают окисление жиров, повреждение аминокислот, нуклеиновых кислот, углеводов, что усиливает сосудистую проницаемость. В качестве модуляторов метаболиты способны увеличивать воспалительные явления или оказывать противовоспалительное действие. Большое значение имеют при развитии хронических заболеваний.
Нейропептиды
К этой группе относятся кальцитонин, нейрокинин А и вещество Р. Это наиболее известные модуляторы из нейропептидов. Эффект действия веществ основывается на следующих процессах:
- привлечение нейтрофилов в очаг воспаления;
- повышение проницаемости сосудов;
- помощь при воздействии других групп нейромедиаторов на чувствительные рецепторы;
- усиление чувствительности нейтрофилов к венозному эндотелию;
- участие в формировании болевых ощущений в процессе воспалительной реакции.
Помимо всех перечисленных, к активным медиаторам также относятся ацетилхолин, адреналин и норадреналин. Ацетилхолин принимает участие в процессе формирования артериальной гиперемии, расширяет сосуды в очаге патологии.
Норадреналин и адреналин выступают в роли модуляторов воспаления, угнетая рост уровня сосудистой проницаемости.
Развитие воспалительной реакции не является нарушением со стороны организма. Наоборот, это показатель того, что иммунная система справляется с поставленными задачами.
Источник
Предпосылки и цель исследования. На долю инсульта с поражением субкортикального белого вещества (ИБВГМ) приходится до 30% всех вариантов инсульта. Механизмы повреждения и восстановления олигодендроцитов и аксонов играют центральную роль в развитии поражения и восстановлении при этих вариантах инсульта, и для всестороннего изучения этих механизмов необходима специализиро- ванная экспериментальная модель, отличающаяся от общепринятых моделей инсульта с поражением серого вещества при окклюзии крупной артерии. Недостаточное восстановление после инсульта у больных пожилого возраста указывает на наличие возможного возрас- тного влияния на процессы повреждения и восстановления, но такое влияние при ИБВГМ ранее не изучали. Методы. Развитие ИБВГМ индуцировали с помощью очаговых микроинъекций вазоконстриктора N5-(1-иминоэтил)-L-орнитина в субкортикальное белое вещество вентральнее зоны моторной коры верхних конечностей молодым (2 месяца) мышам, животным среднего (15 месяцев) возраста и старым (24 месяца) мышам. Результаты. Индукция ИБВГМ приводила к локальной гибели олигодендроцитов с бóльшим числом апоптотических клеток и бóльшему окислительному повреждению в головном мозге у старых мышей, чем у мышей молодого возраста. Повышение экс- прессии хемотаксического протеина-1 и фактора некроза опухоли α (ФНО-α) в нейронах моторной коры коррелировало с бóльшим объ- емом активации микроглии в головном мозге старых мышей через 7 дней после ИБВГМ. Через 2 месяца у старых мышей наблюдали более выраженную атрофию белого вещества головного мозга и значительную потерю кортикостриальных связей по сравнению с молодыми мышами. При проведении поведенческого тестирования выявили ухудшение моторного дефицита передних конечностей после инсульта, коррелирующее с возрастом и ухудшением функционального восстановления у старых животных в отдаленном периоде. Выводы. Возраст оказывает огромное влияние на исход после ИБВГМ, что обусловлено пролонгированной гибелью клеток и выраженным окислительным повреждением, усилением воспаления, более выраженной вторичной атрофией белого вещества и неблагоприятным поведенческим эффектом, которые наблюдали у старых животных по сравнению с молодыми животными.
На долю инсульта с поражением субкортикального белого вещества (ИБВГМ) приходится до 30% всех подтипов инсульта [1, 2] с разрушительными клиническими последствиями. Эти инфаркты приводят к развитию очагового дефицита с неполным восстановлением и являются второй по значимости причиной деменции [3, 4]. Несмотря на обилие литературы, описывающей доклинические исследования, и использованием моделей инсульта с поражением серого вещества при окклюзии крупной артерии у животных, в настоящее время проведено лишь несколько исследований, посвященных изучению механизмов репарации и восстановления белого вещества, что может быть обусловлено отсутствием эффективных моделей ИБВГМ у животных.
Кроме того, большинство исследований с использованием модели ишемического инсульта были выполнены на молодых животных. Ишемический инсульт развивается в основном у людей старшего возраста, и восстановление у пожилых пациентов происходит хуже, чем у пациентов молодого возраста [5, 6].
Существуют различия в нейрофизиологии между молодыми и старыми животными, а патофизиологические особенности ишемии головного мозга изменяются на протяжении всей жизни [7, 8]. Кроме того, эффективность ремиелинизации при поражении белого вещества с возрастом уменьшается [9]. Таким образом, в исследованиях с использованием молодых животных для моделирования ишемического инсульта невозможно полностью оценить влияние ишемии на ткань головного мозга в пожилом возрасте. Недавно мы разработали модель субкортикального инсульта с поражением белого вещества в моторной зоне верхних конечностей у мышей, в которой смоделировали многие особенности этого заболевания у людей. В этой модели индуцированная очаговая ишемия приводит к гибели клеток и разрушению белого вещества в ядре инфаркта и частичному разрушению миелина, гибели аксонов и олигодендроцитов в периинфарктной зоне [10, 11]. В настоящем исследовании эту модель использовали для изучения различий в особенностях повреждения и функциональных исходах после ишемии белого вещества головного мозга между молодыми и старыми животными.
МЕТОДЫ
Мыши
Все эксперименты проводили в соответствии с рекомендациями Национальных институтов здравоохранения по защите животных, их проведение было одобрено Комитетом по исследованиям на животных Калифорнийского университета в Лос-Анджелесе.
В данном исследовании использовали 32 мыши линии C57/BL6 в возрасте 3 месяцев (Jackson), 24 мыши линии C57/BL в возрасте 15 месяцев и 28 мышей линии C57/BL в возрасте 24 месяцев (National Institute on Aging). Группы животных (n=6–8 на группу) наблюдали в 1-й, 2, 7 и 56-й дни после инсульта или псевдовмешательства.
Инсульт с поражением белого вещества
Развитие инсульта с поражением белого вещества индуцировали способом, описанным ранее [10], с некоторыми модификациями. Вазоконстриктор N5-(1-иминоэтил)-L-орнитин (27 мг/мл в стерильном физиологическом растворе; Millipore) вводили через микропипетки в кору под углом 45° с помощью задне-нижнего и передне-верхнего доступов в белое вещество моторной зоны верхних конечностей. Эта процедура обеспечивает выраженное сужение сосудов в месте инъекции, что приводит к развитию очага инфаркта [10, 12]. Выполнили три инъекции (каждая по 200 нл раствора N5-(1-иминоэтил)-L-орнитина) в следующих координатах: A/P: +0,5, 0, -0,5; M/L: -0,96 (для всех 3 инъекций); и D/V: -1,2, -1,15, -1,1. Пипетку оставляли в месте инъекции в течение 5 минут после вмешательства для обеспечения надлежащей диффузии. Животным контрольной группы выполняли псевдовмешательство, в ходе которого проводили краниотомию, как и животным опытной группы, но без последующих инъекций.
Обработка ткани, микроскопия и стереотаксис
Методы обработки вещества головного мозга были описаны ранее [10, 11] (см. подробные методы окрашивания в дополнительных данных on-line). Получали изображения высокого разрешения и конфокальные серии срезов по оси Z (конфокальная система Nikon C2). Области измерения ядра инфаркта, Iba-1-положительных клеток, нейтрофилов и клеточных ядер, меченных введением концевой метки dUTP с использованием терминальной дезоксинуклеотидилтрансферазы, стереотаксически количественно оценивали с помощью оптического фракционирующего зонда и программного обеспечения для количественной оценки нейроанатомических структур (Stereoinvestigator, MBF Bioscience; Виллистон, Вермонт). Изображения стриатума в аксиальной плоскости, окрашенные NF200, количественно оценивали по профилям интенсивности, созданным с помощью программного обеспечения ImageJ (Национальные институты здравоохранения).
Поведение
Походку и функции передних конечностей оценивали с помощью теста ходьбы по сетке и теста pasta matrix task, как описано ранее [13–17] (см. подробные методы оценки поведения в дополнительных данных on-line).
Статистический анализ
Мышей произвольно распределили по группам лечения. Результаты тестов анализировали при ослеплении относительно наличия инсульта и возрас…
- Bamford J., Sandercock P., Dennis M., Burn J., Warlow C. Classification and natural history of clinically identifiable subtypes of cerebral infarction. Lancet. 1991;337:1521–1526.
- Schneider A.T., Kissela B., Woo D., Kleindorfer D., Alwell K., Miller R., et al. Ischemic stroke subtypes: a population-based study of incidence rates among blacks and whites. Stroke. 2004;35:1552–1556.
- Chui H.C. Subcortical ischemic vascular dementia. Neurol Clin. 2007;25:717–40, vi. Srikanth V., Beare R., Blizzard L., Phan T., Stapleton J., Chen J., et al. Cerebral white matter lesions, gait, and the risk of incident falls: a prospective population-based study. Stroke. 2009;40: 175–180.
- Bousser M.G. Stroke prevention: an update. Front Med. 2012;6:22–34.
- Ovbiagele B., Nguyen-Huynh M.N. Stroke epidemiology: advancing our understanding of disease mechanism and therapy. Neurotherapeutics. 2011;8:319–329.
- Li N., Kong X., Ye R., Yang Q., Han J., Xiong L. Age-related differences in experimental stroke: possible involvement of mitochondrial dysfunction and oxidative damage. Rejuvenation Res. 2011;14:261–273.
- Popa-Wagner A., Badan I., Walker L., Groppa S., Patrana N., Kessler C. Accelerated infarct development, cytogenesis and apoptosis following transient cerebral ischemia in aged rats. Acta Neuropathol. 2007;113:277–293.
- Sim F.J., Zhao C., Penderis J., Franklin R.J. The age-related decrease in CNS remyelination efficiency is attributable to an impairment of both oligodendrocyte progenitor recruitment and differentiation. J Neurosci. 2002;22:2451–2459.
- Hinman J.D., Rasband M.N., Carmichael S.T. Remodeling of the axon initial segment after focal cortical and white matter stroke. Stroke. 2013;44:182–189.
- Sozmen E.G., Kolekar A., Havton L.A., Carmichael S.T. A white matter stroke model in the mouse: axonal damage, progenitor responses and MRI correlates. J Neurosci Methods. 2009;180:261–272.
- Horie N., Maag A.L., Hamilton S.A., Shichinohe H., Bliss T.M., Steinberg G.K. Mouse model of focal cerebral ischemia using endothelin-1. J Neurosci Methods. 2008;173:286–290.
- Tennant K.A., Adkins D.L., Scalco M.D., Donlan N.A., Asay A.L., Thomas N., et al. Skill learning induced plasticity of motor cortical representations is time and age-dependent. Neurobiol Learn Mem. 2012;98:291–302.
- Tennant K.A., Jones T.A. Sensorimotor behavioral effects of endothelin-1 induced small cortical infarcts in C57BL/6 mice. J Neurosci Methods. 2009;181:18–26.
- Clarkson A.N., Huang B.S., Macisaac S.E., Mody I., Carmichael S.T. Reducing excessive GABA-mediated tonic inhibition promotes functional recovery after stroke. Nature. 2010;468:305–309.
- Clarkson A.N., Overman J.J., Zhong S., Mueller R., Lynch G., Carmichael S.T. AMPA receptor-induced local brain-derived neurotrophic factor signaling mediates motor recovery after stroke. J Neurosci. 2011;31:3766–3775.
- Overman J.J., Clarkson A.N., Wanner I.B., Overman W.T., Eckstein I., Maguire J.L., et al. A role for ephrin-A5 in axonal sprouting, recovery, and activity-dependent plasticity after stroke. Proc Natl Acad Sci USA. 2012;109:E2230–E2239.
- Reiner A., Hart N.M., Lei W., Deng Y. Corticostriatal projection neurons — dichotomous types and dichotomous functions. Front Neuroanat. 2010;4:142.
- Teskey G.C., Flynn C., Goertzen C.D., Monfils M.H., Young N.A. Cortical stimulation improves skilled forelimb use following a focal ischemic infarct in the rat. Neurol Res. 2003;25: 794–800.
- Chiken S., Tokuno H. Impairment of skilled forelimb use after ablation of striatal interneurons expressing substance P receptors in rats: an analysis using a pasta matrix reaching task. Exp Brain Res. 2005;162:532–536.
- Baltan S. Ischemic injury to white matter: an age-dependent process. Neuroscientist. 2009;15:126–133.
- Lipton P. Ischemic cell death in brain neurons. Physiol Rev. 1999;79:1431–1568.
- Tian L., Cai Q., Wei H. Alterations of antioxidant enzymes and oxidative damage to macromolecules in different organs of rats during aging. Free Radic Biol Med. 1998;24:1477–1484.
- Kwong L.K., Sohal R.S. Age-related changes in activities of mitochondrial electron transport complexes in various tissues of the mouse. Arch Biochem Biophys. 2000;373:16–22.
- Tekkök S.B., Goldberg M.P. Ampa/kainate receptor activation mediates hypoxic oligodendrocyte death and axonal injury in cerebral white matter. J Neurosci. 2001;21:4237–4248.
- Edgar J.M., Nave K.A. The role of CNS glia in preserving axon function. Curr Opin Neurobiol. 2009;19:498–504.
- Matute C., Domercq M., Pérez-Samartín A., Ransom B.R. Protecting white matter from stroke injury. Stroke. 2013;44:1204–1211.
- Flügel A., Hager G., Horvat A., Spitzer C., Singer G.M., Graeber M.B., et al. Neuronal MCP-1 expression in response to remote nerve injury. J Cereb Blood Flow Metab. 2001;21:69–76.
- Yoshizato K., Kuratsu J., Takeshima H., Nishi T., Yoshimura T., Ushio Y. Increased monocyte chemoattractant protein-1 expression by tumor necrosis factor-alpha can mediate macrophage infiltration in gliomas. Int J Oncol. 1996;8:493–497.
- Riches D.W., Chan E.D., Winston B.W. TNF-alpha-induced regulation and signalling in macrophages. Immunobiology. 1996;195:
- 477–490.
- Selmaj K.W., Raine C.S. Tumor necrosis factor mediates myelin and oligodendrocyte damage in vitro. Ann Neurol. 1988;23:339–346.
- Smith R.M., McCarthy J., Sack M.N. TNF alpha is required for hypoxia-mediated right ventricular hypertrophy. Mol Cell Biochem. 2001;219:139–143.
- Lambertsen K.L., Biber K., Finsen B. Inflammatory cytokines in experimental and human stroke. J Cereb Blood Flow Metab. 2012;32:1677–1698.
- Buchanan J.B., Sparkman N.L., Chen J., Johnson R.W. Cognitive and neuroinflammatory consequences of mild repeated stress are exacerbated in aged mice. Psychoneuroendocrinology. 2008;33: 755–765.
- Henry C.J., Huang Y., Wynne A.M., Godbout J.P. Peripheral lipopolysaccharide (LPS) challenge promotes microglial hyperactivity in aged mice that is associated with exaggerated induction of both pro-inflammatory IL-1beta and anti-inflammatory IL-10 cytokines. Brain Behav Immun. 2009;23:309–317.
- Carmichael S.T. Cellular and molecular mechanisms of neural repair after stroke: making waves. Ann Neurol. 2006;59:735–742.
- Carmichael S.T., Wei L., Rovainen C.M., Woolsey T.A. New patterns of intracortical projections after focal cortical stroke. Neurobiol Dis. 2001;8:910–922.
- Li S., Overman J.J., Katsman D., Kozlov S.V., Donnelly C.J., Twiss J.L., et al. An age-related sprouting transcriptome provides molecular control of axonal sprouting after stroke. Nat Neurosci. 2010;13:1496–1504.
Источник
