Матриксные металлопротеиназы и инфаркт миокарда
1. Барбухатти К. О., Антипов Г Н., Порханов В. А. Отдаленные результаты хирургического лечения постинфарктных аневризм левого желудочка // Кубан. науч. мед. вестн. – 2012. – № 1. – С. 12-15 [Barbuhatti KO, Antipov GN, Porhanov VA Otdalennye rezul ’taty hirurgicheskogo lecheniya postinfarktnyh anevrizm levogo zheludochka. Kubanskij nauchnyj medicinskij vestnik. 2012;1:12-15. (In Russ)].
2. Белов Ю. В., Вараксин В. А. Структурно-геометрические изменения миокарда и особенности центральной гемодинамики при постинфарктном ремоделировании левого желудочка // Кардиология. – 2003. – № 1. – С. 1923 [Belov YUV, Varaksin VA Prediction of Left Ventricular Remodeling After Acute Myocardial Infarction. Kardiologiya. 2003;1:19-23. (In Russ)].
3. Бершова Т. В. Роль матриксных металлопротеиназ в процессах ремоделирования сердца у детей с рестриктивной кардиомиопатией // Вопр. соврем. педиатрии. – 2009. – Т. 8. – № 5. – С. 36-39 [Bershova TV The role of matrix metalloproteinases in processes of heart re-modeling in children with restrictive cardiomyopathy. Voprosy sovremennoj pediatrii. 2009;8(5):36-39. (In Russ)].
4. Блеткин А. Н., Борисов И. А., Симоненко В. Б., Савичев Д. Д. Постинфарктное ремоделирование и аневризма левого желудочка // Клин. мед. – 2007. – № 6. – С. 8-14 [Bletkin AN,. Borisov IA, Simonenko VB, Savichev DD. Remodeling of the left ventricle in complicated forms of ischemic heart disease. Klinicheskaya medicina. 2007;6:8-14. (In Russ)].
5. Говорин А. В., Рацина Е. В., Соколова Н. А. Показатели матриксной металлопротеиназы-9 и тканевого ингибитора металлопротеиназ-1 при остром трансмуральном инфаркте миокарда, осложненном аневризмой // Росс. кардиолог. журн. – 2014. – № 7. – С. 87-90 [Govorin NV, Ratsina EV, Sokolova NA Ganges in matrix metalloproteinases and their tissue inhibitors in different forms of ischemic heart disease. Rossijskij kardiologicheskijzhurnal. 2014;7:87-90. (In Russ)].
6. Головкин А. С., Матвеева В. Г., Григорьев Е. В. и др. Послеоперационная динамика уровня матриксных металлопротеиназ у пациентов с осложнениями коронарного шунтирования // Кардиология. – 2012. – Т. 52. – № 9. – С. 4-7 [Golovkin AS, Matveeva VG, Grigoriev EV, et al. Postoperative dynamic changes in matrix metalloproteinase levels in patients with coronary artery bypass graft procedure complications. Kardiologiya. 2012;52(9):4-7. (In Russ)].
7. Григорьева И. Н., Рагино Ю. В. Роль матриксных металлопротеиназ и некоторых цитокинов в развитии фиброза поджелудочной железы // Сучасна Гастроентерологiя. – 2013. – № 1. – С. 21-24. [Grigor’eva IN, Ragino YUV The role of matrix metalloproteinases and some cytokines in the development ofpancreas fibrosis. Suchasna Gastroenterologiya. 2013;1:21-24 (In Russ)].
8. Кухарчик Г. А., Нестерова Н. Н., Гайковая Л. Б. и др. Содержание матриксных металлопротеиназ и их тканевых ингибиторов иремоделирование миокарда у пациентов, перенесших острый коронарный синдром с подъемом сегмента ST // Здоровье – основа человеческого потенциала: проблемы и пути их решения. – 2012. – Т. 7. – № 1. – С. 416-420 [Kuharchik GA, Nesterova NN, Gajkovaya LB et al. Soderzhanie matriksnyh metalloproteinaz i ih tkanevyh ingibitorov iremodelirovanie miokarda u pacientov, perenesshih ostryj koronarnyj sindrom spod’emom segmenta ST. Zdorov’e – osnova chelovecheskogo potenciala – problemy iputi ih resheniya. 2012;7(1):416-420. (in Russ)].
9. Лесниченко И. Ф., Грицаев С. В., Капустин С. И. Матриксные металлопротеиназы: характеристика, роль в лейкозогенезе и прогностическое значение // Вопр. онкол. – 2011. – Т 57. – № 3. – С. 286-294 [Lesnichenko IF, Gritsaev SV, Kapustin SI. Matrix metalloproteinases-2 and -9 in plasma of bone marrow aspirates of patients with acute myeloid leukemia. Voprosy onkologii. 2011;57(3):286-294 (In Russ)].
10. Лупач Н. М., Хлудеева Е. А., Потапов В. Н., Лукьянов П. А. Матриксные металлопротеиназы, оксидантный статус и дисфункция эндотелия с гиперхолестринемией и у пациентов с различными формами ишемической болезни сердца // Тихоокеан. мед. журн. – 2010. – № 4. – С. 71-74 [Lupach NM, Khludeeva EA, Potapov VN, Lukianov PA. Matrix Metalloproteinases, Oxidative Status and Endothelium Dysfunction in Persons with Hypercholesterolemia and in Patients with Various Forms of Ischemic Heart Disease. Pacific Medical Journal. 2010;4:71-74 (In Russ)].
11. Маркелова Е. В., Здор В. В., Романчук А. Л., Бирко 0. Н. Матриксные металлопротеиназы их взаимосвязь с системой цитокинов, диагностический и прогностический потенциал // Иммунопатол., аллергол., инфектол. – 2016. – № 2. – C. 11-22 [Markelova EV, Zdor VV, Romanchuk AL, Birko ON. Matrix metalloproteinases: relationship with cytokines system, diagnostic and prognostic potential. Immunopathology, Allergology, Infectology. 2016;2:11-22. doi: 10.14427/jipai.2016.2.11 (In Russ)].
12. Нестерова Н. Н., Кухарчик Г. А., Сичинава Л. Б. и др. Дисбаланс в системе «матриксные металлопротеиназы – тканевой ингибитор матриксных металлопротеиназ» и характер течения постинфарктного ремоделирования миокарда левого желудочка // Здоровье – основа человеческого потенциала: проблемы и пути их решения. – 2013. – Т. 8. – № 1. – С. 420-424 [Nesterova N, Kukcharchik G, Sichinava L, et al. Disbalance in the «matrix metalloproteinase – tissue inhibitor of matrix metalloproteinases» and the character of postinfarction left ventricular remodeling. Zdorov’e – osnova chelovecheskogo potenciala – problemy i puti ih resheniya. 2013;8(1):420-424 (In Russ)].
13. Овчинников А. Г., Свирида О. Н., Азизова А. Г., Агеев Ф. Т. Состояние баланса коллагена у пациентов с сердечной недостаточностью и нормальной фракцией выброса в зависимости от типа наполнения левого желудочка и соотношения Е/е // Сердечная недостаточность. – 2011. – Т. 12. – № 3. – С. 127-135 [Ovchinnikov AG, Svirida ON, Azizova AG, Ageev FT. Balance of collagen in patients with heart failure and normal ejection fraction, depending on the type of left ventricularfilling and E/e’ ratio. Zhurnal Serdechnaya nedostatochnost’. 2011;12(3):127-135. doi: 10.18087/rhfj.2011.3.1539 (In Russ)].
14. Печерина Т. Б., Груздева О. В., Кашталап В. В. и др. Роль матриксных металлопротеиназ в оценке прогноза у больных инфарктом миокарда с подъемом сегмента ST в период пребывания в стационаре // Кардиология. – 2013. – № 6. – С. 18-24 [Pecherina T.B., Gruzdeva O.V., Kashtalap V.V., et al. The role of matrix metalloproteinases in assessment of prognosis in patients with ST-elevation myocardial infarction during hospital stay. Kardiologija. 2013;6:18-24 (In Russ)].
15. Рогова Л. Н., Шестернина Н. В., Замечник Т. В., Фастова И. А. Матриксные металлопротеиназы, их роль в физиологических и патологических процессах (обзор) // Вестн. новых мед. технол. – 2011. – Т. XVIII. – № 2. – С. 86-89 [Rogova LN, Shesternina NV, Zamechnik TV, Fastova A. Matrix metalloproteinases, their role in physiological and pathological processes (Review). Vestnik novyh medicinskih tekhnologij. 2011;XVIII(2):86-89. (In Russ)].
16. Скромная А. В. Влияние успешного стентирования коронарных артерий у больных с острым коронарным синдромом и хронической ишемической болезнью сердца на активность процессов протеолиза // Медицина неотложных состояний. – 2013. – № 2(49). – С. 165-169 [Skromnaya AV. The influence of successful coronary arteries stenting in patients with acute coronary syndrome and ischemic heart disease on proteolysisprocesses activity. Medicina neotlozhnyh sostoyanij. 2013;2(49):165-169 (In Russ)].
17. Соколова Н. Ю., Бакулина А. В., Магомедова Н.М. и др. Предикторы быстрого прогрессирования каротидного атеросклероза у больных стабильной ишемической болезнью сердца после операций реваскуляризации миокарда // Креативная кардиол. – 2017. – Т. 11. – № 3. – С. 222-234 [Sokolova NYu, Bakulina AV, Magomedova NM, et al. Predictors of rapid progression of carotid atherosclerosis in patients with stable coronary artery disease after myocardial revascularization. Kreativnayakardiologiya. 2017;11(3):222-234. doi: 10.24022/1997-3187-2017-11-3-222-234 (In Russ).].
18. Тепляков А. Т., Андриянова А. В., Пушникова Е. Ю. и др. Тканевой ингибитор матриксных металлопротеиназ-1 (ТИМП-1) как независимый маркер ишемического ремоделирования миокарда при хронической недостаточности // Сибир. мед. журн. – 2014. – Т. 29. – № 2. – С. 28-34 [Teplyakov AT, Andriyanova AV, Pushnikova EY Tissue inhibitor of metalloproteinase-1 (TIMP-1) as an independent marker of ischemic myocardial remodeling in heart failure Sibirskij medicinskij zhurnal. 2014;29(2):28-34 (In Russ)].
19. Труфанов К. В., Ракита Д. Р., Вулех В. М. и др. Прогностическое значение матриксной металлопротеиназы-9 для развития ремоделирования левого желудочка в госпитальном периоде острого инфаркта миокарда // Росс. медико-биолог. вестн. им. акад. И. П. Павлова. – 2012. – № 4. – С. 87-91 [Trufanov KV Rakita DR, Vulekh VM, et al. Prognostic value of matrix metalloproteinase-9 in the course of left ventricular remodeling during hospital period of acute myocardial infarction. Rossijskij mediko-biologicheskij vestnikimeni akademika I.P. Pavlova. 2012;4:87- 91 (In Russ).].
20. Турна А. А. Диагностическое значение активности матриксной металлопротеиназы 9 (желатиназы В) при остром коронарном синдроме // Артериальная гипертензия. – 2010. – Т. 16. – № 6. – С. 582-586 [Tourna AA Diagnostic significance of the matrix metalloproteinase 9 activity (gelatinase B) in acute coronary syndrome. Arterial’naya gipertenziya. 2010;16(6):582-586 (In Russ)].
21. Шляхто Е. В. Кардиопротекция: фундаментальные и клинические аспекты. – СПб.: НП-Принт, 2013. – 399 с. [Shlyahto EV Kardioprotekciya: fundamental’nye i klinicheskie aspekty. Saint-Petersburg,NP-Print,2013;399 (In Russ)].
22. Ярмолинская М. И., Молотков А. С., Денисова В. М. Матриксные металлопротеиназы и ингибиторы: классификация, механизм действия // Журн. акушерства и жен. болезней. – 2012. – Т. 61. – № 1. – С. 113-125 [Yarmolinskaya MI, Molotkov AS, Denisova VM Matrix metalloproteinases and inhibitors: classification, mechanism of action. Zhurnal akusherstva i zhenskih boleznej. 2012;61(1):113-125 (In Russ)].
23. Apple FS, Smith SW, Pearce LA, Murakami MM. Assessment of the multiple-biomarker approach for diagnosis of myocardial infarction in patients presenting with symptoms suggestive of acute coronary syndrome. Clin Chem. 2009:55:93-100. doi: 10.1373/clinchem.2008.102905.
24. Apple KA, Yarbrough WM, Mukherjee R et al. Selective targeting of matrix metalloproteinase inhibition in post-infarction myocardial remodeling. Journal of Cardiovascular Pharmacology. 2006;47:228-235 doi: 10.1097/01.fjc.0000200989.23987.b8.
25. Bannikov GA, Karelina TV, Collier IE et al. Substrate binding of gelatinase B induces its enzymatic activity in the presence of intact propeptide. J Biol Chem. 2002;277;16022-16027 doi: 10.1074/jbc.M110931200.
26. Bellayr IH, Mu X, Li Y. Biochemical insights into the role of matrix metalloproteinases in regeneration: challenges and recent developments. Future Med Chem 2009;1(6):1095-1111. doi: 10.4155/fmc.09.83.
27. Boorsma CE, Draijer C, Melgert BN. Macrophage heterogeneity in respiratory diseases. Mediators Inflamm. 2013;769214. doi: 10.1155/2013/769214.
28. Brew K, Nagase H. The tissue inhibitors of metalloproteinases (DMPs): An ancient family with structural and functional diversity. Biochim Biophys Acta.2010;1803(1):55-71. doi: 10.1016/j.bbamcr.
29. Cavusoglu E, Ruwende C, Chopra Vet al. Tissue inhibitor of metalloproteinase-1 (TIMP-1) is an independent predictor of all-cause mortality, cardiac mortality, and myocardial infarction. Am. Heart J. 2006;151(5):1101-1108. doi: 10.1016/j.ahj.2006.02.029.
30. Cerisano G, Buonamici P, Valenti R et al. Early shortterm doxycycline therapy in patients with acute myocardial infarction and left ventricular dysfunction to prevent the ominous progression to adverse remodeling: the TIPTOP trial. Eur Heart J 2013;35:184-191.
31. Chang C, Werb Z. The many faces of metalloproteases: cell growth, invasion, angiogenesis and metastasis. Trends Cell Biol. 2001;11:37-43. doi: 10.1016/s0962-8924(01)82222-4.
32. Chakraborti S, Mandal M, Das S et al. Regulation of matrix metalloproteinases: an overview. Mol Cell Biochem.2003;253(1-2):269-285. doi: 10.1023/A:1026028303196.
33. Cheung PY, Sawicki G, Wozniak M et al. Matrix metalloproteinase-2 contributes to ischemia-reperfusion injury in the heart. Circulation.2000;101:1833-1839. doi: 10.1161/01.CIR.101.15.1833.
34. Creemers EE, Davis JN, Parkhurst AM. Deficiency of NMP-1 exacerbates LV remodeling after myocardial infarction in mice. Am J Physiol Heart Circ Physiol. 2003;284(1):H364- 71. doi: 10.1152/ajpheart.00511.2002.
35. Creemers EEJM, Cleutjens JPM, Smits JFM et al. Matrix metalloproteinase inhibition after myocardial infarction: a new approach to prevent heart failure? Circ Res.2001;89:201-210. doi: 10.1161/hh1501.094396.
36. Ducharme A, Frantz S, Aikawa M et al. Targeted deletion of matrix metalloproteinase-9 attenuates left ventricular enlargement and collagen accumulation after experimental myocardial infarction. J Clin Invest. 2000;106:55-62. doi: 10.1172/JCI8768.
37. Egeblad M, Werb N. New functions for the matrix metalloproteinases in cancer progression, Nat Rev Cancer.2002;2(3):161-174. doi: 10.1038/nrc745.
38. Halade GV, Jin YF, Lindsey ML. Matrix metalloproteinase (MMP)-9: a proximal biomarker for cardiac remodeling and a distal biomarker for inflammation. Pharmacol Ther 2013;139:32-40. doi: 10.1016/j.pharmthera.2013.03.009.
39. Ikeda U, Shimada K. Matrix metalloproteinases and coronary artery diseases. Clin Cardiol 2003;26:55-59. doi: 10.1002/clc.4960260203.
40. Iyer RP, Jung M, Lindsey ML. MMP-9 signaling in the left ventricle following myocardial infarction. Am J Physiol Heart Circ Physiol. 2016;311(1):H190-8.
41. Iyer RP, Patterson NL, Zouein FA. Early matrix metalloproteinase-12 inhibition worsens post-myocardial infarction cardiac dysfunction by delaying inflammation resolution. International journal of cardiology. 2015;185:198-208. doi:10.1016/j.ijcard.2015.03.054.
42. Jugdutt BI. Ventricular remodeling after infarction and the extracellular collagen matrix: when is enough enough? Circulation. 2003;108(11):1395-1403. doi: 10.1161/01.CIR.0000085658.98621.49.
43. Kandasamy AD, Chow AK, Ali MA, Schulz R. Matrix metalloproteinase-2 and myocardial oxidative stress injury: beyond the matrix. Cardiovasc Res. 2010;85(3):413-23. doi: 10.1093/cvr/cvp268.
44. Kelly D, Khan SQ, Thompson M et al. Plasma tissue inhibitor of metalloproteinase-1 and matrix metalloproteinase-9: novel indicators of left ventricular remodelling and prognosis after acute myocardial infarction. European Heart Journal. 2008;29(17):2116-2124. doi: 10.1093/eurheartj/ehn315.
45. Lacraz S, Nicod LP, Chicheportiche R et al. Il-10 inhibits metalloproteinase and stimulates Timp-1 production in human mononuclear phagocytes. Journal of Clinical Investigation. 1995;96(5):2304-2310. doi: 10.1172/JCI118286.
46. Lalu MM, Pasini E, Schulze CJ. Ischaemia-reperfusion injury activates matrix metalloproteinases in the human heart. European Heart Journal. 2005;26:27-35. doi: 10.1093/ eurheartj/ehi007.
47. Li MJ, Huang CX, Okello E et al. Treatment with spironolactone for 24 weeks decreases the level of matrix metalloproteinases and improves cardiac function in patients with chronic heart failure of ischemic etiology. Can J Cardiol. 2009;25(9):523-526. doi: 10.1016/S0828-282X(09)70138.
48. Leco KJ, Apte SS, Taniguchi GT. Murine tissue inhibitor of metalloproteinase-4 (TIMP-4): cDNA isolation and expression in adult mouse tissues. FEBS Lett. 1997;401 (2-3):213-217. doi: 10.1016/S0014-5793(96)01474-3.
49. Lindsey M, Wedin K, Brown MD. Matrix-dependent mechanism of neutrophil-mediated release and activation of matrix metalloproteinase 9 in myocardial ischemia reperfusion. Circulation. 2001;103:2181-2187. doi: 10.1161/01.CIR.103.17.2181.
50. Lindsey ML, Zamilpa R. Temporal and spatial expression of matrix metalloproteinases and tissue inhibitors of metalloproteinases following myocardial infarction. Cardiovasc. Ther. 2012;30:31-41. doi: 10.1111/j.1755-5922.2010.00207.x.
51. Lijnen HR. Plasmin and matrix metalloproteinases in vascular remodeling. Thromb Haemost. 2001;86:324-333.
52. Newby AC. Dual role of matrix metalloproteinases (matrixins) in intimal thickening and atherosclerotic plaque rupture. Physiological Reviews. 2005;85:1-31. doi: 10.1152/physrev.00048.2003.
53. Onal IK, Altun B, Onal ED et al. Serum levels of ММП-9 and TIMP-1 in primary hypertension and effect of antihypertensive treatment. Eur J Intern Med 2009 Jul 28;20(4):369-372. doi: 10.1016/j.ejim.2008.10.003.
54. Pauschinger M, Rutschow S, Chandrasekharan K et al. Carvedilol improves left ventricular function in murine coxsackievirus-induced acute myocarditis association with reduced myocardial interleukin-1beta and MMP-8 expression and a modulated immune response. Eur J Heart Fail. 2005;7:444-452. doi: 10.1371/journal.pone.0041047.54.
55. Pfeffer MA, Pfeffer JM, Steinberg C et al. Survival after an experimental myocardial infarction: beneficial effects of long-term therapy with captopril. Circulation. 1985;72(2):406-412.
56. Radauceanu A, Ducki C, Virion JM et al. Extracellular matrix turnover and inflammatory markers independently predict functional status and outcome in chronic heart failure. J Card Fail 2008;14:467-474. doi: 10.1371/journal.pone.0052125.
57. Salmela MT, Karjalainen-Lindsberg ML, Puolakkainen P et al. Upregulation and differential expression of matrilysin (MMP-7) and metalloelastase (MMP-12) and their inhibitors TIMP-1 and TIMP-3 in Barrett’s oesophageal adenocarcinoma. Br J Cancer. 2001;85(3):383-392 doi: 10.1054/bjoc.2001.1929.
58. Schonherr E, Schaefer L, O’Connell BC, Kresse H. Matrix metalloproteinase expression by endothelial cells in collagen lattices changes during co-culture with fibroblasts and upon induction of decorin expression. J Cell Physiol. 2001;187:37-47. doi: 10.1002/1097-4652(2001)9999:9999<::AID-JCP1048>3.0.CO;2-W.
59. Spinale FG. Myocardial matrix remodeling and the matrix metalloproteinases: influence on cardiac form and function. Physiologycal Reviews. 2007;87:1285-1342. doi: 10.1152/physrev.00012.2007.
60. Strongin AY. Proteolytic and non-proteolytic roles of membrane type-1 matrix metalloproteinase in malignancy. Biochim Biophys Acta.2010;1803:133-141. doi: 10.1016/j.bbamcr.2009.04.009.
61. Sundstrom J, Evans JS, Benjamin EJ et al. Relations ofplasma total TIMP-1 levels to cardiovascular risk factors and echocardiographic measures: the Framingham heart study. European Heart Journal. 2004;25:1509-1516. doi: 10.1161/01.CIR.0000129318.79570.84.
62. Tyagi SC. Proteinases and myocardial extracellular matrix turnover. Mol Cell Biochem. 1997;168:1-12. doi:10.1023/A:1006850903242.
63. Davy Vanhoutte D, Schellings M, Pinto Y et al. Relevance of matrix metalloproteinases and their inhibitors after myocardial infarction: a temporal and spatial window. Cardiovascular Research. 2006;69(3):604-613. doi: 10.1016/j.cardiores.2005.10.002.
64. Visse R, Nagase H. Matrix metalloproteinases and tissue inhibitors of metalloproteinases: structure, function, and biochemistry. Circ Res. 2003:92:827-839. doi: 10.1161/01.RES.0000070112.80711.3D.
65. Webb CS, Bonnema DD, Ahmed SH et al. Specific temporal profile of matrix metalloproteinase release occurs in patients after myocardial infarction relation to left ventricular remodeling / C. Webb [et al.]. Circulation. 2006;114:1020-1027. doi: 10.1161/CIRCULATIONAHA.105.600353.
66. Weir RA, Clements S, Steedman T et al. Plasma TIMP-4 predicts left ventricular remodeling after acute myocardial infarction. Journal of Cardiac Failure. 2011;17:465-471. doi: 10.1016/j.cardfail.2011.02.002.
67. Yabluchanskiy A, Ma Y, Chiao YA. Matrix metalloproteinase-9 deletion blunts inflammation and facilitates scar formation post-myocardial infarction in the aging left ventricle. Circulation. 2013;128:A15285.
68. Yasuda S; Miyazaki, S Kinoshita H et al. Enhanced cardiac production of matrix metalloproteinase-2 and -9 and its attenuation associated with pravastatin treatment in patients with acute myocardial infarction. Clin Sci (Lond). 2007;112:43-49. doi: 10.1042/CS20060110.
69. Yamamoto D, Takai S, Miyazaki M. Inhibitory profiles of captopril on matrix metalloproteinase-9 activity. Eur J Pharmacol.2008;588(2-3):277-279. doi: 10.1016/j.ejphar.2008.04.031.
Источник
В статье представлены результаты оригинального исследования, посвященного оценке связи концентрации матриксных металлопротеиназ в сыворотке крови с показателями гликемического статуса больных инфарктом миокарда в зависимости от наличия сахарного диабета 2 типа.
Несмотря на то, что за последние несколько лет в большинстве развитых стран отмечается снижение смертности и инвалидизации от сердечно-сосудистых заболеваний (ССЗ), их вклад в статистику заболеваемости остается превалирующим [1]. Известно, что сахарный диабет 2 типа (CД 2) ассоциируется с высоким сердечно-сосудистым риском: инфаркта миокарда (ИМ), инсульта и внезапной сердечной смерти [2, 3]. Более того, около 20–25% пациентов с острым коронарным синдромом (ОКС) имеют ранее или впервые выявленный СД 2 [4]. Пациенты с ОКС в сочетании с СД 2 имеют более высокий риск неблагоприятных исходов, таких как смерть (8,5% против 5,4%), рецидивирующий ИМ или сердечная недостаточность как в раннем, так и в отдаленном периоде наблюдения. Кроме того, в ряде ранее проведенных исследований определяется высокая концентрация биологических маркеров (адипонектина, тропонина, C-реактивного белка, матриксных металлопротеиназ (MMП)-1, -3, -9, N-концевого прогормона натрийуретического пептида B-типа (NT-proBNP) и др.), а также снижение активности тканевого ингибитора матриксных металлопротеиназ-1 (ТИМП-1) у пациентов с ОКС в сочетании с СД 2 [5].
Использование новых биологических маркеров в диагностике и лечении острых и хронических форм ишемической болезни сердца (ИБС) активно изучается, а данные, полученные в ходе исследований, позволяют расширить понимание тонких механизмов патофизиологии ССЗ. Однако возможности клинического использования новых инструментов ограничены. С учетом высокого риска развития осложнений в группе пациентов с СД 2 актуален поиск новых терапевтических стратегий, направленных на ограничение воспаления в стенке сосудов и снижение уровней воспалительных маркеров, а также ММП в сыворотке крови. Однако до сих пор отсутствуют однозначные данные о влиянии СД 2 на экспрессию ММП.
Цель исследования — оценить связь ММП-1, -3, -9 с показателями гликемического статуса больных инфарктом миокарда с подъемом сегмента ST (ИМпST) в зависимости от наличия СД 2.
Материал и методы
В проспективное когортное исследование последовательно включены 175 пациентов с диагнозом ИМпST. Диагноз ИМ был подтвержден согласно критериям Российского кардиологического общества: начало симптомов не более чем за 48 ч до госпитализации; симптомы, заставляющие предположить ИМ (ангинозная боль или ее эквивалент ≥ 20 мин, одышка, синкопальное состояние, остановка кровообращения и др.); электрокардиографические изменения, подъем или снижение сегмента ST ≥1 мм в двух смежных отведениях; предположительно новая полная блокада левой ножки пучка Гиса; формирование патологического зубца Q; выявление кардиоспецифических маркеров некроза миокарда (общая креатинфосфокиназа — КФК и ее фракция МВ, тропонины I и Т). Критериями исключения были возраст пациента моложе 18 лет, а также любые клинически значимые состояния, способные изменять уровень изучаемых биохимических маркеров (онкологические и системные заболевания; наличие почечной, гепатоцеллюлярной недостаточности; острые инфекционные заболевания или обострение хронических; психические заболевания, а также смерть больного в 1-е сут после госпитализации).
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинкской декларации.
У всех пациентов при поступлении в стационар и в динамике на 12-е сут от начала заболевания проводилось определение концентраций ММП-1, -3 и -9 в сыворотке крови методом количественного твердофазного иммуноферментного анализа с помощью лабораторных наборов BCM Diagnostics (США). Измерение уровня HbA1c проводилось быстрым ионообменным методом на 5-е сут госпитализации. Уровень глюкозы в сыворотке венозной крови измеряли при поступлении пациента в стационар, а также на 8-е сут госпитализации (натощак) глюкозооксидазным методом с использованием реактивов «Глюкоза ФС «ДДС». Статистическую обработку данных исследования осуществляли с помощью программы Statistica версии 7.0 (StatSoft, Inc, США). Применяли стандартные методы описательной статистики. Полученные данные представлены в виде медианы и интерквартильного размаха (25-й процентиль; 75-й процентиль). При распределении данных, отличном от нормального, две независимые группы по количественному признаку сравнивали с помощью U-критерия Манна — Уитни [6].
Описание группы исследования было опубликовано ранее [6].
Средний возраст пациентов в общей группе больных ИМпST составил 61,3 (33; 89) года. Среди 175 больных было 116 (66,3%) мужчин. Наиболее часто у пациентов в анамнезе были следующие заболевания: эссенциальная артериальная гипертензия (АГ) (76%) и стенокардия напряжения (53,7%), а также хроническая сердечная недостаточность различных функциональных классов (50,3%) (табл. 1).
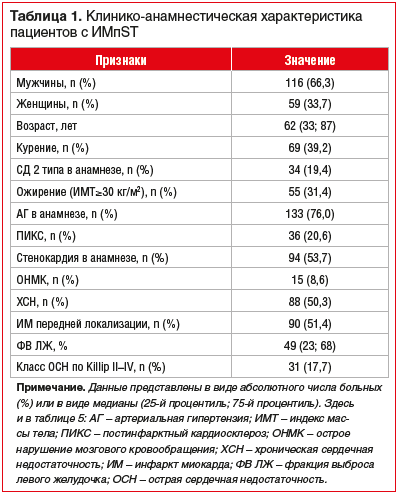
Продолжительность пребывания больных в стационаре составила 14 (12; 16) дней.
Группа контроля была представлена 87 здоровыми добровольцами в возрасте 59 (43; 68) лет, у которых ранее не диагностированы АГ, ИБС, СД, а также без клинически значимой сопутствующей патологии, среди них было 52 (59,8%) мужчины и 35 (40,2%) женщин.
В зависимости от наличия ранее диагностированного и установленного диагноза СД 2 (в соответствии с критериями Всемирной организации здравоохранения 2011 г.) [7]
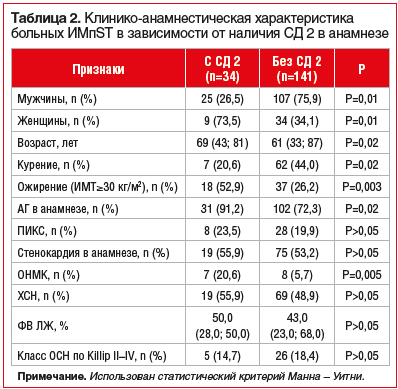
пациенты были распределены на 2 группы с наличием и отсутствием СД 2. У всех участников исследования изучали концентрации ММП-1, -3 и -9 в сыворотке крови. Группу больных ИМпST в сочетании с СД 2 составили 34 (18,2%) пациента: 25 (73,53%) мужчин и 9 (26,47%) женщин в возрасте 69 (43; 81) лет. По наличию сопутствующих заболеваний (хронической обструктивной болезни легких, хронической почечной недостаточности, язвенной болезни) достоверных различий в группах выявлено не было. При сравнительном анализе клинико-анамнестических данных группы больных ИМпST в зависимости от наличия СД 2 определено, что при СД 2 достоверно чаще выявляются такие факторы сердечно-сосудистого риска, как АГ (91,2% и 72,3%) и ожирение (52,9% и 26,2%). Кроме того, медиана возраста пациентов с ИМпST в сочетании с СД 2 достоверно превышала медиану возраста больных ИМпST без СД 2 (р=0,02). Также у пациентов с ИМпST и СД 2 достоверно чаще наблюдались ОНМК в анамнезе (20,6% и 5,7%). Вместе с тем по другим клинико-анамнестическим характеристикам достоверных различий между группами не было (табл. 2).
При оценке объема терапии на догоспитальном этапе было определено, что большинство (61,8% (n=21)) пациентов с ИМпST в сочетании с СД 2 принимали пероральные гипогликемические препараты. При этом основными на догоспитальном этапе были метформин и производные сульфонилмочевины. Комбинированную пероральную сахароснижающую терапию в сочетании с инсулинами получали 4 пациента (12,8%), 9 (26,4%) больных находились только на гипоуглеводной диете (табл. 3).

Результаты исследования
При анализе концентраций ММП в сыворотке крови установлено, что медианные значения этих показателей как в 1-е, так и на 12-е сут ИМпST превышают значения аналогичных маркеров в группе здоровых добровольцев. Определено, что концентрации ММП-1 в 1,7 раза в 1-е сут и в 2,7 раза на 12-е сут превышают значения в контрольной группе; ММП-3 — в 1,2 раза (1-е сут) и в 1,4 раза (12-е сут); ММП-9 — в 1,3 (1-е сут) и в 1,4 раза (12-е сут) соответственно. Было установлено, что значения всех изучаемых ММП в сыворотке крови на 12-е сут ИМпST оказались в 1,1–1,6 раза (р<0,05) выше по сравнению с показателями в 1-е сут заболевания (табл. 4).

Таким образом, у пациентов с ИМпST отмечаются достоверно более высокие значения ММП-1, -3 и -9 на протяжении всего госпитального периода заболевания по сравнению со значениями, полученными в контрольной группе. При этом для всех анализируемых МПП характерно повышение их концентрации к 12-м сут госпитального периода.
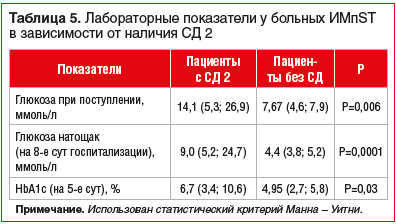
Определено, что в группе пациентов с ИМпST в сочетании с СД 2 при поступлении в стационар закономерно наблюдаются достоверно более высокие концентрации глюкозы (р=0,006), HbA1c (р=0,03), а также глюкозы крови натощак (р=0,0001), чем в группе больных ИМпST без СД 2 (табл. 5).
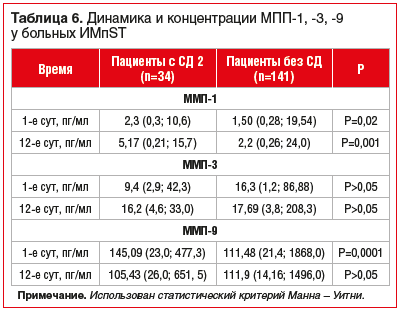
В группе больных ИМпST с СД 2 концентрация ММП-1
в 1-е сут госпитализации оказалась в 1,53 раза (р=0,02), на 12-е сут — в 2,35 раза (р=0,001) выше соответствующих показателей у больных ИМпST без СД 2. Концентрация ММП-9 в 1-е сут у пациентов с ИМпST в сочетании с СД 2 в 1,3 раза превышала концентрации у больных без СД 2 (р=0,0001) (табл. 6).
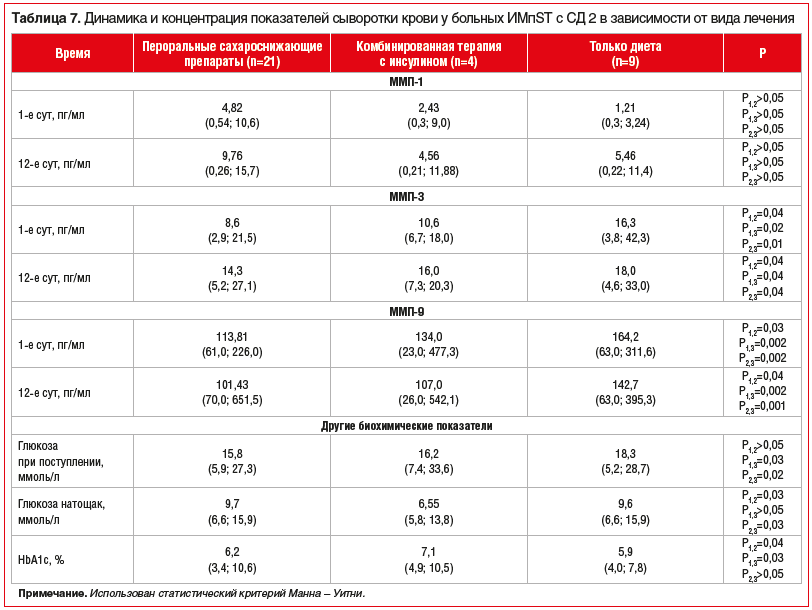
Анализ уровней ММП в зависимости от сахароснижающей терапии выявил следующие закономерности: у пациентов, которые находились только на гипоуглеводной диете, концентрации ММП-3 в 1-е сут пребывания в стационаре в 1,9 раза (р=0,02), на 12-е сут — в 1,3 раза (р=0,04) превышали концентрации ММП у пациентов, которые принимали пероральные сахароснижающие препараты.
Вместе с тем в группе пациентов, которые находились на комбинированной сахароснижающей терапии с инсулином на догоспитальном этапе, наблюдались превалирующие концентрации ММП-3 (1-е и 12-е сут) по сравнению с пациентами, принимавшими пероральные противодиабетические препараты (табл. 7).

Аналогичные тенденции выявлены для ММП-9, концентрация которой также была выше у больных, которые находились только на гипоуглеводной диете (p<0,05). Достоверных различий между 3 группами по уровню ММП-1 определено не было. При этом максимальная гликемия при поступлении регистрировалась также в группе пациентов, которые на догоспитальном этапе находились только на гипоуглеводной диете, — 18,3 (5,2; 28,7) ммоль/л. Однако при оценке глюкозы крови натощак ее минимальные концентрации регистрировались в группе больных с комбинированной терапией.
Полученные результаты позволяют предположить, что концентрация ММП зависит не от вида проводимой терапии, а от компенсации СД 2. Проведен корреляционный анализ между значениями HbA1c и ММП-1, -3, -9 в общей группе пациентов, по результатам которого определена достоверная прямая связь между уровнями HbA1с и ММП-3 (1-е сут: r=0,29, р=0,03; 12-е сут: r=0,38, р=0,007), а также между уровнями HbA1с и ММП-9 (1-е сут: r=0,34, р=0,02; 12-е сут: r=0,41, р=0,01). При проведении корреляционного анализа в группах пациентов в зависимости от наличия СД выявлено, что имеется аналогичная прямая корреляционная связь между уровнями HbA1с и ММП-3: группа с СД — 1-е сут: r=0,34, р=0,02; 12-е сут: r=0,37, р=0,005; группа без СД — 1-е сут: r=0,46, р=0,001; 12-е сут: r=0,28, р=0,04, а также между уровнями HbA1с и ММП-9: группа с СД — 1-е сут: r=0,37, р=0,03; 12-е сут: r=0,4, р=0,01; группа без СД — 1-е сут: r=0,29, р=0,04; 12-е сут: r=0,38, р=0,02.
Определено, что уровень глюкозы крови (при поступлении) также коррелирует с уровнем ММП-3 (1-е сут: r=0,45, р=0,001; 12-е сут: r=0,39, р=0,001) и ММП-9 (1-е сут: r=0,43, р=0,04; 12-е сут: r=0,4, р=0,03). Для ММП-1 статистически значимых связей как с концентрацией глюкозы крови, так и со значениями HbA1с выявлено не было.
Обсуждение результатов
В исследованиях in vitro и in vivo подтвержден тот факт, что некоторые ММП играют ведущую роль в патогенезе дестабилизации атеросклеротической бляшки с последующим ее тромбозом и, как следствие, манифестацией ОКС [8, 9].
При проведении экспериментальных и клинических исследований было установлено, что после ИМ экспрессия MMП повышается уже через несколько часов от начала заболевания [9]. Так, по данным R. Eckart и C. Uyehara [10], у больных ОКС значительно повышаются плазменные концентрации ММП-1, -2, -9. В ряде экспериментальных и клинических исследований также показано, что продукция ММП-3 и ММП-9 существенно возрастает в течение 1-х сут от начала ИМ и сохраняется в избыточном титре на протяжении всего острого периода ИМ [11, 12]. В работах H. Kai [13] и E. Armstrong [14] доказано достоверное повышение концентраций ММП-1, -2, -9 к 7–14-м сут течения ИМпST. Представленные данные согласуются с результатами настоящего исследования, в котором определено, что пациенты с ИМпST характеризуются достоверно более высокими значениями ММП-1, -3 и -9 на протяжении всего госпитального периода заболевания по сравнению с группой здоровых лиц соответствующего возраста. При этом для всех анализируемых ММП характерно повышение их концентрации к 12-м сут госпитального периода.
Активно обсуждается возможность использования некоторых ММП в качестве независимых предикторов не только дестабилизации атеросклеротической бляшки, но и маркеров неблагоприятного течения раннего и отдаленного периодов ИМ [14]. Одной из возможных причин повышенной экспрессии ММП у пациентов без ИБС и с ИМ является наличие сопутствующего СД 2. В немногочисленных работах, посвященных изучению ММП у пациентов с ИМ в сочетании с СД 2, получены неоднозначные результаты в отношении ассоциации гликемического статуса пациента с концентрацией ММП.
Данный факт обусловливает актуальность изучения активности ММП у больных ИМ в сочетании с хронической гипергликемией при СД 2 и при «стрессовой» гипергликемии, которая связана с резким повышением секреции катехоламинов, глюкагона, кортизола, гормона роста, активностью креатинкиназы и увеличением площади некроза миокарда [15].В некоторых исследованиях отмечено, что более чем у половины больных без СД 2 в остром периоде ИМ отмечено повышение уровня глюкозы крови [16].
Существует мнение о том, что не столько сам факт СД 2, сколько наличие хронической гипергликемии является индуцирующим фактором гиперпродукции ММП. В крупных проспективных исследованиях доказано, что прогноз больных ИМ без СД 2 в анамнезе, но с гликемией в остром периоде более 11,1 ммоль/л не отличается от прогноза больных с ранее диагностированным СД 2 [17]. Метаболические нарушения в случае гипергликемии формируют дополнительные факторы риска осложнений со стороны сердечно-сосудистой системы, что приводит к увеличению смертности и негативно сказывается на прогнозе [17, 18]. В своем исследовании A.K. Death [19] продемонстрировал влияние гипергликемии на экспрессию ММП-1 и -2 в эндотелиальных клетках и ММР-9 в макрофагах. В ранее проведенных исследованиях определено, что СД 2 является независимым предиктором неблагоприятного прогноза течения ближайшего и отдаленного периодов у пациентов с ИМ [17]. S.S. Signorelli et al. [20] в своем исследовании наблюдали более высокие концентрации ММП-2 и -9 в сыворотке крови пациентов с СД 2. При сравнении результатов с аналогичными значениями контрольной группы было установлено, что плазменные уровни ММП-2 были выше у пациентов с СД, в то же время у пациентов без СД достоверных различий не получено. Напротив, в работе A. Papazafiropoulou et al. [21] достоверных различий между концентрациями ММП-2 и -9 у пациентов с СД 2 и без него получено не было. В исследовании приняли участие 120 пациентов, 60 из которых имели СД 2. Плазменные концентрации ММП-2 и -9 не различались в группе пациентов с СД и без него.
Другим доказательством патологических эффектов гипергликемии и экспрессии ММП при ИМ на фоне СД 2 являются данные экспериментального исследования L.K. Bhatt и A. Veeranjaneyulu [22]. Авторы предположили, что гипергликемия при СД может увеличивать экспрессию ММП-2 и -9 при ИМ. С этой целью у самцов крыс линии Вистар в течение 3 нед. провоцировали развитие СД. Затем в конце 6-й нед. наблюдения путем лигирования передней нисходящей коронарной артерии в течение 30 мин вызывали ишемическое повреждение миокарда. При анализе полученных данных оказалось, что частота аритмии, смертность, уровень коллагена и уровень ММП-2 и -9 были значительно выше в группе СД по сравнению с крысами без СД. В исследовании А. Dominguez-Rodrigue [23] доказано, что повышенные концентрации ММП-9 у больных ИМпST в сочетании с СД 2
являются неблагоприятным фактором развития госпитальных осложнений. В данное исследование было включено 120 пациентов с ИМпST, из которых 48 имели в анамнезе СД 2. Сывороточные уровни ММП-9 были измерены на 1-е сут госпитализации. Первичными конечными точками исследования были сердечная смерть в стационаре и кардиогенный шок. Определено, что средние сывороточные значения ММП-9 были значительно выше среди пациентов с СД по сравнению с пациентами без СД (р<0,0001). При проведении многофакторного регрессионного анализа определено, что СД и повышение уровня ММП-9 являются независимыми предикторами конечных точек (смерти и кардиогенного шока) в раннем периоде ИМпST.
Следует отметить, что ранее авторами настоящей статьи уже была показана высокая клинико-прогностическая значимость различных факторов воспаления у пациентов с ИМ с проявлением мультифокального атеросклероза или СД [24, 25].
Заключение
В настоящем исследовании доказано, что в группе пациентов с СД 2 в госпитальном периоде ИМпST регистрируются достоверно более высокие концентрации ММП-3 и -9. Определена статистически значимая корреляционная связь в 1-е сут ИМпST между уровнем глюкозы крови, с одной стороны, и уровнями ММП-3, -9, с другой, что свидетельствует о возможном влиянии гипергликемии на экспрессию ММП независимо от наличия в анамнезе СД 2. Кроме того, полученные данные о связи HbA1c с концентрацией ММП-3, -9 могут говорить о том, что уровни ММП потенциально зависят от степени компенсации СД.
Тем не менее доказательств того, что концентрация MMП у больных СД 2 зеркально отражает степень тяжести процесса, нет, т. к. повышенная деградация матрикса может быть проявлением не только хронической гипергликемии, но и других процессов в различных тканях, связанных непосредственно как с течением острого ИМ, так и с СД. Данный факт диктует необходимость дальнейшего изучения потенциального прогностического значения высоких концентраций ММП у больных СД 2.
Источник
