Коронарогенный механизм развития инфаркта миокарда

Различают два вида некроза миокарда: некоронарогенный, вызванный первичным изменением обмена в миокарде, и коронарогенный, связанный с первичным нарушением сосудов сердца. Однако при любом виде некроза миокарда в процесс в той или иной степени вовлекаются и метаболизм, и кровоснабжение.
Причины некоронарогенного некроза миокарда разнообразны. Имеется несколько экспериментальных моделей некроза сердечной мышцы, которые отражают ситуацию, наблюдаемую в естественных условиях (гипоксический некроз, электролитно-стероидная карди-опатия с некрозом, иммунные и нейрогенные поражения сердца).
Коронарогенный некроз миокарда (инфаркт миокарда) — гибель участков миокардиальной ткани — возникает при абсолютной или относительной недостаточности венечного кровообращения.
Абсолютная недостаточность коронарных сосудов — это состояние, при котором к миокарду по системе венечных артерий доставляется меньше крови, чем в норме.
Относительная недостаточность коронарных сосудов — это состояние, при котором к миокарду по системе венечных артерий доставляется нормальное или даже увеличенное количество крови, не обеспечивающее потребности миокарда в условиях повышенной нагрузки.
Основными причинами коронарной недостаточности являются:
o Атеросклероз коронарных сосудов.
o Тромбоз коронарных сосудов, обусловливающий абсолютное уменьшение коронарного кровотока.
o Неврогенный спазм коронарных артерий.
o Стеноз сосуда, при котором даже небольшая нагрузка, физическая или психическая, ведет к ишемии сердечной мышцы; значительная физическая нагрузка или эмоциональное напряжение.
o Эмболия коронарных сосудов.
o Ишемия.
Кроме причин, различают еще факторы риска, т.е. факторы, предрасполагающие к возникновению инфаркта миокарда:
o гипертоническая болезнь;
o сахарный диабет;
o подагра;
o малоподвижный, эмоционально-напряженный образ жизни;
o избыточное питание с потреблением большого количества жиров;
o курение.
После нарушения кровообращения очень быстро (через 30 мин) изменяется структура митохондрий, отмечается набухание или пикноз ядер, исчезает поперечная исчерченность. Мышечные клетки теряют гликоген и калий, в них увеличивается количество лизосом, клетки гибнут и очень скоро окружаются нейтрофилами, которые в дальнейшем сменяются макрофагами, лимфоцитами и плазматическими клетками. В дальнейшем в очаге некроза появляются фиброб-ласты и образуется соединительно-тканный рубец.
Очаг некроза в миокарде оказывает неблагоприятное влияние на деятельность сердца в целом. Это проявляется в нарушении сократимости, возбудимости и проводимости. При инфаркте миокарда изменяется биоэлектрическая активность сердца.
На ЭКГ при инфаркте обычно определяется смещение сегмента S-T, изменение комплекса QRS и зубца Т. Могут появиться экстрасистолы, пароксизмальная тахикардия, фибрилляция предсердий, а в тяжелых случаях и такое грозное осложнение, как фибрилляция желудочков. Часто наблюдается блокада сердца.
Клиника инфаркта миокарда чрезвычайно разнообразна и зависит как от состояния реактивности организма, так и от величины, глубины и локализации самого очага некроза. Но ряд симптомов инфаркта являются стандартными. Они важны не только для диагностики, но и для правильного понимания патогенеза инфаркта. Это прежде всего болевой и резорбционно-некротический синдромы.
Боль при инфаркте имеет характерную локализацию в верхнелевой части тела и за грудиной, а также тягостную эмоциональную окраску, “кинжальная боль”.
Из некротизированных участков мышцы сердца в кровь попадают такие внутриклеточные ферменты, как креатинфосфокиназа, аспартатаминотрансфераза, сердечные изоферменты лактатдегидрогеназы. Резорбция некротических белков сопровождается лейкоцитозом, лихорадкой, увеличением СОЭ.
Появление в кровотоке резорбирующихся белков из очага некроза может вызвать аутоиммунизацию с появлением противосердечных антител, эозинофилию, гиперглобулинемию, реакции замедленной гиперчувствительности к антигенам сердца. Инфаркт миокарда может сопровождаться развитием острой сердечной недостаточности.
Одним из тяжелых осложнений инфаркта миокарда является кардиогенный шок, основной пусковой механизм которого — уменьшение сердечного выброса вследствие снижения сократительных свойств миокарда. При этом наблюдается значительное повышение общего периферического сосудистого сопротивления вследствие увеличения активности симпатоадреналовой и включения ренинангиотензивной системы.
Присоединяющееся нарушение микроциркуляции в тканях ведет к гипоксии, ацидозу, нарушению деятельности мозга и других органов. Увеличивается давление в легочных капиллярах, возникает угроза развития отека легких.
Клиническая картина кардиогенного шока характеризуется симптомами, отражающими низкий минутный объем сердца, недостаточную перфузию органов и тканей, активацию симпатической системы и перикардиальный застой крови и проявляется низким артериальным (особенно систолическим) давлением, низким пульсовым давлением, бледностью кожи, понижением температуры поверхности тела, нарушением почечного кровотока (олигурия и анурия). Обычно развиваются психические расстройства, а в тяжелых случаях — потеря сознания.
При возникновении инфаркта миокарда в первую очередь рекомендуют строгий постельный режим и наркотические анальгетики (для профилактики кардиогенного шока).
Для предотвращения возникновения тромбоза или его прогрессирования, а также образования внутрисердечных тромбов назначают гепарин под ежедневным контролем тромбинового индекса, а через некоторое время — антикоагулянты непрямого действия под ежедневным контролем протромбинового индекса.
При выраженной слабости сердечной мышцы, резкой тахикардии, сердечной астме, значительном падении артериального давления показаны сердечные гликозиды, внутривенное введение 5% раствора глюкозы (капельно), витаминотерапия.
Коронарная недостаточность — типовая форма патологии сердца, характеризующаяся превышением потребности миокарда в кислороде и субстратах метаболизма над их притоком по коронарным артериям, а также нарушением оттока от миокарда продуктов обмена веществ, БАВ, ионов и других агентов.
Коронарную недостаточность подразделяют на:
1. Абсолютную —в основе ограничение кровотока по aa.coronaris (артерии…).
2. Относительную —когда резко повышается потребность миокарда в О2 на фоне отсутствия ограничения коронарного кровотока: при двусторонней пневмонии, хронической эмфиземе, гипертонических кризах, при пороках сердца.
3. Обратимую —проявляется следующими клиническими формами: стенокардией стабильного и нестабильного течения, вариантной, состояниями после реваскуляризации миокарда.
4. Необратимую —проявляется инфарктом миокарда.
Причины коронарной недостаточности:
· коронарогенные
· некоронарогенные.
Патогенез коронарной недостаточности:
1. Возникновение атеросклеротической бляшки в коронарных артериях является морфологической основой ишемического повреждения. При уменьшении просвета венечной артерии на 70-80% возникают выраженные приступы стенокардии напряжения.
2. Спазм коронарных артерий — это сильное сокращение их сосудистой стенки, которое препятствует нормальному кровотоку в сердечной мышце. В патогенезе спазма венечных сосудов важную роль играет активация симпатической нервной системы. Спастическая реакция сосудов сердца на те или иные воздействия может вызвать болевой приступ даже при незначительном стенозе коронарных артерий и, более того, при полном отсутствии такового. В этом случае говорят о так называемой вариантной стенокардии Принцметала, Причиной вариантной стенокардии является нарушение функционального состояния эндотелия сосудов сердца. Вместе с тем коронароспазм может развиваться и без участия вегетативной нервной системы. Факторами, вызывающими сужение сосудов, в этом случае могут быть вазоконстрикторные биологически активные вещества.
3. Тромбоз венечных артерий. Формирование тромбов на поверхности атеросклеротической бляшки, где нарушились структура и целостность эндотелиального слоя, в виде изъязвления и деструкции бляшки. При этом просвет коронарных артерий быстро перекрывается стремительно образующимся тромбом, а коллатеральное кровообращение не успевает компенсировать сниженный кровоток, то возникает нестабильная форма стенокардии (по прежней терминологии — предынфарктное состояние) и может развиться инфаркт миокарда или наступить внезапная сердечная смерть (ВСС).
1. Клинические формы коронарной недостаточности:
а) стенокардия;
б) мелкоочаговый инфаркт миокарда;
в) крупноочаговый инфаркт миокарда.
В основе стенокардии лежит кратковременная ишемия миокарда до 20-28 мин. Эта ишемия обратима для многих миокардиальных волокон, в других развиваются некротические изменения.
Парасимпатические волокна не проводят болевую импульсацию. Импульсация идет по нижнему и среднему сердечному нерву, а также по нижним грудным нервам в гипоталамус, таламус, формируется чувство боли. Боль имеет неясную локализацию, иррадирует в левую руку, лопатку. Боль нужно снимать. Если ишемия длится более 28 мин, то развивается некроз во многих мышечных волокнах. Если ишемия длится в течение 1-2 ч, то изменения в сердечной мышце необратимы.
Фаза альтерации: повышается проницаемость цитоплазматической мембраны миокардиоцитов, происходит набухание митохондрий, разобщение процессов окисления и дыхания.
Некротическая фаза выявляется через 6 ч. Возникает грубая деструкция, отсутствует сократительный акт, в системный кровоток всасываются биологически активные вещества, ферменты. Спустя 24 ч начинается инфильтрация в зону некроза нейтрофилов, которые выделяют протеолитические ферменты. Через 3-5 суток максимально выражена макрофагальная инфильтрация. Через 5-7 дней начинается разрастание фибробластов по периферии.
Фаза фиброза – замещение зоны некроза соединительнотканными волокнами в течение первых 5-8 недель. Окончательное формирование рубца наступает не ранее, чем через 3-4 месяца.
Осложнения:
1. Грубые анатомические осложнения:
разрыв зоны некроза с последующей тампонадой и остановкой сердца;
разрыв межжелудочковой или межсердечной перегородки, отрыв сосочковых мышц;
аневризма – острая, подострая, хроническая.
2. Функциональные осложнения:
кардиогенный шок;
развитие острой сердечной недостаточности.
Механизм кардиогенного шока:
o инфаркт миокарда – боль – усиленная продукция катехоламинов (в 10-20 раз) – спазм периферических сосудов – резкое повышение нагрузки сопротивления на миокард;
o если зона инфаркта располагается вблизи проводящих путей, то возможна блокада их;
o тромбогеморрагический (ДВС) синдром;
o синдром Дресслера. У больного появляется периодическая стенокардия, признаки сердечной недостаточности, перикардит, плеврит, гипертермия. Этот синдром имеет иммунно-аллергическую природу. Образуются вторичные аутоантигены, стимулируется бета- и Т-система, которая повреждает миокард и окружающие ткани;
o резорбционно-некротический синдром. Из зоны инфаркта начинают всасываться белки, ферменты, лактат, креатинфосфокиназы.
Их количество прямо пропорционально интенсивности инфаркта. Появляется через 5-6 ч, максимум развития – 1-2 суток. К 4-5-му дню уровень нормализуется, если нет повторного инфаркта.
В зоне инфаркта идет выработка эндопирогенов, развивается лихорадка.
Токсичные продукты некроза всасываются, достигают печени и подавляют синтез альбуминов, усиливается выработка бета- глобулинов. Возникает диспротекнемия, повышается СОЭ.
Источник
Название: Патологическая физиология
Жанр: Патологічна фізіологія
Просмотров: 7979

15.2.4. коронарогенный инфаркт миокарда
Различают два вида некроза миокарда: некоронарогенный,
вызванный первичным изменением обмена в миокарде, и коронаро-генный, связанный
с первичным нарушением сосудов сердца. Однако при любом виде некроза миокарда в
процесс в той или иной степени вовлекаются и метаболизм, и кровоснабжение.
307
Причины некоронарогенного некроза миокарда разнообразны.
Имеется несколько экспериментальных моделей некроза сердечной мышцы, которые
отражают ситуацию, наблюдаемую в естественных условиях (гипоксический некроз,
электролитно-стероидная карди-опатия с некрозом, иммунные и нейрогенные
поражения сердца).
Коронарогенный некроз миокарда (инфаркт миокарда) — гибель
участков миокардиальной ткани — возникает при абсолютной или относительной
недостаточности венечного кровообращения.
Абсоютная недостаточность коронарных сооудов — это
состояние, при котором к миокарду по системе венечных артерий доставляется
меньше крови, чем в норме.
Относительная недостаточность коронарных сосудов — это
состояние, при котором к миокарду по системе венечных артерий доставляется
нормальное или даже увеличенное количество крови, не обеспечивающее потребности
миокарда в условиях повышенной нагрузки.
Основными причинами коронарной недостаточности являются:
0 Атеросклероз коронарных сосудов.
0 Тромбоз коронарных сосудов, обусловливающий абсолютное
уменьшение коронарного кровотока.
0 Неврогенный спазм коронарных артерий.
0 Стеноз сосуда, при котором даже небольшая нагрузка,
физическая или психическая, ведет к ишемии сердечной мышцы; значительная
физическая нагрузка или эмоциональное напряжение.
0 Эмболия коронарных сосудов.
0 Ишемия.
Кроме причин, различают еще факторы риска, т.е. факторы,
предрасполагающие к возникновению инфаркта миокарда:
0 гипертоническая болезнь;
0 сахарный диабет;
0 подагра;
0 малоподвижный, эмоционально-напряженный образ жизни;
0 избыточное питание с потреблением большого количества
жиров;
0 курение.
После нарушения кровообращения очень быстро (через 30 мин)
изменяется структура митохондрий, отмечается набухание или пик-ноз ядер,
исчезает поперечная исчерченность. Мышечные клетки теряют гликоген и калий, в
них увеличивается количество лизосом,
308
клетки гибнут и очень скоро окружаются нейтрофилами, которые
в дальнейшем сменяются макрофагами, лимфоцитами и плазматическими клетками. В
дальнейшем в очаге некроза появляются фиброб-ласты и образуется
соединительно-тканный рубец.
Очаг некроза в миокарде оказывает неблагоприятное влияние на
деятельность сердца в целом. Это проявляется в нарушении сократимости,
возбудимости и проводимости. При инфаркте миокарда изменяется биоэлектрическая
активность сердца.
На ЭКГ при инфаркте обычно определяется смещение сегмента
8-Т, изменение комплекса (4158 и зубца Т. Могут появиться экстрасистолы,
пароксизмальная тахикардия, фибрилляция предсердий, а в тяжелых случаях и такое
грозное осложнение, как фибрилляция желудочков. Часто наблюдается блокада
сердца.
Клиника инфаркта миокарда чрезвычайно разнообразна и зависит
как от состояния реактивности организма, так и от величины, глубины и
локализации самого очага некроза. Но ряд симптомов инфаркта являются
стандартными. Они важны не только для диагностики, но и для правильного
понимания патогенеза инфаркта. Это прежде всего болевой и
резорбционно-некротический синдромы.
Боль при инфаркте имеет характерную локализацию в
верхнелевой части тела и за грудиной, а также тягостную эмоциональную окраску,
“кинжальная боль”.
Из некротизированных участков мышцы сердца в кровь попадают
такие внутриклеточные ферменты, как креатинфосфокиназа,
аспартатаминотрансфераза, сердечные изоферменты лактатдегидро-геназы. Резорбция
некротических белков сопровождается лейкоцитозом, лихорадкой, увеличением СОЭ.
Появление в кровотоке резорбирующихся белков из очага
некроза может вызвать аутоиммунизацию с появлением противосердечных антител,
эозинофилию, гиперглобулинемию, реакции замедленной гиперчувствительности к
антигенам сердца. Инфаркт миокарда может сопровождаться развитием острой
сердечной недостаточности.
Одним из тяжелых осложнений инфаркта миокарда является
кардиогенный шок, основной пусковой механизм которого — уменьшение сердечного
выброса вследствие снижения сократительных свойств миокарда. При этом
наблюдается значительное повышение общего периферического сосудистого
сопротивления вследствие увеличения активности симпатоадреналовой и включения
ренинангио-тензивной системы.
Присоединяющееся нарушение микроциркуляции в тканях ведет к
гипоксии, ацидозу, нарушению деятельности мозга и других органов. Увеличивается
давление в легочных капиллярах, возникает угроза развития отека легких.
309
Клиническая картина кардиогенного шока характеризуется
симптомами, отражающими низкий минутный объем сердца, недостаточную перфузию
органов и тканей, активацию симпатической системы и перикардиальный застой
крови и проявляется низким артериальным (особенно систолическим) давлением,
низким пульсовым давлением, бледностью кожи, понижением температуры поверхности
тела, нарушением почечного кровотока (олигурия и анурия). Обычно развиваются
психические расстройства, а в тяжелых случаях — потеря сознания.
При возникновении инфаркта миокарда в первую очередь
рекомендуют строгий постельный режим и наркотические анальгетики (для
профилактики кардиогенного шока).
Для предотвращения возникновения тромбоза или его
прогрес-сирования, а также образования внутрисердечных тромбов назначают
гепарин под ежедневным контролем тромбинового индекса, а через некоторое время
— антикоагулянты непрямого действия под ежедневным контролем протромбинового
индекса.
При выраженной слабости сердечной мышцы, резкой тахикардии,
сердечной астме, значительном падении артериального давления показаны сердечные
гликозиды, внутривенное введение 5% раствора глюкозы (капельно),
витаминотерапия.
Источник
Август 22, 2018
Нет комментариев
Некротические повреждения сердечной мышцы, т. е. гибель участков миокарда, бывают связаны или не связаны с нарушением коронарного кровообращения. В зависимости от этого они подразделяются на коронарогеннш и некоронарогенные некрозы.
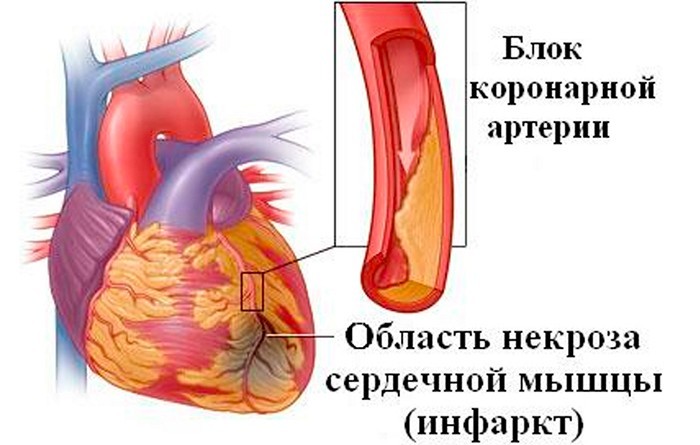
Коронарогенные (ишемические) некрозы миокарда
Некроз миокарда, возникающий вследствие ухудшения коронарного кровотока (ишемии), называется инфарктом миокарда.
Некроз инфаркт миокарда
представляет собой одну из острых форм ИБС, при которой доставка к сердцу кислорода и питательных веществ не удовлетворяет потребности сердца в этих веществах.
Этиология
В этиологии инфаркта миокарда играют важную роль атеросклероз коронарных артерий, их тромбоз, спазм и (достаточно редко) эмболия коронарных артерий. К факторам риска инфаркта миокарда можно отнести все те, которые указаны как факторы риска ИБС (см. начало данного раздела). Сочетание двух или трех факторов риска увеличивает вероятность возникновения инфаркта миокарда.
Патогенез
Выделяют следующие последовательно развивающиеся стадии в патогенезе инфаркта миокарда.
1. Выключение дыхательной цепи митохондрий и активация гликолиза как следствие начавшейся ишемии. Накопление недоокисленных продуктов метаболизма (прежде всего молочной кислоты) обусловливает появление боли.
2. Ингибирование основных метаболических путей, подавление гликолиза (из-за слишком большого снижения pH в ткани миокарда) и цикла Кребса, вследствие чего развивается дефицит аденозинтрифосфата. Наблюдается накопление жирных кислот вследствие угнетения их р. окисления, а также нарушение ионного равновесия в кардиомиоцитах
3. Разрушение мембран кардиомиоцитов в результате включения в патогенез инфаркта так называемой липидной триады. В нее входят активация липаз и фосфолипаз, активация свободнорадикального перекисного окисления липидов и детергентное действие на миокард избытка жирных кислот. Все указанные изменения происходят в мембранах сарколеммы, лизосом, саркоплазматического ретикулума и митохондрий и приводят к их повреждению и повышению проницаемости. Следствием этого является выход аутолитических ферментов лизосом в клетки миокарда, а также накопление в них избытка свободного Са++. Избыток Са++ вызывает контрактуру миофибрилл и приводит к дальнейшей активации липаз и фосфолипаз.
4. Заключительная стадия необратимых повреждений кардиомио-цитов и некроз ишемического участка миокарда.
Клинические проявления
Основными клиническими симптомами инфаркта миокарда являются:
1. Локализующаяся за грудиной сильнейшая боль, иррадиирующая в левое плечо, левую руку и межлопаточную область. Эта боль может возникать в покое днем или в ночное время.
В отличие от приступа стенокардии болевой синдром при инфаркте миокарда длится дольше и не купируется повторным приемом нитроглицерина. Следует отметить, что в тех случаях, когда болевой приступ длится более 15 мин, а принимаемые меры неэффективны, необходимо немедленно вызвать бригаду скорой медицинской помощи.
Встречаются и атипичные формы инфаркта миокарда, при которых характерные симптомы, в частности болевой синдром, могут отсутствовать (безболевая форма инфаркта миокарда).
2. Ослабление сократительной способности миокарда вследствие выпадения из акта сокращения поврежденного участка миокарда ведет к уменьшению сердечного выброса. При этом в зоне некроза с помощью эхокардиографии могут выявляться различные нарушения движения стенки поврежденного желудочка: акинезия, гипокинезия, дискинезия (выбухание участка инфаркта в момент систолы). Последнее может свидетельствовать о формировании острой аневризмы сердца-
3. Аритмии. В связи с изменением в зоне инфаркта биоэлектрических свойств кардиомиоцитов возникают нарушения сердечного ритма (вплоть до развития фибрилляции сердца), что приводит к значительным расстройствам системной гемодинамики и усугубляет нарушение контрактильной функции сердца. Источником эктопической активности на ранних стадиях развития инфаркта служит, как правило, окржающая зону некроза так называемая паранекротическая зона.
4. Появление типичных изменений ЭКГ. К ним относятся смещение сегмента ST выше или ниже относительно изоэлектрической линии, появление патологического комплекса QS (свидетельствует о наличии в миокарде очага глубокой ишемии или некроза), а также появление гигантского зубца Т. Он может быть положительным или отрицательным. Если подобный зубец Т появляется в раннем периоде инфаркта миокарда, его трактуют (как и смещение сегмента ST) как проявление острой ишемии миокарда. Если же он появляется на поздних стадиях, его связывают с формированием в миокарде рубцовых изменений.
В зависимости от особенностей изменений ЭКГ различают следующие формы инфаркта миокарда:
• Q-образующий инфаркт, или Q-инфаркт (с формированием патологического глубокого зубца Q, что может свидетельствовать о крупноочаговом трансмуральном инфаркте);
• Q-необразующий инфаркт, или He-Q-инфаркт (сопровождается не появлением зубца Q, а появлением отрицательного зубца Т, что свидетельствует о мелкоочаговом инфаркте миокарда).
5. В крови повышается содержание так называемых маркеров инфаркта миокарда: миокардиальной фракции креатинфосфокиназы, миоглобина, а также тропонина-Т, который имеет на сегодняшний день наиболее важное значение в диагностике инфаркта миокарда.
6. Одно из важных проявлений инфаркта миокарда – ухудшение реологических свойств крови, что способствует тромбообразованию. При инфаркте миокарда венозный тромбоз диагностируется у 10-15 % больных.
7. Кроме описанных выше изменений могут наблюдаться расстройства мозгового кровообращения, нарушения функции желудочно-кишечного тракта. Через несколько часов от начала инфаркта миокарда развивается лейкоцитоз. Весьма характерно для инфаркта появление так называемого симптома перекреста между числом лейкоцитов в крови и СОЭ, когда в конце 1-й недели выраженность лейкоцитоза снижается, а СОЭ увеличивается.
Осложнения
К ранним осложнениям относят острую сердечную недостаточность, кардиогенный шок, отек легких, механические осложнения (разрыв папиллярных мышц, перегородки и стенок миокарда), тампонаду сердца, перикардит, тромбоэмболию легочной артерии, являющуюся одной из наиболее частых причин внезапной смерти.
К поздним осложнениям (возникают через 2-3 нед. и более от начала инфаркта) относят постинфарктный синдром Дресслера, хроническую недостаточность кровообращения, развитие аневризм сердца, тромбоэмболию легочной артерии и повторные инфаркты миокарда. Что касается синдрома Дресслера, то он возникает через 2-6 нед. от начала инфаркта и проявляется перикардитом, плевритом и пневмонией. В его патогенезе играет роль образование аутоантител к деструктивно измененным при инфаркте белкам миокарда — миокардиальным аутоантигенам.
Принципы патогенетической терапии
1. Ликвидация болевого приступа с помощью сильнодействующих анальгетиков и наркотических средств.
2. Использование антиагрегантов и тромболитических препаратов. В качестве доврачебной помощи рекомендуется использовать аспирин.
3. Уменьшение потребности сердца в кислороде, улучшение его доставки и снижение риска возникновения аритмий ф-адреноблокаторы).
Рекомендуется также использовать:
• ингибиторы ангиотензинпревращающего фермента;
• седативные и снотворные препараты;
• противоаритмические средства.
4. Важное значение имеют и хирургические методы лечения, в частности аортокоронарное шунтирование и баллонная ангиопластика со стентированием коронарных артерий.
Некоронарогенные (неишемические) некрозы миокарда
Поражения сердца этого типа возникают как результат нарушения метаболизма в сердечной мышце в связи с действием на сердце избытка электролитов, гормонов, токсических продуктов обмена, кардиальных аутоантител. Различают следующие виды некоронарогенных некрозов миокарда.
Электролитно-стероидные некрозы
Образование данного вида некрозов связано с патогенным действием на миокард избытка вводимых в организм гормонов коры надпочечников (прежде всего минералокортикоидов) в сочетании с солями натрия. Такое воздействие приводит к увеличению проницаемости мембран кардиомиоцитов для натрия и накоплению его в сердце. Развивающийся впоследствии отек и «осмотический взрыв» клеток миокарда сопровождается возникновением очагов некроза.
Катехоламиновые некрозы миокарда
Повреждающее действие избыточных концентраций катехоламинов на сердце объясняется следующими механизмами.
Во-первых, сами катехоламины, и прежде всего адреналин, обладают прямым повреждающим действием на миокард.
Во-вторых, несмотря на то что катехоламины расширяют коронарные сосуды, они в значительно большей степени увеличивают потребность сердца в кислороде, т. к. повышают частоту сердечных сокращений и артериальное давление. Поэтому при прохождении крови по венечным сосудам кислород утилизируется раньше, чем кровь достигнет прекапиллярного отдела микрососудистого русла. Это приводит к тому, что в миокарде появляются участки, получающие кровь, обедненную кислородом.
В-третьих, под влиянием избытка катехоламинов в миокарде происходит активация перекисного окисления липидов, продукты которого повреждают мембраны кардиомиоцитов.
Токсические и воспалительные некрозы миокарда
Данные виды некрозов возникают при интоксикации или поражении миокарда воспалительным процессом. Токсический миокардит может возникать вследствие воздействия некоторых химических соединений и фармакологических препаратов, например кокаина, лекарственных средств, применяемых при лечении злокачественных опухолей. Эти токсические вещества оказывают прямое повреждающее действие на миокард, приводя к развитию необратимой дистрофии и появлению мелкоочаговых некрозов.
Примером воспалительных некрозов миокарда служат различные миокардиты: ревматические и дифтерийные. При любом воспалительном процессе, как и в данном случае, наблюдается альтерация (повреждение) миофибрилл. Развивающийся воспалительный отек также способствует альтерации. Все это ведет к развитию микронекрозов миокарда.
Аутоиммунные некрозы
Одним из примеров аутоиммунных некрозов миокарда служит синдром Дресслера, о котором было сказано выше.
Поврежденные белки при инфаркте миокарда могут стать аутоантигенами, к которым в организме вырабатываются антитела. Повторное развитие некротического процесса обусловливает запуск реакции «антиген-антитело» во многих участках сердечной мышцы, что вызывает множественные микронекрозы.
Загрузка…
Источник
