Каротидная эндартерэктомия при ишемическом инсульте

Сосудистые заболевания головного мозга (ГМ) занимают 2-е место в структуре смертности от болезней системы кровообращения (39%) и в общей смертности населения (23,4%) [1]. В России ежегодно регистрируется более 450 000 инсультов, из них 100 тыс. — повторные, 75—85% носят ишемический характер [1, 2].
Среди выживших больных повторный инсульт развивается у 5—25% в течение первого года, а после 5 лет — у 20—40% [3]. Особенно неутешительны последствия повторного инсульта: инвалидами становятся 95—100% пациентов, из которых 65—80% нуждаются в постороннем уходе и 70% имеют психические расстройства [4]. У пациентов, перенесших инсульт, деменция развивается в первый год у 7%, через 3 года — у 10%, после 5 лет — у 48% [5]. Для пациентов с постинсультной деменцией характерна более высокая смертность, более высокий риск повторного инсульта [6].
Многие авторы считают пожилой и старческий возраст фактором риска и воздерживаются от хирургического лечения больных со стенозом сонных артерий (СА), перенесших ранее инсульт. В то время как у больных пожилого и старческого возраста на консервативной терапии за 8-летний период наблюдения, инсульт возникал в 16%, летальность после инсульта наблюдалась в 50% [7—9].
Частота выявляемого атеросклеротического поражения СА напрямую зависит от возраста, и чем старше пациент, тем более осложненный характер носит поражение ветвей дуги аорты (ДА) [10]. Вместе с тем достаточно часто скрываясь за сопутствующей патологией, атеросклеротическое поражение СА протекает скрыто — с развитием «тихого» инсульта [11]. Несмотря на относительно незаметное протекание, «тихий» инсульт в любом случае инициирует процессы, приводящие к нарушению функций мозга вплоть до слабоумия [5].
Эффективность хирургической первичной и вторичной профилактики инсульта доказана многоцентровыми рандомизированными исследованиями как в Европе, так и в США [12]. Эти данные подтверждаются работами ведущих ангиохирургов России.
В проведенных исследованиях доказано преимущество каротидной эндартерэктомии (КЭЭ) перед консервативной терапией как способа профилактики нарушений мозгового кровообращения (НМК), но неоднозначно определены сроки выполнения операции после инсульта для повышения эффективности профилактики повторных НМК и для сокращения периода реабилитации. Не учитывалась динамика неврологического статуса, качества жизни (КЖ) и изменение когнитивных функций у пациентов с перенесенным инсультом после КЭЭ. Окончательно не решен вопрос об эффективности и безопасности хирургической реконструкции СА у больных пожилого и старческого возраста.
Изучены результаты лечения 122 пациентов (13 женщин, 109 мужчин, средний возраст 62,4±8,49 года) с хронической сосудисто-мозговой недостаточностью (ХСМН) IV степени и атеросклеротическим поражением С.А. Пациенты были распределены на две основные группы: в 1-ю группу вошли 70 пациентов, перенесших КЭЭ, во 2-ю — 52 пациента, у которых в процессе обследования было обнаружено гемодинамически значимое атеросклеротическое поражение СА, но каротидные реконструкции не выполнялись. Пациенты распределены на возрастные подгруппы (по классификации, предложенной ВОЗ). Пациенты среднего возраста (44 года — 60 лет) вошли в 1A (n=26) и 2A (n=18) подгруппы, пациенты пожилого и старческого возраста (61 год — 89 лет) соответственно в 1Б (n=44) и 2Б (n=34) подгруппы. В 1-й группе основным методом хирургического лечения была КЭЭ. Больным 2-й группы КЭЭ не выполняли в связи с развившимся повторным ишемическим инсультом на госпитальном этапе в 8 случаях, в 3 наблюдениях по причине тяжелого общесоматического состояния, в 24 наблюдениях по причине необходимости выполнения срочной реконструкции артерий нижних конечностей (НК) из-за критической ишемии. Отказ от предложенной операции на СА был в 17 случаях.
Больных осматривал невролог, определена степень неврологического дефицита по шкале Рэнкина (от 0 до IV степени, пациентов с тяжелым нарушением жизнедеятельности V степени по Шкале в исследование не включали), определен восстановительный период после перенесенного инсульта: ранний (2—6 мес), поздний (6—12 мес) восстановительные периоды, стойкие остаточные явления (более 12 мес). По данным УЗИ, большинство больных как 1-й группы, так и 2-й имели стенозы СА в пределах 50—99%. Выраженные и критические стенозы, двусторонние поражения СА чаще выявляли у пациентов пожилого и старческого возраста: в 1Б группе стеноз 50—69% выявлялся в 68% случаев, двустороннее поражение — в 60%, во 2Б группе выраженный и критический стеноз встречался в 58%, двустороннее поражение — в 35%. По данным дуплексного сканирования СА, атеросклеротические бляшки (АСБ) были II и III типа (нестабильные и эмболоопасные). По результата компьютерной томографии (КТ)/магнитно-резонансной томографии (МРТ), ГМ чаще всего ишемические очаги выявлялись в височных долях, теменных, реже — в затылочной области и лобной. По данным МРТ, у 50% выявлялись множественные ишемические очаги ГМ, что указывает на неоднократно переносимые транзиторные ишемические атаки (ТИА), малые инсульты, которые часто протекают асимптомно, но лишний раз доказывают эмбологенность АСБ. У больных, перенесших инсульт, помимо определения выраженности неврологического дефицита оценивался уровень КЖ по опроснику MOS-SF36. Исходно пациенты 1-й и 2-й группы имели равно низкие показатели КЖ с резко сниженными как физическими (PF-Physical Functioning; RF- Role Functioning), так и психологическими (SF — Social Functioning; RE — Role Emotional; MH — Mental Health) компонентами здоровья. Активность жизнедеятельности оценивали по шкале Бартела. Когнитивные нарушения выявляли шкалой психического статуса — MMSE и шкалой лобной дисфункции — FAB. В большинстве случаев как в хирургической, так и в медикаментозной группе выявлены когнитивные и дементные нарушения легкой и средней степени выраженности. Более выраженные нарушения когнитивных функций отмечали у пациентов 2-й группы с тяжелым неврологическим дефицитом.
Ближайшие результаты лечения изучены у всех 122 больных, сроком до 30 дней с момента операции в 1-й группе и отслежены результаты консервативного лечения пациентов 2-й группы (табл. 1).
 Таблица 1. Сравнение частоты осложнений в зависимости от метода лечения в госпитальный период, абс. (%)
Таблица 1. Сравнение частоты осложнений в зависимости от метода лечения в госпитальный период, абс. (%)
Интраоперационный нейромониторинг включал электроэнцефалограмму (ЭЭГ), транскраниальную допплерографию (ТКДГ), измерение ретроградного артериального давления (АД). Среднее время ишемии ГМ при выполнении эндартерэктомии 22 мин, внутрипросветный шунт использовался в 20 (47,6%) наблюдениях. Частота использования шунта объясняется расширением методов интраоперационного нейромониторинга, позволяющих определить показания к сохранению кровообращения с целью защиты ГМ от ишемии на основном этапе реконструкции СА.
Ранние изменения неврологической симптоматики отмечены в виде нарастания неврологического дефицита у 11 (15,7%) пациентов, что связано с повторными ТИА и НМК. Улучшение неврологического статуса: уменьшение атаксии, головокружения, исчезновение шума в ушах, улучшение речи при моторной афазии, увеличение силы и амплитуды движений в конечностях, увеличение полей зрения — у 9 (12,8%) пациентов после КЭЭ.
Положительной динамики неврологического статуса во 2-й группе не отмечено. В табл. 2 представлены пациенты с разным исходным неврологическим статусом до лечения и через 30 дней в группах консервативного лечения и КЭЭ.
 Таблица 2. Соотношение пациентов с разными баллами неврологического статуса по шкале Ренкина и Бартела в госпитальном периоде, абс. (%) Примечание. 0 — нет неврологических нарушений; 1 — минимальные нарушения; 2 — легкие нарушения; 3 — умеренные нарушения; 4 — выраженные нарушения; 5 — инвалид, инсульты; 6 — инсульт с летальным исходом.
Таблица 2. Соотношение пациентов с разными баллами неврологического статуса по шкале Ренкина и Бартела в госпитальном периоде, абс. (%) Примечание. 0 — нет неврологических нарушений; 1 — минимальные нарушения; 2 — легкие нарушения; 3 — умеренные нарушения; 4 — выраженные нарушения; 5 — инвалид, инсульты; 6 — инсульт с летальным исходом.
По шкале Ренкина в 1-й группе отмечается тенденция к смещению шкалы по количеству больных от более тяжелого неврологического статуса к умеренному и легкому неврологическому, во 2-й группе такой динамики не отмечено.
Повторные ишемические эпизоды (ТИА, НМК) чаще наблюдались в позднем восстановительном периоде как в хирургической, так и в консервативной группе, но данные результаты не достоверны р>0,05 (табл. 3).
 Таблица 3. Распределение осложнений хирургического и консервативного лечения в зависимости от срока восстановительного периода с момента предшествующего инсульта, абс. (%)
Таблица 3. Распределение осложнений хирургического и консервативного лечения в зависимости от срока восстановительного периода с момента предшествующего инсульта, абс. (%)
Результаты лечения пациентов 1-й и 2-й группы в зависимости от возраста представлены в табл. 4.
 Таблица 4. Ближайшие результаты лечения в 1-й и 2-й группах у пациентов среднего, пожилого и старческого возраста, абс. (%)
Таблица 4. Ближайшие результаты лечения в 1-й и 2-й группах у пациентов среднего, пожилого и старческого возраста, абс. (%)
В хирургической группе частота инсульта и ТИА у пациентов среднего возраста и пациентов пожилого и старческого возраста в группе КЭЭ достоверно не различается (11% в обеих группах), поэтому считаем, что риск осложнений операции наименее связан с возрастом.
При анализе частоты инсульта и ТИА среди пациентов с разным неврологическим статусом в группе КЭЭ в госпитальном периоде достоверных отличий (p>0,05) не выявлено (табл. 5). В то же время для пациентов группы консервативного лечения имеется статистически значимая зависимость частоты инсульта и ТИА от тяжести неврологического дефицита (p<0,05).
 Таблица 5. Частота возникновения ТИА+ОНМК у больных с различной степенью неврологического дефицита Примечание. * — статистическая значимость для IIС. А — легкие нарушения (по шкале Ренкина 0, 1, 2); В — умеренные нарушения (по шкале Ренкина 3); C — выраженные нарушения (по шкале Ренкина 4, 5).
Таблица 5. Частота возникновения ТИА+ОНМК у больных с различной степенью неврологического дефицита Примечание. * — статистическая значимость для IIС. А — легкие нарушения (по шкале Ренкина 0, 1, 2); В — умеренные нарушения (по шкале Ренкина 3); C — выраженные нарушения (по шкале Ренкина 4, 5).
Получив такое статистически значимое различие во 2-й группе, считаем, что пациентов нужно оперировать, несмотря на тяжесть неврологического дефицита.
Несмотря на наличие множества сопутствующих патологий у пациентов пожилого и старческого возраста, результаты хирургического лечения у них не уступают результатам у пациентов среднего возраста. При сравнении результатов лечения в хирургической и контрольной группах, все же наименьшие осложнения наблюдаются в хирургической.
Отдаленные результаты были прослежены в сроки от 6 мес до 3 лет. Сравнение частоты осложнений в зависимости от метода лечения представлено в табл. 6.
 Таблица 6. Соотношение частоты осложнений в группе КЭЭ и группе консервативного лечения за 3 года, абс. (%) Примечание. Здесь и в табл. 7.: ТИА — транзиторные ишемические атаки; ОНМК — острое нарушение мозгового кровообращения; ОИМ — острый инфаркт миокарда.
Таблица 6. Соотношение частоты осложнений в группе КЭЭ и группе консервативного лечения за 3 года, абс. (%) Примечание. Здесь и в табл. 7.: ТИА — транзиторные ишемические атаки; ОНМК — острое нарушение мозгового кровообращения; ОИМ — острый инфаркт миокарда.
Общее количество летальных случаев от повторного ОНМК за 36 мес в хирургической группе — 3 (5%), в консервативной — 4 (8%).
Случаи повторных ТИА и инсультов у пациентов консервативной группы наблюдались в ипсилатеральном бассейне, ведь источник эмболии мозговых артерий (нестабильная атеросклеротическая бляшка) не устранен. Выявлены ишемические случаи контралатерального бассейна, что свидетельствует о прогрессировании и отрицательной динамике заболевания.
За 3-летний период наблюдения эпизодов повторной ишемии ГМ во 2-й группе (22,4%), что достоверно больше (p=0,05), чем в 1-й (8,5%) (табл. 7).
 Таблица 7. Соотношение частоты осложнений в возрастных подгруппах за 3 года наблюдения, абс. (%) Примечание. * — статистически значимые отличия. При оценке результатов лечения пациентов пожилого и старческого возраста случаи повторной ишемии ГМ чаще наблюдались во 2Б группе — 32% против 9% в 1Б группе (р<0,05).
Таблица 7. Соотношение частоты осложнений в возрастных подгруппах за 3 года наблюдения, абс. (%) Примечание. * — статистически значимые отличия. При оценке результатов лечения пациентов пожилого и старческого возраста случаи повторной ишемии ГМ чаще наблюдались во 2Б группе — 32% против 9% в 1Б группе (р<0,05).
При анализе отрицательных событий в группах показатель инсульта и смерти у пациентов пожилого и старческого возраста значительно меньше после выполнения КЭЭ, чем в контрольной группе. По прошествии 36 мес частота НМК+летальность составляет 18% в 1Б группе против 45% — вo 2Б группе, частота ТИА+летальность —36% в 1Б группе против 45% — вo 2B группе (рис. 1, 2).
 Рис. 1. Динамика возникновения инсульта и летальность в возрастных подгруппах. Здесь и на рис. 2—5: * — статистическая значимость относительно исходных данных.
Рис. 1. Динамика возникновения инсульта и летальность в возрастных подгруппах. Здесь и на рис. 2—5: * — статистическая значимость относительно исходных данных.
 Рис. 2. Динамика возникновения ТИА и летальность в возрастных подгруппах.
Рис. 2. Динамика возникновения ТИА и летальность в возрастных подгруппах.
Исходя из полученных результатов, можно сделать вывод, что риск КЭЭ при лечении пациентов пожилого и старческого возраста не превышает риска при лечении пациентов среднего возраста. КЭЭ является эффективным методом профилактики повторных НМК у пациентов старше 60 лет, перенесших ранее ИМ.
Изменение неврологического статуса у пациентов после КЭЭ в период наблюдения 6—36 мес оценивали по шкале Ренкина. Отмечается положительная динамика в виде снижения степени очагового неврологического дефицита, которая максимально проявляется на 1-м и 2-м годах наблюдения после КЭЭ. Отмечается прирост пациентов без неврологической симптоматики на 15% ко 2-му году наблюдения и уменьшение с 8,5 до 2% количество больных с умеренными неврологическими нарушениями (ходьба без посторонней помощи)
Динамика неврологического статуса у пациентов различной возрастной группы представлена на рис. 3.
 Рис. 3. Динамика неврологического статуса по шкале Рэнкина у пациентов разного возраста в группах КЭЭ и консервативного лечения.
Рис. 3. Динамика неврологического статуса по шкале Рэнкина у пациентов разного возраста в группах КЭЭ и консервативного лечения.
У пациентов 2Б группы после перенесенного инсульта на фоне стеноза внутренних СА и эпизодов повторяющихся ишемических атак имеется тенденция к ухудшению неврологического статуса.
У пациентов после выполненной КЭЭ показатель повседневной активности по шкале Бартела увеличивается с 86 до 95 баллов ко 2-му году наблюдения, что свидетельствует об адаптации, уменьшении степени двигательных нарушений, что позволяет пациентам вести более активный и независимый образ жизни, но с некоторым снижением к 3-му году за счет увеличения случаев повторных инсультов. Показатель повседневной активности у пациентов пожилого и старческого возраста не отличается от данных пациентов среднего возраста к 3-му году наблюдения и соответствует 89 баллам. В то время как в группе консервативного лечения пациентов пожилого и старческого возраста эти показатели отстают (68 баллов), хоть и без статистической значимости.
Количественно оценено К.Ж. Динамика показателя физического функционирования (PF), ролевого функционирования (RP — повседневна ролевая деятельность, выполнение повседневных обязанностей), интенсивности боли (BP) имеют статистически достоверную положительную динамику у пациентов после КЭЭ в сравнении с контрольной группой. Общее состояние здоровья (GH), жизненная активность (VT) как самооценка больного, его общего состояния, «жизненных сил» и перспектив лечения также увеличились. Больные отмечают расширение физических возможностей в повседневной работе, повышение социальной активности, эмоционального состояния, что отражено в шкалах социального функционирования (SF) и ролевого функционирования (RE) с повышением баллов у больных после КЭЭ. Когнитивные и психические расстройства оказывают на бытовую, социальную и профессиональную адаптацию не меньшее влияние, чем моторный дефицит. Поэтому наблюдаемым больным после КЭЭ и получавшим консервативную терапию проведен контрольный скрининговый тест на когнитивные и мнестические расстройства. Выявлена положительная динамика в 1-й группе в виде уменьшения степени дементных нарушений до легкой степени выраженности и отсутствие прогрессирования когнитивных дисфункций: показатель FAB увеличился с 14 до 17 баллов, MMSE — с 18 до 23. Во 2-й группе сохраняется уровень деменции умеренной степени выраженности с когнитивной дисфункцией: показатель FAB без изменений — 13 баллов, MMSE снизился с 18 до 16. Если оценивать результаты в зависимости от возраста, то положительная динамика показателей когнитивных функций у пациентов хирургической группы: увеличивается показатель шкалы FAB у пациентов 1A группы с 15,5 до 17, у пациентов пожилого и старческого возраста — с 14,8 до 17, в то время как в группе медикаментозной терапии снижение когнитивных функций: с 14 до 11,7 баллов во 2A группе и с 13,4 до 12,2 — во 2Б. Показатель психического состояния (MMSE) во 2Б группе ухудшается с 19 до 17,6 балла, а у пациентов 1Б группы увеличивается с 17,8 до 23 (р<0,05). Такая же динамика у пациентов среднего возраста.
Объединенный показатель физического компонента здоровья МH также с достоверно положительной динамикой у пациентов хирургической группы (рис. 4). Динамика показателя психологического компонента здоровья MH у пациентов среднего, пожилого и старческого возраста отражена на рис. 5.
 Рис. 4. Динамика неврологического статуса по индексу PH у пациентов группы КЭЭ и консервативного лечения.
Рис. 4. Динамика неврологического статуса по индексу PH у пациентов группы КЭЭ и консервативного лечения.
 Рис. 5. Динамика неврологического статуса по индексу MH у пациентов группы КЭЭ и консервативного лечения.
Рис. 5. Динамика неврологического статуса по индексу MH у пациентов группы КЭЭ и консервативного лечения.
Отмечается достоверное улучшение когнитивных функций, показателей физического и психического компонентов здоровья у пациентов с ХСМН IV степени после КЭЭ.
КЭЭ является эффективным методом профилактики прогрессирования ишемии головного мозга, когнитивных нарушений, улучшает неврологический статус у пациентов с ишемическим инсультом в анамнезе.
Не выявлено достоверной зависимости частоты возникновения ишемических осложнений после КЭЭ от срока восстановительного периода после предшествующего инсульта и тяжести неврологического дефицита. КЭЭ может быть проведена с равной эффективностью как в ранний восстановительный период (от 2 мес), так и в период стойких остаточных явлений (более 6 мес).
У пациентов пожилого и старческого возраста с инсультом в анамнезе КЭЭ является эффективным методом профилактики повторных нарушений мозгового кровообращения, и их возраст не является противопоказанием к операции.
КЭЭ как хирургический метод реваскуляризации головного мозга снижает степень дементных нарушений, улучшает КЖ за счет лучшей социальной адаптации и ролевого функционирования, повышает объединенный показатель психического и физического компонента здоровья у пациентов после ишемического инсульта.
Авторы заявляют об отсутствии конфликта интересов.
Источник
В статье приведены современные подходы к оценке эффективности каротидной эндартерэктомии в остром периоде ишемического инсульта

Введение
В настоящее время активно обсуждаются преимущества хирургического лечения перед применением консервативных методов у пациентов с гемодинамически значимым сужением сонных артерий [1–6]. Основными целями хирургического лечения являются как профилактика повторных нарушений мозгового кровообращения, так и улучшение реабилитационного прогноза у пациентов. Реваскуляризация головного мозга в остром периоде ишемического инсульта (ИИ) до сих пор является поводом для обсуждения среди специалистов и предметом исследований. Основными дискуссионными вопросами в настоящее время являются время от начала инсульта до проведения операции и критерии отбора пациентов для выполнения хирургического вмешательства [4–7]. В последние годы наибольшую актуальность приобрели нейрофизиологические методы исследования спонтанной и вызванной активности головного мозга, способные выявить функциональные нарушения, имеющие важное прогностическое значение, значительно влияющие на исход заболевания и определяющие возможности восстановления нарушенных при ИИ функций [8–11].
Таким образом, все изложенное обусловило актуальность изучения нейрофизиологических особенностей у больных ИИ в процессе восстановления нарушенных функций, которым в острейшем периоде была выполнена реваскуляризация головного мозга, что определило цель исследования.
Целью настоящего исследования явилось изучение динамики спектрально-когерентных показателей ЭЭГ и показателей соматосенсорных вызванных потенциалов у больных атеротромботическим ИИ, которым в острейшем периоде была выполнена каротидная эндартерэктомия на стороне поражения.
Материал и методы
В основу работы положены результаты обследования 54 пациентов с первым в анамнезе атеротромботическим ИИ с полушарной локализацией вследствие гемодинамически значимого поражения внутренней сонной артерии на стороне развития ишемии. Всем пациентам в течение 2 нед. от начала заболевания была выполнена каротидная эндартерэктомия. Среди них мужчин было 44 человека (81%), женщин – 10 (19%). Средний возраст пациентов – 69,14±7,4 года. Левополушарная локализация очага ишемии наблюдалась у 29 (53,7%) человек, правополушарная локализация – у 25 (46,3%). Суммарный балл по шкале NIHSS в 1-е сут составил 12,4±2,7. Средняя величина стенозирующего поражения внутренней сонной артерии на стороне поражения составила 81,2±3,1. Средние сроки оперативного лечения в этой группе составили 4,7±2,7 дня.
При определении показаний к операции на сонных артериях руководствовались известными положениями: диагноз «ишемический инсульт»; отсутствие данных за геморрагический инсульт; очаг ишемии, по данным СКТ или МРТ головного мозга, не превышающий 1/3 области полушарий (в среднем величина очага составила 3,2±0,2 см), кровоснабжаемого ипсилатеральной среднемозговой артерией; отсутствие грубого неврологического дефицита (non disabling – неинвалидизирующий инсульт), средний балл по шкале NIHSS не превышал 14; наличие гемодинамически значимого поражения экстракраниального отдела ипсилатеральной сонной артерии в виде стеноза более 60% просвета сосуда и/или признаки нестабильности, и/или изъязвления атеросклеротической бляшки. Противопоказаниями к оперативному лечению были: выраженный отек головного мозга, стойкая артериальная гипертензия, плохо поддающаяся медикаментозной терапии, обширная зона ишемии головного мозга, тяжелые сопутствующие заболевания (недавно перенесенный инфаркт миокарда, признаки острой и хронической недостаточности внутренних органов), наличие пенумбры менее 50% от размера ишемического очага по данным перфузионной КТ головного мозга.
Группу сравнения составили 52 пациента, прооперированных спустя 2 нед. после развития инсульта: 27 (51,9%) пациентов с левополушарной локализацией очага и 25 (48,1%) пациентов – с правополушарной. Среди них мужчин было 40 человек (76,9%), женщин – 12 (23,1%). Средний возраст пациентов составил 68,2±7,1 года. Средний балл на момент поступления по шкале NIHSS составил 12,7±2,8. Средняя величина стенозирующего поражения внутренней сонной артерии на стороне ишемии составила 84,1±3,5. Средние сроки оперативного лечения в этой группе составили 18,4±2,3 дня.
Для регистрации ЭЭГ использовали 19-канальный цифровой электроэнцефалограф-нейрокартограф фирмы Nicolet One (CША). Для количественной оценки спектра мощности использовали программу «Нейрокартограф», которая позволяла рассчитать мощности и показатели ВПК для основных диапазонов частот ЭЭГ: дельта (0–4 Гц), тета (4–8 Гц), альфа-1 (8–10 Гц), альфа-2 (10–13 Гц), бета (13–30 Гц). Исследование соматосенсорных вызванных потенциалов (ССВП) выполняли на 4-канальном электронейромиографе с функциями исследования вызванных потенциалов мозга «Нейро-МВП-4» фирмы «Нейрософт» (Россия). Выделялись основные пики вызванного потенциала: P18, N20, P23, N30, P45. Вычислялись латентные периоды пиков N20, P23, N30, P45 и амплитуда N20–P23 пиков. Для лучшей идентификации компонентов ССВП проводили сопоставление результатов при ипси- и контрлатеральной регистрации. Запись проводилась до операции и на 2, 7, 14, 21-е сут после операции. Статистическая обработка данных проводилась при помощи пакета статистических программ S-Plus 2005 (Math Soft Inc) с использованием методов непараметрической статистики. Для выявления достоверных различий между средними выборок использовались критерии Вилкоксона и Колмогорова.
Результаты
Динамика выраженности неврологического дефицита по шкале NIHSS у пациентов с неврологическим дефицитом средней степени тяжести, прооперированных в различные сроки от развития инсульта, представлена на рисунке 1.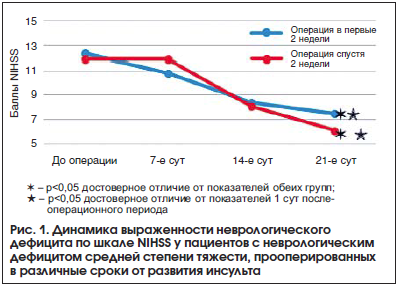
В 1-е сут после операции у пациентов основной группы выявлены достоверно более высокие (p<0,05) показатели мощности спектра медленноволновой активности во всех областях обоих полушарий, преимущественно в передних, центральных и теменных отделах, по сравнению с группой сравнения. Альфа-активность была дезорганизована с нарушением зональных различий. При количественном анализе отмечалось перераспределение мощности спектра альфа-активности с более низкими показателями мощности спектра в височно-затылочных отделах, преимущественно пораженного полушария. Бета-активность была распределена диффузно с некоторым преобладанием в лобно-центральных, центральных, теменных и лобно-височных отделах интактного полушария.
На 7-е сут после операции отмечалось достоверное (p<0,05) уменьшение медленноволновой активности, преимущественно тета-диапазона, в обоих полушариях с некоторым преобладанием ее в лобно-центральных, центральных, теменных и височных отделах пораженного полушария. Преимущественным изменением у больных в этот период было угнетение альфа-активности в обоих полушариях (p<0,05), и наиболее выраженными были изменения альфа-2-активности. При этом в группе сравнения альфа-активность, преимущественно альфа-1 диапазона, регистрировалась широко, наблюдали ее достоверное увеличение в лобно-центральных, теменных, височно-затылочных и затылочных отделах пораженного полушария (p<0,05). К концу 2-й нед. после операции у пациентов обеих групп выявлялось значительное уменьшение медленноволновой активности в обоих полушариях с преобладанием ее в пораженном полушарии по сравнению с предыдущим исследованием. В основной группе сохранялось общее угнетение альфа-активности в обоих полушариях, более выраженное на стороне очага поражения. Отмечалось уменьшение альфа-1-активности в лобно-центральных, центральных и лобно-височных отделах пораженного и клинически интактного полушарий (p<0,05). Эти данные коррелировали с тяжестью клинического состояния, оцениваемого по шкале NIHSS (p<0,05). В группе сравнения отмечали значительное нарастание (p<0,05) альфа-активности, преимущественно альфа-1 диапазона, в интактном полушарии в лобно-центральных, центральных, теменных, височных и затылочных отделах. В то же время в лобно-центральных, лобно-височных и затылочных отделах пораженного полушария имело место уменьшение альфа-активности, преимущественно альфа-1-диапазона (p<0,05). К 21 сут послеоперационного периода наблюдалось дальнейшее уменьшение медленноволновой активности у пациентов обеих групп. Выявлено достоверное (p<0,05) уменьшение тета- и дельта-активности в лобно-центральных и лобно-височных областях в сравнении с предыдущим исследованием. У больных обеих групп отмечалось увеличение альфа-активности во всех отделах, за исключением затылочных. Наиболее выраженное ее увеличение в основной группе наблюдалось в лобно-центральном, центральном и височном отделах пораженного полушария по сравнению с предыдущим исследованием (p<0,05). Эти данные коррелировали с тяжестью клинического состояния, оцениваемого по шкале NIHSS (p<0,05).
В 1-е сут после операции в обеих группах наблюдалось усиление внутриполушарных связей в интактном полушарии. Были выявлены достоверно более высокие (p<0,05) показатели ВПК во всех частотных диапазонах в лобно-височной, центрально-височной и центрально-затылочной областях. Усиление внутриполушарных взаимодействий в интактном полушарии наблюдалось в течение всего острейшего периода. Эти данные коррелировали с тяжестью клинического состояния, оцениваемого по шкале NIHSS (p<0,05).
У пациентов обеих групп к концу 1-й нед. после операции отмечалось повышение показателей ВПК в пораженном полушарии. Зарегистрировано статистически значимое увеличение (p<0,05) ВПК в лобно-височных и височно-затылочной областях пораженного полушария в альфа-, тета-диапазонах по сравнению с предыдущим исследованием. Кроме того, наблюдалось достоверное повышение (p<0,05) ВПК в центрально-височной и лобно-центральной областях интактного полушария в альфа- и тета-диапазонах. В остальных областях интактного полушария, по сравнению с показателями 1-х сут после операции, сохранялись высокими показатели ВПК в большинстве частотных диапазонов.
Анализ динамики показателей ВПК выявил, что в конце 2-й нед. после операции в основной группе происходило усиление внутриполушарных взаимосвязей в большинстве областей пораженного полушария (p<0,05). В клинически интактном полушарии отмечалось уменьшение показателей ВПК во всех частотных диапазонах, более выраженное в лобно-височных, центрально-височных и центрально-затылочных отделах, по сравнению с предыдущим исследованием (p<0,05). Эти данные коррелировали с тяжестью клинического состояния, оцениваемого по шкале NIHSS (p<0,05). В группе сравнения наблюдали выраженное увеличение показателей ВПК в лобно-центральных и, в большей степени, в лобно-височных областях обоих полушарий, преимущественно в клинически интактном полушарии (p<0,05). Эти данные коррелировали с изменениями тяжести неврологического дефицита по шкале NIHSS (p<0,05).
К концу 3-й нед. после операции в основной группе наблюдалось достоверное уменьшение показателей ВПК во всех частотных диапазонах в лобно-центральной и лобно-височной областях интактного полушария по сравнению с предыдущим исследованием (p<0,05) (рис. 2). В лобно-височных, лобно-центральных, центрально-височных областях на стороне очага поражения регистрировались высокие показатели ВПК во всех частотных диапазонах без динамики по сравнению со 2-й нед. после операции. Эти данные коррелировали с тяжестью клинического состояния, оцениваемого по шкале NIHSS (p<0,05). В группе сравнения отмечали увеличение показателей ВПК в передних областях обоих полушарий, преимущественно в альфа- и бета-диапазонах, по сравнению с предыдущим исследованием. Выявили достоверное увеличение (р<0,05) ВПК в лобно-височной области пораженного полушария. Эти данные также коррелировали с изменениями тяжести неврологического дефицита по шкале NIHSS (p<0,05).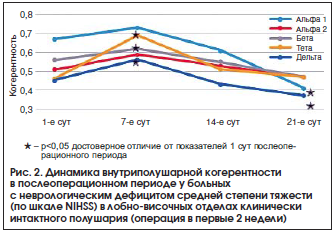
В 1-е сут после операции у пациентов обеих групп отмечалось достоверное уменьшение латентности всех пиков, наиболее выраженное для N30 и Р45 обоих полушарий, при этом изменения преобладали на стороне поражения (p<0,05). Однако к концу 1-й нед. послеоперационного периода у пациентов основной группы наблюдалось cтатистически значимое увеличение латентности пиков Р23, N30 и Р45 на стороне поражения и пиков N20, N30 и Р45 – на стороне клинически интактного полушария по сравнению с показателями 1-х сут (p<0,05). При этом увеличение показателей латентности пиков N30 и P45, по сравнению с показателями 1-х сут как на стороне поражения, так и на стороне клинически интактного полушария, сохранялось в течение первых 2 нед. после операции. На стороне клинически интактного полушария к концу 2–й нед. после операции латентность пиков Р23, N30 и Р45 были выше по сравнению с таковой в группе сравнения (p<0,05). В группе сравнения наблюдалось cтатистически значимое уменьшение латентности пиков N30 и Р45 на стороне обоих полушарий по сравнению с показателями основной группы (p<0,05). При этом уменьшение показателей латентности пиков N30 и P45 по сравнению с показателями основной группы на стороне пораженного полушария сохранялось в течение всех 3-х нед. после операции. К концу 3-й нед. послеоперационного периода отмечалось статистически значимое снижение латентности N20, Р23, N30 и Р45 на стороне поражения и латентности N30, Р45 на стороне клинически интактного полушария по сравнению с показателями 7 сут (p<0,05). При этом показатели латентностей на стороне пораженного полушария были ниже, а на стороне клинически интактного полушария – выше (достоверно ниже для Р45 (p<0,05)) по сравнению с группой сравнения (табл. 1).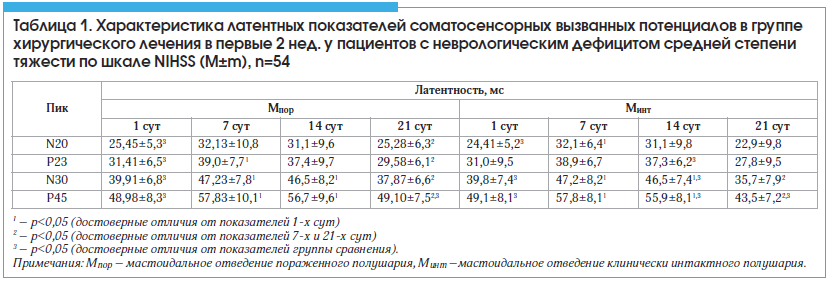
В первые 2 нед. после операции в обеих группах отмечалось достоверное увеличение показателей амплитуды комплекса N20-P23 как на стороне пораженного, так и на стороне клинически интактного полушария (p<0,05). Однако к концу 2-й нед. после операции в основной группе отмечалось значительное снижение амплитуды как на стороне пораженного, так и на стороне клинически интактного полушария по сравнению с показателями 1-х сут после операции. При этом снижение амплитуды на стороне поражения было также достоверным по сравнению с показателями 7-х сут после операции и показателями группы сравнения (p<0,05). К концу 3-й нед. послеоперационного периода отмечалось увеличение показателей амплитуды на стороне пораженного полушария по сравнению с контрольной группой и 1-ми сут после операции (p<0,05). Вместе с этим амплитуда комплекса N20-P23 на стороне клинически интактного полушария была ниже по сравнению с показателями группы сравнения (p<0,05) (табл. 2). 
Обсуждение
Таким образом, для пациентов с неврологическим дефицитом средней степени тяжести по шкале NIHSS вне зависимости от сроков оперативного вмешательства было характерным уменьшение патологических изменений ЭЭГ в виде снижения мощности спектра медленноволновой активности к концу 1-й нед. после операции. Наиболее выраженными эти изменения были в лобно-центральных и лобно-височных отделах обоих полушарий. У пациентов, прооперированных в первые 2 нед. после развития инсульта, начиная с 1-й и до конца 2-й нед. послеоперационного периода наблюдалось угнетение альфа-активности, преимущественн?
